热处理对牛乳成分的影响以及热敏感指标的变化研究进展
杨晋辉,李松励*,郑 楠,文 芳,王加启
(1.中国农业科学院北京畜牧兽医研究所,农业部奶产品质量安全风险评估实验室(北京),农业部奶及奶制品质量监督检验测试中心(北京),动物营养学国家重点实验室,北京 100193;2.列日大学让布卢农学生物技术学院动物科学系,比利时 那慕尔 让布卢 5030)
热处理对牛乳成分的影响以及热敏感指标的变化研究进展
杨晋辉1,2,李松励1,*,郑 楠1,文 芳1,王加启1
(1.中国农业科学院北京畜牧兽医研究所,农业部奶产品质量安全风险评估实验室(北京),农业部奶及奶制品质量监督检验测试中心(北京),动物营养学国家重点实验室,北京 100193;2.列日大学让布卢农学生物技术学院动物科学系,比利时 那慕尔 让布卢 5030)
热加工可以有效杀灭生牛乳中的各种致病微生物,但也会对牛乳成分产生影响。随着热处理温度的升高,乳清蛋白变性和凝集、乳糖异构化和降解、美拉德反应等理化反应会依次发生,这些反应中活性成分(例如碱性磷酸酶和乳清蛋白)的减少或反应产物的生成(例如乳果糖和糠氨酸)都可作为热加工强度的标识。本文对牛乳的热加工条件、牛乳在受热情况出现的理化变化以及相应的热敏感成分的变化进行综述。
牛乳成分;热处理;热敏感指标;热诱导变化
牛乳含有丰富的蛋白、脂肪、维生素、矿物质等多种营养成分,被誉为“白色血液”,是人类膳食营养中不可或缺的重要组分,但在我国乳及乳制品消费比重仅占食品消费比重的4.6%[1]。2014年我国人均乳产品消费量为33 kg,仍然远低于发达国家260 kg[2]。我国生鲜乳产量在2008~2015年增长持续放缓,同期的乳制品的进口量却呈高速增长,2014年乳制品进口量为193.39万 t,折合后的生鲜乳约占国内生鲜乳产量的32%,这无疑为高速增长的乳产品加工提供了额外的原料[3],二次加工也在所难免。热加工可以保证牛乳饮用健康,但高温加热和过度加工就会造成活性成分和重要营养物质的损失。超高温灭菌对乳中营养成分破坏程度要比巴氏杀菌严重,但其占据了国内液态乳市场的主体[4]。
当牛乳受热时,会发生一系列变化,包括pH值降低、磷酸钙的沉淀、乳清蛋白的变性以及和酪蛋白的互作、乳糖异构化、美拉德反应和酪蛋白颗粒的变化[5]。在保证牛乳安全卫生前提下,降低对营养物质的损伤是热加工工艺优化的主要原则。然而,我国尚缺乏对各种热加工工艺的规范和指导,因此,对牛乳热加工损伤的评价以及热敏感指标的筛选至关重要。本文阐述了各种加工工艺和热处理条件下,牛乳中可能出现的一些反应,以及相应热敏感成分的变化,为今后的研究提供参考。
1 热处理工艺
热处理的目的在于降低微生物数量、钝化微生物或生乳原有酶的活性,并延长货架期[6]。根据牛乳的热加工工艺,市场上出售的牛乳分为巴氏杀菌乳(pasteurized milk)、灭菌乳(sterilized milk),巴氏杀菌的加热温度为60~80 ℃,而灭菌乳的处理温度范围是100~150 ℃[6]。所有的加热过程又分为3 个阶段:升温、保持和冷却,保持阶段的热负荷效应最为显著。
巴氏杀菌旨在杀灭牛乳中有害微生物,以延长牛乳的保存时间,尽量减少牛乳中营养物质的损失[6]。除了间歇式工艺和连续式工艺两种经典方法外,不同国家和地区还对巴氏杀菌加热不同温度和时间组合做出了规定[7-9]。加热后碱性磷酸酶反应呈阴性,这可以用于检测热负荷是否足够,有时也同时检测过氧化物酶活性,以避免加热过度[10],而在欧盟,过氧化物酶阴性的牛乳需要标识为高温巴氏乳[11]。
灭菌工艺的目标是使产品实现商业无菌,并延长货架期;主要目标是最耐热的致病菌(肉毒杆菌)芽孢的灭活,因此其灭活条件121 ℃、3 min也成为了灭菌工艺的最低要求[12]。灭菌乳又可分为保持灭菌(in-container sterilization)乳和超高温(灭菌)(ultra-high temperature treated,UHT)乳两类。保持灭菌是将经过巴氏杀菌、均质、灌装入容器并密封等处理之后,然后牛乳连同容器一起再行灭菌,加工条件因产品包装而异,其升温过程和降温过程都非常长。UHT工艺又分为以下几个流程:热再生的预热(80~95 ℃)、预热温度的保持、升温至灭菌温度、灭菌温度的保持、冷却和无菌灌装。嗜温微生物孢子灭活的有效性和控制化学变化的有限化,分别界定了灭菌温度和保持时间组合的下限和上限[6]。UHT工艺又分为直接加热和间接加热两种。直接加热就是直接将过热蒸汽与牛乳混合,而间接加热则是通过牛乳和加热媒介(热水和蒸汽)之间的热交换实现加热[13-14]。预热(15 s至几分钟)主要促使乳清蛋白变性,以免其在高温加热部件表面沉积,这对于间接UHT特别重要。预热和最后的冷却步骤通常是间接UHT的工艺,直接UHT最终在真空舱内闪蒸冷却,而间接UHT利用平板或管式热交换器[13]。从预热到灭菌加热的升温过程、冷却的降温过程,间接工艺都要慢于直接工艺,牛乳受热伤害也会更严重[6,15]。

表1 典型热加工的温度和保持时间[16]Table 1 Temperature and holding time in typical thermal processing[16]
2 牛乳受热后的变化
牛乳在受热后会产生诸多变化。首先分子内二硫键重组,形成分子间的二硫键,乳清蛋白变性凝集,乳脂球膜表面蛋白、酪蛋白与乳清蛋白也会结合[17]。其次加热促使蛋白变性,激活氨基酸残基,特别是半胱氨酸,释放H2S,改变牛乳风味;随着温度的升高,磷酸钙沉淀会增加,乳糖的分解以及酪蛋白的脱磷酸作用也会增强,释放H+逐渐增加,牛乳pH值降低[16]。乳糖与乳清蛋白、膜蛋白发生美拉德反应,生成棕色物质。在乳清蛋白的催化作用下,多不饱和脂肪酸会形成相应的共轭异构体。多数牛乳的内源酶和细菌分泌酶会在加工过程中被钝化。维生素结合蛋白、免疫球蛋白、金属结合蛋白、抗菌蛋白、多数生长因子和激素等生物活性蛋白都也会在加热过程失去活性。丝氨酸、丝氨酸磷酸酯、糖基化丝氨酸和半胱氨酸及其残基通过β消去反应形成脱氢丙氨酸,而脱氢丙氨酸会继续和赖氨酸或半胱氨酸残基反应,形成蛋白分子内或分子间交联[16]。酪蛋白是一种高度磷酸化钙结合蛋白,除κ-酪蛋白受热会从颗粒表面解离外,其余酪蛋白的热稳定性相对较高。这些反应中,乳清蛋白的变性、乳糖异构化及分解和美拉德反应较为重要。
2.1 乳清蛋白的变性
乳清蛋白占牛乳总蛋白的20%,高级结构中有典型的球状蛋白,其对热变性非常敏感。根据溶解度差异,乳清蛋白的变性顺序为α-乳白蛋白(α-lactalbumin,α-La)>β-乳球蛋白(β-lactoglobulin,β-Lg)>牛血清白蛋白(bovine serum albumin,BSA)>免疫球蛋白;而差示扫描量热法的结果所得到的变性顺序为免疫球蛋白>β-Lg>α-La>BSA,差异可能由于金属结合蛋白(α-La和乳铁蛋白)在热变性过程中出现的复性[17]。α-La和β-Lg的变性都是一级和二级动力学反应过程。其中对β-Lg的变性和凝集过程研究最为广泛,如图1所示。
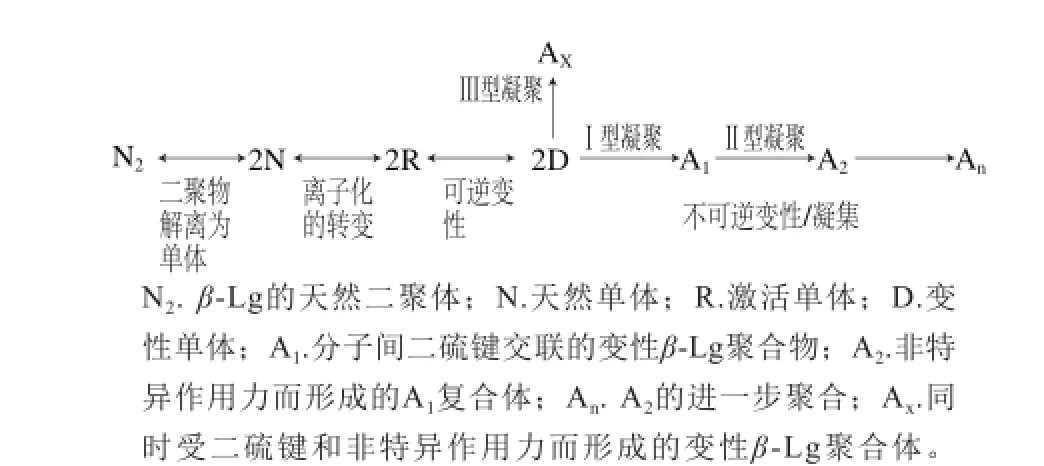
图1 β-Lg受热变性和凝集[18]Fig. 1 Denaturation and aggregation of milk β-Lg during thermal treatment[18]
天然二聚体受热变为天然单体,进一步转变为激活单体,激活单体诱导单体内部的二硫键破坏,巯基暴露,并与之结合形成激活的二聚体,经过多次反应形成激活多聚体;反应的终点便是两个活化的单体或凝结物在其表面形成二硫键,新形成的结合物再无暴露的巯基[19]。在78 ℃加热条件下,非活性的β-Lg单体在开始阶段随着时间延长而含量增加,但也随着凝集物浓度的增加而降低[20]。乳清蛋白的凝集主要是半胱氨酸之间的残基发生不可逆反应形成共价键,变性之后β-Lg先形成寡聚体,再形成可溶性的聚合物[21-22],可溶性的聚合物非特异凝集进一步聚合形成胶体颗粒,分子间的二硫键(Ⅰ型凝集)、非特异作用力(范德华力、二硫键重排、疏水力,Ⅱ型凝集)以及两种作用同时存在(Ⅲ型凝集)都会促进乳清蛋白的凝集[17]。β-Lg会和α-La、κ-酪蛋白之间发生广泛的二硫键交联,形成不同形式的蛋白复合体,这个过程与pH值有关[16]。与直接加热系统相比,UHT的间接加热系统中有更多的β-Lg与酪蛋白颗粒结合[23-24]。
1.3 试验方法 试验采用随机区组设计,3次重复,小区面积15 m2;株行距为27 cm×35 cm,每塘留2株,种植密度21.0万株/hm2。10月15日播种,统一采用打塘直播的方式,氮、磷、钾及硼肥统一按:底种肥施普钙450 kg/hm2;硼砂(纯B≥9%)15.0 kg/hm2;苗肥施硫酸钾150 kg/hm2,苗期及蕾苔期共施尿素600 kg/hm2。试验地四周设保护行,对油菜出苗期、五叶期、苔期、花期及成熟期进行观察记载。成熟后按要求取样,进行主要农艺性状考种。及时收获、脱粒、称重计产,并用FOSS 近红外品质分析仪进行室内品质检测[6-8]。
2.2 乳糖的变化
2.2.1 乳糖的异构化和降解
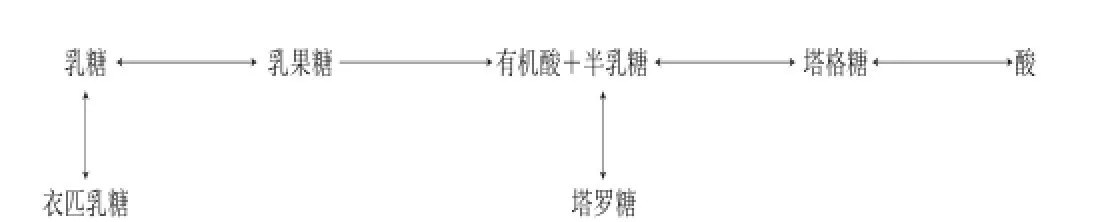
图2 温和碱性条件下乳糖受热变化[16]Fig. 2 Heat-induced changes in lactose under mild alkaline condition[16]
乳糖在温和碱性条件下的异构化和降解如图2所示。蛋白存在的条件下,会加速乳糖的降解和向衣匹乳糖(epilactose)的转化[25]。在酸、碱或碱土金属离子催化下,乳糖经烯醇化/醛酮异构化和差向异构化形成乳果糖,pH值增高和氨基的参与都可以加速反应的进行。在酸存在的条件下,乳糖经烯醇化异构后随即发生β消除。2-己酮糖的反应速率要快于醛糖,并且易于烯醇化,2-己酮糖能形成更多的降解产物;氧存在的条件下,烯二醇双键断裂形成对应的羧酸,如甲酸和树胶糖酸,糖降解所形成的二羰基产物经过二苯乙醇酸重排后,会形成各种各样的有机酸。高温或浓碱条件下,双键的反醛醇断裂便会形成羟醛和羟基酮。1,2-烯醇化衍生物在酸性条件下经过一系列β消除,生成2-糠醛或5-羟甲基二糠醛。主要反应产物会通过羟醛缩合和分子间环化形成一系列其他产物。氨基存在的条件下,α-二羰基组分可以进一步发生Strecker降解,氧化氨基酸[26]。乳糖或乳果糖也可以通过美拉德反应与酪蛋白形成果糖基赖氨酸,进一步降解。牛乳中这些反应产物微乎其微,其产生主要决定于热加工的程度[26]。
2.2.2 美拉德反应
美拉德反应源于蛋白氨基中氮原子对醛糖或酮糖中亲电羰基发起的亲核攻击。牛乳中参与反应的主要成分是蛋白和乳糖,两者结合脱去水后形成Schiff碱,经结构重排形成N-葡萄糖基胺,再经重排形成Amadori产物,1-氨基-1-脱氧-2-酮糖或α-2-氨基-2-脱氧醛糖,前者稳定性优于后者,后者也可以通过醛酮异构转变为前者。如图3所示,依据反应条件的不同,1-氨基-1-脱氧-2-酮糖经过不同途径最终形成棕色的多聚物或共聚物类黑精[26]。部分产物降解形成脱氧基二酮糖和脱氧基醛酮糖,其中脱氧基乳果糖会和赖氨基Amadori产物结合,经酸水解后会形成稳定的糠氨酸或吡咯酸,经氧化裂解后便形成羧甲基赖氨酸和三羟丁酸[16]。

图3 美拉德反应的步骤[26-27]Fig. 3 Maillard reaction stages[26-27]
3 热敏感指标变化及筛选
牛乳中的热敏感指标主要分为两类:Ⅰ型指标主要为热敏感成分的降解、变性和灭活,如乳清蛋白和酶类,通常用于指示巴氏杀菌热处理强度,Ⅱ型指标则主要为牛乳受热变化所生成的产物,如乳果糖、糠氨酸、羟甲基糠醛(hydroxymethylfurfural,HMF)等,其能有效监测灭菌处理的热加工强度[27]。不同热加工条件下的热敏感成分含量如表2所示,不同热处理条件下热敏感成分变化如图4所示。
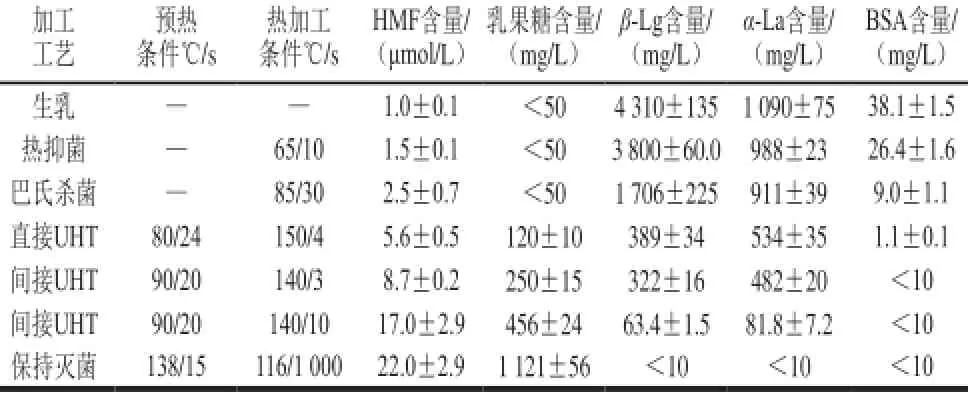
表2 不同热加工条件下热敏感成分含量[28]Table 2 The contents of heat-sensitive components in milk during different heat treatments[28]
3.1 Ⅰ型指标
3.1.1 酶
巴氏杀菌加热的最低要求是杀灭牛乳中的所有致病菌,而最耐热的致病菌,结核杆菌的灭菌温度仅比碱性磷酸酶(alkaline phosphatase,ALP)的灭活温度稍低,因此将ALP的活性作为加热效果的评判指标[6]。ALP活性的对照也被用于鉴定巴氏杀菌乳的卫生洁净状况;满足联合国粮农组织/世界卫生组织(food and agriculture organization/world health organization,FAO/ WHO)规定的最低巴氏杀菌条件(72 ℃、15 s)的热处理会使ALP的活性低于10 mg /mL对硝基苯酚;但在Mg2+存在的条件下,ALP的变性温度会高出20 ℃,判定过程中出现假阳性[27]。γ-谷氨酰转肽酶(gamma-glutamyl transpeptidase,GGTP)能够检测75 ℃、10~60 s或70~80 ℃、16 s的热处理[29];GGTP可替代ALP用于巴氏杀菌乳加热效果的评定[30]。在65 ℃、15 s条件下,GGTP活性仅有少许降低,而在72 ℃、15 s条件下,仍有初始活力的50%;75 ℃、15 s条件下,活力仅剩余10%;78 ℃、15 s加热条件下,残余活力低于检出限;并在79 ℃、16 s条件下完全失活[31]。乳过氧化物酶系统有较强的抑菌作用,酶的失活温度为85 ℃,如图4B所示。当加热温度升至85~90 ℃时,芽孢杆菌会热休克形成孢子,威胁乳的品质,因此将过氧化物酶作为巴氏杀菌热加工上限的指标[6]。而过氧化物酶在热失活过程中的反应阶数为1.5,在3 个温度范围内的有着不同的激活能量,中段温度的激活能量为634 kJ/mol,约有30%~80%酶失活,z值为3.7 ℃;而若要完全失活,z值为9.4 ℃[32]。尽管乳过氧化物酶存在再次激活和光化学失活的特性,但不影响其作为巴氏杀菌加热上限估计参数的应用[27]。
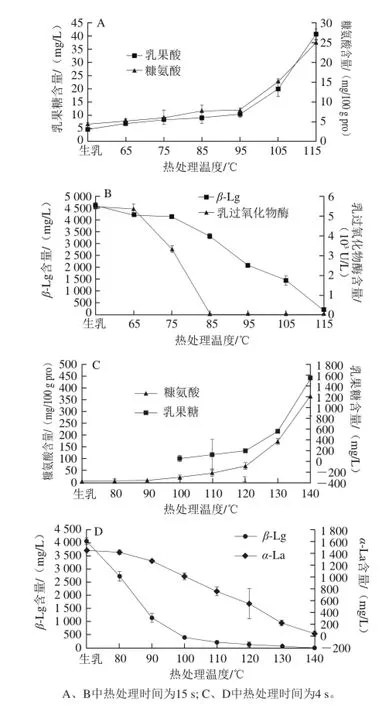
图4 不同热处理条件下热敏感指标的变化情况[37-38]Fig. 4 Changes in heat-sensitive components of milk during different heat treatments[37-38]
3.1.2 乳清蛋白
乳清蛋白氮指数(whey protein nitrogen index,WPNI)和热数量(heat number,HN)成功应用于乳粉的热处理分级[33-34]。相对可溶乳清蛋白氮(relative soluble whey protein nitrogen,RSWPN)对各种加热等级的巴氏杀菌乳极其敏感,结合过氧化物酶可用于鉴别市售巴氏杀菌乳的热处理分级:15.5%以上的液态乳被评为“高品质的新鲜巴氏杀菌乳”,对应加热温度为72~75 ℃;14.0%~15.5%的被评为“新鲜巴氏杀菌乳”,加热温度为75~80 ℃;11%~14%的被评为“巴氏杀菌乳”,处理温度为80~88 ℃;当然,牛乳的均质会降低约1 个单位RSWPN值[35]。针对RSWPN测定费时费力的缺陷,(免疫球蛋白(immunoglobulin G,IgG)+ BSA)/β-Lg是良好的替代指标,其也可以用于鉴别极低热和低热处理的乳粉[36]。其他乳清蛋白氮参数如变性乳清蛋白氮(denatured whey protein nitrogen,DWPN)含量、等电点沉淀的相对酪蛋白含量(relative casein content,RCC/%)也可以作为判定乳粉和巴氏杀菌乳热分级的敏感指标[27]。
变性的乳清蛋白也可用作鉴别牛乳热处理分级,主要乳清蛋白的热敏感性次序和变性反应速率常数的温度依赖性是一致的。70~80 ℃范围内,IgG是最敏感的乳清蛋白[39-40];70~150 ℃,β-Lg的热敏感性要强于α-La[39,41],70~75 ℃,β-Lg的变异体B的稳定性要好于α-La[42]。如图4所示,α-La在巴氏杀菌条件下变性较少,是高温热处理(灭菌过程)的优良指标,β-Lg的变性较好地描述了较为温和的热处理(从巴氏杀菌到直接UHT加工),但在剧烈的加工条件下变性广泛。酸可溶α-La是灭菌处理更适宜的指示参数,其在保持灭菌乳、间接UHT乳、直接UHT乳、高温巴氏杀菌乳、巴氏杀菌乳、生乳中的含量分别为0~40、40~590、220~1 020、750~1 090、900~1 080、1 010~1 120 mg/L;但由于其测定的困难,可由酸可溶β-Lg代替,其在保持灭菌乳、间接UHT乳、直接UHT乳、高温巴氏杀菌乳、巴氏杀菌乳、生乳中分别为0、50~600、100~1 100、1 000~2 600、2 300~3 400、3 100~3 600 mg/L[39,43];欧盟也考虑将50 mg酸可溶β-Lg结合过氧化物酶阴性作为UHT和保持灭菌加热的上限[27]。pH 4.6可溶和不可溶部分的乳清蛋白含量可作为牛乳热加工的标记,可溶部分含量的下降会伴随着不可溶部分含量的上升[44]。生乳中70%的可溶α-La会在UHT乳中变为不可溶部分,几乎所有(>90%)的生乳中的BSA和β-Lg经过UHT加热后与酪蛋白发生共沉淀[45-46]。
3.2 Ⅱ型指标
尽管实验条件不相同,报道中乳糖异构化的动力学参数和乳果糖对商品乳热处理评估效果却趋于一致,因此,乳果糖浓度可以作为形容牛乳热处理的热损伤指标[47-48];由于实验室很难模拟工厂间接UHT工艺中加热和冷却的步骤,其模型的预测可靠性弱于相应的直接UHT和保持灭菌模型,且预测值远低于真实值[43,48]。乳果糖在高温短时灭菌加工条件下并不会生成(图4),而在UHT灭菌,特别是保持灭菌工艺中会大量生成,其含量可以作为鉴定UHT和保持灭菌工艺的热敏感指标[16]。由于相同热处理乳果糖值的分布范围较广,UHT乳和保持灭菌乳的范围有一部分是重叠的(直接UHT乳中41~670 mg/L、间接UHT乳中120~1 430 mg/L、保持灭菌乳中412~1 840 mg/L),市售巴氏杀菌乳中的乳果糖含量极低(0~80 mg/L)[27]。间接UHT工艺中较长的预热和冷却过程,以及保持灭菌工艺中较高的预热温度和较长的加热时间都会造成热加工过度[6],产品中的乳果糖含量偏高(表2),其他研究中也报道了灭菌乳中类似的过热加工[27]。因此,我国的标准中对于巴氏杀菌乳和UHT乳中乳果糖上限的规定分别为100 mg/L和600 mg/L[49]。另外,在牛乳的喷粉过程中并无乳果糖生成,高温粉复原产品中56~116 mg/L的乳果糖也可能是由于干燥前牛乳受热处理而产生的;贮存温度过高或经过脱脂处理的牛乳,其乳果糖含量也会有一定程度的升高[27],加工过程中,压力由100 MPa升至600 MPa,也会促使乳糖向乳果糖转化,乳果糖含量升高[50]。
由于分子的稳定性和定量检测的可能性,糠氨酸作为热敏感指标在实际检测中受到了广泛关注和应用[27,43]。牛乳中的糠氨酸生成速率受蛋白含量的影响较大,因此,糠氨酸含量的表示单位应以蛋白为基础(mg/100 g pro)[27]。随这热处理程度的增加,牛乳中糠氨酸含量变化如图4C所示;生乳中的糠氨酸含量为6~36 mg/100 g pro,随着巴氏杀菌温度的升高,72~98 ℃、15 s的加热条件下会额外产生1.6~5.5 mg/100 g pro的糠氨酸[27,37-38];但随着加热温度的继续增加,糠氨酸含量成倍增长,140 ℃、4 s处理乳中的糠氨酸含量是生乳中的30~72 倍[38,51]。糠氨酸在巴氏杀菌乳、UHT乳、保持灭菌乳中含量分别为5~8、40~220、220~450 mg/100 g pro[27]。糠氨酸含量也被用于评价乳粉中的美拉德反应的范围,脱脂乳粉中的糠胺酸会由低热处理的55 mg/100 g pro升至高热处理的350 mg/100 g pro[52]。贮存过程中,UHT乳、巴氏杀菌乳和乳粉糠氨酸含量还会进一步上升[27,51,53],同样,加工过程压力的升高也会导致乳中糠氨酸含量的上升[54]。
如表2所示,HMF的浓度会随着热处理条件增强而升高,其可以作为高热处理的敏感指标[55],但不同类型乳中HMF浓度却与产品对应的热处理强度相关性较差[53]。美拉德反应中,剧烈的热处理会引起糖的焦化和有色组分的生成,并且乳果糖浓度和感官参数有一定相关性,颜色分析可以协助判定UHT乳和保持灭菌乳[56];然而,颜色分析受生鲜乳颜色影响较大,其仅适用于加工条件评估和优化的在线使用[27]。6-甲基腺苷在生鲜乳中并不存在,形成于热诱导的重排,115~150 ℃范围内反应为一阶反应,反应动力学类似于乳果糖和HMF的形成,然而其作为热敏感指标使用却并不广泛[27]。
3.3 联合使用
通过不同指标的联合使用,能够准确区分不同热加工处理的样品。酸可溶β-Lg和乳果糖的组合能够准确区分市售产品中的直接UHT、间接UHT和保持灭菌乳,酸可溶β-Lg(α-La)可以很好地指示低热处理的样品,而乳果糖则可以很好的指示高热处理的样品[27,39]。欧盟和国际乳业联盟将酸可溶β-Lg高于50 mg/L,并且乳果糖含量低于600 mg/L的牛乳,才标识为UHT乳,否则就是保持灭菌乳[27]。随着相对可溶乳清蛋白含量的逐渐降低,蛋白表面疏水力先升高后降低,两者结合可以用于鉴别巴氏杀菌乳、UHT乳和保持灭菌乳[57]。随着热处理温度的升高和时间的延长,牛乳中乳果糖含量的增加趋势高于糠氨酸,乳果糖/糠氨酸会逐渐增大,我国标准也结合两者比例对产品进行鉴定[49,51];两者结合也能较为有效地区分巴氏杀菌乳、超巴氏杀菌乳和UHT乳[58]。过氧化物酶测试和酸可溶β-Lg结合被证明是一种能够有效区分过氧化物酶阴性和阳性巴氏杀菌乳的指标,乳中2 600~3 000 mg/L的酸可溶β-Lg,为过氧化物酶阳性巴氏杀菌乳热损伤判定上限提供了较大的韧性;乳过氧化物酶阴性乳的上限则有11%的RSWPN提供,否则,其会与UHT乳共享相同的热损伤[27]。酸可溶β-Lg指数结合糠氨酸指数可以用于指示巴氏杀菌乳中掺入复原乳或高热处理乳,72 ℃、15 s至96 ℃、38 s产生的β-Lg质量浓度的范围是500~3 700 mg/L。硫醇基的数量适于表征牛乳的低热处理,而美拉德反应产物更适用于指示牛乳灭菌过程,两者结合可以很好地辨别牛乳的热处理方式[59]。
4 结 语
与巴氏杀菌相比,UHT的高热处理以及保持灭菌长时间高温都会对牛乳造成较大的热损伤,牛乳中乳清蛋白变性、乳糖异构化和降解、美拉德反应也更为严重。牛乳中的酶和乳清蛋白含量可以指示巴氏杀菌的热处理强度,而乳果糖和糠氨酸含量更适合于反应灭菌工艺的热损伤程度,我国标准中将乳果糖和糠氨酸含量同时作为液态乳的判定指标,无疑推动了巴氏杀菌乳和UHT乳的规范生产。
[1] 农业部奶业管理办公室. 2014年中国奶业统计摘要[M]. 北京: 中国奶业协会, 2015: 18-22.
[2] 王加启. 优质乳是奶业发展的方向[J]. 中国畜牧兽医, 2012, 39(6): 1-5. DOI:10.3969/j.issn.1671-7236.2012.06.001.
[3] 王加启, 郑楠. 中国奶产品质量安全研究报告[M]. 北京: 中国农业科学技术出版社, 2016: 8-12.
[4] 王加启. 决定我国奶业发展方向的5个重要指标[J]. 中国奶牛, 2011(3): 5-9. DOI:10.3969/j.issn.1004-4264.2011.03.001.
[5] WALSTRA P, JENNESS R, BADINGS H T. Dairy chemistry and physics[M]. New York: Wiley, 1984: 214-289.
[6] TAMIME A Y. Milk processing and quality management[M]. Chichester: Wiley-Blackwell Publishing Ltd., 2009: 345-375.
[7] European Council. Commission Regulation (EC)No 2074/2005 of 5 December 2005 laying down implementing measures for certain products under Regulation (EC) No 853/2004 of the European Parliament and of the Council and for the organisation of official controls under Regulation (EC) No 854/2004 of the European Parliament and of the Council and Regulation (EC) No 882/2004 of the European Parliament and of the Council, derogating from Regulation (EC) No 852/2004 of the European Parliament and of the Council and amending Regulations (EC) No 853/2004 and (EC) No 854/2004[M]. Brussels: Off i cial Journal of the European Union, 2005: 27-58.
[8] US Public Health Service. Grade ‘A’ pasteurized milk ordinance[S]. Washington DC: US Department of Health and Human Services, 2013: 89-96.
[9] New Zealand Food Standards Agency. Standard for pasteurisation heat treatments MRD standard 3[S]. Revision 2. Wellington: Food Standards Australia New Zealand, 1993: 1-20.
[10] Statutory Instruments. Food milk and dairies, the dairy products (hygiene) regulations[M]// Instruments Standards( NO 1086). London: HMSO, 1995: 32-33.
[11] European Council. Laying down the health rules for the production and placing on the market of raw milk, heat-treated milk and milkbased products[J]. Official Journal of the European Communities, 1992, 35: 1-32.
[12] MANNING L. Food and drink-good manufacturing practice: a guide to its responsible management[M]. 3rd ed. London: Institute of Food Science and Technology, 1991: 1-118.
[13] BURTON H. UHT processing of milk and milk products[M]. London: Elsevier, 1988: 95.
[14] MEHTA R S. Milk processed at ultra-high-temperatures: a review[J]. Journal of Food Protect, 1980, 43(3): 212-225.
[15] BIZIAK R B, SWARTZEL K R, JONES V A. Energy use for continuous thermal processing of milk[J]. Journal of Food Science, 1985, 50(6): 1607-1610. DOI:10.1111/j.1365-2621.1985.tb10544.x.
[16] FOX P F, UNIACKE-LOWE T, MCSWEENEY P L H, et al. Dairy chemistry and biochemistry[M]. 2nd ed. Switzerland: Springer, 2015: 344-367.
[17] BRODKORB A, CROGUENNEC T, BOUHALLAB S, et al. Heatinduced denaturation, aggregation and gelation of whey proteins[M]. London: Springer, 2016: 156-166.
[18] MULVIHILL D M, DONOVAN M. Whey proteins and their thermal denaturation: a review[J]. Irish Journal of Food Science and Technology, 1987, 11: 43-75.
[19] ROEFS S P F M, de KRUIF K G. A model of the denaturation and aggregation of β-lactoglobulin[J]. European Journal of Biochemistry, 1994, 226: 883-889. DOI:10.1111/j.1432-1033.1994.00883.x.
[20] KEHOE J J, MORRIS E R, BRODKORB A. The inf l uence of bovine serum albumin on beta-lactoglobulin denaturation, aggregation and gelation[J]. Food Hydrocolloid, 2007, 21(5/6): 747-755. DOI:10.1016/ j.foodhyd.2006.10.001.
[21] BAUSSAY K, BON C L, NICOLAI T, et al. Influence of the ionic strength on the heatinduced aggregation of the globular protein β-lactoglobulin at pH 7[J]. International Journal of Biological Macromolecules, 2004, 34: 21-28. DOI:10.1016/ j.ijbiomac.2003.11.003.
[22] POUZOT M, NICOLAI T, VISSCHERS R W, et al. X-ray and light scattering study of the structure of large protein aggregates at neutral pH[J]. Food Hydrocolloid, 2005, 19(2): 231-238. DOI:10.1016/ j.foodhyd.2004.06.003.
[23] CORREDIG M, DALGLEISH D G. The binding of alpha-lactalbumin and beta-lactoglobulin to casein micelles in milk treated by different heating systems[J]. Milchwissenschaft, 1996, 51(3): 123-127.
[24] OLDFIELD D J, SINGH H, TAYLOR M W. Kinetics of heat-induced whey protein denaturation and aggregation in skim milks with adjusted whey protein concentration[J]. Journal of Dairy Research, 2005, 72(3): 369-378. DOI:10.1017/S002202990500107X.
[25] CALVO M M, OLANO A. Formation of galactose during heat treatment of milk and model systems[J]. Journal of Dairy Research, 1989, 56(5): 737-740.
[26] O'BRIEN J. Non-enzymatic degradation pathways of lactose and their signif i cance in dairy products[M]. New York: Springer, 2009: 231-279.
[27] PELLEGRINO L, RESMINI P, LUF W. Assessment(induces) of heat treatment of milk[M]. Brussels: International Dairy Federation, 1995: 409-453.
[28] MORALES F J, ROMERO C, JIMENEZ-PEREZ S. Characterization of industrial processed milk by analysis of heat-induced changes[J]. International Journal of Food Science and Technology, 2000, 35(2): 193-200. DOI:10.1046/j.1365-2621.2000.00334.x.
[29] BAUMRUCKER C R. Gamma-Glutamyl transpeptidase of bovine milk membranes: distribution and characterization[J]. Journal of Dairy Science, 1979, 62(2): 253-258.
[30] MCKELLAR R C, EMMONS D B, FARBER J. Gamma-Glutamyl transpeptidase in milk and butter as an indicator of heat treatment[J]. International Dairy Journal, 1991, 1(4): 241-251. DOI:10.1016/0958-6946(91)90017-3.
[31] PATEL S S, WILBEY R A. Heat exchanger performance: gammaglutamyl transpeptidase assay as a heat treatment indicator for dairy products[J]. Journal of the Society of Dairy Technology, 1989, 42: 79-80. DOI:10.1111/j.1471-0307.1989.tb02162.x.
[32] OLSZEWSKI E, REUTER H. The inactivation and reaction behavior of lactoperoxidase in milk at temperatures between 50 ℃ and 135 ℃[J]. Z Lebensm Unters Forsch, 1992, 194: 235-239. DOI:10.1007/BF01198413.
[33] American Dry Milk Institute. Determination of undenatured whey protein nitrogen in nonfat day milk, standard for grade of dry milks[S]. Chicago: American dry milk institute, 1971: 916.
[34] International Standardization Organization. Dried milk-assessment of heat class-heat number references method: 6735[S]. Geneva: ISO, 1985: 1-15.
[35] ANDREINI R, PRATI F, RESMINI P. Valutazione della qualita del latte crudo e del latte paetorizzato in differenti condizioni di processo[M]. Roma: Istituto Nazionale Nutrizione, 1992: 156-195.
[36] van den BEDEM J W, LEENHEER J. Heat treatment classif i cation of low heat and extra low heat skim milk powder by HPLC[J]. Netherland Milk Dairy Journal, 1988, 42: 345-350.
[37] LAN X Y, WANG J Q, BU D P, et al. Effects of heating temperatures and addition of reconstituted milk on the heat indicators in milk[J]. Journal of Food Science, 2010, 75(8): C653-C658. DOI:10.1111/ j.1750-3841.2010.01802.x.
[38] SAKKAS L, MOUTAFI A, MOSCHOPOULOU E, et al. Assessment of heat treatment of various types of milk[J]. Food Chemistry, 2014, 159: 293-301. DOI:10.1016/j.foodchem.2014.03.020.
[39] RESMINI P, PELLEGRINO L, HOGENBOOM J A, et al. Thermal denaturation of whey protein in pasterized milk. fast evaluation by HPLC[J]. Italy Journal of Food Science, 1989, 3: 51-62.
[40] LUF W, FEIERSINGER G, BRANDL E. On detection of IgG-content as an indicator[J]. Proceeding of European Conference on Food Chemistry VI, 1991, 2: 669-674.
[41] DANNENBERG F, KESSLER H. Application of reaction kinetics to the denaturation of whey proteins in heated milk[J]. Milchwissenschaft, 1988, 43: 3-7.
[42] DALGLEISH D G. Denaturation and aggregation of serum proteins and caseins in heated milk[J]. Journal of Agricultural and Food Chemistry, 1990, 38: 1995-1999. DOI:10.1021/jf00101a001.
[43] ANDREINI R, CHIODI J, de NONI I, et al. Evaluation of heat damage in UHT and in bottle sterilized milk samples treated in Italy[J]. Scienza e Tecnica Lattiero-Casearia, 1990, 41(6): 472-492.
[44] MANZO C, NICOLAI M A, PIZZANO R. Thermal markers arising from changes in the protein component of milk[J]. Food Control, 2015, 51: 251-255. DOI:10.1016/j.foodcont.2014.11.029.
[45] MANZO C, PIZZANO R, ADDEO F. Detection of pH 4.6 insoluble beta-lactoglobulin in heat-treated milk and Mozzarella cheese[J]. Journal of Agricultural And Food Chemistry, 2008, 56(17): 7929-7933. DOI:10.1021/jf801190t.
[46] PIZZANO R, MANZO C, NICOLAI M A, et al. Occurrence of major whey proteins in the pH 4.6 insoluble protein fraction from UHT-treated milk[J]. Journal of Agricultural And Food Chemistry, 2012, 60(32): 8044-8050. DOI:10.1021/jf3024563.
[47] ANDREWS G R. Determining the energy of activation for the formation of lactulose in heated milks[J]. Journal of Dairy Research, 1985, 52(2): 275-280.
[48] BERG H E. Reactions of lactose during heat treatment of milk: a quantitative study[D]. Wageningen: Landbouwuniversiteit, 1993: 20-35.
[49] 全国畜牧业标准化技术委员会. 巴氏杀菌乳和UHT灭菌乳中复原乳的鉴定: NY/T 939—2016[S]. 北京: 中国农业出版社, 2016: 1-10.
[50] MARTINEZ-MONTEAGUDO S I, SALDANA M D A. Kinetics of lactulose formation in milk treated with pressure-assisted thermal processing[J]. Innovative Food Science & Emerging Technologies, 2015, 28: 22-30. DOI:10.1016/j.ifset.2014.12.010.
[51] 汪慧. 不同热加工处理的生鲜乳与复原乳产品鉴别方法的研究[D].扬州: 扬州大学, 2014: 25-31.
[52] RESMINI P, PELLEGRINO L. HPLC of furosine for evaluating Maillard reaction damage in skimmilk powders during processing and storage[J]. Bulletin of International Dairy Federation, 1994, 298: 31-36.
[53] O’BRIEN J M, MORRISSEY P A. The Maillard reaction in milk products[J]. Bulletin of the International Dairy Federation, 1989, 238: 53-61.
[54] PEREDA J, FERRAGUT V, QUEVEDO J M, et al. Heat damage evaluation in ultra-high pressure homogenized milk[J]. Food Hydrocolloids, 2009, 23(7): 1974-1979. DOI:10.1016/j.foodhyd.2009.02.010.
[55] FINK R, KESSLER H G. Comparison of methods for distinguishing UHT treatment and sterilization of milk[J]. Milchwissenschaft, 1988, 43(5): 275-280.
[56] ANDREWS G R, MORANT S V. Lactulose content, colour and the organoleptic assessment of ultra heat treated and sterilized milks[J]. Journal of Dairy Research, 1987, 54(4): 493-507.
[57] PAGLIARINI E, IAMETTI S, PERI C, et al. An analytical approach to the evaluation of heat damage in commercial milks[J]. Journal of Dairy Science, 1990, 73: 41-44. DOI:10.3168/jds.S0022-0302(90)78643-2.
[58] BOITZ L I, MAYER H K. Evaluation of furosine, lactulose and acidsoluble beta-lactoglobulin as time temperature integrators for whipping cream samples at retail in Austria[J]. International Dairy Journal, 2015, 50: 24-31. DOI:10.1016/j.idairyj.2015.06.002.
[59] CHOUKRI A, GUINGAMP M F, HUMBERT G, et al. A new analytical approach to differentiate heated commercial milks[J]. Proceeding of European Conference on Food Chemistry VI, 1992, 2: 563-568.
Effect of Heat Treatment on Milk Components and Changes in Heat-Sensitive Components: A Review
YANG Jinhui1,2, LI Songli1,*, ZHENG Nan1, WEN Fang1, WANG Jiaqi1
(1. Ministry of Agriculture-Milk Risk Assessment Laboratory, Ministry of Agriculture-Milk and Dairy Product Inspection Center, State Key Laboratory of Animal Nutrition, Institute of Animal Science, Chinese Academy of Agricultural Sciences, Beijing 100193, China; 2. Animal Science Unit, Gembloux Agro-Bio Tech, University of Liège, Gembloux 5030, Belgium)
Heat processing is necessary to effectively inactivate pathogenic bacteria in raw milk but simultaneously affect milk components. Whey protein denaturation and aggregation, lactose isomerization and degradation, and Maillard reaction occur successively in milk subjected to heat treatment at increasing temperatures. The reduced activity of active components (e.g. enzyme and whey protein) or the formation of reaction products (e.g. lactulose and furosine) indicates the heat load during thermal processing. Heat treatment conditions for milk as well as physiochemical changes and changes in the corresponding sensitive components during the process are discussed in this paper.
milk components; heat treatment; heat-sensitive components; heat-induced changes
10.7506/spkx1002-6630-201707048
TS252.42
A
1002-6630(2017)07-0302-07
杨晋辉, 李松励, 郑楠, 等. 热处理对牛乳成分的影响以及热敏感指标的变化研究进展[J]. 食品科学, 2017, 38(7): 302-308. DOI:10.7506/spkx1002-6630-201707048. http://www.spkx.net.cn
YANG Jinhui, LI Songli, ZHENG Nan, et al. Effect of heat treatment on milk components and changes in heat-sensitive components: a review[J]. Food Science, 2017, 38(7): 302-308. (in Chinese with English abstract)
10.7506/spkx1002-6630-201707048. http://www.spkx.net.cn
2016-04-29
中国农业科学院科技创新工程项目(ASTIP-IAS12);国家现代农业(奶牛)产业技术体系建设专项(nycytx-04-01);农业部生鲜乳质量安全风险评估专项(GJFP2015009)
杨晋辉(1987—),男,博士,研究方向为牛乳质量评定。E-mail:710593491@163.com
*通信作者:李松励(1983—),女,助理研究员,博士研究生,研究方向为生鲜乳质量安全风险评估。E-mail:37860538@qq.com

