外泌体对组织纤维化调节作用的研究进展
饶志坚,常芸,王世强
(1.国家体育总局体育科学研究所,北京100061;2.上海体育学院运动科学学院,上海200438;3.湖南工业大学体育学院,湖南株洲412000)
·综述·
外泌体对组织纤维化调节作用的研究进展
饶志坚1,2,常芸1,王世强3
(1.国家体育总局体育科学研究所,北京100061;2.上海体育学院运动科学学院,上海200438;3.湖南工业大学体育学院,湖南株洲412000)
外泌体是由细胞释放的一种纳米囊泡,包括心肌细胞、肝细胞及多种干细胞在内的各种细胞都会释放外泌体。外泌体在细胞间起着通讯作用,它携带着信使RNA、微RNA和蛋白质参与了几乎所有病理生理过程。组织细胞损伤后释放的外泌体能通过触发炎症、激活成纤维细胞等途径启动修复和(或)再生反应,导致组织纤维化。而干细胞释放的外泌体则能通过促进细胞存活、减少细胞凋亡等途径减轻组织纤维化。本文综述不同来源的外泌体对几种常见组织纤维化调节作用的研究进展。
外泌体;组织纤维化;微RNA;干细胞
组织纤维化,包括心肌纤维化、肝纤维化、肾纤维化和肺纤维化等是许多疾病致残和致死的主要原因之一。尽管纤维化发生机制尚未阐明,但成纤维细胞的激活被认为是组织纤维化的中心环节[1]。成纤维细胞与其他细胞和(或)细胞因子之间的信息交流在组织纤维化过程中发挥关键作用,如内皮型一氧化氮合酶活性下降[2]或血小板源性生长因子水平上升[3]及转化生长因子β(transforming growth factor-β,TGF-β)的生成[4]可导致成纤维细胞的激活和迁移。然而,近年来大量的研究发现,组织纤维化过程中细胞和因子间还有一种交流通路,称为外泌体[5]。外泌体是一种直径为30~100 nm的囊泡,携带着信使RNA(mRNA)、微RNA(microRNA,miRNA)和蛋白质等内容物,在细胞间起着通讯介质的作用,参与了几乎所有的生理和病理过程[6]。近年来的研究表明,外泌体参与了组织纤维化的形成过程,外泌体内容物可与细胞外基质相互影响,包括整合素、基质金属蛋白酶(matrix metalloprotenases,MMP)和免疫球蛋白超家族成员[7]。因此有人提出外泌体可能成为新的纤维化诊断指标。此外,干细胞移植是治疗组织纤维化的一种新技术,但在治疗过程中有许多困难,如到达病灶的干细胞少、病灶微环境杀死干细胞等。而有学者发现,干细胞释放的外泌体具有干细胞的部分功能[8],且外泌体可通过血液将其内容物携带到靶细胞,并能保护其内容物不被酶降解,因此外泌体有可能应用于治疗组织纤维化。本文简要综述了近几年外泌体和组织纤维化的研究进展,为进一步的研究提供思路。
1 外泌体
外泌体是密度为1.13~1.19 kg·L-1纳米囊泡,电镜下呈圆形或杯状结构,100 000×g离心可沉淀[9]。这些纳米囊泡源于多囊泡体,多囊泡体的膜向内凹陷,形成一个膜包围的结构,其基部逐渐与多囊泡体的膜分离,脱落后形成腔内小囊泡,小囊泡里面包裹的主要是细胞质。多囊泡体的泡膜与质膜融合,导致其中的小囊泡排到细胞外环境中,即为外泌体。因此,外泌体的分子组成可反应其来源,靶向到特定的细胞群并影响这些细胞的功能。外泌体可由多种细胞形成和释放,如心脏干/祖细胞(cardiac stem/progenitor cells,CSC/CPC)、心肌细胞、肝星状细胞(hepatic stellate cells,HSC)、肝细胞、T细胞、胚胎干细胞(embryonic stem cells,ESC)和间充质干细胞(mesenchymal stem cells,MSC)等。目前,国内外关于外泌体形成和释放机制的研究很少。Abdullah等[10]发现,淀粉样蛋白可通过增强c-Jun氨基端激酶磷酸化而抑制星形胶质细胞外泌体的释放;而Sinha等[11]发现,皮质肌动蛋白结合蛋白(cortactin)可通过调控肌动蛋白来促进外泌体的释放。尽管外泌体形成和释放的机制仍待进一步研究,但能确定的是外泌体能将其内容物从一个细胞输送到另一个细胞,且能保护其内容物不被酶降解,因此它能调节细胞间的信息交流。细胞应激可导致细胞释放的外泌体携带的mRNA和蛋白质发生变化[12],表明外泌体一定程度上可反映细胞所处的生理状态[13],外泌体传送的功能分子可以维持或改变特定细胞的功能状态,因此外泌体有望从诊断、治疗和药物呈递等方面改变许多疾病的治疗面貌。
2 组织纤维化
纤维化是指各种原因造成组织损伤的愈合反应,表现为组织内细胞外基质过度沉积,组织顺应性下降,引起组织功能障碍。目前,组织纤维化的具体机制仍不明确,但可能与以下几种因素有关[14]:①血管紧张素-肾素-醛固酮系统的激活;②炎症反应与氧化应激;③生长因子的分泌及释放;④血管内皮功能障碍。这些因素通过作用于组织细胞、成纤维细胞、炎症细胞(中性粒细胞,单核-巨噬细胞,淋巴细胞等)、内皮细胞和细胞外基质,最终导致组织纤维化[15-16]。可见,组织纤维化是通过多种效应细胞相互作用而实现的。之前认为细胞间的相互作用是通过自分泌、旁分泌和远距分泌等方式分泌调节因子而达成的。但近十年来发现,外泌体也可作为细胞间信息交流的方式,表明外泌体可能在组织纤维化过程中发挥一定的作用[5]。
目前,纤维化的诊断方法主要有以下几种[17]:①组织学检查,是诊断组织纤维化可靠的方法,但对组织有较大创伤;②影像学方法,如B超、CT和MRI等,简单易行但特异性不高;③体液(血清或尿液)标志物,包括细胞外基质成分、降解产物、参与其代谢的酶和细胞因子等,易于测定且是非侵入性的,但无组织特异性。各种检测手段都有其诊断价值,无法用一个指标完全替代其他指标,临床上一般结合多种诊断方法进行综合评价。
除了器官移植,临床上尚无治疗组织纤维化的有效手段,而器官移植面临许多困难,包括捐赠器官少、费用高和免疫排斥反应等,因此亟需应用更加有效的治疗方法。目前研究认为,潜在的治疗靶点有血管紧张素系统、内皮细胞系统、生长因子和炎症因子等,但由于对组织纤维化过程的认识还不够透彻,而且参与组织纤维化过程的调节因子有多重功能,且其调节和激活下游信号因子十分复杂,因而临床前实验和临床试验得出的结果往往相互矛盾[18]。比如主动脉缩窄术后,抑制TGF-β受体可减少纤维化及胶原蛋白的表达[19];但另一项采用抗TGF-β的方法发现,尽管成纤维细胞激活减少,胶原蛋白转录水平也下降,但心功能并未明显改善[20],且还有可能增加死亡率[21]。因此,在无更多实验证实其临床效应之前,应用TGF-β疗法还需谨慎。干细胞因具有免疫调节能力、自我更新能力和分化能力,而且获取成本低而备受关注。因此,研究人员认为干细胞移植可能是一种治疗组织纤维化有效的方法,对此展开研究并得到了积极结果[22]。但干细胞治疗靶向性不强,且在输往损伤组织过程中及在损伤组织微环境中易受影响。研究发现,干细胞可分泌外泌体,且其外泌体具有其部分功能。因此,干细胞外泌体也可用于治疗组织纤维化[23]。
3 外泌外对组织纤维化的调节
3.1 外泌体与心肌纤维化
心肌纤维化是由各种病因所致心肌细胞损伤引起的。受损的心肌细胞可释放外泌体,且成分与正常心肌细胞释放的外泌体成分有较大差异,因而可引发修复过程,最终导致心肌纤维化。如糖尿病性心肌病患者通常伴随心肌纤维化。Wang等[24]发现,糖尿病性心肌病患者心肌细胞释放的外泌体中热休克蛋白20(heat shock protein 20,HSP20)含量显著低于对照组,表明HSP20表达下降可能是此类患者心肌纤维化的原因之一。为进一步证实HSP20是心肌纤维化的关键因子,该团队随后采用链脲佐菌素(streptozotocin,STZ)处理野生型小鼠和HSP20过表达的转基因小鼠诱导糖尿病。结果发现,HSP20过表达可减轻STZ引起的心肌纤维化。提取心肌细胞外泌体发现,外泌体中HSP20水平高于对照组,用阻断剂阻断外泌体的形成后可抵消HSP20对糖尿病性心肌病的保护效应。而通过一些干预方式可促进正常心肌细胞释放外泌体,这种外泌体有减轻心肌纤维化的功能,如运动能有效地防治糖尿病性心肌病。Chaturvedi等[25]发现,运动可通过促进心肌细胞释放外泌体来减轻糖尿病性心肌病患者心肌纤维化,这种外泌体携带的miR-455,-29b,-323-5p和-466水平升高,进而下调MMP-9的表达,阻断下游细胞外基质重塑。此外,心肌梗死再灌注对心肌造成二次损伤后,采用远端缺血适应(remote ischemic conditioning,RIC)可有效保护左心室舒张功能,减少心肌间充质纤维化,减少氧化应激。Yamaguchi等[26]发现,RIC组血清外泌体中miR-29a水平升高,低氧处理C2C12细胞后,它们释放的外泌体中miR-29a水平也显著升高,而miR-29a是组织纤维化的关键调节因子之一(有抗纤维化作用)。提示再灌后RIC可上调外泌体中miR-29a水平,进而减轻心肌纤维化。
干细胞移植(主要是CPC/CSC,ESC和MSC)可用于治疗心肌梗死、减轻心肌纤维化,但梗死后的缺血微环境可杀灭干细胞,因而降低治疗效果。随后研究发现,外泌体具有其母细胞的部分功能,因此针对干细胞外泌体能否治疗心肌梗死、减轻心肌纤维化展开了许多研究。
CPC/CSC移植可治疗心肌病,CSC释放的外泌体能改善心功能,减少心肌细胞的凋亡,减轻心肌纤维化[27]。Gray等[28]体外低氧处理CPC,然后提取外泌体。结果发现,与对照组相比,低氧处理后CPC释放的外泌体中有7种miRNA(miR-15b,-17,-20a,-103,-199a,-210和-292)表达上调。提示缺血/低氧刺激CPS释放的外泌体中miRNA表达上调,进而作用于成纤维细胞,降低其促纤维化因子的表达,减轻心肌纤维化。
MSC可用于治疗心肌梗死,除了可分化的特性,它还能通过释放外泌体保护梗死后的心肌细胞。在体实验表明,缺血预适应后MSC释放的外泌体可显著减轻梗死后的心肌纤维化,外泌体中miR-21,-22,-24,-199a-3p和-210含量升高,然后直接作用于甲基CpG结合蛋白2而减少心肌细胞凋亡[29]。此外,Zhao等[30]也发现,人脐带间充质干细胞释放的外泌体可提高心收缩功能,减轻心肌纤维化,减少心肌细胞的凋亡,这些功能可能与外泌体调节Bcl-2家族成员的表达有关。MSC除能通过减少心肌细胞凋亡减轻心肌纤维化外,用MSC外泌体预处理CSC后,CSC的增殖能力和分化能力增强,能更有效地减轻心肌纤维化,修复心功能,这可能与MSC释放的外泌体中携带有复杂的mRNA和miRNA基因网络有关[23]。
ESC有再生心肌细胞的功能,其释放的外泌体也能增强心功能,促进血管生成及心肌细胞的存活,减少心肌纤维化。人ESC来源的心血管祖细胞及其释放的外泌体可改善慢性心衰小鼠的心功能,并减少纤维化面积(尽管与对照组无显著性差异),在其外泌体内发现49种miRNA表达较高,其中78%可通过增加心肌细胞存活和(或)增殖及促进DNA修复来提高心功能,同时减轻纤维化及心衰[31]。ESC外泌体除了直接增加心肌细胞的存活来减轻心肌纤维化外,还可增强CPC的存活并促进其增殖,进而减轻心肌纤维化。其可能机制是ESC外泌体中富含miR290-295基因簇,尤其是miR-294,它们能增强CPC存活和促进CPC增殖[32]。
可见CPC/CSC,MSC和ESC除了本身可用于减轻心肌纤维化,它们释放的外泌体也有减轻心肌纤维化的功能。这一功能可能是通过外泌体携带的miRNA来增加受损心肌细胞的存活率和(或)减轻炎症实现的。
3.2 外泌体与肝纤维化
肝纤维化是由肝细胞损伤引发的。在肝纤维化发生的过程中,受损肝细胞释放的外泌体可通过多种途径发挥其促纤维化作用。首先肝细胞可释放含有多种自体RNA(self-RNA)的外泌体,这些自体RNA能激活HSC的Toll样受体3(Toll-like recep⁃tor 3,TLR3),然后促使HSC表达的CC类趋化因子配体20(C-C motif chemokine ligand 20,CCL20)增多,CCL20再募集大量CCR6+和γδ T细胞,最终使白细胞介素(interleukin,IL)-17A,IL-1β和IL-21在肝纤维化早期表达升高,而敲除TLR3基因后IL-17A的表达水平降低,肝纤维化面积也减少[33]。其次,受损肝细胞释放的外泌体能直接上调纤维化标志物的水平,如TGF-β受体Ⅱ、α平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)和Ⅰ型胶原蛋白α2,这可能与外泌体中前体miR-17-92基因簇表达上升有关[34]。最后,受损肝细胞释放的外泌体可抑制抗纤化因子的表达,如miR-122可使低氧诱导因子1α、波形蛋白及丝裂原活化蛋白激酶3等组织重塑因子表达上调,从而促进肝纤维化[35]。
肝纤维化通路主要由HSC调控,它可生成促纤维化因子,如结缔组织生长因子CCN2。研究发现,肝细胞释放的外泌体除了通过上述几个途径调节肝纤维化过程外,还能通过调节HSC的活动来影响纤维化过程。外泌体一方面可调节HSC表达CCN2,另一方面还能调节CCN2在HSC间的转运[36]。外泌体对CCN2的调节可能是通过其携带的miR-214实现的。肝纤维化时,CCN2表达上调,而miR-214水平降低,miR-214可直接结合CCN2 3’-UTR从而抑制CCN2及其下游基因的表达[37]。因此,HSC外泌体中miR-214含量下降可能是肝纤维化的诱因。Twist1能上调miR-214的表达,而肝纤维化发生时外泌体中Twist1的表达被抑制,且实验证实休眠HSC释放的外泌体中Twist1表达水平很高,但HSC激活后释放的外泌体中Twist1表达水平却很低,表明肝损伤导致HSC激活后Twist1的表达被抑制,从而使miR-214表达下降,CNN2的表达升高,最终形成肝纤维化[38]。可见,外周外泌体中Twist1,miR-214和CCN2的表达水平可反映肝纤维化程度。因此,血清外泌体能可作为新的诊断肝纤维化的生物标志物。
肝内其他细胞,如血窦内皮细胞能通过释放外泌体调控HSC的迁移和激活,从而调节肝纤维化过程。内皮细胞释放含有鞘氨醇激酶1(sphingosine kinase 1,SK1)的外泌体,外泌体通过纤连蛋白-整合素依赖途径黏附到HSC上,再通过发动蛋白-2依赖途径内化到HSC内,然后激活HSC并促进它的迁移,进而引起肝纤维化。SK1可由成纤维细胞生长因子2(fibroblast growth factor-2,FGF-2)激活,而FGF-2已被证实在肝纤维化过程中对外泌体的释放十分重要[39]。鞘氨醇-1-磷酸(sphingosine 1-phosphate,S1P)是SK1的下游蛋白,SK1含量升高的外泌体中S1P含量也很高,S1P能募集HSC,并通过激活丝氨酸/苏氨酸激酶导致HSC的迁移。S1PR2的抑制剂能减轻四氯化碳诱导的肝纤维化[40]。
可见,肝损伤后,肝中各种来源的外泌体通过多种途径引起肝纤维化,但干细胞释放的外泌体却可用于治疗肝纤维化。如Li等[41]发现,MSC释放的外泌体可减轻肝纤维化、炎症和胶原堆积,其可能机制是MSC释放的外泌体下调TGF-β1及p-Smad2的表达,减少Ⅰ型和Ⅲ型胶原蛋白的生成,从而减少上皮间充质转化。
3.3 外泌体与肾纤维化
在肾纤维化过程中,不同类型细胞释放的外泌体通过不同途径发挥其调节作用。如肾近端小管上皮细胞损伤后释放的外泌体携带的基因信息(如TGF-β1mRNA)可激活肾间充质成纤维细胞,TGF-β1快速激活修复或(和)再生反应,促进成纤维细胞的增殖,上调α-SMA、F-肌动蛋白和Ⅰ型胶原蛋白的表达,最终导致纤维化[42]。而肾小球内皮细胞损伤后其释放的外泌体携带大量的TGF-β1mRNA,通过TGF-β/Smad3信号通路促进肾小球系膜细胞内α-SMA的表达,使肾细胞外基质过度堆积,形成肾纤维化[43]。人体试验也发现,从尿液提取的外泌体中miR-29c与Smad3和MMP2呈负相关,且miR-29c表达水平与肾慢性化指数(即肾小球硬化、纤维性新月体、小管萎缩和间充质纤维化的评分,分数越高纤维化越严重)也呈负相关[44],表明外泌体中的miR-29c可作为新的诊断肾纤维化的生物标志物。
受损肾细胞释放的外泌体可促进肾纤维化,而干细胞释放的外泌体却可用于治疗肾纤维化。如Wang等[45]发现,miR-Let7c-MSC通过释放含有miR-Let7c的外泌体抑制促纤维化因子(Ⅰ型胶原蛋白、MMP-9、TGF-β1和TGF-β1R)的基因表达,若使用外泌体抑制剂GW4869则可拮抗这一效应。这些结果表明,HSC通过释放携带miR-Let7c的外泌体至损伤区域,抑制促纤维化因子的基因表达,发挥其抗纤维化功能。
3.4 外泌体与其他组织纤维化
除上述几个重要的脏器组织外,其他组织纤维化与外泌体的研究较少。de Jong等[46]研究发现,内皮损伤后释放的外泌体中赖氨酰氧化酶样蛋白2(lysyl oxidase-like 2,LOXL2)表达上升2倍,这种外泌体可增强胶原交联活性,促进真皮细胞外基质重塑;而LOXL 2基因敲除的内皮细胞损伤后释放的外泌体不能促进真皮细胞外基质重塑,表明内皮细胞损伤后释放的外泌体通过LOXL2调控真皮细胞外基质的重塑,进而影响皮肤纤维化和伤口愈合。
此外,Choi等[47]用人MSC(human MSC,hMSC)及其释放的外泌体干预肺纤维化小鼠。结果发现,hMSC可分化成Ⅰ型肺细胞并成功表达表面蛋白,直接替代纤维化,从而减轻肺纤维化;而hMSC释放的外泌体虽然效果不如直接移植hMSC,但仍然能显著减轻胶原堆积和炎症等非特异性肺纤维化的症状。
4 结语
外泌体作为一种细胞间的通讯介质,参与了组织纤维化的病理生理过程(图1)。目前,对外泌体形成和释放的机制所知甚少,是今后亟待研究的领域。外泌体所携带的功能分子受其母细胞种类及其母细胞所处环境的影响,对不同靶细胞的功能也有所不同。组织细胞损伤后释放的外泌体可触发炎症、引起修复或(和)再生反应,导致组织纤维化。因此,外泌体及其内容物可作为诊断组织纤维化的新标志物,避免活检对组织器官的损伤,但组织纤维化的特异性外泌体还需更进一步的验证。而干细胞(如ESC,MSC和CSC/CPC)释放的外泌体却能减轻组织纤维化、修复组织器官的功能。因此,这些外泌体可被用于治疗组织纤维化,克服干细胞移植治疗纤维化的一些障碍。此外,还能通过直接构建外泌体将抗纤维化药物载入外泌体中,用于治疗组织纤维化。综上所述,外泌体在组织纤维化的诊断、治疗和药物呈递方面都有一定的应用前景,但还需更多的研究了解其临床影响。
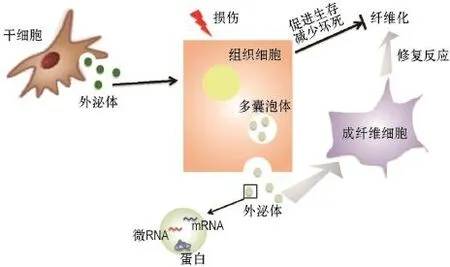
图1 外泌体在组织纤维化过程中的作用.
[1]Frangogiannis NG.Fibroblast-extracellular matrix interactions in tissue fibrosis[J].Curr Pathobiol Rep,2016,4(1):11-18.
[2]Shah V,Haddad FG,Garcia-Cardena G,Frangos JA,Mennone A,Groszmann RJ,et al.Liver sinu⁃soidal endothelial cells are responsible for nitric oxide modulation of resistance in the hepatic sinu⁃soids[J].J Clin Invest,1997,100(11):2923-2930.
[3]DeLeve LD.Liver sinusoidal endothelial cells in hepatic fibrosis[J].Hepatology,2015,61(5):1740-1746.
[4]Evans RA,Tian YC,Steadman R,Phillips AO. TGF-Beta1-mediated fibroblast-myofibroblast ter⁃minal differentiation-the role of Smad proteins[J]. Exp Cell Res,2003,282(2):90-100.
[5]van Niel G,Porto-Carreiro I,Simoes S,Raposo G. Exosomes:a common pathway for a specialized function[J].J Biochem,2006,140(1):13-21.
[6]De Toro J,Herschlik L,Waldner C,Mongini C. Emerging roles of exosomes in normal and patho⁃logical conditions:new insights for diagnosis and therapeutic applications[J].Front Immunol,2015,6:203.
[7]Vrijsen KR,Sluijter JP,Schuchardt MW,van Balkom BW,Noort WA,Chamuleau SA,et al. Cardiomyocyte progenitor cell-derived exosomes stimulate migration of endothelial cells[J].J Cell Mol Med,2010,14(5):1064-1070.
[8]Yao K,Ricardo SD.Mesenchymal stem cells as novel micro-ribonucleic acid delivery vehicles in kidney disease[J].Nephrology(Carlton),2016,21(5):363-371.
[9]Théry C,Amigorena S,Raposo G,Clayton A. Isolation and characterization of exosomes from cell culture supernatants and biological fluids[J]. Curr Protoc Cell Biol,2006,Chapter 3:Unit 3.22.
[10]Abdullah M,Takase H,Nunome M,Enomoto H,Ito J,Gong JS,et al.Amyloid-β reduces exosome release from astrocytes by enhancing JNK phos⁃phorylation[J].J Alzheimers Dis,2016,53(4):1433-1441.
[11]Sinha S,Hoshino D,Hong NH,Kirkbride KC,Grega-Larson NE,Seiki M,et al.Cortactin promotes exosome secretion by controlling branched actin dynamics[J].J Cell Biol,2016,214(2):197-213.
[12]de Jong OG,Verhaar MC,Chen Y,Vader P,Gremmels H,Posthuma G,et al.Cellular stress conditions are reflected in the protein and RNA content of endothelial cell-derived exosomes[J].J Extracell Vesicles,2012,1:18396-http://dx.doi. org/10.3402/jev.v1i0.18396
[13]Yellon DM,Davidson SM.Exosomes:nanoparti⁃cles involved in cardioprotection?[J].Circ Res,2014,114(2):325-332.
[14]Wynn TA.Cellular and molecular mechanisms of fibrosis[J].J Pathol,2008,214(2):199-210.
[15]Prabhu SD,Frangogiannis NG.The biological basis for cardiac repair after myocardial infarction:from inflammation to fibrosis[J].Circ Res,2016119(1):91-112.
[16]Kong P,Christia P,Frangogiannis NG.The patho⁃genesis of cardiac fibrosis[J].Cell Mol Life Sci,2014,71(4):549-574.
[17]Manning DS,Afdhal NH.Diagnosis and quantita⁃tion of fibrosis[J].Gastroenterology,2008,134(6):1670-1681.
[18]Travers JG,Kamal FA,Robbins J,Yutzey KE,Blaxall BC.Cardiac fibrosis:the fibroblast awakens[J].Circ Res,2016,118(6):1021-1040.
[19]Engebretsen KV,Skårdal K,Bjørnstad S,Marstein HS,Skrbic B,Sjaastad I,et al.Attenuated development of cardiac fibrosis in left ventricular pressure overload by SM16,an orally active inhibitor of ALK5[J].J Mol Cell Cardiol,2014,76:148-157.
[20]Kuwahara F,Kai H,Tokuda K,Kai M,Takeshita A,Egashira K,et al.Transforming growth factor-beta function blocking prevents myocardial fibrosis and diastolic dysfunction in pressure-overloaded rats[J].Circulation,2002,106(1):130-135.
[21]Frantz S,Hu K,Adamek A,Wolf J,Sallam A,Maier SK,et al.Transforming growth factor beta inhibition increases mortality and left ventricular dil⁃atation after myocardial infarction[J].Basic Res Cardiol,2008,103(5):485-492.
[22]Volarevic V,Lako M,Stojkovic M.Stem cells,inflammation,and fibrosis[J].Stem Cells Int,2016;2016:3891386.
[23]Zhang Z,Yang J,Yan W,Li Y,Shen Z,Asahara T. Pretreatment of cardiac stem cells with exosomes derived from mesenchymal stem cells enhances myocardial repair[J].J Am Heart Assoc,2016,5(1):e002856.
[24]Wang X,Gu H,Huang W,Peng J,Li Y,Yang L,et al.Hsp20-mediated activation of exosome biogenesis in cardiomyocytes improves cardiac function and angiogenesis in diabetic mice[J]. Diabetes,2016,65(10):3111-3128.
[25]Chaturvedi P,Kalani A,Medina I,Familtseva A,Tyagi SC.Cardiosome mediated regulation of MMP9 in diabetic heart:role of mir29b and mir455 in exer⁃cise[J].J Cell Mol Med,2015,19(9):2153-2161.
[26]Yamaguchi T,Izumi Y,Nakamura Y,Yamazaki T,Shiota M,Sano S,et al.Repeated remote isch⁃emic conditioning attenuates left ventricular remod⁃eling via exosome-mediated intercellular communi⁃cation on chronic heart failure after myocardial infarction[J].Int J Cardiol,2015,178:239-246.
[27]Vandergriff AC,de Andrade JB,Tang J,Hensley MT,Piedrahita JA,Caranasos TG,et al.Intravenous cardiac stem cell-derived exosomes ameliorate cardiac dysfunction in doxorubicin induced dilated cardiomyopathy[J].Stem Cells Int,2015,2015:960926.
[28]Gray WD,French KM,Ghosh-Choudhary S,Maxwell JT,Brown ME,Platt MO,et al.Identifica⁃tion of therapeutic covariant microRNA clusters in hypoxia-treated cardiac progenitor cell exosomes using systems biology[J].Circ Res,2015,116(2):255-263.
[29]Feng Y,Huang W,Wani M,Yu X,Ashraf M.Isch⁃emic preconditioning potentiates the protective effect of stem cells through secretion of exosomes by targeting Mecp2 via miR-22[J].PLoS One,2014,9(2):e88685.
[30]Zhao Y,Sun X,Cao W,Ma J,Sun L,Qian H,et al. Exosomes derived from human umbilical cord mesen⁃chymal stem cells relieve acute myocardial isch⁃emic injury[J].Stem Cells Int,2015,2015:761643.
[31]Kervadec A,Bellamy V,El Harane N,Arakélian L,Vanneaux V,Cacciapuoti I,et al.Cardiovascular progenitor-derived extracellular vesicles recapitu⁃late the beneficial effects of their parent cells in the treatment of chronic heart failure[J].J Heart Lung Transplant,2016,35(6):795-807.
[32]Khan M,Nickoloff E,Abramova T,Johnson J,Verma SK,Krishnamurthy P,et al.Embryonic stem cell-derived exosomes promote endogenous repair mechanisms and enhance cardiac function following myocardial infarction[J].Circ Res,2015,117(1):52-64.
[33]Seo W,Eun HS,Kim SY,Yi HS,Lee YS,Park SH,et al.Exosome-mediated activation of Tolllike receptor 3 in stellate cells stimulates interleu⁃kin-17 production by γδ T cells in liver fibrosis[J]. Hepatology,2016,64(2):616-631.
[34]Brandon-Warner E,Feilen NA,Culberson CR,Field CO,deLemos AS,Russo MW,et al. Processing of miR17-92 cluster in hepatic stellate cells promotes hepatic fibrogenesis during alcoholi nduced injury[J].Alcohol Clin Exp Res,2016,40(7):1430-1442.
[35]Csak T,Bala S,Lippai D,Satishchandran A,Catalano D,Kodys K,et al.MicroRNA-122 regu⁃lates hypoxia-inducible factor-1 and vimentin in hepatocytes and correlates with fibrosis in dietinduced steatohepatitis[J].Liver Int,2015,35(2):532-541.
[36]Charrier A,Chen R,Chen L,Kemper S,Hattori T,Takigawa M,et al.Exosomes mediate intercellular transfer of pro-fibrogenic connective tissue growth factor(CCN2)between hepatic stellate cells,the principal fibrotic cells in the liver[J].Surgery,2014,156(3):548-555.
[37]Chen L,Charrier A,Zhou Y,Chen R,Yu B,Agarwal K,et al.Epigenetic regulation of connectivetissue growth factor by microRNA-214 delivery in exosomes from mouse or human hepatic stellate cells[J].Hepatology,2014,59(3):1118-1129.
[38]Chen L,Chen R,Kemper S,Charrier A,Brigstock DR.Suppression of fibrogenic signaling in hepatic stellate cells by Twist1-dependent microRNA-214 expression:role of exosomes in hori⁃zontal transfer of Twist1[J].Am J Physiol Gastroin⁃test Liver Physiol,2015,309(6):G491-G499.
[39]de Assuncao TM,Lomberk G,Cao S,Yaqoob U,Mathison A,Simonetto DA,et al.New role for Kruppel-like factor 14 as a transcriptional activator involved in the generation of signaling lipids[J].J Biol Chem,2014,289(22):15798-15809.
[40]Wang R,Ding Q,Yaqoob U,de Assuncao TM,Verma VK,Hirsova P,et al.Exosome adherence and internalization by hepatic stellate cells triggers sphingosine 1-phosphate-dependent migration[J]. J Biol Chem,2015,290(52):30684-30696.
[41]Li T,Yan Y,Wang B,Qian H,Zhang X,Shen L,et al.Exosomes derived from human umbilical cord mesenchymal stem cells alleviate liver fibrosis[J].Stem Cells Dev,2013,22(6):845-854.
[42]Borges FT,Melo SA,Özdemir BC,Kato N,Revuelta I,Miller CA,et al.TGF-β1-containing exosomes from injured epithelial cells activate fibro⁃blasts to initiate tissue regenerative responses and fibrosis[J].J Am Soc Nephrol,2013,24(3):385-392.
[43]Wu XM,Gao YB,Cui FQ,Zhang N.Exosomes from high glucose-treated glomerular endothelial cells activate mesangial cells to promote renal fibrosis[J].Biol Open,2016,5(4):484-491.
[44]Solé C,Cortés-Hernández J,Felip ML,Vidal M,Ordi-Ros J.miR-29c in urinary exosomes as pre⁃dictor of early renal fibrosis in lupus nephritis[J]. Nephrol Dial Transplant,2015,30(9):1488-1496.
[45]Wang B,Yao K,Huuskes BM,Shen HH,Zhuang J,Godson C,et al.Mesenchymal stem cells deliver exogenous microRNA-let7c via exosomes to atten⁃uate renal fibrosis[J].Mol Ther,2016,24(7):1290-1301.
[46]de Jong OG,van Balkom BW,Gremmels H,Verhaar MC.Exosomes from hypoxic endothelial cells have increased collagen crosslinking activity through up-regulation of lysyl oxidase-like 2[J].J Cell Mol Med,2016,20(2):342-350.
[47]Choi M,Ban T,Rhim T.Therapeutic use of stem cell transplantation for cell replacement or cytoprotective effect of microvesicle released from mesenchymal stem cell[J].Mol Cells,2014,37(2):133-139.
Research progress in exosomes in tissue fibrosis
RAO Zhi-jian1,2,CHANG Yun1,WANG Shi-qiang3
(1.China Institute of Sport Science,Beijing 100061,China;2.School of Kinesiology,Shanghai University of Sport,Shanghai 200438,China;3.College of Physical Education,Hunan University of Technology,Zhuzhou 412000,China)
Exosomes are extracellular nanovesicles secreted by a variety of cell types such as cardiomyocyte,hepatocytes,and stem cells.They carry specific sets of mRNA,microRNA,and proteins, which play a role in intercellular communication in almost each physiological and pathological process. Exosomes,which are released after tissue cell injury,can initiate repair/regeneration responses by triggering inflammation and active fibroblast,and finally lead to tissue fibrosis.However,exosomes released by stem cells can retard tissue fibrosis by enhancing cell survival and reducing apoptosis.In this paper, we reviewed the research progress in the relationship between exosomes and tissue fibrosis.
exosomes;tissue fibrosis;microRNA;stem cells
CHANG Yun,E-mail:changyun@ciss.cn
R963
:A
:1000-3002-(2017)03-0262-07
10.3867/j.issn.1000-3002.2017.03.010
Foundation item:The project supported by Fad of CISS-BSF16-21 from Ministry of science and Technoloqy of China; Humam Exercise Capability Development and Protection from the Key Laboratory of shanghai Municipality(11DZ2261100)
2016-08-29接受日期:2017-03-21)
(本文编辑:齐春会)
国家体育总局体育科学研究所基本科研业务(16-21);上海市人类运动能力开发与保障重点实验室资助(11DZ2261100)
饶志坚,男,博士研究生,主要从事运动心脏病生理学研究,E-mail:1101294556@qq.com;常芸,女,运动医学博士,研究员,博士生导师,主要从事运动心脏病生理学研究。
常芸,E-mail:changyun@ciss.cn

