卵巢未成熟畸胎瘤的临床病理特点及治疗方式
刘 艳, 王 肖, 赵 婷, 卢 媛
复旦大学附属妇产科医院妇科, 上海 200011
·短篇论著·
卵巢未成熟畸胎瘤的临床病理特点及治疗方式
刘 艳, 王 肖, 赵 婷, 卢 媛*
复旦大学附属妇产科医院妇科, 上海 200011
目的: 探讨卵巢未成熟畸胎瘤的临床病理特点以及不同手术方式(卵巢肿块剥除术、附件切除术、全子宫+双附件切除术)对其预后的影响,分析卵巢肿块剥除术用于临床明显早期卵巢未成熟畸胎瘤的可行性。方法: 回顾性分析1997年7月至2015年8月在复旦大学附属妇产科医院诊治并经病理证实的50例卵巢未成熟畸胎瘤患者的临床资料,依据手术方式分为3组。比较各组患者的临床病理特点及预后情况。结果: 50例患者无失访,随访时间3~207个月。FIGO分期:ⅠA期34例,ⅠC1期10例,ⅠC2期3例,ⅡB、ⅢB、ⅢC各1例。卵巢肿块剥除术组、患侧附件切除术组、全子宫+双侧附件切除术组5年无病生存率分别是100%、86.8%、100%。行保留生育功能手术的45例患者中,明显早期患者42例。50例患者中无病死,总的5年无病生存率为91.0%。50例患者中,复发4例,复发后3例患者接受补充手术治疗、1例接受辅助化疗,再次手术患者的术后病理提示复发病灶为成熟畸胎瘤。45例保留生育功能手术的患者中,44例月经恢复正常,仅1例术后月经周期缩短。术后有生育要求的患者共13例,其中11例患者成功受孕并正常分娩,2例患者至研究末期未孕(1例因输卵管因素、1例原因不明)。结论: 卵巢未成熟畸胎瘤初次治疗时多为早期,对局限于卵巢的明显早期的未成熟畸胎瘤患者可行卵巢肿块剥除术,术后根据病理分级选择化疗方案。
卵巢未成熟畸胎瘤;卵巢肿块剥除术;附件切除术;化疗;预后
卵巢未成熟畸胎瘤约占卵巢恶性生殖细胞瘤的30%[1-2],好发于青少年女性,多能早期发现,初次治疗时多为Ⅰ期[3]。目前普遍认为,对于希望保留生育功能的卵巢未成熟畸胎瘤年轻患者,不论期别早晚,只要子宫和对侧卵巢正常,均可进行保留生育功能的手术,切除患侧附件,且可仅对可疑淋巴结进行活检,无需进行盆腔淋巴结清扫术[4-5]。而对于病灶局限于卵巢且包膜完整的早期未成熟畸胎瘤患者,是否可以仅进行卵巢肿块剥除术,以尽可能地保留正常卵巢功能,目前尚不明确[5-6]。美国肿瘤综合协作网公布的卵巢癌临床实践指南[7](2016年,1版)明确提出,对ⅠA期Ⅰ级卵巢未成熟畸胎瘤患者进行保留生育功能的手术后,可密切随访观察而无需化疗。然而,对于ⅠA期Ⅱ级和Ⅲ级未成熟畸胎瘤术后患者是否必须进行化疗仍存在争议[2,6]。
本研究回顾性分析复旦大学附属妇产科医院1997年7月至2015年8月收治的50例卵巢未成熟畸胎瘤患者资料,探讨卵巢未成熟畸胎瘤的临床病理特点及不同手术方式对患者预后(如保留生育功能患者术后月经及生育情况)的影响,分析对局限于卵巢的早期未成熟畸胎瘤患者进行卵巢囊肿剥除术的安全性,并探讨明显早期Ⅱ、Ⅲ级卵巢未成熟畸胎瘤患者术后可否密切随访而不化疗。
1 资料与方法
1.1 一般资料 选取复旦大学附属妇产科医院1997年7月至2015年8月收治的卵巢未成熟畸胎瘤患者50例。查阅病史,记录患者的临床病理资料,并电话随访患者生存预后、术后生育及月经情况。随访时间截点为2016年1月;如果患者死亡,则以死亡时间为随访终止时间。总生存时间为病理确诊时间至因本疾病死亡的时间或末次随访时间。无病生存时间为病理确诊时间至疾病复发时间或末次随访时间。
1.2 肿瘤分期 将所有患者手术病理分期按照2015年国际妇产科联盟(FIGO)分期标准[8]重新进行。依据美国肿瘤综合协作网公布的卵巢癌临床实践指南(2016, 1版),未成熟畸胎瘤年轻患者经术中全面探查显示病灶局限时,多行保留生育功能的手术,可不行盆腔淋巴结清扫。Zhao等[9]研究也显示,对于局限于卵巢无明显盆腹腔病灶的早期患者可不行完整分期手术,且是否进行完整分期手术对早期患者预后无影响。因此,对未进行全面分期手术患者的分期可按照术中探查所见进行。肿瘤局限于卵巢(卵巢外盆腹腔、大网膜、肠壁未见病灶,未见可疑淋巴结肿大)且包膜完整者为ⅠA期;病灶包膜完整但手术致包膜破裂者暂分为ⅠC1期;包膜自然破裂为ⅠC2期;腹水细胞学阳性为ⅠC3期。肿瘤分级参照Norris等[10]1976年提出的标准。
1.3 统计学处理 采用SPSS 20.0统计软件进行分析。采用Kaplan-Meier法绘制生存曲线。采用Log-Rank检验分析预后的单因素差异,组间比较采用交叉表法。检验水准(α)为0.05。
2 结 果
2.1 患者临床病理特点 本组患者年龄10~39岁,平均(23.26±6.73)岁,其中患者年龄≥20岁者34例、<20岁者16例。主要以腹胀、腹痛、腹部包块为主要临床表现。肿块直径2.2~25 cm,平均(14.23±4.61) cm。合并对侧成熟畸胎瘤患者15例(30.0%)。50例患者中,术前行糖类抗原125(CA125)检测者37例,其中CA125>35 U/mL者26例(70.3%);行甲胎蛋白(AFP)检测者38例,其中AFP>9 ng/mL者30例(78.9%)。按照FIGO 2015年分期标准进行分期:ⅠA期34例,ⅠC1期10例,ⅠC2期3例,ⅡB期、ⅢA期、ⅢC期各1例。接受化疗和未接受化疗患者分别39例、11例。按照手术方式分组,所有患者的临床病理特点见表1。
2.2 明显早期患者的不同手术方式及术后处理 如果术中探查见病灶局限于卵巢,与周围组织无粘连,盆腹腔腹膜光滑完整,无明显可疑卵巢外病灶及肿大淋巴结,虽然未行完整分期手术,仍可认为是明显早期(Ⅰ期)。本研究中共42例患者符合此标准,13例患者行卵巢肿块剥除术。13例中,11例患者冰冻切片提示为成熟畸胎瘤,而术后病理提示为未成熟畸胎瘤,患者要求密切随访或联合化疗而暂不手术,故术后并未补充手术;1例患者术中病理即提示为卵巢未成熟畸胎瘤,但患者出于生育考虑拒绝行患侧附件切除术,术后联合化疗并密切随访;1例患者因急腹症急诊手术未行冰冻病理检查,术后病理提示为未成熟畸胎瘤,术后患者要求联合化疗并密切随访。其余29例患者行患侧附件切除术。
2.3 不同手术方式明显早期患者的临床特点比较 根据术后是否接受化疗,将42例明显早期卵巢未成熟畸胎瘤患者分为2组:化疗组32例,其中ⅠA期23例、ⅠC1期7例、ⅠC2期2例;未化疗组10例,其中ⅠA期7例、ⅠC1期2、ⅠC2期1例。本研究对明显早期卵巢未成熟畸胎瘤进行肿块剥除术和附件切除术的患者进行比较发现,两组患者除冰冻病理结果外,其余临床病理特点之间的差异均无统计学意义(表2)。
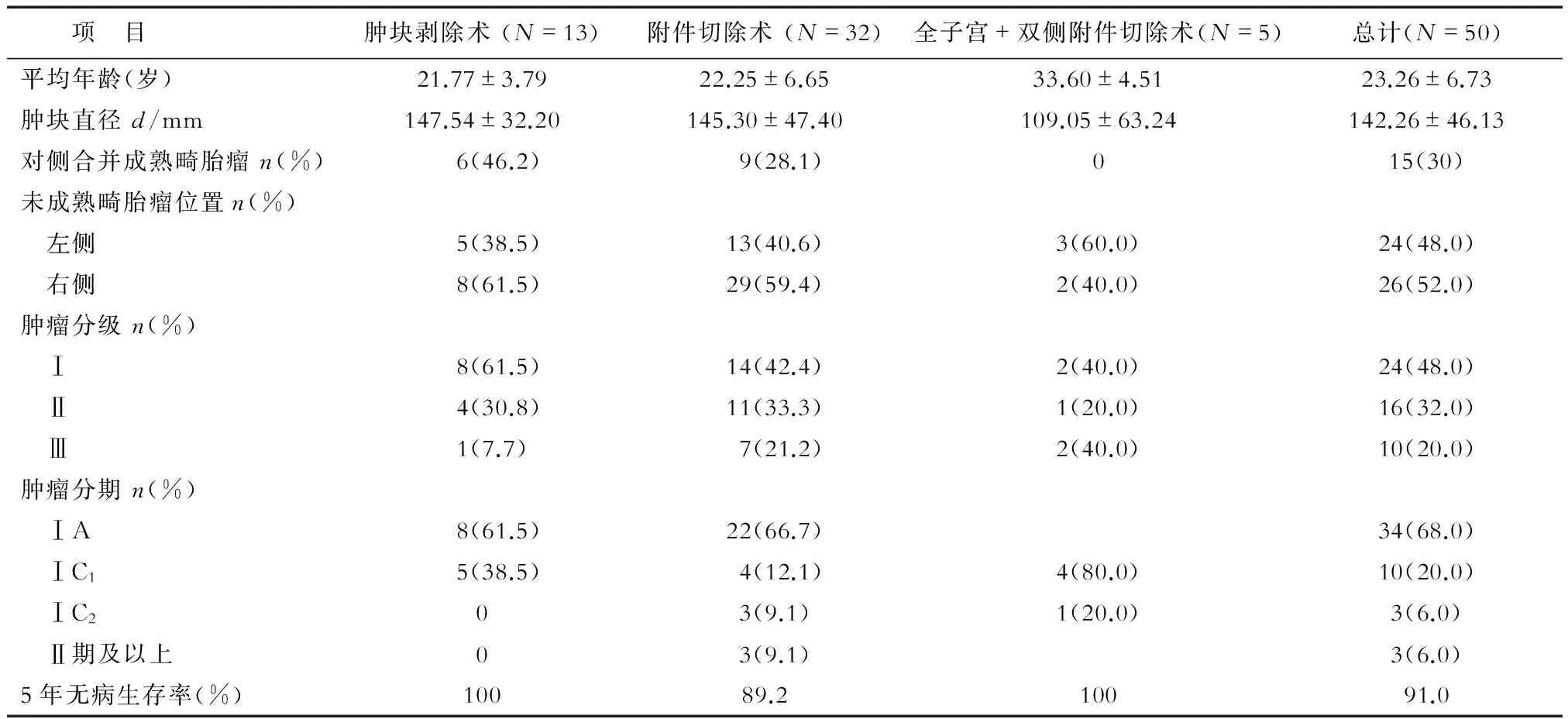
表1 患者基本临床病理特点
Ⅱ期及以上:ⅡB、ⅢB、ⅢC期,各1例
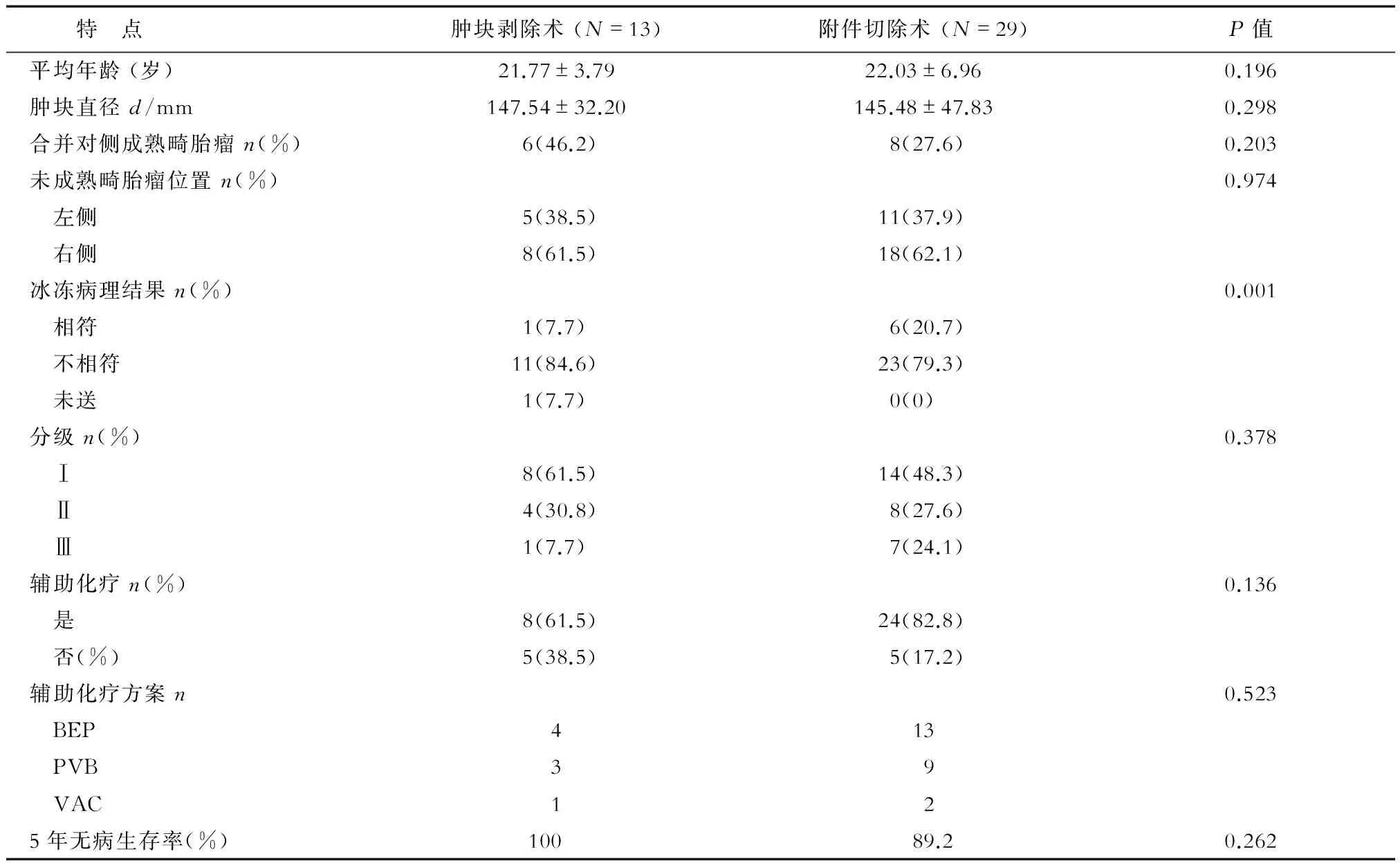
表2 不同手术方式患者临床病理特点的比较
2.4 生存预后 50例中无病死患者,总的5年无病生存率为91.0%,其中进行肿块剥除术患者的5年无病生存率为100%,进行附件切除术患者的5年无病生存率为86.8%,进行全子宫+双侧附件切除术患者的5年无病生存率为100%,差异无统计学意义(P=0.370)。
50例患者中,复发4例,复发患者的临床特点见表3。4例复发患者平均随访(90.0±59.82)个月,无病生存时间平均(9.25±5.85)个月,复发后3例患者接受补充手术治疗、1例接受辅助化疗,再次手术患者的术后病理提示复发病灶为成熟畸胎瘤。
42例行保留生育功能手术的明显早期患者中,肿块剥除术组和附件切除术组无病生存率分别为100%、89.2%,差异无统计学意义(P=0.262,图1)。

表3 4例复发患者的临床资料
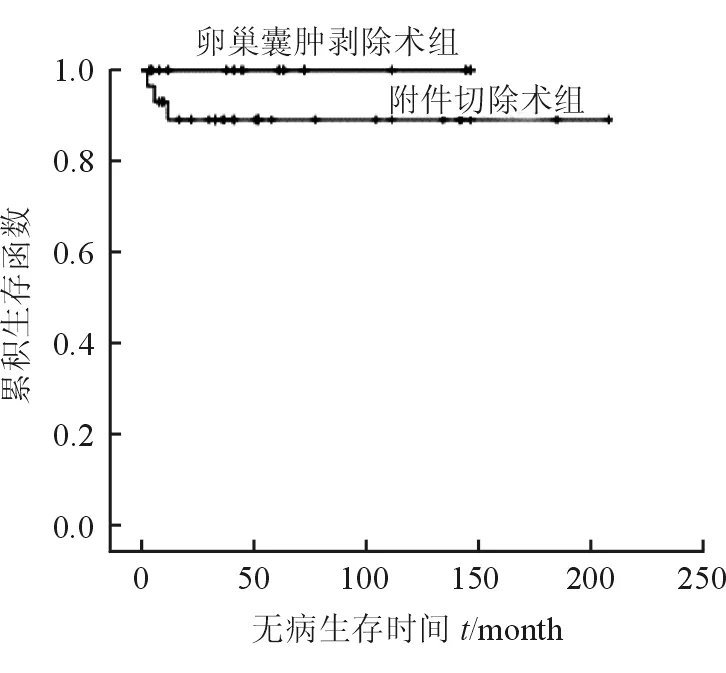
图1 进行肿块剥除术和附件切除术的明显早期患者的生存曲线
50例患者中,术后联合化疗39例,未接受化疗者11例。化疗组和非化疗组5年无病生存率分别为89.6%、100%,差异无统计学意义。
2.5 月经及妊娠结局 45例保留生育功能的手术患者中,44例月经恢复正常,仅1例术后月经周期缩短。13例卵巢囊肿剥除术患者中,术后4例患者有生育要求并正常分娩。32例行附件切除术的患者中,23例患者至研究末期时无生育要求;有生育要求的9例患者中,7例自然妊娠并正常分娩,1例患者因输卵管因素至研究末期时未孕,目前已接受双侧输卵管整形和通液术,1例患者不孕原因不明。
3 讨 论
3.1 卵巢未成熟畸胎瘤的基本临床病理特点 卵巢未成熟畸胎瘤发病率较低,患者多较年轻,平均发病年龄约24岁,绝大多数<30岁。肿块直径增大迅速,多在短期内增加为10~20 cm。本研究中肿块直径平均约14.2 cm,略小于Billmire等[11]报道的平均18 cm。该病以腹部不适和自觉腹围增加或腹部包块为主要临床症状。70%~90%患者发现时为ⅠC期[2,12-13]。卵巢未成熟畸胎瘤多发生于单侧,18.5%~36.4%的患者可同时合并对侧卵巢成熟畸胎瘤[11-12]。卵巢未成熟畸胎瘤对化疗十分敏感,且预后良好,5年总生存率为80%~100%[1,12,14],即使复发也多向成熟畸胎瘤转化。
有研究[15-16]表明,约50%的卵巢未成熟畸胎瘤患者中血清CA 125 >35 U/mL。本研究行CA 125检测者中约70.30%血清CA 125水平升高,复发患者和未复发患者的CA 125平均值分别是117.95 U/mL、321.53 U/mL,差异有统计学意义,提示CA 125可能与肿瘤复发相关,血清中CA 125含量越高,复发率相对越高[17]。血清AFP水平越高预后越差[18-19]。有研究[15]表明,当血清AFP水平>400 ng/mL时,提示预后不佳的意义更大。在卵巢未成熟畸胎瘤患者中血清AFP水平大于正常者为30%~60%[15]。本研究中,复发与未复发患者AFP平均值分别是1 523 ng/mL和318 ng/mL,差异有统计学意义(P<0.05)。CA 125、AFP水平可能与复发相关,血清CA 125、AFP水平越高复发风险相对越高。
3.2 患者不同手术方式对预后的影响 卵巢未成熟畸胎瘤预后较好,即使复发也多向成熟畸胎瘤转化复发时可通过手术或化疗治愈[20]。目前,推荐的治疗方式为患侧附件切除术[13]。对于明显早期(限于卵巢)的未成熟畸胎瘤患者,能否只进行卵巢肿块剥除术,其安全性尚不清楚。
本研究中明显早期患者中,13例患者进行肿块剥除术,患者术后联合化疗或密切随访,随访时间4~146个月,平均(57.69±49.48)个月,随访期间无患者复发或死亡,5年无病生存率100%;进行附件切除术患者平均随访(69.14±56.69)个月,5年无病生存率为89.2%,差异无统计学意义(P=0.262)。Beiner等[21]回顾性分析8例只进行肿块剥除术的患者,术后密切随访或联合化疗的未成熟性畸胎瘤患者在平均4.7年的随访时间内无复发或死亡。Vicus等[2]报道了7例进行囊肿剥除术的未成熟畸胎瘤患者,其中只有1例(ⅠA期Ⅰ级)患者术后3个月复发,并向成熟畸胎瘤转化,随访期间无患者死亡。Alwazzan等[12]、Sigismondi等[22]各报道1例进行肿块剥除术的Ⅰ期未成熟畸胎瘤患者,术后无明显复发及转移。对于明显早期(肿块局限于卵巢,无卵巢外病灶)的卵巢未成熟畸胎瘤进行肿块剥除术与附件切除术,预后可能无明显统计学差异,但是仍然需要大样本研究证明。
3.3 化疗对明显早期卵巢未成熟畸胎瘤预后的影响 本研究Ⅰ期未成熟畸胎瘤化疗组和非化疗组5年无病生存率分别89.6%和100%,差异无统计学意义(P=0.348)。本研究中非化疗组5年无病生存率达100%,10例术后未化疗的患者分别是:6例ⅠA期Ⅰ级、2例ⅠC1期Ⅰ级、1例ⅠC2期Ⅰ级、1例ⅠA期Ⅱ级;另4例患者随访时间36~72个月,平均(48.50±16.09)个月,随访期间无患者死亡或复发。多项研究[4,24-25]认为,对Ⅰ期卵巢恶性生殖细胞肿瘤进行初始手术,患者预后良好;同时有研究[6,23,26]认为,虽然FIGO分期和分级是影响预后的重要因素,但是对早期卵巢未成熟畸胎瘤联合化疗并不能降低其复发率,因此化疗对早期卵巢恶性生殖细胞瘤的利弊尚需进一步研究。
3.4 术后月经及妊娠结局 绝大多数卵巢恶性生殖细胞肿瘤患者术后联合化疗后多能恢复正常月经并正常妊娠,对胎儿无明显致畸性[5,27-28]。本研究中,进行保留生育功能手术患者术后月经恢复率达44/45(97.8%),与Park等[29]报道的37/40(90.2%)基本相符;有生育要求的患者妊娠成功率达84.6%,与Alwazzan等[12]报道的(10/12)83.3%基本相符,略小于Solheim等[30]报道的87.2%(34/39)。
综上所述,卵巢未成熟畸胎瘤多发生于生育年龄的年轻妇女,好发于单侧,预后较好,术后患者妊娠结局良好。对于明显早期卵巢未成熟畸胎瘤患者,可进行卵巢肿块剥除术,尽可能保留患侧卵巢正常组织,但术中需仔细探查及操作尽量避免肿块破裂。早期未成熟畸胎瘤患者术后是否需尽早联合化疗仍需大样本的临床研究。
[ 1 ] CHEN C H,YANG M J, CHENG M H, et al.Fertility preservation with treatment of immature teratoma of the ovary[J].J Chin Med Assoc,2007,70(5):218-221.
[ 2 ] VICUS D, BEINER M E, CLARKE B, et al.Ovarian immature teratoma:Treatment and outcome in a single institutional cohort[J].Gynecol Oncol,2011,123(1):50-53.
[ 3 ] MANGILI G, SIGISMONDI C, GADDUCCI A, et al.Outcome and risk factors for recurrence in malignant ovarian germ cell tumors:A MITO-9 retrospective study[J].Int J Gynecol Cancer,2011,21(8): 1414-1421.
[ 4 ] LOW J J, ILANCHERAN A, NG J S.Malignant ovarian germ-cell tumours[J].Best Pract Res Clin Obstet Gynaecol,2012,26(3): 347-355.
[ 5 ] PARKINSON C A, HATCHER H M, EARL H M, et al.Multidisciplinary management of malignant ovarian germ cell tumours[J].Gynecol Oncol,2011,121(3): 625-636.
[ 6 ] MANGILI G, SCARFONE G, GADDUCCI A, et al.Is adjuvant chemotherapy indicated in stage Ⅰ pure immature ovarian teratoma (IT)? A multicentre Italian trial in ovarian cancer (MITO-9) [J].Gynecol Oncol,2010,119(1):48-52.
[ 7 ] MORGAN RJ J R, ARMSTRONG D K, ALVAREZ R D, et al.Ovarian Cancer, Version 1.2016, NCCN Clinical Practice Guidelines in Oncology[J].J Natl Compr Canc Netw,2016,14(9):1134-1163.
[ 8 ] PRAT J, FIGO Committee on Gynecologic Oncology.FIGO’s staging classification for cancer of the ovary, fallopian tube, and peritoneum: abridged republication[J].Gynecol Oncol,2015,26(2):87-89.
[ 9 ] ZHAO T, ZHANG H, LIU Y, et al.The role of staging surgery in the treatment of apparent early-stage malignant ovarian germ cell tumours[J].Aust N Z J Obstet Gynaecol,2016, 56(4):398-402.
[10] NORRIS H J, ZIRKIN H J, BENSON W L.Immature (malignant) teratoma of the ovary: a clinical and pathologic study of 58 cases[J].Cancer,1976, 37(5): 2359-2372.
[11] BILLMIRE D F.Malignant germ cell tumors in childhood[J].Semin Pediatr Surg,2006,15(1):30-36.
[12] ALWAZZAN A B, POPOWICH S, DEAN E, et al.Pure immature teratoma of the ovary in adults:thirty-year experience of a single tertiary care center[J].Int J Gynecol Cancer,2015,25(9):1616-1622.
[13] REDDIHALLI P V, SUBBIAN A, UMADEVI K, et al.Immature teratoma of ovary--outcome following primary and secondary surgery: study of a single institution cohort[J].Eur J Obstet Gynecol Reprod Biol,2015,192: 17-21.
[14] ZANETTA G, BONAZZI C, CANTM, et al.Survival and reproductive function after treatment of malignant germ cell ovarian tumors[J].J Clin Oncol,2001,19(4):1015-1020.
[15] KAWAI M, KANO T, KIKKAWA F, et al.Seven tumor markers in benign and malignant germ cell tumors of the ovary[J].Gynecol Oncol,1992,45(3): 248-253.
[16] LI H, HONG W, ZHANG R, et al.Retrospective analysis of 67 consecutive cases of pure ovarian immature teratoma[J].Chin Med J (Engl),2002, 115(10): 1496-1500.
[17] USTUNYURT E, GUNGOR T, ISKENDER C, et al.Tumor markers in mature cystic teratomas of the ovary[J].Arch Gynecol Obstet,2009,279(2):145-147.
[18] KHALEGHNEJAD-TABARI A, MIRSHEMIRANI A, ROUZROKH M, et al.Pediatric germ cell tumors;a 10-year experience[J].Iran J Pediatr, 2014, 24(4): 441-444.
[19] PAUNIAHO S L, TATTI O, LAHDENNE P, et al.Tumor markers AFP,CA 125,and CA 19-9 in the long-term follow-up of sacrococcygeal teratomas in infancy and childhood[J].Tumour Biol,2010,31(4): 261-265.
[20] BONAZZI C, PECCATORI F, COLOMBO N, et al.Pure ovarian immature teratoma, a unique and curable disease: 10 years′ experience of 32 prospectively treated patients[J].Obstet Gynecol,1994,84(4): 598-604.
[21] BEINER M E, GOTLIEB W H, KORACH Y, et al.Cystectomy for immature teratoma of the ovary[J].Gynecol Oncol,2004,93(2):381-384.
[22] SIGISMONDI C, SCOLLO P, FERRANDINA G, et al.Management of bilateral malignant ovarian germ cell tumors:A MITO-9 retrospective study[J].Int J Gynecol Cancer,2015,25(2):203-207.
[23] ABDUL RAZAK A R, LI L, BRYANT A, et al.Chemotherapy for malignant germ cell ovarian cancer in adult patients with early stage,advanced and recurrent disease[J].Cochrane Database Syst Rev,2011(3): CD007584.
[24] MARINA N M, CUSHING B, GILLER R, et al.Complete surgical excision is effective treatment for children with immature teratomas with or without malignant elements: a Pediatric Oncology Group/Children’s Cancer Group Intergroup Study[J].J Clin Oncol,1999,17(7): 2137-2143.
[25] DARK G G, BOWER M, NEWLANDS E S, et al.Surveillance policy for stage I ovarian germ cell tumors[J].J Clin Oncol,1997,15(2):620-624.
[26] PASHANKAR F, HALE J P, DANG H, et al.Is adjuvant chemotherapy indicated in ovarian immature teratomas A combined data analysis from the malignant germ cell tumor international collaborative[J].Cancer, 2016, 122(2): 230-237.
[27] SAGAE S, SASAKI H, NISHIOKA Y, et al.Reproductive function after treatment of malignant germ cell ovarian tumors[J].Mol Cell Endocrinol,2003,202(1-2):117-121.
[28] GERSHENSON D M.Fertility-sparing surgery for malignancies in women[J].J Natl Cancer Inst Monogr,2005(34): 43-47.
[29] PARK J Y, KIM D Y, SUH D S, et al.Outcomes of pediatric and adolescent girls with malignant ovarian germ cell tumors[J].Gynecol Oncol,2015,137(3): 418-422.
[30] SOLHEIM O, TROPÉ C G, ROKKONES E, et al.Fertility and gonadal function after adjuvant therapy in women diagnosed with a malignant ovarian germ cell tumor (MOGCT) during the "cisplatin era"[J].Gynecol Oncol,2015,136(2):224-229.
[本文编辑] 叶 婷, 晓 路
Clinical-pathological characteristics and treatment of ovarian immature teratoma
LIU Yan, WANG Xiao, ZHAO Ting, LU Yuan*
Department of Gynaecology, Obstetrics and Gynecology Hospital, Fudan University, Shanghai 200011, China
Objective: To investigate the clinical-pathological characteristics of ovarian immature teratoma and the effects of different surgery methods (cystectomy, salpingo-oophorectomy and hysterectomy+ bilateral salpingo-oophorectomy) on the prognosis of the patients and to analyze the role of cystectomy for apparent early-stage ovarian immature teratoma.Methods: Clinical data of 50 patients who were pathologically diagnosed with immature teratoma between Jul.1997 and Aug.2015 at the Obstetrics and Gynecology Hospital of Fudan University were analyzed retrospectively.According to the surgery methods, these patients were divided into three groups.The clinical-pathological characteristics and the prognosis of disease were compared.Results: All 50 cases were participated in the study.The follow-up time was 3-207 months.FIGO stage as follows:ⅠA (34 patients), ⅠC1(10 patients), ⅠC2(3 patients) and ⅡB, ⅢB and ⅢC (1 patient).Patients were divided into cystectomy group, salpingo-oophorectomy group and hysterectomy and bilateral salpingo-oophorectomy group.The five year disease-free survival (DFS) was 100%,86.8%,100%, respectively.There were 45 patients underwent fertility-sparing surgery, 42 patients were the apparently early stage.No patient died among 50 cases, the total five year DFS rate was 91.0%.Among 50 cases, 4 cases were relapsed, and 3 cases had supplement surgery, 1 case was received assisted treatment, the postoperative pathology indicated that the recurrence was mature teratoma.Among 45 cases, 44 cases had normal period, only 1 case has shorten the period time.There were 13 patients with fertility requirements after surgery, including 11 cases of successful pregnant,and delivered 11 healthy infants, 2 cases were infertility (1 case due to tubal factor, 1 case of unexplained).Conclusions: Majority of patients are diagnosed with ovarian immature teratoma at an early stage.The data suggested that cystectomy could be considered for apparent early-stage patients affected by pure immature teratoma.Chemotherapy regimen is determined by pathological grade.
ovarian immature teratoma; cystectomy; salpingo-oophorectomy; chemotherapy; prognosis
2016-05-27 [接受日期] 2016-11-22
上海市卫生和计划生育委员会资助项目(201540224),上海市科学技术委员会资助项目(15140903000).Supported by Foundation of Shanghai Municipal Health and Family Planning Commission(201540224) and Foundation of Shanghai Science and Technology Committee(15140903000).
刘 艳,硕士,住院医师.E-mail: 1121220841@qq.com
*通信作者(Corresponding author).Tel: 021-33189900-6855, E-mail: yuanlu@fudan.edu.cn
10.12025/j.issn.1008-6358.2017.20160625
R 737.31
A

