蒙药红花对急性肝损伤大鼠TNF⁃α表达及肝细胞凋亡的影响
刘鑫,白梅荣
(内蒙古民族大学1.医学院病原生物学与免疫学教研室;2.蒙医药学院蒙药制剂教研室,内蒙古 通辽 028000)
蒙药红花对急性肝损伤大鼠TNF⁃α表达及肝细胞凋亡的影响
刘鑫1,白梅荣2
(内蒙古民族大学1.医学院病原生物学与免疫学教研室;2.蒙医药学院蒙药制剂教研室,内蒙古 通辽 028000)
目的 观察蒙药红花对D⁃氨基半乳糖(D⁃GalN)诱导的大鼠急性肝损伤的保护作用,并研究其可能的作用机制。方法采用D⁃GalN灌胃复制大鼠急性肝损伤模型,观察红花混悬液给药后小鼠血清天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、谷胱甘肽过氧化物酶(GSH⁃Px)、肝组织中肿瘤坏死因子α(TNF⁃α)含量的变化及肝细胞的凋亡情况。结果 蒙药红花能显著降低急性肝损伤大鼠血清ALT及AST活性,提高血清和肝组织GSH⁃Px含量,减轻细胞凋亡程度,对TNF⁃α的作用不明显。结论 蒙药红花可能通过抗氧化与逆转细胞凋亡等机制,保护D⁃GalN诱导的急性肝损伤大鼠受损肝细胞。
蒙药红花;急性肝损伤;肿瘤坏死因子α;凋亡
红花是菊科红花属植物,其花冠具有很高的药用价值,属传统医学常用药材。蒙医传统理论中,红花性凉,能够抑协日、清热、调经、清肝、止痛、消肿。红花常用于肝、心、血等热症及月经不调、鼻衄、呕血、外伤出血等疾病[1],尤其是被作为君药广泛应用在红花清肝十三味丸、额力根汤、德都红花七味丸等十几个常用保肝复方中[2]。经临床实践证实,以红花为君药的保肝复方药物治疗急、慢性肝病疗效肯定。
本研究利用D⁃氨基半乳糖(D⁃galactosamine,D⁃GalN)诱导的大鼠急性肝损伤模型,观察大鼠肝脏凋亡细胞百分率变化、肝脏组织中肿瘤坏死因子α(tumor necrosis factor α,TNF⁃α)含量变化,并检测血清中丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartate aminotrans⁃ferase,AST)、谷胱甘肽过氧化物酶(glutathione per⁃oxidase,GSH⁃Px)的含量,探讨蒙药红花对急性肝损伤保护作用的机制。
1 材料与方法
1.1 材料
1.1.1 药物与试剂:红花购自内蒙古通辽市药材公司,羧甲基纤维素钠(CMC⁃Na)购自国药集团化学试剂有限公司;D⁃GalN购自北京拜迪生物有限公司;护肝片购自广东康尔丹制药有限公司(批号Z20054567);ALT、AST、GSH⁃Px生化检测试剂盒及细胞凋亡检测试剂盒(G0033)购自南京建成生物有限公司。
1.1.2 仪器:流式细胞仪⁃BD Calibur(美国BD公司);罗氏全自动生化分析仪(上海同舸医疗器械有限公司)。
1.1.3 实验动物:雄性Sprague⁃Dawley大鼠[SCKK(吉)⁃2011⁃0004]40只,体质量(200±10)g,购自亿斯实验动物技术有限责任公司。
1.2 方法
1.2.1 红花混悬液大、小剂量的计算方法:临床上红花每日常用量为3 g,按照人均体质量计算出临床等效量为0.43 g/kg,通过预实验设小剂量为临床等效量,大剂量为临床等效量的9倍(3.87 g/kg)。红花粉碎后用CMC⁃Na稀释成混悬液。
1.2.2 实验分组:将大鼠分为5个实验组(每组8只),分别为正常组、模型组、护肝片组、红花大剂量组(3.90 g/kg)及红花小剂量组(0.43 g/kg)。各剂量组给予相应浓度的红花CMC⁃Na混悬液,正常组及模型组给予等量CMC⁃Na溶液,护肝片组给予护肝片0.36 mg/kg。分别对每组大鼠灌胃给药1次/d,共21 d。除正常组外,其他各组末次给药30 min后给予D⁃GalN生理盐水溶液(300 mg/kg)腹腔注射。禁食不禁水,20 h后麻醉取材。
1.2.3 AST、ALT检测:腹主动脉取血后,分离血清,按试剂盒操作方法测定血清AST和ALT。
1.2.4 GSH⁃Px检测:取部分冻存肝组织,室温解冻后,4℃生理盐水冲洗。滤纸干燥,匀浆,制备成含上清1%的组织匀浆液,按照说明书取上清。比色法测定肝组织及血清中GSH⁃Px含量。
1.2.5 TNF⁃α检测:取部分冻存肝组织,委托北京北方生物技术研究所,采用放射免疫分析法检测。
1.2.6 细胞凋亡指数测定:取新鲜大鼠肝脏组织,分离肝细胞,制备单细胞悬液(浓度为1×106/mL);按照试剂盒说明书孵育后,上机检测凋亡率。
1.3 统计学分析
2 结果
2.1 ALT和AST活性检测结果
与模型组比较,正常组大鼠血清AST和ALT保持较低水平,差异有统计学意义(P<0.05);护肝片组及红花大、小剂量组AST和ALT活性降低,差异有统计学意义(P<0.05),见表1。
表1 ALT、AST活性检测结果(,n=8)Tab.1 Results of ALT and AST activity(,n=8)

表1 ALT、AST活性检测结果(,n=8)Tab.1 Results of ALT and AST activity(,n=8)
Compared with model group,1)P<0.05,2)P<0.01.
Group ALT(U/L) AST(U/L)Control 35.91±10.092) 94.31±15.002)Model 627.51±282.81 622.43±257.12 Liver⁃protecting tablet 295.17±85.521) 315.90±84.631)Low⁃dose Carthamus tinctorius 292.46±161.531) 333.05±151.511)High⁃dose Carthamus tinctorius 285.52±155.861) 381.82±174.311)
2.2 血清及肝组织GSH⁃Px活性检测结果
与模型组比较,正常组血清和肝组织GSH⁃Px活性保持较高水平,差异有统计学意义(P<0.05),红花大、小剂量组血清和肝组织GSH⁃Px、护肝片组血清GSH⁃Px活性明显升高,差异有统计学意义(P<0.01,P<0.05,P<0.05),见表2。
2.3 细胞凋亡检测结果
与模型组比较,正常组肝细胞凋亡数保持较低水平,差异有统计学意义(P<0.05),护肝片组和红花大、小剂量组细胞凋亡数明显降低,差异有统计学意义(P<0.05,P<0.05,P<0.01),见表3、图1。
2.4 TNF⁃α含量检测结果
与模型组比较,正常组大鼠血清TNF⁃α水平较低,差异有统计学意义(P<0.01);护肝片组与红花大、小剂量组大鼠血清TNF⁃α含量虽有降低趋势,但差异无统计学意义(P>0.05),见表3。
3 讨论
病毒性肝炎引起的急性肝损伤在蒙医基础理论三根学说(赫依、希拉、巴达干,近似中医的气、热、寒)中偏重于希拉,但在不同个体和疾病病程中可以向其他方向倾斜。红花是中国民族医药的瑰宝,各种传统医学均有应用,在蒙医理论中,既可单独应用,也可与其他多种药物配伍,通过调节三根平衡从而达到防病治病的目的。通过实践经验及临床资料证实,红花在心血管、肝病等疾病中疗效肯定。但目前关于蒙药红花抗肝损伤活性的相关研究有限,基础实验数据尚显不足。本研究选择大鼠GSH⁃Px活性、肝脏凋亡细胞百分率、肝脏组织中TNF⁃α含量作为检测指标,分别从抗氧化、抑制凋亡及炎症反应等角度探讨蒙药红花对D⁃GalN肝损伤的保护作用,同时检测血清中ALT、AST等含量作为疗效监测指标,从细胞和分子水平上为阐明蒙药红花对肝脏的保护作用机制提供基础数据,也为本研究组其他实验摸索研究方向。
表2 血清及肝组织GSH⁃Px活性检测结果(,n=8)Tab.2 GSH⁃Px levels in serum and liver tissue(,n=8)
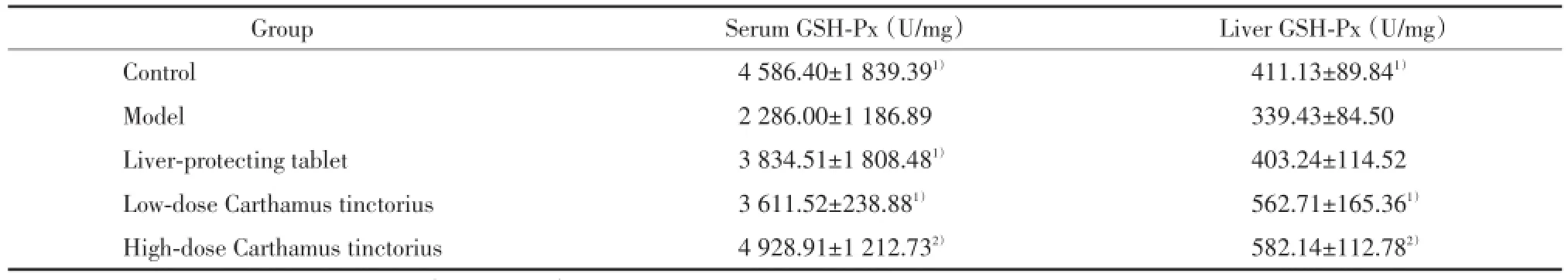
表2 血清及肝组织GSH⁃Px活性检测结果(,n=8)Tab.2 GSH⁃Px levels in serum and liver tissue(,n=8)
Compared with model group,1)P<0.05,2)P<0.01.
Group Serum GSH⁃Px(U/mg) Liver GSH⁃Px(U/mg)Control 4 586.40±1 839.391) 411.13±89.841)Model 2 286.00±1 186.89 339.43±84.50 Liver⁃protecting tablet 3 834.51±1 808.481) 403.24±114.52 Low⁃dose Carthamus tinctorius 3 611.52±238.881) 562.71±165.361)High⁃dose Carthamus tinctorius 4 928.91±1 212.732) 582.14±112.782)
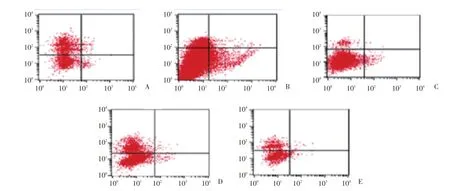
图1 细胞凋亡率Fig.1 Rate of cell apoptosis
表3 TNF⁃α含量及细胞凋亡检测结果(,n=8)Tab.3 Content of TNF⁃α and the apoptotic index(,n=8)
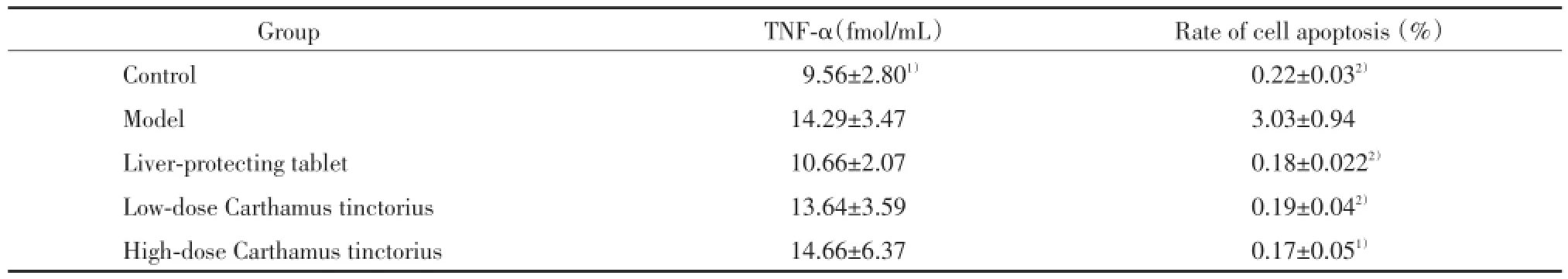
表3 TNF⁃α含量及细胞凋亡检测结果(,n=8)Tab.3 Content of TNF⁃α and the apoptotic index(,n=8)
Compared with model group,1)P<0.05,2)P<0.01.
Group TNF⁃α(fmol/mL) Rate of cell apoptosis(%)Control 9.56±2.801) 0.22±0.032)Model 14.29±3.47 3.03±0.94 Liver⁃protecting tablet 10.66±2.07 0.18±0.0222)Low⁃dose Carthamus tinctorius 13.64±3.59 0.19±0.042)High⁃dose Carthamus tinctorius 14.66±6.37 0.17±0.051)
我国卫生部颁布的《中药药理实验指导原则》中明确指出D⁃GalN肝损伤动物模型可以应用于保肝降酶新药的药理实验研究[3⁃4]。研究[3,5]表明,D⁃GalN复制的肝损伤可模拟病毒性肝损伤,该模型的临床症状、肝功能检测指标、肝脏病理改变均与病毒性肝炎具有相似性。D⁃GalN通过多途径引起肝细胞损伤,包括消耗尿嘧啶核苷,从而影响细胞器和酶,损伤肝细胞;改变细胞内离子浓度,抑制线粒体功能,激活磷脂酶,加速氧化自由基产生增多,加剧肝损伤[6⁃7];影响肝细胞RNA合成,引起凋亡[8⁃10];减少GSH⁃Px,影响TNF⁃α分泌[11⁃12]。
本研究结果显示,红花大剂量组和红花小剂量组大鼠血清AST和ALT活性均较模型组显著降低,说明蒙药红花确实对D⁃GalN引起的急性肝损伤发挥了显著的保护作用。组织形态学研究亦证实了这一实验结果[13]。GSH⁃Px是重要的抗氧化酶,能够有效清除代谢过程中产生的自由基,本研究中红花小剂量组血清和肝组织GSH⁃Px活性明显升高,红花大剂量组血清GSH⁃Px活性达到正常组大鼠水平,肝脏局部GSH⁃Px活性甚至超越正常组大鼠水平。说明红花给药组能够显著提高大鼠血清及肝组织中的GSH⁃Px活性,提示蒙药红花对急性肝损伤的保护可能与提高肝脏细胞抗氧化反应有关。凋亡检测结果也证实,红花混悬液大剂量及小剂量组细胞凋亡数均较模型组明显降低,且GSH⁃Px与凋亡检测结果存在剂量相关性,提示蒙药红花抑制肝细胞凋亡可能与降低肝细胞氧化应激反应有关。为了进一步探讨蒙药红花抗肝细胞凋亡的机制,本研究组将在后续实验中通过细胞色素C和Bax/Bcl⁃2蛋白等凋亡相关因子探讨线粒体通路在抗凋亡中的作用[14⁃15]。模型组TNF⁃α检测结果显著高于正常组,提示D⁃GalN复制的急性肝损伤模型中有炎性细胞因子参与,与其他研究结果相符[16⁃17]。本研究中,红花给药组TNF⁃α水平并未较模型组明显下降,但细胞凋亡水平下降明显,提示蒙药红花可能主要通降低抗氧化应激反应保护肝细胞,减少肝细胞凋亡。另外,炎症损伤机制复杂,涉及多种细胞因子及多种炎症细胞,本研究并未选择其他炎症相关产物进行检测,不排除蒙药红花存在其他抗炎机制的可能。
综上所述,蒙药红花能够通过抗氧化及减少肝细胞凋亡等机制减轻急性肝损伤,发挥保肝降酶的作用。急性肝损伤修复机制较为复杂,红花是否还通过其他途径参与修复尚需进一步研究。
[1]国家中医药管理局中华本草编委会.中华本草.蒙药卷[M].上海:上海科学技术出版社,2004.
[2]王秀梅,韩晓静,白梅荣,等.HPLC法测定红花地上部分羟基红花黄色素A和木犀草素的含量[J].中国民族民间医药,2014,8(2):29-30.
[3]布秀娟.肝损伤动物模型制作研究进展[J].中国医药导报,2014,11(12):166-168.
[4]徐敏.肝损伤动物模型的研究[J].河北联合大学学报(医学版)2012,14(3):342-343.
[5]张明.两种肝损伤模型的建立及其切片观察[J].动物医学进展,2010,31(7):121-123.
[6]待萍,刘华屏.常用的急性肝损伤动物模型[J].中国病理生理杂志,1995,11(4):447-448.
[7]徐中南,吴锡铭,王佩,等.18α甘草酸对D⁃氨基半乳糖引起的大鼠急性肝损伤治疗作用[J].临床肝胆病杂志,2012,28(1):63-65,70.
[8]WATANABE T,JONO H,HAN J,et al.Synergistic acti⁃vation of NF’⁃kappa B by nontypeable Haemophilus influenzae and tumor necro⁃sis factor alpha[J].Proc Natl Acad Sci USA,2004,101(10):3563. DOI:10.1073/pnas.0400557101.
[9]李达民.梗阻性黄疸致肝细胞凋亡的研究进展[J].中国普通外科杂志,2014,32(7):967-970.DOI:10.7659/j.issn.1005⁃6947.2014.07.020.
[10]KEPPLER D,FROHLICH J,REUTTER W,et al.Changes in uri⁃dinenucleotides during liver perfusion with D⁃galactosamine[J]. FEBS Lett,1969,4(4):278-280.DOI:10.1016/0014⁃5793(69)80255⁃3.
[11]阎宁,许瑞龄.马来酸二乙酯对半乳糖胺脂多糖致小鼠急性肝损伤发生中核转录因子表达的影响[J].山西医药杂志,2003,32(6):538.
[12]STACHLEWITZ RF,SEABRA V,BRADFORD B,et al.Glycine and uridine prevent D⁃galactosamine hepatotoxicity in the rat:role of Kupffer cells[J].Hepatolotgy,1999,29(2):737.DOI:10.1002/hep.510290335.
[13]娜仁满都拉,白梅荣,桂荣.红花混悬液抗D⁃氨基半乳糖致大鼠肝细胞凋亡的机理研究[J].中成药,2016,38(3):655-658.
[14]吴兰芳,杨爱珍,刘和,等.线粒体调控细胞凋亡的研究进展[J].中国农学通报,2010,26(8):63-68.
[15]梁凯,曹秉振.线粒体调控的细胞凋亡研究进展[J].生物医学工程与临床,2014,18(5):501-505.
[16]TRACEY KJ,CERAMI A.Tumor necrosis factor apleiotropic cy⁃tokine and therapeutic target[J].Annu Rev Med,1994,45:491-503.DOI:10.1146/annurev.med.45.1.491.
[17]颜天华.肿瘤坏死因子肝损伤机理研究进展[J].国外医学(药学分册),1998,25(6):330-334.DOI:10.13220/j.cnki.ji⁃pr.1998.06.003.
(编辑 王又冬)
Effects of the Mongolian Medicine Carthamus Tinctorius on TNF⁃α Expression and Hepatocyte Apoptosis in Rats with Acute Liver Injury
LIU Xin1,BAI Meirong2
(1.Department of Immunology and Microbiology,School of Medicine,Inner Mongolia University for Nationalities,Tongliao 028000,China;2.Department of Pharma⁃ceutics,School of Traditional Mongolian Medicine,Inner Mongolia University for Nationalities,Tongliao 028000,China)
Objective To observe the protective effect of Mongolian medicine Carthamus tinctorius in acute liver injury induced by D⁃GlaN(D⁃galactosamine)in rat models.Methods The acute liver injury model was established by intragastric administration D⁃GlaN in rats.The levels of serum aspartate aminotransferase(AST),alanine aminotransferase(ALT),glutathione(GSH⁃Px),the content of tumor necrosis factor⁃α(TNF⁃α)in liver tissue and the apoptosis of hepatocytes were determined.Results Mongolian medicine safflower can significantly reduce the activity of serum ALT and AST and liver tissue GSH⁃Px,and the degree of cell apoptosis;however,no obvious change of the TNF⁃α content was observed. Conclusion The Mongolian medicine Carthamus tinctorius has protective effect in D⁃GlaN⁃induced acute liver injury rats probably via anti⁃oxi⁃dative and anti⁃apoptotic abilities.
Mongolian medicine Carthamus tinctorius;acute liver injury;TNF⁃α;apoptosis
R285.5
A
0258-4646(2017)02-0116-04
10.12007/j.issn.0258⁃4646.2017.02.005
内蒙古蒙医药工程技术研究院科研课题(GCY201508022)
刘鑫(1980-),女,讲师,硕士. E-mail:aixinxin1014@163.com
2016-08-25
网络出版时间:

