汉族人群中白介素23受体基因多态性与肺结核易感性的关联性研究
金鎏 张治国 曹树辉 王伟 王旭 程建 苏虹 李传友
汉族人群中白介素23受体基因多态性与肺结核易感性的关联性研究
金鎏 张治国 曹树辉 王伟 王旭 程建 苏虹 李传友
目的 探索白细胞介素23受体(IL-23R)基因多态性在汉族人群中的分布,以及与肺结核患病的关联。方法 选取2014年3月至2015年12月在首都医科大学附属北京胸科医院所收治的肺结核住院患者作为病例组,共243例;选取北京市昌平区结核病防治所于2014年5—10月进行结核病体检的健康者作为对照组,共226名。利用NCBI数据库筛选出9个IL-23R基因单核苷酸多态性(single nucleotide polymorphism,SNP)位点(rs3762318、rs11209026、rs10889657、rs10889677、rs6682925、rs1004819、rs11465804、rs2201841、rs7514847)作为待测位点,利用高温连接酶检测技术对待测位点进行检测并做基因分型,比较病例组和对照组等位基因及基因型频率,分析找出连锁不平衡和易感单倍型,从而发现该基因多态性与肺结核易感性之间的关系。结果 经过比较分析,IL-23R多态性位点rs6682925最小等位基因C在病例组中频率为44.0%(213/484),高于对照组中的37.4%(169/452),差异有统计学意义[χ2=4.24,P=0.040;OR(95%CI)值:1.32(1.01~1.71)];基因型 TT在病例组频率为30.1%(73/242),低于对照组的38.9%(88/226),差异有统计学意义[χ2=3.99,P=0.040;OR(95%CI)值:0.68(0.46~0.99)]。rs3762318等位基因C频率在病例组中为16.0%(78/486),高于对照组的10.2%(46/450),差异有统计学意义[χ2=7.04,P<0.01;OR(95%CI)值:1.69(1.14~2.49)];基因型CC在病例组中频率为3.3%(8/243),高于对照组的0.4%(1/225),差异有统计学意义[χ2=5.02,P=0.040;OR(95%CI)值:7.63(0.95~61.46)];基因型TT频率在病例组中为71.5%(173/243),低于对照组的80.0%(180/225),差异有统计学意义[χ2=4.89,P=0.030;OR(95%CI)值:0.62(0.40~0.95)]。连锁分析和单倍型分析中发现由9个目标SNP位点构建的单倍型CTCACTCTG在病例组中期望频率为5.1%,在对照组中为2.2%,差异有统计学意义[χ2=5.65,P=0.017;OR(95%CI)值:2.44(1.14~5.19)]。结论 IL-23R的rs6682925和rs3762318多态性位点突变在汉族人群中有较高的频率,且和肺结核患病相关;携带由9个目标SNP点位构建的单倍型CTCACTCTG是肺结核的危险因素。
结核,肺; 白细胞介素23; 受体,白细胞介素; 多态性,单核苷酸; 疾病易感性; 病例对照研究
尽管感染结核分枝杆菌(Mycobacteriumtuberculosis,MTB)是导致结核病的必要条件,但大多数感染者却并未发病,研究表明,仅有10%的感染者会进一步发展为活动性结核病[1]。这就提示我们结核病的发病与个体的免疫状态相关,而个体免疫状态的差异与遗传因素密不可分。机体有效地抵抗MTB感染需要天然免疫和适应性免疫协同完成,白细胞介素-23(interleukin-23,IL-23)在两者中起到重要的连接作用。IL-23复合物为IL-23 P19和IL-12 P40两个亚单位组成,分别对应受体IL-23R和IL-12R β1[2-3]。目前研究表明,IL-23为CD4+T细胞的活化、增殖、分化的关键细胞因子,IL-23可以诱导CD4+T细胞的增殖,并可以增强树突状细胞(dendritic cell,DC)等抗原提呈细胞的活动,直接诱导DC分泌γ干扰素(IFN-γ)和IL-12,从而活化抗原提呈细胞,增强辅助T细胞1(Th1)的活动,进而增强巨噬细胞的吞噬、自然杀伤细胞的杀伤能力,以及组织的炎性反应等作用[4]。近年来,Th17在结核病感染的机制中被关注。有研究表明,Th17通过趋化因子募集中性粒细胞在病灶的聚集并调节由病原体感染而引起的炎性反应,从而促进肉芽肿的形成和维持其完整性[5-7]。如果IL-23及其受体缺失,可导致肺部感染组织严重的炎性反应和纤维蛋白的沉积,这可能会导致MTB扩散进而发展为活动性肺结核[8-9]。IL-23R存在于Th17表面,为Th17分化和存活的重要细胞因子;若IL-23缺失,则Th17不能增殖和存活[10-11]。IL-23R基因多态性与结核病发病之间的关联研究在汉族人群中尚无报道,而我国是结核病高负担国,结核病疫情严峻[12]。本研究对我国汉族人群IL-23R基因9个多态性位点进行分析,以探索IL-23R基因多态性与肺结核易感性之间的关联。
对象和方法
1.研究对象:选取2014年3月至2015年12月在首都医科大学附属北京胸科医院所收治的肺结核住院患者作为病例组,共243例;选取北京市昌平区结核病防治所于2014年5—10月进行结核病体检的健康者作为对照组,共226名。两组研究对象均为汉族且无亲属关系。研究对象的纳入通过了首都医科大学附属北京胸科医院及北京市昌平区结核病防治所伦理委员会的审核,并经研究对象知情同意。
样本量的确定使用NCSS-PASS 11软件,根据非配对病例-对照研究样本量计算方法,通过NCBI数据库给出的人群中标签单核苷酸多态性(single nucleotide polymorphism,SNP)的频率,SNP的频率取值P0=20%,根据实验预测结果,在OR=2,α=0.05(双侧),β=0.1的水平上,通过软件计算得出病例组和对照组各需样本数量为230,考虑到实验成功率并非100%,因此,确定两组样本数量均为245。由于实验过程中造成样本损失,最终具有有效数据的研究对象为病例组243例,对照组226名。
2.纳入标准:(1)病例组:①痰培养检测呈阳性,同时胸部X线摄片显示有结核样病灶;②痰培养阴性,但影像学检测显示活动性肺结核征象,且通过抗结核药物治疗好转,临床证实为肺结核;③结核菌素试验(PPD试验)强阳性,结核感染T细胞斑点试验(T-SPOT.TB)检测阳性,并伴有明显肺结核临床症状者;④无糖尿病、恶性肿瘤、HIV感染等免疫功能低下者,无肺炎、尘肺等相似呼吸系统疾病者。(2)对照组:①无结核病史,无糖尿病、恶性肿瘤、HIV感染者;②经PPD检测、T-SPOT.TB检测、影像学诊断无MTB感染及活动性结核病者;③无肺结核临床症状,且无肺炎、尘肺等相似病患。
3.实验器材和试剂:(1)实验器材:基因组提取采用天根DP318-02血液基因组DNA提取试剂盒(北京诺博莱德科技有限公司);PCR试验采用北京东胜创新生物科技有限公司的东胜龙黑金刚EDC-810 PCR仪;用3730XL基因测序仪(美国ABI公司)对PCR产物进行测序;离心机:Allegra 25R台式高速冷冻离心机(美国Beckman公司)、Micro 17R微量台式离心机(美国Thermo公司);微量可调移液器(德国Eppendorf公司)。(2)主要试剂:Taq酶(加拿大Fermentas公司)、dNTP(加拿大Fermentas公司)、Taq DNA ligase(美国NEB公司)。
4.标本收集:采集研究对象肘部静脉血5 ml,常温下保存不超过24 h,-80 ℃低温长期保存。采集的血标本提取完血清后,对剩余血块进行DNA提取,即将血块用垫有2层无菌纱布的注射器进行挤压过滤,再用垫有4层无菌纱布的注射器进一步挤压过滤[13]。通过该方法处理,可有效过滤掉血块中的纤维状成分,血块充分被打散,血细胞处于游离状态,并利用全血DNA提取试剂盒进行DNA提取。
5.SNP的选择和分型:IL-23R基因位于染色体1p31区域,全长298 660 bp。通过NCBI数据库获取IL-23R基因的全场序列,并对IL-23R基因的标签SNP进行检索。根据对现有SNP的报道为依据,SNP与结核病发病有类似免疫机制的疾病相关联,且在人群中分布频率>5%,进行SNP筛选。最终从基因上游2 kb区域、外显子、内含子中筛选出SNP:rs3762318、rs11209026、rs10889657、rs10889677、rs6682925、rs1004819、rs11465804、rs2201841、rs7514847,作为待检测多态性位点(表1)。基因分型采用高温连接酶检测反应(ligase detection reaction,LDR),通过聚合酶链式反应(polymerase chain reaction,PCR)对目标基因片段进行扩增,利用高温连接酶实现对基因多态性位点的识别(高温连接酶一旦检测到DNA与互补的2条寡聚核苷酸接头对应处存在着基因点突变类型的碱基错配,则连接反应就不能进行),再将所得PCR产物进行测序,判断目标点位的基因型。

结 果
1.基本情况:研究对象中,病例组有243例,对照组有226名;两组研究对象年龄、性别、婚姻状况、文化程度比较差异均无统计学意义,均衡可比(表2)。

表1 所选标签SNP的信息
注 Chr1:一号染色体;Arg:精氨酸;Gln:谷氨酰胺
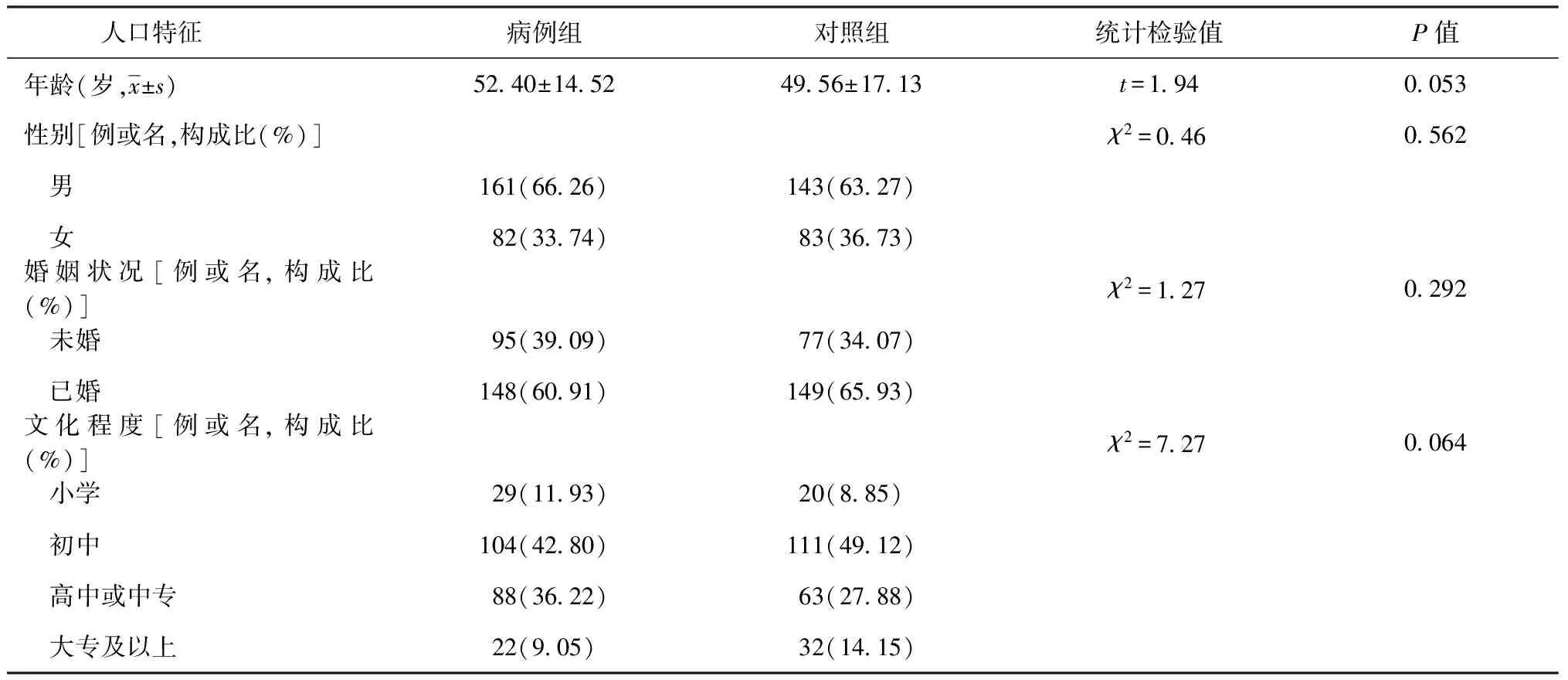
表2 不同人口特征在病例组和对照组分布情况的比较
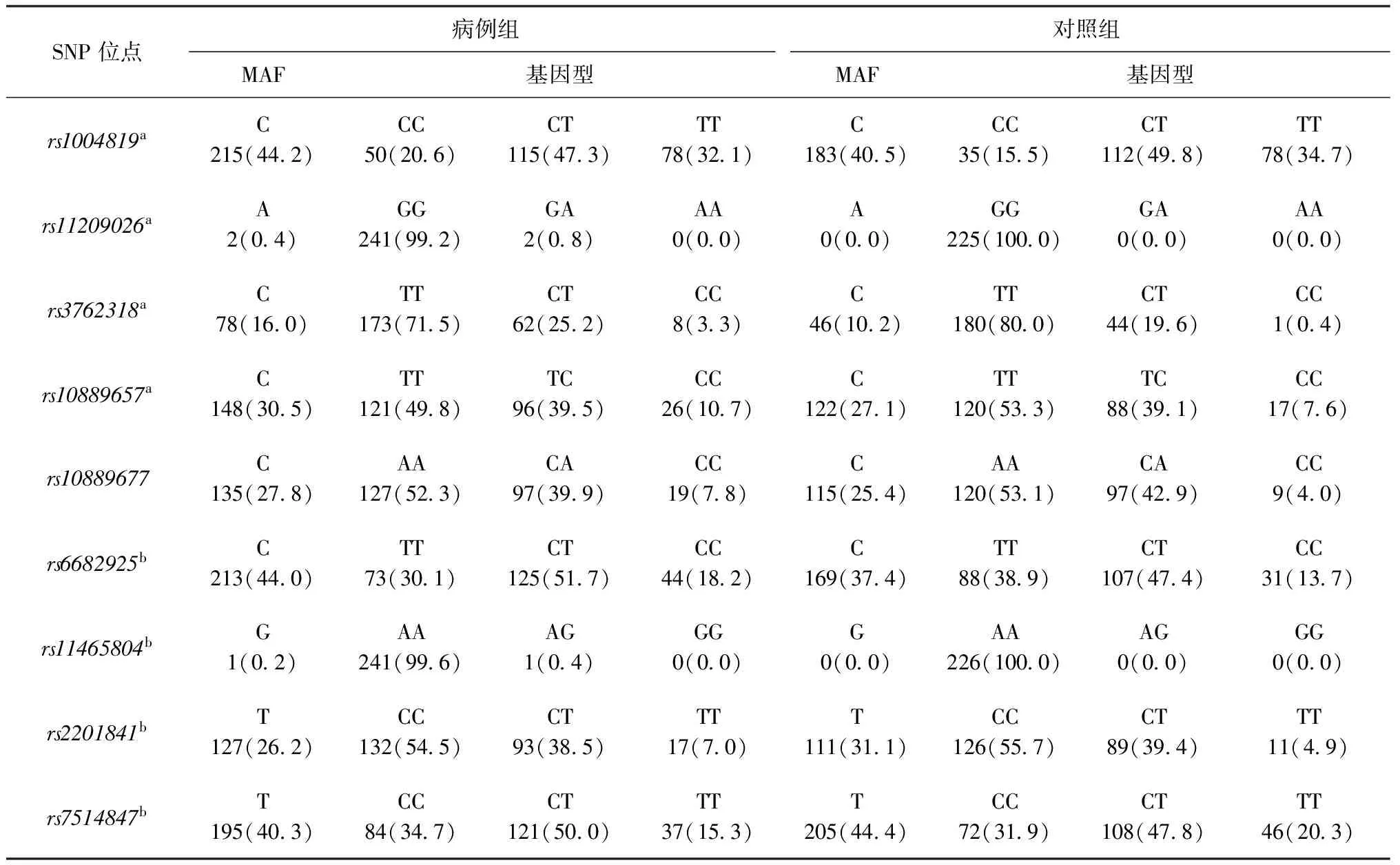
表3 等位基因和基因型在病例组和对照组中分布情况
注 SNP:单核苷酸多态性;MAF:最小等位基因频率;a:该点位对照组缺失1名研究对象信息;b:该点位病例组缺失1例研究对象信息;表中括号外数值为等位基因或基因型频次,括号内数值为等位基因或基因型频率(%)
2.基因多态性与疾病关联分析:对9个SNP位点的基因型分布分别在病例组和对照组中进行Hardy-Weinberg平衡检测,发现各基因型均满足Hardy-Weinberg平衡(P>0.05)。对9个SNP位点进行分型,并计算最小等位基因和基因型频率(表3),分别在病例组和对照组之间比较最小等位基因和各基因型分布的差异。通过单因素logistic回归分析可以看出,rs6682925和rs3762318在病例组和对照组间的分布差异有统计学意义(表4)。
利用SHEsis软件对该样本进行了连锁不平衡分析和单倍型分析,从而确定各位点之间的关联以及发现是否存在具有疾病风险的单倍型[14]。其中,通过连锁不平衡分析评估该9个SNP位点是否存在非随机相关,并给出各点位关联度D′值和r2值。

表4 rs6682925和rs3762318位点等位基因和基因型在病例组和对照组间分布的比较
注 SNP:单核苷酸多态性;a:该点位病例组缺失1例研究对象信息;b:该点位对照组缺失1名研究对象信息;表中括号外数值为等位基因或基因型频次,括号内数值为等位基因或基因型频率(%)

表5 IL-23R多态位点单倍型期望频率在病例组和对照组间的比较
注 各点位从染色体上游至下游顺序依次为rs3762318、rs10889657、rs6682925、rs10889667、rs1004819、rs7517847、rs2201841、rs11465804、rs11209026;a:单倍型频率分布在病例组或对照组中大于3%
D′值结果显示各多态性位点普遍存在非随机相关,以D′≥0.8作为连锁不平衡强关联标准,则有13组位点两两组合存在强关联;以r2≥0.8作为连锁不平衡强关联标准,r2值显示rs10889677和rs2201841存在强关联,r2=0.88。由于各位点间普遍存在连锁不平衡,因而全部9个SNP位点被纳入到单倍型分析中。经分析存在51种单倍型组合,其中,对10种单倍型在组间的分布进行了比较,而其余单倍型频率由于均小于3%,因而予以排除。经分析,IL-23 R单倍型CTCACTCTG在病例组中的期望频率为5.1%,明显高于对照组中的2.2%,差异有统计学意义,携带CTCACTCTG单倍型者肺结核患病风险是未携带者的2.44倍(表5)。
讨 论
IL-23及其受体在机体免疫应答中起到重要的作用。近年来,大量关于IL-23R基因多态性与免疫相关疾病的关联已被报道。Dong等[15]在中国汉族人群中发现IL-23R多态性位点rs7517847中等位基因G和基因型GG,rs11209032中基因型AA,rs17375018中等位基因T与强直性脊柱炎密切相关;Szabo等[16]在欧洲白人人群中发现IL-23多态性位点rs1343151最小等位基因A,rs10889677中基因型AA是克罗恩病的风险因素;Lee和Song[17]在一项关于IL-23R与牛皮鲜的荟萃分析中发现多态性点rs6687695和rs11209026中的最小等位基因T和A与牛皮鲜发病相关。这不仅揭示了IL-23R多态性在各人群中广泛分布,而且在免疫相关疾病中起到重要的影响。除了自身免疫性疾病,Zhang等[18]在汉族人群中发现由分枝杆菌感染的麻风病与多态性点位rs3762318存在关联,其中最小等位基因A是麻风病的保护因素。然而,IL-23R基因多态性与结核病之间的关联研究却很少。2013年,Ben-Selma和Boukadida[19]在突尼斯人群中进行了研究,结果表明IL-23R多态性位点rs11209026在该人群中突变频率很高,最小等位基因A和基因型AA是肺结核的危险因素;而在维吾尔族人群中发现,IL-23R多态性位点rs7518660基因型AA,rs10889677基因型CC在肺结核患者与健康对照者中分布存在明显差异,并影响IL-23R基因拷贝数[20-22]。而SNP在不同人群中的分布常会出现较大差异,IL-23R多态性与肺结核的关联研究在汉族人群中尚无报道。
本次研究发现,rs6682925和rs3762318的最小等位基因和最小等位基因纯合子在肺结核患者和健康对照者中存在分布差异,其中rs6682925中最小等位基因C为肺结核的风险基因,其在健康人中的基因频率达37.4%,与先前报道的汉族人群该基因分布基本吻合[23],印证了该基因在汉族人群中有较高的突变频率。同时,该突变位点曾被广泛验证在恶性肿瘤和冠心病患者中具有较高突变频率[23-25],在结核病患者中尚未见报道。在多态性位点rs3762318中,本研究发现携带最小等位基因C,突变基因型CC者均有肺结核患病风险,其中最小等位基因C频率在健康人群中达10.2%,与Zhang等[18]在2011年做的一项关于麻风病的全基因组关联分析的最小等位基因频率基本一致。有趣的是,携带最小等位基因C是麻风病患病的保护因素,而在本次研究中确定其为肺结核患病的危险因素。该结果不能简单解释为由于抽样造成,虽然结核病与麻风病均由分枝杆菌引起,而发病机制不尽相同,因而该差异需要持续关注。同时,本次研究验证了多态性位点rs1004819等位基因T虽然在汉族人群中存在较高的突变率,但无论是等位基因还是基因型,均与肺结核患病没有关联。该结果与突尼斯进行的肺结核相关性研究的结论存在明显差异[19],从而验证了该位点多态性不是汉族人的肺结核患病的风险基因。江道斌等[22]在中国维吾尔族人群中发现rs10889677位点基因型CC与肺结核的易感性相关(OR=1.53,95%CI:1.01~2.31);在本次研究中未发现该位点基因型CC与肺结核患病存在相关性,究其原因,可能为抽样误差所致,尚待进一步探究。而rs10889677位点T→C突变在汉族人群中普遍存在,最小等位基因频率为25.4%,应持续关注。
多位点之间的单倍型分析较单个点位的分析具有明显优势,以往进行的SNP研究往往忽略了各位点之间的关联,而当同一基因上多个突变等位基因相互作用,则可构建出一个对疾病表型有更强作用的“超级等位基因”。 Epstein和Satten[26]指出,当疾病是由于同一染色体上多个易感变量的相互作用引发时,单倍型分析能更为有效地找出发病关联。本次研究通过连锁不平衡分析确定了各检测位点之间的关联度,而单倍型分析发现在IL-23R基因中单倍型CTCACTCTG与肺结核患病相关。
由于我国人群广泛接种卡介苗,传统的结核菌素试验在区分结核分枝杆菌感染者和由于接种卡介苗的健康者存在困难,因而难以将隐性感染者从健康对照中筛出,从而影响研究结果。本研究在健康对照者的选择上,从1263名体检人员中选取了PPD阴性,且T-SPOT.TB阴性的226名作为对照组,有效地筛选出无结核隐性感染的健康对照者,从而提高了研究效率。
本研究尚存在一些不足:(1)仅对IL-23R基因内的9个多态性位点进行了检测。由于IL-23R基因多态性位点众多,笔者仅通过数据库筛选了部分标签位点进行验证分析。虽然进行了连锁不平衡和单倍型分析,但与其他未检测位点是否具有关联性不得而知。而影响到基因表达往往是多个位点共同参与的结果。(2)本次研究未纳入潜伏感染者作为研究对象。IL-23R基因多态性对于健康者感染MTB到潜伏感染者发病的影响则需进一步验证。(3)未进行基因表达水平的验证。由于受体存在于细胞膜表面,通过一般的血清学方法无法检测到IL-23R受体的表达水平,而受制于标本状态也很难进行细胞流式实验。因而突变位点的对象中,IL-23R 的表达水平无法得知。(4)在进行统计分析时,考虑到多重校正相对严格保守,可能会筛掉一些有意义的位点,由于本次研究位点较少,且各SNP位点均位于同一染色体上,因而本研究统计分析结果未进行多重比较校正。
综上所述,本次研究发现IL-23R基因rs6682925和rs3762318多态性位点的变异在汉族人群中有较高的频率,且和肺结核患病相关;单倍型CTCACTCTG是肺结核患病的危险因素。rs10889677在汉族人群中具有较高的突变率,可能与肺结核患病相关,应持续关注。基因与基因间相互关联则需要进一步探究,而多态性位点rs6682925和rs3762318是否影响到机体IL-23R表达水平也需要进行进一步验证。
[1] Möller M, de Wit E, Hoal EG. Past, present and future directions in human genetic susceptibility to tuberculosis. FEMS Immunol Med Microbiol, 2010, 58(1): 3-26.
[2] Beadling C, Slifka MK. Regulation of innate and adaptive immune responses by the related cytokines IL-12, IL-23, and IL-27. Arch Immunol Ther Exp (Warsz), 2006, 54(1): 15-24.
[3] Oppmann B, Lesley R, Blom B, et al. Novel p19 protein engages IL-12p40 to form a cytokine, IL-23, with biological activities similar as well as distinct from IL-12. Immunity, 2000, 13(5): 715-725.
[4] Langrish CL, McKenzie BS, Wilson NJ, et al. IL-12 and IL-23: master regulators of innate and adaptive immunity. Immunol Rev, 2004, 202: 96-105.
[5] Khader S, Bell GK, Pearl JE, et al. IL-23 and IL-17 in the establishment of protective pulmonary CD4+T cell responses after vaccination and duringMycobacteriumtuberculosischallenge. Nat Immunol, 2007, 8(4): 369-377.
[6] Miyamoto M, Prause O, Sjöstrand M, et al. Endogenous IL-17 as a mediator of neutrophil recruitment caused by endotoxin exposure in mouse airways. J Immunol, 2003, 170(9): 4665-4672.
[7] Stark M, Huo Y, Burcin T, et al. Phagocytosis of apoptotic neutrophils regulates granulopoiesis via IL-23 and IL-17. Immunity, 2005, 22(3): 285-294.
[8] Dragon S, Saffar AS, Shan L, et al. IL-17 attenuates the anti-apoptotic effects of GM-CSF in human neutrophils. Mol Immunol, 2008, 45(1): 160-168.
[9] Zelante T, De Luca A, Bonifazi P, et al. IL-23 and the IL-17 pathway promotes inflammation and impair antifungal immune resistance. Eur J Immunol, 2007, 37(10): 2695-2706.
[10] Yen D, Cheung J, Scheerens H, et al. IL-23 is essential for T cell-mediated colitis and promotes inflammation via IL-17 and IL-6. J Clin Invest, 2006, 116(5): 1310-1316.
[11] Khader SA, Cooper AM. IL-23 and IL-17 in tuberculosis. Cytokine, 2008, 41(2): 79-83.
[12] World Health Organization. Global tuberculosis report 2016. Geneva: World Health Organization, 2016.
[13] Che N, Li S, Zhang Z, et al. Identification of a novel IRGM promoter single nucleotide polymorphism associated with tuberculosis. Clin Chim Acta, 2010, 411(21/22): 1645-1649.
[14] Shi YY, He L. SHEsis, a powerful software platform for analyses of linkage disequilibrium, haplotype construction, and genetic association at polymorphism loci. Cell Res, 2005, 15(2): 97-98.
[15] Dong H, Li Q, Zhang Y, et al. IL23R gene confers susceptibility to ankylosing spondylitis concomitant with uveitis in a Han Chinese population. PLoS One, 2013, 8(6): e67505.
[16] Szabo M, Safrany E, Pazar B. Marked diversity of IL23R gene haplotype variants in rheumatoid arthritis comparing with Crohn’s disease and ankylosing spondylitis. Mol Biol Rep, 2013, 40(1): 359-363.
[17] Lee YH, Song GG. Associations between interleukin-23R and interleukin-12B polymorphisms and psoriasis susceptibility: a meta-analysis. Immunol Invest, 2013, 42(8): 726-736.
[18] Zhang F, Liu H, Chen S, et al. Identification of two new loci at IL23R and RAB32 that influence susceptibility to leprosy. Nat Genet, 2011, 43(12): 1247-1251.
[19] Ben-Selma W, Boukadida J. IL23R(Arg381Gln) functional polymorphism is associated with active pulmonary tuberculosis severity. Clin Vaccine Immunol, 2012, 19(8): 1188-1192.
[20] Jiang D, Wubuli A, Hu X, et al. The variations of IL-23R are associated with susceptibility and severe clinical forms of pulmonary tuberculosis in Chinese Uygurs. BMC Infect Dis, 2015, 15: 550.
[21] 江道斌, 胡昕, 李双, 等. 白细胞介素23受体基因单核苷酸多态性与肺结核和耐药肺结核易感性的相关性. 中华医学杂志, 2015, 95(20):1576-1580.
[22] 江道斌, 胡昕, 李双, 等. 新疆维吾尔族人群白介素-23受体基因拷贝数变异与结核病易感性的相关性. 中华医学遗传学杂志, 2016, 33(1): 97-100.
[23] Zhang M, Cai ZR, Zhang B, et al. Functional polymorphisms in interleukin-23 receptor susceptibility to coronary artery disease. DNA Cell Biol, 2014, 33 (12): 891-897.
[24] Chu H, Cao W, Chen W, et al. Potentially functional polymorphisms in IL-23 receptor and risk of esophageal cancer in a Chinese population. Int J Cancer, 2012, 130(5): 1093-1097.
[25] Liu Y, Pan S, Liu L, et al. A genetic variant in long non-coding RNA HULC contributes to risk of HBV-related hepatocellular carcinoma in a Chinese population. PLoS One, 2012, 7(4): e35145.
[26] Epstein MP, Satten GA. Inference on haplotype effects in case-control studies using unphased genotype data. Am J Hum Genet, 2003, 73(6): 1316-1329.
(本文编辑:李敬文)
Relationship between interleukin-23 receptor gene polymorphisms and susceptibility to pulmonary tuberculosis in Chinese Han population
JINLiu*,ZHANGZhi-guo,CAOShu-hui,WANGWei,WANGXu,CHENGJian,SUHong,LIChuan-you.
*DepartmentofEpidemiologyandBiostatistics,SchoolofPublicHealth,AnhuiMedicalUniversity,Hefei230031,China
s:SUHong,Email:suhong5151@sina.com;LIChuan-you,Email:bjjysxjmyslcy@126.com
Objective To investigate distribution of interleukin-23 receptor (IL-23R) polymorphisms in Chinese Han and the relationship between the distribution and pulmonary tuberculosis (PTB). Methods A case-control study was performed, 243 PTB cases were selected as case group hospitalized Beijing Chest Hospital, Capital Medical University during March 2014 to December 2015 and 226 healthy controls were recruited by the tuberculosis physical examination in Beijing Changping Center for tuberculosis control and prevention during May 2014 to October 2014. Nine polymorphic sites (rs3762318,rs11209026,rs10889657,rs10889677,rs6682925,rs1004819,rs11465804,rs2201841,rs7514847) were screened out using NCBI database, single nucleotide polymorphisms (SNPs) were detected by ligase detection reaction (LDR) for genotyping and frequency comparision, linkage analysis and haplotype analysis were performed to find out linkage disequilibrium and haplotype. Through above-mentioned methods, the association between IL-23R SNPs and PTB were estimated. Results There was a significant difference in the distribution of IL-23R gene polymorphism at polymorphic siters6682925 between PTB cases and healthy controls, allele C frequency in cases (44.0% (213/484)) was significantly higher than in controls (37.4% (169/452)) (χ2=4.24,P=0.040;OR=1.32, 95%CI: 1.01-1.71); genotype TT frequency in cases (30.1% (73/242)) was also significantly higher than in controls (38.9% (88/226)) (χ2=3.99,P=0.040;OR=0.68, 95%CI: 0.46-0.99). As to polymorphic siters3762318, allele T frequency in cases (16.0% (78/486)) was significantly higher than in controls (10.2% (46/450)) (χ2=7.04,P<0.01;OR=1.69, 95%CI: 1.14-2.49); genotype CC frequency in cases (3.3% (8/243)) was significantly higher than in controls (0.4% (1/225)) (χ2=5.02,P=0.040;OR=7.63, 95%CI: 0.95-61.46); genotype TT frequency in cases (71.5% (173/243) was significantly higher than in controls (80.0% (180/225)) (χ2=4.89,P=0.030;OR=0.62, 95%CI: 0.40-0.95). Haplotype CTCACTCTG built by nine target SNPs sites in cases was found significantly different from controls by haplotype analysis (5.1% vs. 2.2%,χ2=5.65,P=0.017;OR=2.44, 95%CI: 1.14-5.19). Conclusion Polymorphic sitesrs6682925 andrs3762318 are widely existed among Chinese Han population and these two SNPs are susceptible to PTB. Haplotype CTCACTCTG built by the nine SNPs sites is a risk factor for susceptibility to PTB in Chinese Han population.
Tuberculosis, pulmonary; Interleukin-23; Receptors, interleukin; Polymorphism, single nucleotide; Disease susceptibility; Case-control studies
10.3969/j.issn.1000-6621.2017.05.017
230031 合肥,安徽医科大学公共卫生学院流行病与卫生统计系(金鎏、王旭、程建、苏虹);北京市昌平区结核病防治所(张治国);首都医科大学附属北京胸科医院 北京市结核病胸部肿瘤研究所细菌免疫研究室(曹树辉、王伟、李传友)
苏虹,Email:suhong5151@sina.com;李传友,Email:bjjysxjmyslcy@126.com
2016-12-26)

