白藜芦醇对单个核细胞氧化应激的作用和影响*
乔瑞君,郑华月
(南阳医学高等专科学校第一附属医院 儿科,河南 南阳 473000)
白藜芦醇对单个核细胞氧化应激的作用和影响*
乔瑞君,郑华月
(南阳医学高等专科学校第一附属医院 儿科,河南 南阳 473000)
目的探讨高氧暴露早产儿外周血单个核细胞应用白藜芦醇对氧化应激的影响。方法52例早产儿随机分为白藜芦醇+高氧组和高氧组,每组26例,选取同期吸入常压空气早产儿20例作为对照组。抽取患儿桡动脉血2 ml,采用Ficoll密度梯度离心法分离单个核细胞。观察3组单个核细胞活性氧水平、培养液丙二醛(MDA)水平、细胞自噬体、血红细胞加氧酶(HO-1)蛋白水平及活性。结果3组活性氧、MDA、细胞自噬体、HO-1蛋白水平、HO-1活性比较,差异有统计学意义(P<0.05),高氧组活性氧、MDA、细胞自噬体、HO-1蛋白水平、HO-1活性高于对照组和白藜芦醇+高氧组;白藜芦醇+高氧组活性氧、MDA、细胞自噬体、HO-1蛋白水平、HO-1活性高于对照组。结论白藜芦醇能够有效对抗高氧暴露产生的氧化应激,减少氧化应激损伤。
早产儿;高氧;白藜芦醇;单个核细胞;氧化应激
早产儿出生后长时间处于低氧血症状态,与运动障碍、认知、视网膜病变等不良预后相关[1]。早产儿长期和/或过量补充氧气,会破坏肺组织,这可能与早产儿肺组织发育不成熟、氧化应激及抗氧化防御机制间的相互作用有关[2]。白藜芦醇具有抗癌、抗氧化等作用[3-6]。魻ZDEMIR等[7]发现,白藜芦醇可以通过抗炎、抗氧化特性对高氧性肺损伤起防治作用。本研究通过对高氧暴露早产儿应用白藜芦醇,探讨其对外周血单个核细胞氧化应激的影响。
1 资料与方法
1.1 一般资料
选择2015年3月-2016年6月于南阳医学高等专科学校第一附属医院住院治疗的52例早产儿作为研究对象。其中,男性32例,女性20例;胎龄29~35周,平均(31.7±2.8)周;其中早产儿非透明膜病34例,早产窒息后肺炎18例。采用随机数字表将其分为白藜芦醇+高氧组和高氧组,每组26例。白藜芦醇+高氧组,男性15例,女性11例;胎龄30~35周,平均(31.8±2.7)周。高氧组男性17例,女性9例;胎龄29~34周,平均(31.6±2.8)周。选取同期吸入常压空气的早产儿20例作为对照组。其中,男性12例,女性8例;胎龄30~32周,平均(32.0± 1.6)周。3组性别比例、胎龄比较,差异无统计学意义(P>0.05)。本研究经本院临床试验伦理委员会审查批准。
1.2 纳入与排除标准
1.2.1 纳入标准 ①入选患儿符合《早产儿管理指南》相关诊断标准[8];②患儿监护人知情同意,并签署知情同意书。
1.2.2 排除标准 ①肺部先天性疾病,如先天性肺发育不全、肺隔离症、先天性支气管肺囊中、先天性肺动静脉瘘、先天性肺动静脉血管异常;②先天性心脏病,如肺动脉狭窄、主动脉缩窄、房间隔缺损、室间隔缺损、动脉导管未闭、法洛四联征等;③肺炎严重感染;④有溶血倾向或溶血性疾病;⑤颅内出血;⑥消化道出血;⑦患儿监护人不同意进行相关治疗。
1.3 治疗方法
抽取患儿桡动脉血2 ml,置于抗凝管中,采用Fi coll密度梯度离心法分离单个核细胞,肝素抗凝静脉血与等量Hank's液充分混匀,用滴管沿管壁缓慢叠加于分层液面上,注意保持清楚的界面。2 000 r/min水平离心20 min。离心后管内分为3层,上层为血浆和Hank's液,下层主要为红细胞和粒细胞。中层为淋巴细胞分离液,在上、中层界面处有一以单个核细胞为主的白色云雾层狭窄带,单个核细胞包括淋巴细胞和单核细胞;此外,还含有血小板。用毛细血管插到云雾层,吸取单个核细胞。置入另一短管中,加入> 5倍体积的Hank's液,1 500 r/min离心10 min,洗涤细胞2次。末次离心后,弃上清,加入含10%小牛血清的无血清细胞冻存培养基(roswell park memorial institute 1640,RPMI 1640),重悬细胞。
1.3.1 对照组 单个核细胞置于细胞培养箱中,培养箱参照早产儿温箱要求进行设置,温度32~35℃,湿度55%~65%,5%二氧化碳CO2。
1.3.2 高氧组 培养环境同对照组,采用新生儿空气、氧气混合器(无锡法斯达医学设备有限公司)向细胞培养箱中输注95%浓度的氧气,20 min后密闭培养箱。
1.3.3 白藜芦醇+高氧组 培养环境同高氧组,在通入高浓度氧前,应用5μmol/L白藜芦醇在单个核细胞中。
1.4 观察指标
1.4.1 单个核细胞活性氧检测 3组均培养48 h,收集各组单个核细胞和培养液。采用活性氧检测试剂盒(上海翊圣生物科技有限公司),将收集好的细胞悬浮于适量稀释好的药物,于37℃细胞培养箱内避光孵育。阳性对照:先用无血清培养基等稀释阳性对照到常用工作浓度100 μmol/L,加入细胞37℃避光孵育0.5~4.0 h,可看到活性氧水平提高,探针装载前,按照1︰1 000用无血清培养液稀释二氯荧光黄二乙酸酯(2',7'-Dichlorodihydrofluorescein diacetate,DCFH-DA)至终浓度为10 μmol/L。去除细胞内药物,离心收集细胞,加入适当稀释好的探针,使其细胞密度为1.0×106~2.0×107。用无血清细胞培养液洗涤细胞1~2次,以充分去除未进入细胞内的DCFH-DA。收集细胞后用荧光分光光度计,使用488 nm激发波长,525 nm发射波长,实时或逐时间点检测刺激前后荧光的强弱。
1.4.2 培养液丙二醛(Malondialdehyde,MDA)含量检测 采用MDA测定试剂盒(南京建成生物工程研究所),取各组培养液0.1~0.2 ml,按说明书加入样本和试剂,漩涡混匀,>95℃沸水浴40 min,流水冷却,4 500 r/min离心10 min,取上清液待测,采用532 nm波长,1 cm光径比色测定各组吸光度值,得出MDA含量。
1.4.3 细胞自噬体检测 采用细胞自噬染色检测试剂盒[单丹磺酰尸胺(Monodansylcadaverine,MDC)法](北京雷根生物技术有限公司),用去离子水稀释1×缓冲液;离心,收集细胞,用1×缓冲液清洗细胞1次,弃上清液;加入适量的1×Wash Buffer重悬细胞,计数并调节细胞浓度至1×106/ml;取适量细胞悬液至新的离心管(eppendorf tubes,EP)中,加入MDC Stain,轻轻混匀,室温避光染色;离心收集细胞,用1×Wash Buffer清洗细胞2次,弃上清液;加入Collection Buffer重悬细胞,滴加于载玻片上并加盖玻片;荧光显微镜下观察(激发滤光片波长355 nm,阻断滤光片波长512 nm),计数并拍照,测定荧光强度。
1.4.4 血红素加氧酶 -1(heme oxygenase-1,HO-1)蛋白水平及活性检测 HO-1蛋白水平采用人HO-1酶联免疫检测试剂盒(上海生工生物工程股份有限公司)进行检测。①加样:分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、标准孔、待测样品孔。在酶标包被板上标准品准确加样50 μl,待测样品孔中先加样品稀释液40 μl,然后再加待测样品10 μl(样品最终稀释度为5倍)。加样将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀;②温育:用封板膜封板后置37℃温育30 min;③配液:将30倍浓缩洗涤液用蒸馏水30倍稀释后备用;④洗涤:小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30 s后弃去,重复5次,拍干;⑤加酶:加入酶标试剂50 μl/孔,空白孔除外;⑥显色:先加入显色剂A 50 μl/孔,再加入显色剂B 50μl/孔,轻轻震荡混匀,37℃避光显色10 min;⑦终止:加终止液50 μl/孔,终止反应(此时蓝色立转黄色);⑧测定:以空白空调零,450 nm波长依序测量各孔的吸光度。测定应在加终止液后15 min内进行。
1.5 统计学方法
数据分析采用SPSS 18.0统计软件,计量资料以均数±标准差(±s)表示,多组间比较用单因素方差分析,两两比较采用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 3组单个核细胞活性氧、MDA含量比较
3组活性氧、MDA水平比较,经单因素方差分析,差异有统计学意义(P<0.05),高氧组活性氧、MDA水平高于对照组和白藜芦醇+高氧组,白藜芦醇+高氧组活性氧、MDA水平高于对照组。见表1。
2.2 3组细胞自噬体水平比较
对照组自噬体为(0.34±0.04),高氧组为(1.21± 0.09),白藜芦醇+高氧组为(0.46±0.05),经单因素方差分析,差异有统计学意义(P<0.05),高氧组自噬体水平高于对照组和白藜芦醇+高氧组,白藜芦醇+高氧组自噬体水平高于对照组。
2.3 3组HO-1蛋白水平及活性比较
3组HO-1蛋白水平及活性比较,经单因素方差分析,差异有统计学意义(P<0.05),高氧组HO-1蛋白水平及活性高于对照组和白藜芦醇+高氧组,白藜芦醇+高氧组HO-1蛋白水平及活性高于对照组。见表2。
表1 3组单个核细胞活性氧、MDA含量比较 (±s)
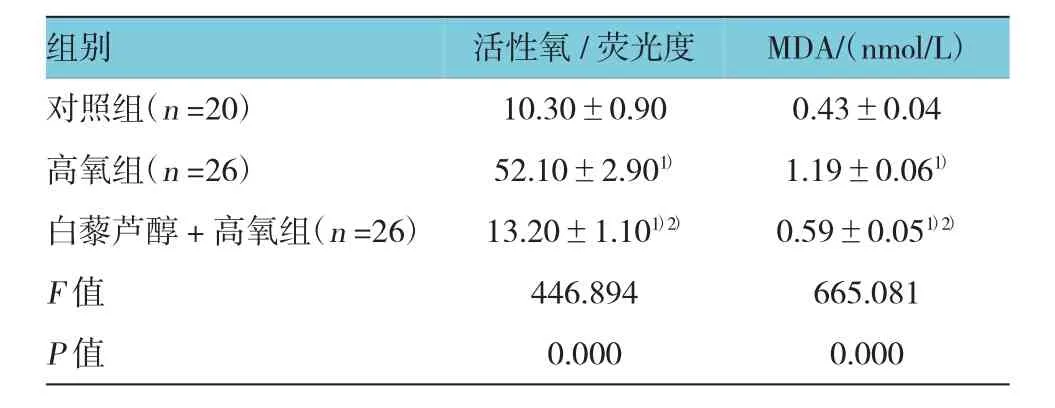
表1 3组单个核细胞活性氧、MDA含量比较 (±s)
注:1)与对照组比较,P<0.05;2)与高氧组比较,P<0.05
组别MDA/(nmol/L)对照组(n=20) 10.30±0.90 0.43±0.04高氧组(n=26) 52.10±2.901) 1.19±0.061)白藜芦醇+高氧组(n=26) 13.20±1.101)2) 0.59±0.051)2)F值 446.894 665.081 P值 0.000 0.000活性氧/荧光度
表2 3组HO-1蛋白水平及活性比较 (±s)

表2 3组HO-1蛋白水平及活性比较 (±s)
HO-1活性/ [mmol/(L·h)]对照组(n=20) 1.10±0.23 53.10±7.90高氧组(n=26) 1.81±0.32 77.40±12.10白藜芦醇+高氧组(n=26) 1.23±0.27 57.30±8.20 F值 23.663 26.368 P值 0.000 0.000组别HO-1蛋白水平/荧光度
3 讨论
早产儿进行氧疗是临床常规治疗方法之一,SOLA等[9]发现,85%~94%的血氧饱和度可以升高早产儿的病死率,91%~95%的血氧饱和度可以导致不良反应发生。因此合理的供氧浓度,采用预防措施减少高氧暴露的危害十分重要。白藜芦醇是一种天然多酚,在细胞凋亡、生存、分化中具有多种作用。JIN等[10]研究发现,细胞损伤,如氧化和脂质过氧化;自由基,如活性氧自由基引起的DNA损伤,导致疾病的发生,而白藜芦醇具有清除自由基、抗氧化损伤的作用。SONG等[11]发现,白藜芦醇具有调节炎症、细胞存货和凋亡的能力。本研究通过白藜芦醇对高氧暴露下早产儿单个核细胞的氧化应激作用,探讨其作用机制。
3.1 白藜芦醇的抗氧化应激作用
JIN等[10]采用自由基清除实验发现,白藜芦醇对人肝脏肿瘤HepG2细胞氧化应激损伤有保护作用。SEIF EL-DIN等[12]对302只肝损伤大鼠进行研究发现,白藜芦醇可以减轻肝损伤和炎症,减少炎症浸润和水肿,降低肿瘤坏死因子-α、白介素6、丙氨酸和天冬氨酸转氨酶水平,恢复肝脏谷胱甘肽、超氧化物歧化酶、丙二醛水平正常化,说明白藜芦醇抑制炎症与氧化应激反应有关。OURIQUE等[13]发现,丙戊酸钠是一种在儿童和成人癫痫的治疗中广泛使用的药物,长期使用可能导致男性生殖功能障碍,氧化应激是其主要作用机制,而白藜芦醇可以用来防止丙戊酸钠的氧化损伤。ATAIE等[14]认为,氧化应激可诱导神经元损伤,调节细胞内信号传导,最终导致细胞凋亡或坏死,神经元死亡,而使用多酚抗氧化剂可以减少神经元死亡和氧化应激。
3.2 早产与高氧暴露
全裕凤等[15-16]对高体积分数氧暴露早产儿进行研究发现,高氧组患者外周血单个核细胞血红素加氧酶-1、HO-1蛋白、HO-1活性表达水平,以及血清胆红素、血浆一氧化碳CO、血红蛋白水平显著升高,且高于空气组。杨熙等[17]对出现呼吸窘迫综合征且需要吸氧的早产儿外周血单个核细胞进行研究发现,随着吸氧浓度不断增加,单个核细胞产生的活性氧、MDA水平也随之升高,而去乙酰化酶沉默接合型信息调节因子2同源蛋白1转位率也逐渐增加,其蛋白表达水平显著下降,说明高氧暴露可能导致氧化应激反应发生。刘雪雁等[18]对足月新生大鼠进行高浓度氧吸入,发现高氧暴露第3天时肺泡发育停滞,逐渐出现纤维化,第7天发现胶原纤维和网状纤维沉积。杨熙等[19]对40例早产儿的外周血单个核细胞进行研究发现,应用白藜芦醇可以明显降低高氧导致的活性氧、MDA、去乙酰化酶沉默接合型信息调节因子2同源蛋白1转位率升高,说明白藜芦醇具有抗氧化应激的能力。魻ZDEMIR等[7]对新生幼鼠进行研究发现,白藜芦醇通过其抗炎和抗氧化特性对高氧性肺损伤起防治作用。本研究发现,3组活性氧、MDA、细胞自噬体、HO-1蛋白水平、HO-1活性比较,差异有统计学意义,高氧组活性氧、MDA、细胞自噬体、HO-1蛋白水平、HO-1活性高于对照组和白藜芦醇+高氧组,白藜芦醇+高氧组活性氧、MDA、细胞自噬体、HO-1蛋白水平、HO-1活性高于对照组,与上述研究结果相近。
综上所述,白藜芦醇能够明显降低高氧暴露早产儿活性氧、MDA、细胞自噬体、HO-1蛋白水平、HO-1活性,有效对抗高氧暴露产生的氧化应激,减少氧化应激损伤。
[1]POETS C F,ROBERTS R S,SCHMIDT B,et al.Association between intermittent hypoxemia or bradycardia and late death or disability in extremely preterm infants[J].JAMA,2015,314(6): 595-603.
[2]BUCZYNSKI B W,MADUEKWE E T,O'REILLY M A.The role of hyperoxia in the pathogenesis of experimental BPD[J].Semin Perinatol,2013,37(2):69-78.
[3]POULSEN M M,J覫RGENSEN J,JESSEN N,et al.Resveratrol in metabolic health:an overview of the current evidence and perspectives[J].Ann N Y Acad Sci,2013,1290:74-82.
[4]HONG M,TAN H Y,LI S,et al.Cancer stem cells:the potential targets of chinese medicines and their active compounds[J]. Int J Mol Sci,2016,17(6):893.
[5]RAJ P,ZIEROTH S,NETTICADAN T,et al.An overview of the efficacy of resveratrol in the management of ischemic heart disease[J].Ann N Y Acad Sci,2015,1348(1):55-67.
[6]PIROLA L,FR魻JD魻S.Resveratrol:one molecule,many targets[J]. IUBMB Life,2008,60(5):323-332.
[7]魻ZDEMIR 魻M,G魻ZKESER E,BIR F,et al.The effects of resveratrol on hyperoxia-induced lung injury in neonatal rats[J]. Pediatr Neonatol,2014,55(5):352-357.
[8]《中华儿科杂志》编辑委员会,中华医学会儿科学分会新生儿学组.早产儿管理指南[J].中华儿科杂志,2006,44(3):188-191.
[9]SOLA A,GOLOMBEK S G,MONTES BUENO M T,et al.Safe oxygen saturation targeting and monitoring in preterm infants:can we avoid hypoxia and hyperoxia[J].Acta Paediatr,2014,103(10): 1009-1018.
[10]JIN J,LI Y,ZHANG X,et al.Evaluation of both free radical scavenging capacity and antioxidative damage effect of polydatin[J]. Adv Exp Med Biol,2016,923:57-62.
[11]SONG J,JUN M,AHN M R,et al.Involvement of miR-Let7A in inflammatory response and cell survival/apoptosis regulated by resveratrol in THP-1 macrophage[J].Nutr Res Pract,2016,10(4): 377-384.
[12]SEIF EL-DIN S H,EL-LAKKANY N M,SALEM M B,et al. Resveratrol mitigates hepatic injury in rats by regulating oxidative stress,nuclear factor-kappa B,and apoptosis[J].J Adv Pharm Technol Res,2016,7(3):99-104.
[13]OURIQUE G M,P魭S T S,SACCOL E M,et al.Resveratrol prevents oxidative damage and loss of sperm motility induced by long-term treatment with valproic acid in wistar rats[J].Exp Toxicol Pathol,2016,68(8):435-443.
[14]ATAIE A,SHADIFAR M,ATAEE R.Polyphenolic antioxidants and neuronal regeneration[J].Basic Clin Neurosci,2016,7(2):81-90.
[15]全裕凤,郑明慈,张华,等.高体积分数氧暴露早产儿外周血单个核细胞血红素加氧酶-1表达水平及其活性的变化[J].实用儿科临床杂志,2011,26(2):116-118.
[16]全裕凤,郑明慈,欧维林,等.高氧暴露对早产儿血单个核细胞血红素加氧酶-1蛋白表达水平及活性的影响[J].中国新生儿科杂志,2011,26(1):37-39.
[17]杨熙,董文斌,李清平,等.早产儿氧暴露后外周血单个核细胞活性氧增加使SIRT1产生核质穿梭[J].细胞与分子免疫学杂志,2015, 31(12):1669-1676.
[18]刘雪雁,俞志凌,薛辛东.吸入高浓度氧对新生大鼠一般状态及肺病理形态学的影响[J].天津医药,2007,35(5):354-356.
[19]杨熙,董文斌,李清平,等.白藜芦醇对高氧诱导早产儿外周血单个核细胞氧化应激损伤的影响及其机制研究[J].中国当代儿科杂志,2016,18(1):72-77.
(童颖丹 编辑)
Effect of resveratrol on oxidative stress in peripheral blood mononuclear cells of hyperoxia-exposed preterm infants*
Rui-jun Qiao,Hua-yue Zheng
(Department of Pediatrics,the First Affiliated Hospital of Nanyang Medical College,Nanyang,Henan 473000,China)
ObjectiveTo investigate the effect of resveratrol on oxidative stress in peripheral blood mononuclear cells of hyperoxia-exposed premature infants.MethodsFifty-two cases of premature infants were randomly divided into resveratrol plus high oxygen group and high oxygen group with 26 cases in each group, and 20 preterm infants with normal atmospheric air inhalation during the same period were selected as control group.Each infant was drawn 2 ml of blood from the radial artery,and then mononuclear cells were isolated by Ficoll density gradient centrifugation.The levels of reactive oxygen species and malondialdehyde(MDA)in the culture medium,autophagosomes and the level and activity of erythrocyte oxygenase(HO-1)protein were observed.ResultsThe active oxygen,MDA,autophagosomes,HO-1 protein level and HO-1 activity were significantly different among the 3 groups(P<0.05),which were the highest in the high oxygen group and lowest in the control group.ConclusionsResveratrol can effectively protect premature infants from oxidative stress injury induced by hyperoxia exposure.
premature infant;high oxygen;resveratrol;mononuclear cell;oxidative stress
R722.6
A
10.3969/j.issn.1005-8982.2017.09.013
1005-8982(2017)09-0064-05
2016-10-17
河南省教育厅科学技术研究重点项目(No:142102810950)
郑华月,E-mail:huangqijunsc@163.com

