丹皮酚通过下调COX-2表达及PGE2合成抑制大肠癌细胞增殖及诱导细胞凋亡
李 明, 谭诗云
武汉大学人民医院消化内科,湖北 武汉430060
丹皮酚通过下调COX-2表达及PGE2合成抑制大肠癌细胞增殖及诱导细胞凋亡
李 明, 谭诗云
武汉大学人民医院消化内科,湖北 武汉430060
目的观察丹皮酚对大肠癌细胞增殖活性和细胞凋亡的影响,并探讨丹皮酚对大肠癌的抑制作用是否与其下调COX-2表达及PGE2合成有关。方法以大肠癌LoVo细胞株为研究对象,CCK-8比色法检测不同浓度丹皮酚或PGE2或塞来昔布处理后细胞活力及丹皮酚对PGE2刺激细胞增殖的影响;流式细胞仪检测细胞凋亡情况;Western blotting方法检测COX-2和凋亡相关蛋白Bax、Bcl-2、Caspase-3、Caspase-9的表达情况;ELISA法检测大肠癌细胞上清液中PGE2含量。结果丹皮酚处理后LoVo细胞活力显著降低,呈明显的时间和浓度依赖性;流式细胞仪检测结果显示丹皮酚可诱导LoVo细胞凋亡;丹皮酚可降低LoVo细胞COX-2表达及上清液中PGE2含量;经PGE2处理后LoVo细胞活力明显增强,丹皮酚可抑制PGE2诱导的LoVo细胞活力增加;经塞来昔布处理后,LoVo细胞活力显著降低,且细胞凋亡率增加;经丹皮酚处理后,LoVo细胞Bax蛋白表达上调,Bcl-2蛋白表达下调,Pro-Caspase-3、Pro-Caspase-9表达减弱,而Cleaved-Caspase-3、Cleaved-Caspase-9表达增强,呈浓度依赖性。结论丹皮酚可抑制LoVo细胞增殖并诱导细胞凋亡,可能的机制是通过下调COX-2表达及PGE2合成进而激活线粒体凋亡途径。
丹皮酚;大肠癌;环氧合酶-2;前列腺素E2; 凋亡
大肠癌是常见消化道恶性肿瘤。全球大肠癌发病率位居恶性肿瘤的第3位,每年有超过120万新增病例,并有超过60万病例死亡[1]。欧美等发达国家和地区大肠癌发病率位居恶性肿瘤的第3位,病死率则高居恶性肿瘤相关死亡的第2位[2]。在我国,每年新发大肠癌病例约13万,并以平均4%的增幅不断攀升[3]。大肠癌已经成为我国发病率增长速度最快,且发病年龄逐渐年轻化的恶性肿瘤,其病死率已位居我国恶性肿瘤的第4位[4]。目前研究认为大肠癌的发生和进展是一个多环节、多步骤的复杂过程。尽管Wnt信号通路的异常激活被认为是大肠癌发生的始动因素,但是在绝大多数大肠癌中高表达的环氧合酶-2(cyclooxygenase-2, COX-2)被认为在肿瘤进展和侵袭转移过程中起着关键作用。作为前列腺素E2(PGE2)合成的限速酶,过表达的COX-2又可大量产生PGE2。二者共同参与肿瘤发生与进展[5-6]。因此,COX-2可能是抗肿瘤作用的一个靶点。
丹皮酚(Paeonol),又称牡丹酚,是从中草药牡丹、芍药根皮和徐长卿干燥根或全草中提取的小分子酚类化合物。其具有抗炎、肝肾保护、降血糖、免疫调节、心血管保护、抗菌、解热镇痛、抗过敏、抑制血小板聚集和中枢抑制作用等广泛的药理学活性[7-11]。在肿瘤防治方面,丹皮酚对皮肤癌、乳腺癌及肝癌等多种肿瘤细胞均有抑制作用[12-15]。然而,目前关于丹皮酚抗肿瘤作用的分子机制知之甚少,对细胞因子、基因调控和信号转导通路等方面的研究还有待进一步深入研究。本实验拟观察丹皮酚对大肠癌细胞增殖和凋亡的影响,并探讨丹皮酚是否通过下调COX-2表达及PGE2合成发挥抗大肠癌细胞作用。
1 材料与方法
1.1 材料结肠癌LoVo细胞由中国科学院上海细胞库提供;主要试剂:丹皮酚购自宁波天真药业有限公司(纯度>98%);胎牛血清购自GBICO;CCK-8试剂盒购自日本同仁化学;培养板购自Corning公司;PGE2、塞来昔布购自sigma公司;凋亡试剂盒购自BD公司;PGE2ELISA试剂盒购自美国BPB公司;COX-2、Bax、Bcl-2、Pro-Caspase-3/9、Cleaved-Caspase-3/9及β-actin抗体购自Cell Signaling Technology公司。DMEM/F-12培养液、辣根酶标记山羊抗兔或山羊抗鼠IgG购自碧云天生物技术研究所。
1.2 方法
1.2.1 细胞培养:用10%胎牛血清的DMEM/F-12培养基培养LoVo细胞,将细胞培养瓶置于恒温37 ℃,体积分数5% CO2,饱和湿度的培养箱中。取对数期的细胞进行后续实验。
1.2.2 CCK-8比色法检测细胞活力:取对数生长期的细胞,消化、离心、洗涤后用培养基重悬,利用细胞计数板计数,调整细胞浓度为5×104/ml;取96孔板3块,分别标记为d1、d2、d3,将细胞悬液以每孔200 μl接种至3块96孔板中,放置培养箱中孵育过夜;细胞贴壁后,分为对照组和实验组,实验组分别加入实验设计好的处理药物,对照组加入等量的细胞培养基,并设置空白组。每组设5个复孔,放置培养箱中分别培养24、48和72 h。每个处理时间截止前2 h取出培养板,每孔加入20 μl的CCK-8试剂,再置于细胞培养箱中继续孵育2 h,后取出培养板,用酶标仪测定各孔在450 nm处的吸光度值(A值),根据公式计算细胞活力=(处理组A值-空白组A值)/(对照组A值-空白组A值)×100%。
1.2.3 PI/Annexin V检测细胞凋亡率:取对数生长期细胞,消化、离心、洗涤后用培养基重悬,利用细胞计数板计数,调整细胞浓度为1×105个/ml,将细胞悬液接种至6孔板内,每孔2 ml,放置培养箱中孵育过夜;细胞贴壁后,分别加入预设计药物浓度处理48 h。取出6孔培养板,消化、洗涤、收集细胞,根据凋亡试剂盒操作说明进行操作,每管加入缓冲液500 μl将各组细胞重悬,再根据要求加入PI及Annexin V试剂各5 μl,避光室温孵育15 min,流式细胞仪检测细胞凋亡率。
1.2.4 ELISA法检测PGE2:按照预定分组处理24 h,吸取培养基离心后将上清液移至高压消毒的EP管中备用。加入标准品至酶标板中,设置梯度,分别取各组上清液样品100 μl,加入至酶标板中,再分别将每孔加入酶标液50 μl,室温放置90 min。具体操作步骤根据试剂盒要求进行,根据标准品曲线计算样品中PGE2浓度。
1.2.5 Western blotting检测COX-2、Bax、Bcl-2、Pro-Caspase-3/9、Cleaved-Caspase-3/9蛋白表达:取对数生长期细胞,消化、离心、洗涤后用培养基重悬,利用细胞计数板计数,调整细胞浓度为1×105个/ml,将细胞悬液接种至细胞培养皿内,放置培养箱中孵育过夜,待细胞贴壁后,分别加入0、30、60、120 mg/L的丹皮酚处理48 h。消化、离心、洗涤、收集各组细胞,每管加入200 μl预冷蛋白裂解液,4 ℃条件下裂解30 min,再行超声裂解;4 ℃条件下12 000 r/min离心10 min,将上清液小心移至经高压消毒的EP管内,分装标记后-80 ℃储存。根据蛋白测定试剂盒说明书测定提取细胞总蛋白质;取40 μg样品行SDS-PAGE电泳,然后转膜至PVDF膜,5% BSA封闭1 h,根据蛋白分子量切割条带,分别加入COX-2、Bax、Bcl-2、Pro-Caspase-3/9、Cleaved-Caspase-3/9一抗,4 ℃摇床上孵育过夜;加入TBST洗膜,再加入说明书要求稀释的二抗,室温下孵育2 h,再次TBST洗膜,ECL显色、曝光、显影、定影、拍照并分析数据。
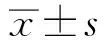
2 结果
2.1 丹皮酚对LoVo细胞活力的影响如图1所示,15、30、60、120、240 mg/L的丹皮酚处理LoVo细胞后,与对照组(0 mg/L)比较,细胞存活率逐渐降低,呈时间和浓度依赖性,药物浓度越高、作用时间越长,其细胞存活率越低。
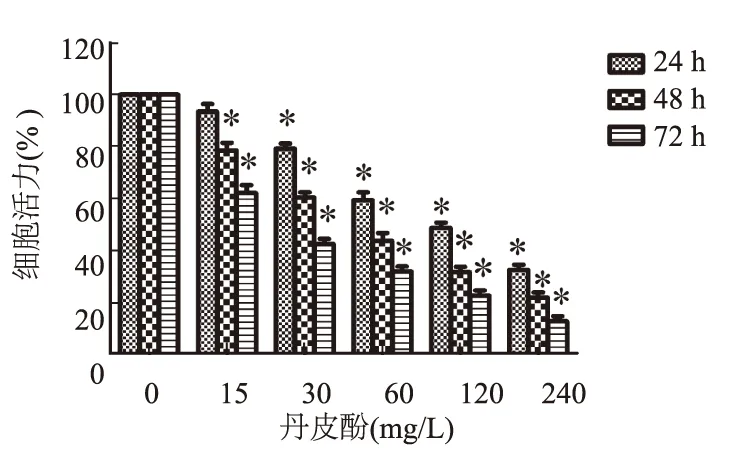
注:与对照组(0 mg/L丹皮酚)比较,*P<0.05。
图1 丹皮酚对LoVo细胞活力的影响
Fig 1 The effect of Paeonol on the cell survival in LoVo colorectal cancer cells
2.2 丹皮酚对LoVo细胞凋亡率的影响将30、60、120 mg/L的丹皮酚处理后的LoVo细胞用PI/Annexin V双染标记,再行流式细胞仪检测。如图2所示,丹皮酚处理后,细胞凋亡率从15.4%上升至38.6%,而对照组凋亡率仅为0.6%。
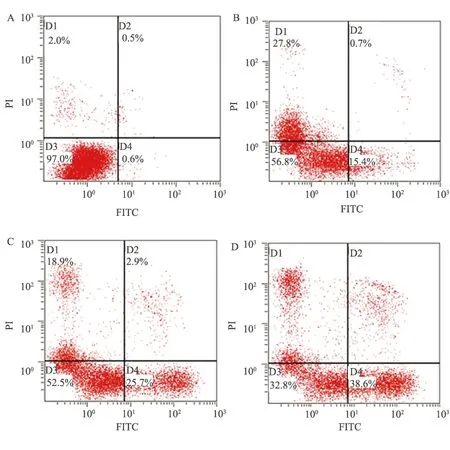
图2 丹皮酚对LoVo细胞凋亡率的影响
A:0 mg/L; B:30 mg/L; C:60 mg/L; D:120 mg/L
Fig 2 The effect of Paeonol on the cell apoptosis in LoVo colorectal cancer cells
2.3 丹皮酚对LoVo细胞COX-2表达及PGE2合成的影响如图3A所示,30、60、120 mg/L的丹皮酚分别处理LoVo细胞48 h后,Western blotting 结果显示随着丹皮酚浓度的升高,COX-2蛋白表达量逐渐降低。浓度为30、60、120 mg/L的丹皮酚分别处理LoVo细胞48 h后对细胞上清液中PGE2浓度的影响,结果发现随着药物浓度的增加,细胞上清液中PGE2浓度明显降低(见图3B),与对照组比较,差异均有统计学意义(P<0.05)。

注:与对照组(0 mg/L丹皮酚)比较,#P<0.05。
图3 丹皮酚对LoVo细胞COX-2表达及PGE2合成的影响
A:丹皮酚下调LoVo细胞COX-2表达;B:丹皮酚降低LoVo细胞上清液中PGE2含量
Fig 3 The effect of Paeonol on the expression of COX-2 and synthesis of PGE2
2.4 PGE2对LoVo细胞增殖的影响不同浓度(5、10、20 μmol/L) PGE2处理LoVo细胞24 h后,随着PGE2浓度的增加,LoVo细胞增殖作用也增加(见图4A)。再选用10 μmol/L PGE2观察PGE2作用不同时间对LoVo细胞增殖作用,发现PGE2作用48 h对LoVo细胞增殖促进效果最佳(见图4B)。
2.5 丹皮酚对PGE2促进LoVo细胞增殖效应的影响如图5所示,10 μmol/L PGE2作用LoVo细胞48 h可明显促进细胞增殖,而给予60、120 mg/L丹皮酚后均可降低PGE2对LoVo细胞增殖的促进效应,且120 mg/L丹皮酚抑制作用更为明显。
2.6 COX-2特异性抑制剂塞来昔布对结直肠癌细胞增殖的影响如图6所示,25、50、100 μmol/L的塞来昔布分别作用24、48、72 h对结直肠癌细胞系LoVo细胞增殖均有抑制作用,且呈现明显的浓度依赖效应及时间依赖效应。
2.7 COX-2特异性抑制剂塞来昔布对LoVo细胞凋亡的影响将25、50、100 μmol/L的塞来昔布处理LoVo细胞48 h后,用PI/Annexin V双染标记,再行流式细胞仪检测。如图7所示,细胞凋亡率逐渐升高。

注:与对照组(0 μmol/L PGF2)比较,#P<0.05。
图4 不同浓度PGE2处理不同时间对LoVo细胞增殖的影响
A:0、5、10、20 μmol/L PGE2分别处理LoVo细胞24 h后对细胞活力的影响;B:10 μmol/L PGE2处理LoVo细胞0、24、48、72 h后对细胞活力的影响
Fig 4 The effect of PGE2with different concentrations, different time on the cell survival in LoVo colorectal cancer cells

注:与空白组比较,*P<0.05;与单独PGE2组比较,#P<0.05。
图5 丹皮酚抑制PGE2诱导的LoVo细胞增殖效应
Fig 5 Paeonol could inhibit PGE2-induced proliferation of LoVo cells
2.8 丹皮酚对LoVo细胞凋亡相关蛋白Bax、Bcl-2、Caspase-3/9表达的影响Western blotting结果显示(见图8),丹皮酚作用48 h后,LoVo细胞Bax蛋白表达随着药物浓度的升高也逐渐增加,而Bcl-2蛋白表达量则逐渐降低,Pro-Caspase-3、Pro-Caspase-9表达减弱,而Cleaved-Caspase-3、Cleaved-Caspase-9表达增强,呈浓度依赖性。

注:与对照组(0 μmol/L赛来昔布)比较,#P<0.05。
图6 COX-2特异性抑制剂塞来昔布对LoVo细胞增殖的影响
Fig 6 The effect of Celecoxib on the cell proliferation in LoVo colorectal cancer cells
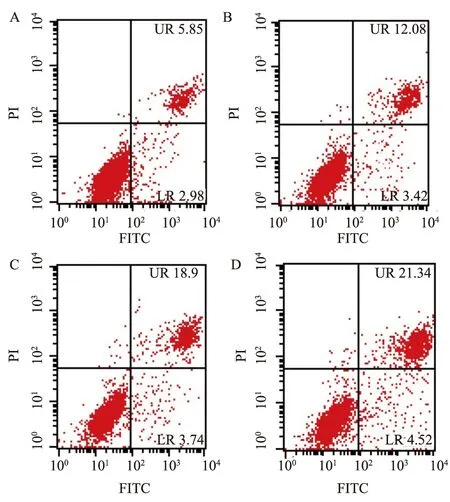
图7 塞来昔布对细胞LoVo细胞凋亡的影响
A: 0 μmol/L; B: 25 μmol/L; C: 50 μmol/L; D:100 μmol/L
Fig 7 The effect of Celecoxib on the apoptosis in LoVo colorectal cancer cells
3 讨论
前期研究发现,丹皮酚对肝癌等多种肿瘤细胞均有抗肿瘤作用。Chou等[16]研究发现丹皮酚可抑制角叉菜聚糖诱导的大鼠热觉过敏反应,减少大鼠爪部皮肤渗出液中中性粒细胞浸润和TNF-α、IL-β、IL-10、COX-2、PGE2的含量。Chae等[17]研究发现丹皮酚可显著拮抗脂多糖诱导的炎症反应。但是,丹皮酚对于肿瘤中特别是大肠癌中COX-2的作用及其意义并未报道,因此,本研究以COX-2及其产物PGE2为切入点,对丹皮酚在大肠癌中增殖和凋亡中的作用及其作用机制进行探讨。

图8 丹皮酚对LoVo细胞凋亡相关蛋白Bax、Bcl-2、Caspase-3、Caspase-9表达的影响
Fig 8 The effect of Paeonol on the expressions of Bax, Bcl-2, Caspase-3 and Caspase-9 in LoVo colorectal cancer cells
本实验CCK-8细胞活性实验结果显示,丹皮酚处理可降低细胞活力,呈时间和浓度依赖性,药物浓度越高、作用时间越长,其细胞存活率越低。丹皮酚处理LoVo细胞48 h后,可显著促进细胞凋亡,呈剂量依赖性。这些结果提示丹皮酚可能通过抑制细胞增殖并诱导细胞凋亡发挥抗肿瘤作用。细胞凋亡是程序化、多基因调控的细胞死亡过程,细胞凋亡机制在维持机体内环境稳定中扮演着重要角色,是重要生理调控机制[18-19];细胞过度增殖和凋亡不足在肿瘤发生、发展中具有重要意义[20],因此通过诱导细胞凋亡可能是肿瘤治疗的有效途径之一。本研究进一步探讨了丹皮酚对细胞凋亡线粒体途径的影响,丹皮酚处理48 h后,Western blotting检测结果显示LoVo细胞的Bcl-2表达下调,Bax表达上调,Pro-Caspase-3、Pro-Caspase-9表达减弱,而Cleaved-Caspase-3、Cleaved-Caspase-9表达增强,且呈剂量依赖性。
COX-2在包括大肠癌在内的多种肿瘤细胞中均呈过表达状态。而作为PGE2合成的限速酶,过表达的COX-2又可产生大量PGE2。二者共同参与肿瘤的发生与发展。下调COX-2及PGE2表达后可促进细胞凋亡、抑制血管新生、促进细胞免疫而发挥抗肿瘤作用。因此,COX-2可能是抗肿瘤作用的一个靶点。流行病学研究已经证实,非甾体类抗炎药(nonsteroidal anti-inflammatory drugs, NSAIDs)或COX-2特异性抑制剂在一定程度上可预防胃肠道肿瘤[21]。三项随机对照研究(PreSAP、APC、Approve)评估了COX-2特异性抑制剂在散发结肠腺瘤患者复发中的预防作用及安全性,结果发现三项研究中均可有效降低结肠腺瘤的复发,特别是降低了进展期结肠腺瘤(advanced adenomas)的复发率[22-24]。然而,长期应用此类药物可导致胃肠道甚至一系列心血管毒性等不良反应发生,限制了其在健康人群中的应用,临床推荐仅对特殊家族性腺瘤息肉病等特殊人群使用。因此,寻找毒性小,而又能有效抑制COX-2的药物可为大肠癌治疗提供更好的选择,也可能为大肠癌的预防和治疗提供更好的策略。研究证实过表达的COX-2可通过减弱TGF-β的抑制细胞增殖效应促进细胞增殖[25];同时,COX-2可调控PI3K信号通路及Bcl-2表达抑制细胞凋亡,也可通过诱导P53基因突变及调控Fas蛋白减弱凋亡信号发挥抗细胞凋亡作用[26-27]。本实验中,丹皮酚能抑制LoVo细胞COX-2表达及PGE2合成,PGE2处理后可促进LoVo细胞的增殖效应,且丹皮酚可抑制PGE2促进LoVo细胞的增殖效应。此外,COX-2特异性抑制剂处理后也可观察到细胞增殖抑制及细胞凋亡增加。这些研究结果提示丹皮酚可能通过抑制COX-2及PGE2合成抑制LoVo细胞增殖并诱导细胞凋亡。
综上所述,本研究发现,丹皮酚在体外能抑制LoVo细胞增殖并诱导其凋亡,可能的机制是抑制COX-2表达和PGE2合成,进而激活线粒体凋亡途径。
[1]Jemal A, Bray F, Center MM, et al. Global cancer statistics [J]. CA Cancer J Clin, 2011, 61(2): 69-90.
[2]Siegel R, Naishadham D, Jemal A.Cancer statistics, 2013 [J]. CA Cancer J Clin, 2013, 63(1): 11-30.
[3]Center MM, Jemal A,Ward E. International Trends in Colorectal Cancer Incidence Rates [J]. Cancer Epidemiol Biomarkers Prev, 2009, 18(6):1688-1694.
[4]Ganapathi S, Kumar D, Katsoulas N, et al. Colorectal cancer in the young: trends,charactistics and outcome [J]. Int J Colorectal, 2011, 26(7): 927-934.
[5]Wang D, Wang H, Brown J, et al. CXCL1 induced by prostaglandin E2 promotes angiogenesis in colorectal cancer [J]. J Exp Med, 2006, 203(4): 941-951.
[6]Chell S, Kaidi A, Williams AC, et al. Mediators of PGE2synthesis and signalling downstream of COX-2 represent potential targets for the prevention/treatment of colorectal cancer [J]. Biochim Biophys Acta, 2006, 1766(1): 104-119.
[7]Park J, Kim HY, Lee SM. Protective effects of moutan cortex radicis against acute hepatotoxicity [J]. Afr J Tradit Complement Altern Med, 2011, 8(5): 220-225.
[8]Hu S, Shen G, Zhao WG, et al. Paeonol, the main active principles of Paeonol moutan,ameliorates alcoholic steatohepatitis in mice [J]. J Ethnopharmacol, 2010, 128(1): 100-106.
[9]Lee H, Lee G, Kim H, et al. Paeonol, a major compound of Moutan Cortex, attenuates cisplatin-induced nephrotoxicity in mice [J]. Evid-Based ComplAlt, 2013, 2013: 310989.
[10]Fu PK, Wu CL, Tsai TH, et al. Anti-inflammatory and anticoagulative effects of Paeonol on LPS-induced acute lung injury in rats [J].Evid-Based ComplAlt, 2012, 2012: 837513.
[11]ThiHa D, Trung TN, HienIT, et al. Selected compounds derived from Moutan Cortex stimulated glucose uptake and glycogen synthesis via AMPK activation in human Hep G2 cells [J]. J Ethnopharmacol, 2010, 131(2): 417-424.
[12]Horng CT, Shieh PC, Tan TW, et al. Paeonol suppresses chondrosarcoma metastasis through up-regulation of miR-141 by modulating PKCδ and c-Src signaling pathway [J]. Int J Mol Sci, 2014, 15(7): 11760-11772.
[13]Peng LH, Xu SY, Shan YH, et al. Sequential release of salidroside and paeonol from a nanosphere-hydrogel system inhibits ultraviolet B-induced melanogenesis in guinea pig skin [J]. Int J Nanomed, 2014, 9: 1897-908.
[14]Lin X, Yi Z, Diao J, Shao M, et al. ShaoYao decoction ameliorates colitis-associated colorectal cancer by downregulating proinflammatory cytokines and promoting epithelial-mesenchymal transition [J]. J Transl Med, 2014, 12: 105.
[15]Cai J, Chen S, Zhang W, et al. Paeonol reverses paclitaxel resistance in human breast cancer cells by regulating the expression of transgelin 2 [J]. Phytomedicine, 2014, 21(7): 984-991.
[16]Chou TC. Anti-inflammatory and analgesic effects of paeonol in carrageenan-evoked thermal hyperalgesia [J]. Br J Pharmacol, 2003, 139(6): 1146-52.
[17]Chae HS, Kang OH, Lee YS, et al. Inhibition of LPS-induced iNOS, COX-2 and inflammatory mediator expression by paeonol through the MAPKs inactivation in RAW 264.7 cells [J]. Am J Chin Med, 2009, 37(1): 181-194.
[18]Modjtahedi H, Cho BC, Michel MC, et al. A comprehensive review of the preclinical efficacy profile of the ErbB family blocker afatinib in cancer [J]. Naunyn Schmiedebergs Arch Pharmacol, 2014, 387(6): 505-21.
[19]Moran AE, Hunt DH, Javid SH, et al. Apc deficiency is associated with increased Egfr activity in the intestinal enterocytes and adenomas of C57BL/6JMin/+ mice [J]. J Biol Chem, 2004, 279(41):43261-43272.
[20]Roberts RB, Min L, Washington MK, et al. Importance of epidermal growth factor receptor signaling in establishment of adenomas and maintenance of carcinomas during intestinal tumorigenesis [J]. Proc Natl Acad Sci U S A, 2002, 99(3): 1521-1526.
[21]Marnett LJ, DuBois RN. COX-2: atarget for colon cancer prevention [J]. Annu Rev Pharmacol Toxicol, 2002, 42: 55-80.
[22]McLean MH, Murray GI, Fyfe N, et al. COX-2 expression in sporadic colorectal adenomatous polyps is linked to adenoma characteristics [J]. Histopathology, 2008, 52(7): 806-815.
[23]Ogino S, Kirkner GJ, Nosho K, et al. Cyclooxygenase-2 expression is an independent predictor of poor prognosis in colon cancer [J]. Clin Cancer Res, 2008, 14(24): 8221-8227.
[24]Vane JR, Bakhle YS, Botting RM. Cyclooxygenases 1 and 2 [J]. Annu Rev Pharmacol Toxicol, 1998, 38: 97-120.
[25]Milella M, Gelibter A, Di Cosimo S, et al. Pilot study of celecoxib and infusional 5-fluorouracil as second-line treatment for advanced pancreatic carcinoma [J]. Cancer, 2004, 101(1): 133-138.
[26]Young LE, Sanduja S, Bemis-Standoli K, et al. The mRNA binding proteins HuR and tristetraprolin regulate cyclooxygenase 2 expression during colon carcinogenesis [J]. Gastroenterology, 2009, 136(5):1669-1679.
[27]Daikoku T, Hirota Y, Tranguch S, et al. Conditional loss of uterine Pten unfailingly and rapidly induces endometrial cancer in mice [J]. Cancer Res, 2008, 68(14): 5619-5627.
(责任编辑:马 军)
Paeonol inhibits cell proliferation and induces cell apoptosis through down regulating the expression of COX-2 and PGE2synthesis in LoVo colorectal cancer cells
LI Ming, TAN Shiyun
Department of Gastroenterology, Renmin Hospital of Wuhan University, Wuhan 430060, China
Objective To observe the effect of Paeonol on cell proliferation and apoptosis, and investigate whether its antitumor effect is associated with down regulation of COX-2 expression and PGE2synthesis in colorectal cancer cells. Methods The LoVo colorectal cancer cells served as the experimental subjects. After treatment with Paeonol at different concentrations respectively at different time, the cell survival of LoVo was determined by the CCK-8 method. LoVo cells were treated with PGE2and with or without Paeonol for different time and the cell survival was determined. After treatment with Paeonol at different concentrations for 48 hours, cell apoptosis was detected by flow cytometry. Western blotting was used to detect espressions of COX-2, Bax, Bcl-2, Caspase-3 and Caspase-9 proteins. The expression of PGE2in the culture medium was detected by ELISA. Results After treatment with Paeonol, the proliferation of LoVo cells was significantly inhibited, which showed a dose-and time-dependent manner. Flow cytometry assays demonstrated that Paeonol significantly induced apoptosis of LoVo cells. Paeonol reduced cyclooxygenase-2 (COX-2) expression and prostaglandin E2(PGE2) synthesis in LoVo cells. PGE2promoted the cell proliferation and Paeonol inhibited PGE2-induced proliferation of LoVo cells. Celecoxib inhibited cell proliferation and induced apoptosis of LoVo cells. Increasing doses of Paeonol increased expression of Bax and decreased expression of anti-apoptotic Bcl-2 attenuated expressions of Pro-Caspase-3 and Pro-Caspase-9, strengthened expressions of Cleaved-Caspase-3 and Cleaved-Caspase-9. Conclusion Paeonol can inhibit cell proliferation and induce apoptosis of colorectal cancer cells, which is associated with down requlation of COX-2 espression and PGE2synthsis.
Paeonol; Colorectal cancer; Cyclooxygenase-2; Prostaglandin E2; Apoptosis
10.3969/j.issn.1006-5709.2017.02.003
李明,主治医师,博士,研究方向:消化道肿瘤的防治。E-mail:liming870221@sina.com
谭诗云,医学博士,主任医师,教授,博士研究生导师,研究方向:消化道肿瘤的防治。E-mail:tanshiyun1962@163.com
R735.3+4
A 文章编号:1006-5709(2017)02-0128-06
2016-07-31

