辉锑矿铁源固硫还原熔炼直接炼锑
徐康宁,陈永明,王岳俊,薛浩天,叶龙刚,张文博
辉锑矿铁源固硫还原熔炼直接炼锑
徐康宁1,陈永明2,王岳俊1,薛浩天2,叶龙刚2,张文博1
(1. 河套学院理学系,巴彦淖尔015000;2. 中南大学冶金与环境学院,长沙410083)
以Na2CO3-NaCl熔盐作为熔炼介质,提出以铁源为固硫剂的辉锑矿还原固硫直接熔炼,以解决当前炼锑工艺存在的温度高、流程长等缺点。结果表明:在Sb2S3-FeO-C反应体系中,Sb2S3的还原固硫反应分步进行,Sb2S3先与FeO发生交互反应生成Sb2O3和FeS,Sb2O3再被还原剂还原成金属锑。以Fe2O3为固硫剂的熔炼实验得到最佳工艺条件为:=1.0、碳粉质量为精矿质量的40%、熔炼温度850 ℃、熔炼时间60 min。在此最佳条件下,锑直收率为91.48%,粗锑品位94.31%。较传统火法炼锑工艺,熔炼温度降低300 ℃以上,熔炼过程中硫以FeS形式被固定,消除低浓度二氧化硫烟气的污染。
锑冶金;熔盐熔炼;固硫机理;氧化铁渣
我国锑资源储量占全球总量的80%左右,是全球第一大锑生产国,生产工艺有火法和湿法两大类[1−2],其中以火法冶炼为主。多数锑冶炼企业采用挥发焙烧(熔炼)−还原熔炼工艺,设备以鼓风炉和反射炉为主,该工艺存在流程长、能耗高、低浓度SO2烟气污染、熔炼炉热效率低等问题,生产技术和装备严重落后于铅、铜等大宗有色金属的生产,因此锑冶炼行业亟须进行技术改造和产业升级[3−4]。
针对当前炼锑行业存在的问题,近些年来,研究者开发了多项强化冶金工艺。火法炼锑方面,戴曦等[5]进行了辉锑矿富氧挥发熔池熔炼试验,在1200℃、80%富氧的条件下,渣含锑最低0.33%(质量分数)。MENG等[6]研究了脆硫锑铅矿中硫化锑的水蒸汽选择性氧化挥发,获得的铅焙砂和锑烟尘中铅和锑直收率最高为97%和85%。LIU等[7]研究了辉锑矿的强化挥发熔炼,弃渣含锑低于1%,烟气中SO2浓度高于8%,达到了制酸标准。上述火法工艺主要存在氧化锑高温下粘结烟道、有价金属分散等不足之处。湿法炼锑方面,AWE等[8]采用Na2S+NaOH浸出硫化锑,通过电积时加入CuO/Fe沉S2−,得到表面质量良好的锑;YANG等[9]在新氯化−水解法的基础上利用HCl+Cl2/SbCl5浸出金锑矿,Cl2/SbCl5可在浸出液电积过程再生;另外,FeCl3酸性溶液也是常用浸出剂[10]。ZHANG等[11]对辉锑矿矿浆电解进行了系统研究,张成禄等[12]将矿浆电解用于处理脆硫锑铅矿,锑浸出率可达97%。上述锑湿法工艺多存在成本高、废水量大、规模小等问题。
为克服锑冶炼工艺中存在的问题,本文作者所在团队将固硫熔炼、碱性熔炼[13]、熔盐冶金[14]等清洁冶金新方法进行有机融合,提出了硫化锑熔盐固硫−还原熔炼工艺。新工艺使用氧化铁作为铁源来固硫,在NaCl-Na2CO3熔盐中实现一步炼锑,改变了传统氧化−还原的炼锑路线,消除了低浓度SO2烟气的排放。另外,我国氧化铁资源及富含氧化铁的二次废渣量十分大,特别是含金的黄铁矿烧渣[15],堆存这些烧渣既占用土地资源、又污染环境,而且会造成资源浪费。因此,使用氧化铁渣作为固硫剂,一方面可用铁固定硫化锑中的硫;另一方面渣中有价金属可被金属锑捕集,起到了废渣资源化处置的效果。
1 实验
1.1 实验试剂和设备
反应机理研究试验所用的硫化锑为分析纯级(阿拉丁公司生产),无定型态。还原碳粉、三氧化二铁、铁粉为分析纯级产品(国药集团生产);试验主要设备为气氛箱式炉(合肥日新公司生产)、气氛管式炉(合肥日新公司生产)、箱式马弗炉(长沙远东电炉厂生产)。本试验采用氧化铁(Fe2O3)为固硫剂,由于Fe2O3在熔炼温度范围内(800~1000 ℃)会发生还原分解,因此直接选取纯氧化亚铁(FeO)进行固硫反应机理研究。FeO由实验室合成[16]:按(Fe)/(Fe2O3)=2.65进行配料,混匀后装入模具,压制(150 MPa)成片状。而后在氮气气氛下反应30 min,温度控制在925 ℃左右,反应完毕后进行骤冷处理,最后研碎到0.1 mm以下备用。其XRD检测结果如图1所以。从图1中可以看出,合成氧化亚铁纯度高,无杂峰。工艺研究试验中以湖南省辰州矿业有限责任公司提供的硫化锑精矿为研究对象,其化学成分如表1所列。其他试剂氧化铁、碳酸钠、氯化钠和碳粉均为分析纯级(国药集团生产)。

表1 试验所用硫化锑精矿的化学成分

图1 实验合成FeO的XRD谱
1.2 实验方法
反应机理研究:首先将反应物按一定比例混合后在热重−差热仪(美国TA 仪器公司生产,SDT Q600)上检测,其中FeO的理论加入量按Sb2S3中的硫全部生成FeS计算,差热仪在氮气保护下以10 ℃/min升温速度从室温加热到1000 ℃。通过热力学分析推测还原固硫过程可能存在的化学反应及其发生温度;而后在不同温度、时间条件下进行Sb2S3与FeO的反应行为实验,通过XRD(Rigaku D/MAX 24, 000)检测分析反应产物中的物相变化,从而得出生成物物相变化规律,最终得出硫化锑还原固硫熔炼的反应机理,实验技术路线如图2所示。

图2 反应机理研究技术路线图
进行Sb2S3与FeO的反应行为研究时,取10 g硫化锑和1.0倍理论量的氧化亚铁,充分混合后装入20 mL刚玉坩埚中,待炉内环境达到实验条件后,将坩埚放入气氛管式炉中反应,反应过程中通入99.99%的高纯N2进行气氛保护(流速大于0.6 L/min),以防止混合物料在反应过程氧化。实验延续至设定时间后,快速取出坩埚,在低温区氮气保护下急冷并取样分析。
以Fe2O3为固硫剂的熔炼实验:将100 g硫化锑精矿、100 g NaCl-Na2CO3混合共晶熔盐(43%NaCl)、氧化铁、还原碳粉混合均匀后装入刚玉坩埚,放入箱式马弗炉。其中氧化铁的理论加入量按原料中的硫全部生成硫化亚铁计算,实际加入量为理论加入量乘以过量倍数(表示理论量的倍数)。分别在不同温度下熔炼一定时间后,取出坩锅并在室温下急冷,分离金属锑和熔炼渣,对金属锑称取质量并取样分析,考察Fe2O3加入量、还原剂碳粉用量、熔炼时间和熔炼温度等条件对试验结果的影响。
2 结果与讨论
2.1 硫化锑还原固硫机理分析
在熔盐中进行还原固硫熔炼时,熔盐主要起惰性反应介质的作用,而真正起固硫作用的是固硫剂。在硫化锑与氧化亚铁的还原固硫熔炼过程主要发生以下综合反应:
Sb2S3+3FeO+3C=2Sb+3FeS+3CO(g) (1)
Sb2S3+3FeO+3CO(g)=2Sb+3FeS+3CO2(g) (2)
上述综合反应的具体历程有待确定,因此本研究分别在Sb2S3-FeO体系和Sb2S3-FeO-C体系中进行了反应行为研究。
2.1.1 Sb2S3-FeO体系
N2气氛中,Sb2S3:FeO按摩尔比1:3混合后的TG-DTA曲线,如图3(a)所示。TG曲线在517℃~750℃之间有显著的质量损失过程,质量损失率为25%~30%,为样品本身及产物挥发所引起。DTA曲线在231 ℃处的吸热峰主要是发生硫化锑晶型转变[1],在523 ℃处的弱吸热峰则可能发生了吸热化学反应;同时在853 ℃处还有一较强吸热峰。

图3 Sb2S3-FeO混合物的TG-DTA结果和反应产物的XRD谱
为考察Sb2S3与FeO在不同温度下的反应产物,在TG-DTA分析的基础上分别选取550 ℃、700 ℃、1000 ℃进行了反应实验。混合物配比与DTA相同,反应时间为1 h,产物的XRD检测结果如图3(b)所示。从图3(b)中可以看出,上述3个温度条件下产物主要为Sb2O3和FeS,并且直到1000 ℃时产物物相也没有变化,这是因为Sb2S3与FeO按反应(3)发生了交互反应;但随着反应温度升高,FeS的特征衍射峰强度不断增强,Sb2O3的特征衍射峰强度有所减弱,这是因为Sb2O3高温下极易挥发,在1000 ℃的蒸汽压达到22.93 kPa,导致其相对含量因挥发而减少,而FeS相对含量增加。上述结果说明,提高温度有利于Sb2S3与FeO进行反应,但温度升高也会导致产物Sb2O3挥发加剧[17]。
Sb2S3+3FeO=3FeS+Sb2O3(3)
2.1.2 Sb2S3-FeO-C体系
在Sb2S3-FeO体系的基础上加入还原剂碳粉,按式(1)的化学计量系数关系进行配料,氮气气氛下测试TG-DTA结果如图4(a)所示。由图4(a)可以看出,Sb2S3-FeO-C体系与Sb2S3-FeO体系的TG-DTA分析结果相似,TG曲线在517~750 ℃之间均有显著的质量损失过程,为物料中Sb2S3及生成物的挥发所致。在869 ℃处有一强吸热峰,此时有吸热反应发生,此后伴随物料质量的减少。
根据热重分析结果,分别在550 ℃、700 ℃、1000 ℃下研究Sb2S3-FeO-C体系的反应行为,结果如图4(b)。从图4(b)中可以看出,当反应温度为550 ℃时,产物主要有FeS、Sb、Sb2O4和FeSb2S4(锑铁锍);反应温度为700 ℃时,产物主要有FeS、Sb和Sb2O4;反应温度为1000 ℃时,产物主要有FeS、Sb和FeSb2。
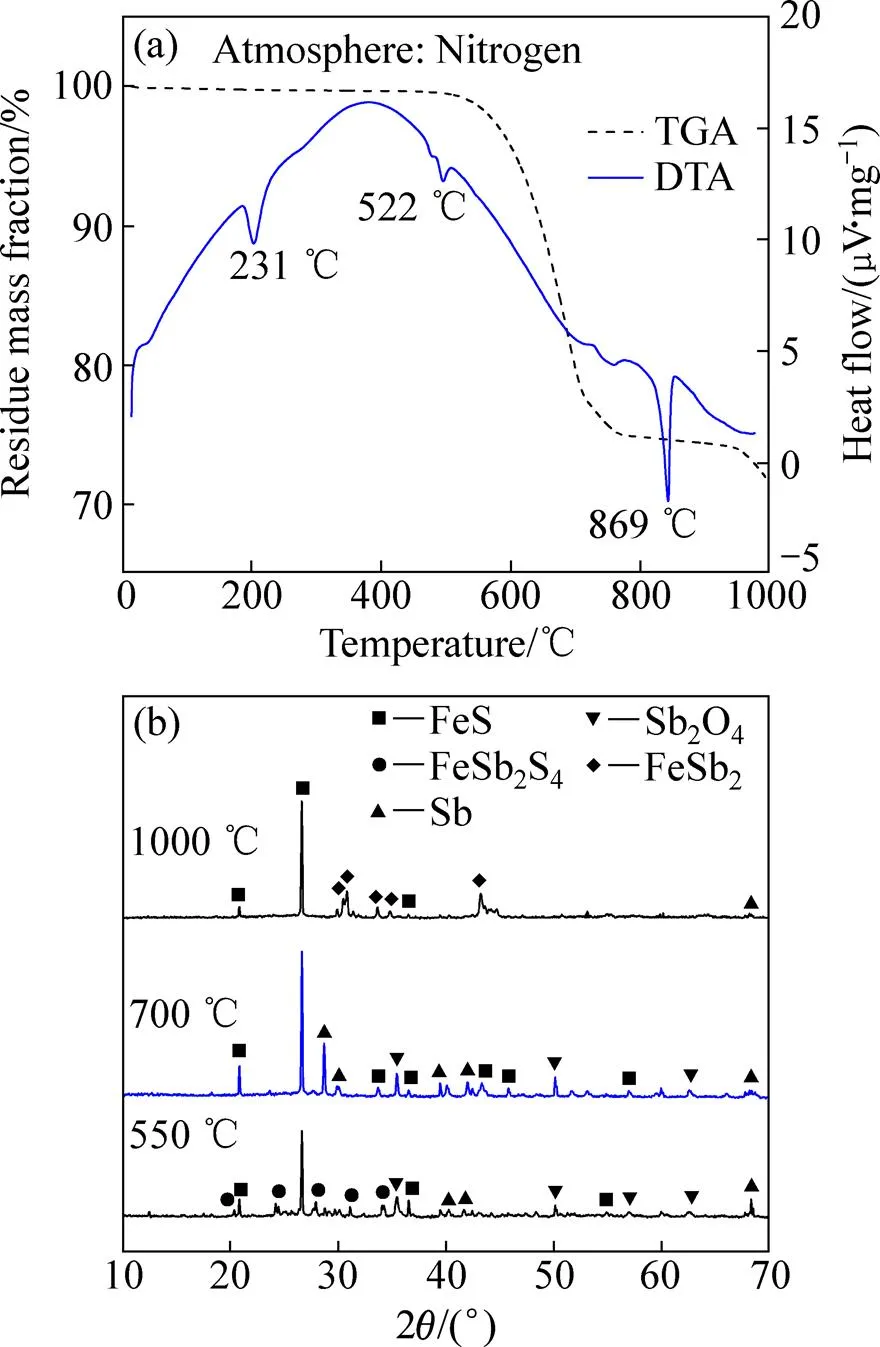
图4 Sb2S3-FeO-C混合物的TG-DTA结果和反应产物的XRD谱
由反应产物可知,Sb2S3与FeO发生交互固硫反应生成了FeS,反应产物的XRD衍射图谱中未发现Sb2O3的特征峰,而是有金属锑的峰出现,说明Sb2S3与FeO反应生成的Sb2O3在碳还原剂存在的体系中被还原成为Sb。这是因为一方面根据热力学计算,反应(4)在433 ℃时的ΔΘ变为负值,随着温度升高绝对值增大,在700 ℃和1000 ℃时分别为−137.66 kJ/mol和−277.94 kJ/mol,因此,在实验考察的温度范围内Sb2O3的还原反应极易进行;另一方面,Sb2S3的分解和碳热分解反应在较难进行[1],因此,金属锑可能的生成途径只有Sb2S3先与FeO生成Sb2O3,再被还原成金属。反应温度在550 ℃时有少量FeSb2S4生成,由反应生成的FeS与Sb2S3结合在一起所致;当反应温度为700 ℃时,FeSb2S4的峰消失,说明此化合物不稳定,进一步升高温度可使其分解。当反应温度为1000 ℃时,XRD分析结果未发现锑的氧化物的特征峰,这是由于一方面布多尔反应使高温下反应体系还原气氛增强;另一方面,反应温度为1000 ℃时,物料熔化更多,使反应物接触更加充分而促进了氧化锑的还原反应;与此同时,高温下Sb2S3挥发致使固硫剂FeO过量,而多余的FeO被还原生成Fe,进而与Sb形成锑铁合金(FeSb2)。
Sb2O3+3C=2Sb+3CO(g) (4)
因此,综合以上试验结果可以推断,硫化锑与氧化亚铁的还原固硫反应分步进行,即Sb2S3首先与固硫剂FeO发生交互反应生成Sb2O3和FeS,Sb2O3再被还原剂C或CO还原成金属锑,温度越高还原越充分,但也必须控制适宜的熔炼温度和还原气氛,以防止FeO被还原生成Fe,被锑捕集后形成FeSb2影响粗锑品位。
2.2 辉锑矿熔炼试验
在机理研究的基础上,进行了以硫化锑精矿为原料、Fe2O3为固硫剂的熔盐熔炼试验,考察Fe2O3加入量、熔炼时间、熔炼温度,还原剂碳粉加入量等条件对试验结果的影响,结果如图5所示。
2.2.1 氧化铁加入量
保持熔炼温度为900 ℃,熔炼时间为180 min、还原碳用量为精质量的30%,以固定精矿中的元素硫所需理论氧化铁量为理论倍数(=1,表示理论量的倍数),改变氧化铁加入倍数分别进行实验,结果如图5(a)所示。结果表明,氧化铁的加入量对锑直收率和品位的影响较大。氧化铁量增加,熔炼反应向右进行,有利于提高体系的固硫效果。但是,随着氧化铁加入量的不断提高,一方面生成的FeS易生成锑铁锍,锑铁锍会恶化熔盐的流动性;另一方面过量氧化铁会发生还原反应,铁被锑捕集后影响粗锑的品位。从图5(a)中也可以看出,随着氧化铁加入量超过1.0倍理论量,锑直收率和粗锑品位持续下降。综合考虑固硫效果和金属回收率指标,选择过剩1.0倍为最佳氧化铁用量。

图5 熔炼条件对粗锑品位及锑直收率的影响
2.2.2 熔炼温度
保持熔炼时间为180 min,还原碳粉用量为精矿量的30%,Fe2O3用量过量系数为1.0,考察熔炼温度对锑提取过程的影响,结果如图5(b)所示。结果表明,温度对金属锑直收率影响显著,当熔炼温度从800 ℃升高至950 ℃时,锑直收率由85.62%提升至95.80%,渣含锑从4.43%降低至0.99%。因为当温度低于800 ℃时,炉料难以熔化形成黏度小、流动性好的熔盐,在动力学上不利于反应的快速进行,并造成金属相和熔盐渣混合而难于分离。随着熔炼温度升高,炉料与熔盐共融并形成流动性良好的反应体系,并加快反应动力学。但是熔炼温度太高,会加剧反应物的挥发,能耗较大。从粗锑品位、锑的直收率以及能耗综合考虑,确定最佳熔炼温度为850 ℃。
2.2.3 熔炼时间
保持还原碳用量为精矿量的30%,Fe2O3用量过量系数为1.0,熔炼温度为850 ℃,考察熔炼时间对锑提取结果的影响,结果如图5(c)所示。从图5(c)中可以看出,熔炼时间对锑直收率的影响不明显,在所研究的熔炼时间范围内,锑直收率基本保持在85%左右;而熔炼时间对粗锑品位的影响较为显著,熔炼进行60 min后,即可达到了较高的品位和直收率,这是因为火法反应温度高,反应强度大,动力学上可以很快完成。而当熔炼时间由60 min延长至240 min时,粗锑的品位从93.10%下降至74.99%。因为延长熔炼时间,金属锑和熔盐的挥发量加大,熔盐黏度增加,不利于金属的分层。此外,随着熔炼的进行,金属铁的生成量也会增加,粗锑品位随熔炼时间的延长而下降。因此,选定最佳熔炼时间为60 min。
2.2.4 碳粉量
保持熔炼时间60 min,Fe2O3用量过量系数为1.0,熔炼温度为850 ℃,考察还原剂碳粉加入量对熔炼结果的影响,结果如图5(d)所示。结果表明,当还原碳粉用量由精矿量10%提高至40%时,锑直收率由50%提高至94.99%,而粗锑品位基本维持在92%~98%,并呈略微下降的趋势。这是由于还原碳粉的加入一方面提高还原气氛而有利于熔炼反应进行,另一方面,还原性气氛过强使所添加的氧化铁也会被还原进入金属相,从而降低粗锑品位和固硫效果。因此,综合考虑,确定最佳还原碳粉用量为精矿用量的40%。
2.3 综合扩大实验
依据单因素条件试验结果,确定氧化铁作为铁源固硫的硫化锑精矿直接熔炼的优化条件为:= 1.0、碳粉质量为精矿质量的40%、熔炼温度850 ℃、熔炼时间60min。在此条件下进行综合试验,规模为1000 g硫化锑精矿每次,熔炼完成后分离金属和熔盐渣。熔盐渣进行水浸以分离渣和盐,水浸的条件为液固比5:1、50 ℃溶解2 h。进行了水浸液和水浸渣的成分分析,计算主要元素Sb、Fe的分配关系如图6 所示。

图6 熔炼产物中主要元素的分配关系
从图6中可以看出,锑的直收率91.48%,并且86.91%的铁和82.28%的硫富集于水浸渣中,说明硫主要以不溶性的硫铁化合物的形式被固定,计钠盐固硫在内的综合固硫率可达95.31%。结果表明,精矿中有价元素得到有效回收, 99%以上的Au伴随Sb进入金属相,可以在后续精炼过程中提取回收。
熔盐渣(水浸前)与水浸渣的XRD物相分析分别如图7所示。熔盐渣中主要成分为NaFeS2、NaCl和Na2S2O3,说明有少部分Na2CO3参与了熔炼反应,生成了钠硫化合物。从图7(b)可知,熔盐渣经过水浸后,其水浸渣的主要成分为S0和Fe3O4,这是因为在水浸过程很有可能是发生了RICKARD[18]所提到的自氧化反应:
2FeS+4H2O=2FeOOH+3H2(g)+3S0(5)
而生成物的FeOOH在水浸渣烘干过程中,发生脱水氧化,从而形成Fe3O4。

图7 熔盐渣和水浸渣的物相成分
3 结论
1) Sb2S3首先与FeO发生交互反应生成Sb2O3与FeS,Sb2O3再被还原剂还原成金属锑,即反应过程分两步进行:
第一阶段:
Sb2S3+3FeO=Sb2O3+3FeS
第二阶段:
Sb2O3+3C=2Sb+3CO(g)
Sb2O3+3CO(g)=2Sb+3CO2(g)
总反应:
2Sb2S3+6FeO+3C=4Sb+6FeS+3CO2(g)
2) 以氧化铁为固硫剂的硫化锑矿熔盐熔炼的最佳工艺条件为:氧化铁过量1.0倍、精矿质量40%的碳粉、熔炼温度850 ℃、熔炼时间60 min。在此最佳工艺条件下,锑直收率达91.48%,所得粗锑品位为94.31%,粗锑中主要杂质元素为Fe(4.44%)和Pb(0.50%)。综合固硫率在95%以上,新工艺基本消除了低浓度SO2烟气排放难题,同时有价金属综合回 收好。
REFERENCES
[1] 赵天从. 锑[M]. 北京: 冶金工业出版社, 1987: 95−99.ZHAO Tian-cong. Antimony[M]. Beijing: Metallurgical Industry Press, 1987: 95−99.
[2] LIU Wei-feng, YANG Tian-zu, CHEN Lin, BING Shu. Development of antimony smelting technology in China[C]//4th International Symposium on High-Temperature Metallurgical Processing. San Antonio: TMS, 2013.
[3] LIU F Y, LE X C, MCKNIGHT-WHITFORD A, XIA Y L, WU F C. Antimony speciation and contamination of waters in the Xikuangshan antimony mining and smelting area, China[J]. Environmental Geochemistry and Health, 2010, 32(5): 401−413.
[4] WILSON S C, LOCKWOOD P V, ASHLEYPM T. The chemistry and behaviour of antimony in the soil environment with comparisons to arsenic: A critical review. Environmental Pollution[J]. 2010, 158(5): 1169−1181.
[5] 戴 曦, 周康洁, 李良斌, 徐兴良. 辉锑矿富氧挥发熔池熔炼工艺研究[J]. 矿冶, 2015, 24(4): 27−31. DAI Xi, ZHOU Kang-jie, LI Liang-bin, XU Xing-liang. Study of oxygen-enriched volatile bath smelting of stibnite concentrate[J]. Mining and Metallurgy, 2015, 24(4): 27−31.
[6] MENG Y S, HUA Y X, ZHU F L. Effect of ZnS content on Pb-Sb separation of PbS-Sb2S3-ZnS ternary system under water vapor atmosphere[J]. Transaction of the Indian Institute of Metals, 2015, 68(1): 37−41.
[7] LIU W, LUO H L, QING W Q, ZHENG Y X, YANG K, HAN J W. Investigation into oxygen-enriched bottom-blown stibnite and direct reduction[J]. Metallurgy and Materials Transaction B, 2014, 45(4): 1281−1290.
[8] AWE S A, SUNDKVIST J, BOLIN N, SANDSTROM A. Process flowsheet development for recovering antimony from Sb-bearing copper concentrates[J]. Minerals Engineering, 2013, 49: 45−53.
[9] YANG J G, WU Y T. A hydrometallurgical process for the separation and recovery of antimony[J]. Hydrometallurgy, 2014, 143: 68−74.
[10] MAHLANGU T, GUDYANGA F P, SIMBI D J. Reductive leaching of stibnite(Sb2S3) flotation concentrates using metallic iron in a hydrochloric acid medium Ⅱ: kinetics[J]. Hydrometallurgy, 2007, 88(3): 132−142.
[11] ZHANG Y J, YANG X W, DENG L H, YAO G. Leaching mechanism of sulfide ores in slurry electrolysis[J]. Transaction of Nonferrous Metals Society of China, 2000, 10(1): 105−108.
[12] 张成禄, 王成彦, 陈永强, 杨永强, 王文凡, 谢 雄. 高砷锑金精矿矿浆电解生产实践[J]. 有色金属(冶炼部分), 2014, 55(11): 16−20. ZHANG Yong-lu, WANG Cheng-yan, CHEN Yong-qiang, YANG Yong-qiang, WANG Wen-fan, XIE Xiong. Plant practice of slurry electrolysis of high arsenic gold-bearing stibnite concentrate[J]. Nonferrous Metals (Extractive Metallurgy), 2014, 55(11): 16−20.
[13] 刘小文, 杨建广, 李 静, 陈永明, 孙亚辉, 唐谟堂. Bi2S3-ZnO-Na2CO3体系热力学分析及应用[J]. 中国有色金属学报, 2012, 22(1): 310−314. LIU Xiao-wen, YANG Jian-guang, LI Jing, CHEN Yong-ming, SUN Ya-hui, TANG Mo-tang. Thermodynamic analysis of Bi2S3-ZnO-Na2CO3and its application[J]. The Chinese Journal of Nonferrous Metals, 2012, 22(1): 310−314.
[14] CHEN Y M, YE L G, TANG C B, YANG S H, TANG M T, ZHANG W H. Solubility of Sb in binary Na2CO3-NaCl molten salt[J]. Transactions of Nonferrous Metals Society of China, 2015, 25(9): 3146−3151.
[15] ZHU D Q, CHEN D, PAN J, CUI Y, ZHOU X L. One step technology to separate copper, zinc, lead from iron in metallurgical slag and pyrite cinder(Ⅰ): Laboratory scale test[J]. Mineral Process and Extractive Metallurgy, 2012, 121(2): 79−85.
[16] 冯子勇, 黄宝贵. 游离氧化亚铁的合成工艺研究[J]. 矿冶工程, 1993, 13(2): 69−71. FENG Zi-yong, HUANG Bao-gui. A technique for synthesizing free ferrous oxide[J]. Mining and Metallurgical Engineering, 1993, 13(2): 69−71.
[17] 卢红波. 锡阳极泥硫化焙烧分离锑[J]. 中国有色金属学报, 2015, 25(11): 3202−3208. LU Hong-bo. Separation of antimony from tin anode slime by sulfidation roasting[J]. The Chinese Journal of Nonferrous Metals, 2015, 25(11): 3202−3208.
[18] RICKARD D. Kinetics of pyrite formation by the H2S oxidation of iron (Ⅱ) monosulfide in aqueous solutions between 25 and 125 ℃: The rate equation[J]. Geochim Cosmochim AC, 1997, 61(1): 115−134.
(编辑 王 超)
Reducing and sulfur-fixing smelting of stibnite to produce antimony by one-step using iron materials as sulfur-fixing agent
XU Kang-ning1, CHEN Yong-ming2, WANG Yue-jun1, XUE Hao-tian2, YE Long-gang2, ZHANG Wen-bo1
(1. Science Department, Hetao College, Bayannur 015000, China;2. School of Metallurgy and Environment, Central South University, Changsha 410083, China)
In the views of the shortcomings in the current antimony smelting process which are high energy consumption and a long flow, a new process was proposed to smelt antimony directly from stibnite by reducing and sulfur-fixing reaction in NaCl-Na2CO3molten salt. The reaction mechanism of reductive sulfur-fixation process of Sb2S3was investigated. The results show that, for Sb2S3-FeO-C system, Sb2O3and FeS are generated by sulfur-fixation reaction between Sb2S3and FeO. And then, Sb2O3can be consecutively reduced to Sb by reductive agent. The influencing parameters during smelting process are comprehensively investigated, including sodium salt content and composition, ferric oxide dosage, smelting temperature and smelting time. The optimum conditions are determined as follows:=1.0,C:concentrate=40%, smelting temperature of 850 ℃ and smelting time of 60 min. Under the optimal smelting conditions, the average direct recovery rate of antimony and grade of crude antimony are 91.48% and 94.31%,respectively. Comparing to the traditional pyro-metallurgical process, the smelting temperature of present process is reduced at least 300 ℃. And sulfur is fixed in the form of FeS in the smelting process, so low concentration of SO2emission could be avoided completely.
antimony metallurgy; molten salt smelting; sulfur-fixing mechanism; ferric oxide slag
Project(51104182) supported by the National Natural Science Foundation of China
2016-05-17; Accepted date: 2016-10-11
CHEN Yong-ming; Tel: +86-731-88830470; E-mail: thirtythree61@aliyun.com
10.19476/j.ysxb.1004.0609.2017.05.025
1004-0609(2017)-05-1061-07
TF818
A
国家自然科学基金资助项目(51104182)
2016-05-17;
2016-10-11
陈永明,副教授,博士;电话:0731-88830470;E-mail:thirtythree61@aliyun.com

