肝细胞再生磷酸因子-1在脑胶质瘤组织中的表达及对脑胶质瘤细胞凋亡的影响
权俊杰, 屈建强, 周 乐
(西安交通大学第二附属医院神经外科, 陕西 西安 710004)
肝细胞再生磷酸因子-1在脑胶质瘤组织中的表达及对脑胶质瘤细胞凋亡的影响
权俊杰, 屈建强, 周 乐
(西安交通大学第二附属医院神经外科, 陕西 西安 710004)
目的:探讨肝细胞再生磷酸因子-1(PTP4A1)在脑胶质瘤组织中的表达及对脑胶质瘤细胞凋亡的影响及机制。方法:组织蛋白提取试剂盒提取脑胶质瘤及瘤旁组织中的总蛋白,Western blot检测PTP4A1的蛋白表达;将siRNA-NC、PTP4A1-siRNA转染至对数生长期的人脑胶质瘤U251细胞,未转染任何siRNA的作为对照组,各组细胞转染48h后,Western blot检测PTP4A1、Ki67、PCNA、Cleaved caspase3、β-catenin、Cyclin D1、C-myc的蛋白表达;CCK8实验检测细胞增殖;流式细胞仪检测细胞凋亡。结果:脑胶质瘤组织中PTP4A1的蛋白表达显著高于瘤旁组织(P<0.01);siRNA-NC组 PTP4A1的蛋白表达与对照组差异无统计学意义(P>0.05),PTP4A1-siRNA组PTP4A1的蛋白表达显著低于对照组(P<0.01);与对照组及siRNA-NC组比较,PTP4A1-siRNA组的细胞存活率及Ki67、PCNA、β-catenin、Cyclin D1、C-myc的蛋白表达显著降低,细胞凋亡率及Cleaved caspase3蛋白表达显著升高(P<0.01)。结论:PTP4A1在脑胶质瘤组织中高表达,沉默PTP4A1的表达可通过下调Wnt/β-catenin信号通路抑制人脑胶质瘤U251细胞增殖及诱导其凋亡。
PTP4A1; 脑胶质瘤; 凋 亡; Wnt/β-catenin信号通路
脑胶质瘤是常见的中枢神经系统恶性肿瘤,约占颅内肿瘤的45%,具有病死率高、致死率高及治愈率低等特点。近些年随着医疗科学的进步,对脑胶质瘤的治疗主要采用手术辅助放化疗的方法,但由于治疗部位的特殊性及脑胶质瘤的增殖性和侵袭性,其治疗效果并不理想[1,2]。近些年,随着基因工程的发展,从分子生物学角度研究脑胶质瘤的发病机制成为研究热点。PTP4A1是促肝细胞再生磷酸酶因子(phosphatase of regenerating liver, PRLs)家族中的一员,在肝脏、小肠绒毛、神经细胞、支气管肺上皮等均有表达,在多种肿瘤细胞,如舌鳞癌、黑色素瘤等均有高表达,其表达影响肿瘤的发生及发展[3,4]。RNA干扰(RNA interference,RNAi)是一种能使序列特异性基因在转录后发生沉默的现象,是研究基因功能有效的方法,且已有大量研究显示RNA干扰沉默基因表达对胃癌、肺癌等多种肿瘤有抑制生长及诱导凋亡的作用[5,6],也有研究指出沉默PTP4A1的表达可抑制舌鳞癌细胞的增殖、诱导细胞凋亡及阻滞细胞周期[7]。本研究旨在沉默PTP4A1的表达对脑胶质瘤细胞增殖及凋亡的影响及机制。以期为脑胶质瘤的诊断及治疗提供理论基础。
1 材料与方法
1.1 组织和细胞:脑胶质瘤组织及相应的瘤旁组织(距肿瘤1cm以上)石蜡切片取自西安交通大学第二附属医院2015年2至2016年6月存档蜡块,共40例,其中男性24例,女性16例,年龄5~71岁,平均年龄43.2岁,患者术前均未行放化疗及其他免疫性治疗。所有样品采集均经过患者以及家属的知情同意。人脑胶质瘤U251细胞购自中国医学科学院。
1.2 主要试剂和仪器:胰酶、胎牛血清、RPMI1640培养基、青链霉素均购自美国Gibco公司;siRNA-NC组、PTP4A1-siRNA购自上海生工生物工程有限公司;BCA试剂盒、CCK8试剂盒、Annexin V-FITC凋亡试剂盒均购自碧云天生物技术研究所;PTP4A1、Cleaved caspase3、Ki-67、PCNA、β-catenin、Cyclin D1、C-myc单克隆抗体及辣根过氧化物标记的二抗均购自美国abcam公司;CO2细胞培养箱购自德国Heraeus公司;酶标仪购自TECAN公司;PAGE凝胶电泳仪、电泳凝胶图像分析系统均购自美国Bio-Rad公司;流式细胞仪购自美国Becton Dickinson公司。
1.3 PTP4A1基因在脑胶质瘤组织的表达:组织蛋白提取试剂盒提取脑胶质瘤组织及相应的瘤旁组织中的总蛋白,利用二喹啉甲酸(bicinchoninic acid,BCA)试剂盒检测蛋白的质量。配置12%分离胶10 mL和5%浓缩胶5mL,按照1:1比例充分混匀蛋白样品与上样缓冲液,置于100℃孵育器中变性5min,取变性蛋白进行聚丙烯酰氨凝胶电泳(SDS-PAGE)分离,浓缩胶使用120V电压,分离胶使用160V电压。电泳结束后4℃转PVDF膜1.5h,50g/L的脱脂奶粉室温封闭1h,以PTP4A1和GAPDH单克隆抗体作为一抗(1:500稀释),4℃孵育过夜,TBST清洗后加入二抗(辣根过氧化物酶标记的羊抗鼠IgG,1:1000稀释),37℃孵育1h,ECL发光剂显影,自动凝胶成像系统采集图像。以GAPDH作为内参,分析蛋白表达水平。
1.4 细胞培养:取出保存在液氮罐中的U251细胞,置于37℃的水浴锅中解冻后在含有10%FBS、100μg/mL链霉素和100U/mL青霉素的RPMI1640细胞培养基中,置于37℃,5% CO2,95%饱和湿度的培养箱中培养。细胞生长密度达到80~90%时,用胰蛋白酶消化后根据实验要求进行传代。细胞进入对数生长期后再用于实验研究。
1.5 细胞转染及转染效果检测:取生长至对数期的U251细胞,调整细胞浓度为1×105个/mL,接种于6孔细胞培养板中,每孔加入2mL,细胞生长密度达到50%时进行转染,转染分为3组,即siRNA-NC(非特异性siRNA干预)、PTP4A1-siRNA(PTP4A1-siRNA干预)转染到细胞内,未转染任何siRNA作为空白对照组。转染参照Invitrogen 公司的脂质体LipofectamineTM2000转染说明进行操作。各组细胞转染48h后收集细胞,按照1.3方法检测各组中PTP4A1的蛋白表达。
1.6 细胞增殖及增殖相关蛋白表达检测:采用CCK8法检测细胞增殖。取生长至对数期的U251细胞,以5×104个/mL浓度每孔加200μL接种至96孔细胞培养板中,每组设置5个重复孔,置于37℃,5% CO2培养箱中培养,细胞生长密度达到皿底50%以上时,转染siRNA,转染48h后,向每孔细胞中加入CCK-8试剂10μL,37℃孵育4h,酶标仪在490nm波长处读取吸光度A。计算细胞增殖率。细胞增殖率=(转染组细胞A/对照组细胞A)×100%。增殖相关蛋白Ki-67、PCNA的蛋白表达根据1.3方法。
1.7 细胞凋亡及凋亡相关蛋白表达检测:采用Annexin V/PI双染法检测细胞凋亡。取转染48h的各组细胞,调整细胞浓度为(0.5~1.0)×106个/mL,预冷的PBS洗涤细胞3次,加入500μL结合缓冲液悬浮细胞,取悬浮细胞再加入5μL的Annexin-V和PI各,室温下避光反应15min,再加400μL结合缓冲液,流式细胞仪检测细胞凋亡率。各组中Cleaved caspase3蛋白参照1.3方法。
1.8 Wnt/β-catenin信号通路相关蛋白表达检测:收集转染48h的各组细胞,提取细胞中的蛋白,按照1.3方法检测β-catenin、Cyclin D1、C-myc的蛋白表达。

2 结 果
2.1 脑胶质瘤组织中PTP4A1的表达:组织蛋白提取试剂盒提取脑胶质瘤及瘤旁组织中的总蛋白,Western blot检测PTP4A1的蛋白表达,结果显示,脑胶质瘤组织中PTP4A1(0.422±0.037)的蛋白表达显著高于瘤旁组织(0.093±0.010)(P<0.01)。见图1。
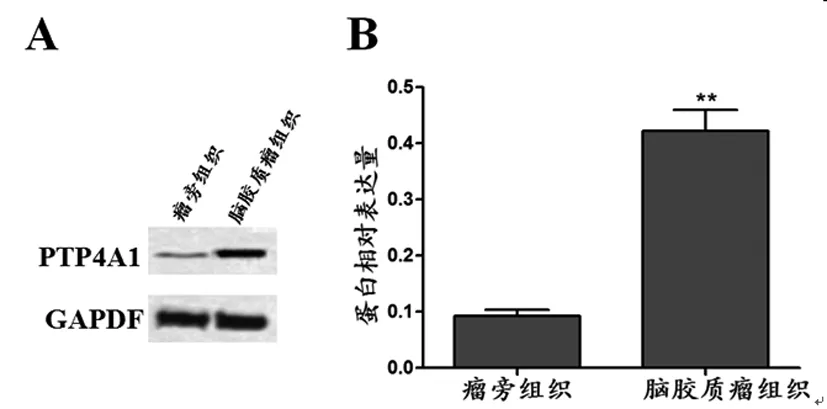
图1 脑胶质瘤组织中PTP4A1的表达
注:A:Western blot检测结果图;B:PTP4A1的蛋白相对表达量;与瘤旁组织比较,**P<0.01
2.2 转染后细胞中PTP4A1的蛋白表达:收集转染48h的各组siRNA,Western blot检测各组细胞中PTP4A1的蛋白表达,结果显示,siRNA-NC组(0.240±0.023) PTP4A1的蛋白表达与对照组(0.234±0.028)差异无统计学意义(P>0.05),PTP4A1-siRNA组(0.060±0.015)的PTP4A1的蛋白表达显著低于对照组(P<0.01)。见图2。

图2 PTP4A1在转染后细胞中的蛋白表达
注:A:Western blot检测结果图;B:PTP4A1的蛋白相对表达量;与Control组比较,**P<0.01
2.3 抑制PTP4A1的表达降低U251细胞增殖:CCK8实验检测各组siRNA转染48h后的细胞增殖情况,结果显示,与对照组(92.83±6.81)%及siRNA-NC组(93.42±5.97)%比较,PTP4A1-siRNA组(59.65±8.69)%的细胞存活率显著降低(P<0.01)。进一步检测与增殖相关蛋白ki67及PCNA的表达,结果显示,与对照组(0.455±0.042)(0.153±0.025)及siRNA-NC组(0.449±0.039)(0.147±0.021)比较,PTP4A1-siRNA组ki67(0.130±0.018)及PCNA(0.071±0.014)的蛋白表达均显著下调(P<0.01)。见图3。

图3 抑制PTP4A1的表达对U251细胞增殖的影响
注:A:细胞存活率;B:Western blot检测结果图;B:PTP4A1的蛋白相对表达量;与Control组比较,**P<0.01
2.4 抑制PTP4A1的表达诱导U251细胞凋亡:流式细胞仪检测各组siRNA转染48h后的细胞凋亡情况,结果显示,与对照组(2.47±0.86)%及siRNA-NC组(2.42±0.92)%比较,PTP4A1-siRNA组(15.53±1.64)%的细胞凋亡率显著升高(P<0.01)。进一步检测凋亡相关蛋白Cleaved caspase3的蛋白表达,结果显示,与对照组(0.046±0.011)及siRNA-NC组(0.039±0.009)比较,PTP4A1-siRNA组(0.205±0.019)Cleaved caspase3的蛋白表达显著上调(P<0.01)。见图4。

图4 抑制PTP4A1的表达对U251细胞凋亡的影响
注:A:流式细胞仪检测结果图;B:细胞凋亡率;C:Western blot检测结果图;D:蛋白相对表达量;与Control组比较,**P<0.01
2.5 Western blot检测β-catenin、Cyclin D1、C-myc的蛋白表达:各组siRNA转染48h后,Western blot检测Wnt/β-catenin信号通路相关蛋白β-catenin、Cyclin D1、C-myc的蛋白表达,结果显示,与对照组(0.589±0.042)、(0.305±0.036)、(0.154±0.023)及siRNA-NC组(0.607±0.046)、(0.310±0.031)、(0.150±0.021)比较,PTP4A1-siRNA组β-catenin(0.243±0.032)、Cyclin D1(0.107±0.025)、C-myc(0.094±0.017)的蛋白表达均显著下调(P<0.01)。见图5。

图5 Western blot检测β-catenin、Cyclin D1、C-myc的蛋白表达
注:A:Western blot检测结果图;B:蛋白相对表达量;与Control组比较,**P<0.01
3 讨 论
肿瘤的发生是一个多基因、多阶段、多因素的过程,包括抑癌基因、癌基因、DNA损伤修复基因的遗传变异及突变,研究引起肿瘤发病的原因及机制对于治疗具有重要的意义。促肝细胞再生磷酸酶因子家族包括PRL-1(PTP4A1)、PRL-2(PTP4A2)、PRL-3(PTP4A3)三个成员,分别定位于6q12、1p35、8q24.3染色体上,在肿瘤的发生及转移中起到重要作用。其异常表达可促进细胞生长、裸鼠的移植瘤生长及细胞的变异等,目前已在多种肿瘤中检测到PRLs的高表达[8]。PRL-1是PRLs家族中第一个被发现的成员,研究显示,食管癌中PTP4A1的表达与淋巴转移及肿瘤的分期呈现正相关[9];转染了PTP4A1的小鼠成纤维细胞系细胞的增殖明显[10];肺癌、胰腺癌细胞中沉默PTP4A1的表达可降低肿瘤的侵袭及迁移能力[11,12]。本研究拟采用RNAi技术进一步研究沉默PTP4A1的表达对脑胶质瘤细胞增殖及凋亡的影响。结果显示,PTP4A1在脑胶质瘤组织中高表达,沉默其表达可抑制脑胶质瘤细胞增殖及诱导凋亡。
细胞凋亡是细胞的一种程序性死亡过程,增殖与凋亡平衡是维持机体正常的生长、发育、生殖所必须,目前已发现Ki67、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)及Caspase3与细胞的增殖及凋亡密切相关。Ki67即细胞核相关抗原,仅分布于细胞核内,是增殖性细胞的标志物,是目前应用最广泛的增殖细胞标志之一,在膀胱癌、乳腺癌等肿瘤中较常见[13,14]。PCNA只存在于正常细胞及增殖细胞内,是细胞异常增殖的关键蛋白,在胃癌、肝癌等多种肿瘤中均有高表达[15,16]。Caspase3是细胞凋亡过程中的关键蛋白,属于Caspase家族,是Caspase级联反应的效应蛋白,其激活可引起胃癌、肺癌等多种肿瘤细胞的凋亡[17,18]。本研究结果显示,沉默PTP4A1的表达可显著上调Cleaved Caspase3蛋白表达,下调Ki67、PCNA蛋白表达。
Wnt信号通路是一条在进化上相对保守的信号途径,参与细胞凋亡、分化、坏死、个体发育等过程。依据通路的激活是否依赖β-catenin的活化分为经典的Wnt信号通路和非经典的Wnt信号通路,Wnt/β-catenin是经典的Wnt信号通路,参与胚胎发育、细胞的增殖及分化等重要过程,其异常激活可导致癌症的发生[19]。研究显示,激活Wnt/β-catenin信号通路可促进脑胶质瘤、肺癌等多种肿瘤的发生及发展,而抑制该通路的激活可降低肿瘤的生长[20,21]。本研究检测沉默PTP4A1的表达对Wnt/β-catenin信号通路相关蛋白表达的影响,结果显示,β-catenin、Cyclin D1、C-myc的蛋白表达均显著下调。
综上所述,PTP4A1在脑胶质瘤的发生及发展过程中起重要作用,沉默PTP4A1的表达可通过抑制Wnt/β-catenin信号通路降低脑胶质瘤细胞的增殖及诱导细胞凋亡。该研究为脑胶质瘤的诊断及治疗提供了理论依据。
[1] Choi C, Raisanen J M, Ganji S K, et al. Prospective longitudinal analysis of 2-hydroxyglutarate magnetic resonance spectroscopy identifies broad clinical utility for the management of patients with IDH-mutant glioma[J].Journal of Clinical Oncology, 2016, 34(33): 4030~4039.
[2] Ceccarelli M, Barthel F P, Malta T M, et al. Molecular profiling reveals biologically discrete subsets and pathways of progression in diffuse glioma[J].Cell, 2016, 164(3): 550~563.
[3] Lu Z, Guo H, Lin Y, et al. Effects of PTEN gene silencing on invasion and EMT in oral squamous carcinoma Tca8113 cells[J].Journal of Oral Pathology & Medicine, 2017, 46(1): 31~38.
[4] Rubio T. Regulatory mechanisms of phosphatase of regenerating liver (PRL)-3[J].Biochemical Society Transactions, 2016, 44(5): 1305~1312.
[5] Huang X, Jiao S F, Zhu F C, et al. Construction of a RNAi lentiviral vector targeting ARK5 gene and its effect on the biological behavior of gastric cancer SGC7901 cells[J].Zhonghua zhong liu za zhi, 2016, 38(2): 93~99.
[6] Yan Y, Liu L, Xiong H, et al. Functional polyesters enable selective siRNA delivery to lung cancer over matched normal cells[J].Proceedings of the National Academy of Sciences, 2016, 113(39): E5702~E5710.
[7] Flores-Pérez A, Marchat L A, Rodríguez-Cuevas S, et al. Suppression of cell migration is promoted by miR-944 through targeting of SIAH1 and PTP4A1 in breast cancer cells[J].BMC Cancer, 2016, 16(1): 379.
[8] Lee J D, Jung H, Min S H. Identification of proteins suppressing the functions of oncogenic phosphatase of regenerating liver 1 and 3[J].Experimental and Therapeutic Medicine, 2016, 12(5): 2974~2982.
[9] Nakayama N, Yamashita K, Tanaka T, et al. Genomic gain of the PRL-3 gene may represent poor prognosis of primary colorectal cancer, and associate with liver metastasis[J].Clinical & Experimental Metastasis, 2016, 33(1): 3~13.
[10] Horiguchi K, Nakakura T, Yoshida S, et al. Identification of THY1 as a novel thyrotrope marker and THY1 antibody-mediated thyrotrope isolation in the rat anterior pituitary gland[J].Biochemical and Biophysical Research Communications, 2016, 480(2): 273~279.
[11] Voena C, Varesio L M, Zhang L, et al. Oncogenic ALK regulates EMT in non-small cell lung carcinoma through repression of the epithelial splicing regulatory protein 1[J].Oncotarget, 2016, 7(22): 33316.
[12] Gungabeesoon J, Tremblay M L, Uetani N. Localizing PRL-2 expression and determining the effects of dietary Mg2+[J].Histochemistry and Cell Biology, 2016, 146(1): 99~111.
[13] Kopsiaftis S, Sullivan K L, Garg I, et al. AMPK 2 Regulates Bladder Cancer Growth through SKP2-Mediated Degradation of p27[J].Molecular Cancer Research, 2016, 14(12): 1182~1194.
[14] Abubakar M, Howat W J, Daley F, et al. High‐throughput automated scoring of Ki67 in breast cancer tissue microarrays from the Breast Cancer Association Consortium[J].The Journal of Pathology: Clinical Research, 2016, 2(3): 138~153.
[15] Nguyen P H, Giraud J, Staedel C, et al. All-trans retinoic acid targets gastric cancer stem cells and inhibits patient-derived gastric carcinoma tumor growth[J].Oncogene, 2016, 35(43): 5619~5628.
[16] Gu L, Hickey R J, Reckamp K L, et al. Structural analysis identifies an orally active PCNA inhibitor that inhibits the growth of small cell lung cancer cells without causing significant toxicity to nonmalignant cells[J].Journal of Thoracic Oncology, 2016, 11(2): S22~S23.
[17] 申建刚, 张定国, 朱惠明. 血管内皮生长因子-A siRNA 对人肝癌 HepG2 细胞凋亡的影响及机制[J].中国老年学杂志, 2016, 36(03): 542~544.
[18] Liu C, Vojnovic D, Kochevar I E, et al. UV-A irradiation activates Nrf2-regulated antioxidant defense and induces p53/caspase3-dependent apoptosis in corneal endothelial cellsUV-A activates Nrf2 and induces p53 in corneal endothelial cells[J].Investigative Ophthalmology & Visual Science, 2016, 57(4): 2319~2327.
[19] Ye S, Zhang D, Cheng F, et al. Wnt/β-catenin and LIF-Stat3 signaling pathways converge on Sp5 to promote mouse embryonic stem cell self-renewal[J].Cell Sci, 2016, 129(2): 269~276.
[20] Yue X, Cao D, Lan F M, et al. MiR-301a is activated by the Wnt/β-catenin pathway and promotes glioma cell invasion by suppressing SEPT7[J].Neuro-oncology, 2016, 18(9): 1288~1296.
[21] Shi J, Jiang X, Yu Z, et al. ZNRF3 contributes to the growth of lung carcinoma via inhibiting Wnt/β-catenin pathway and is regulated by miR-93[J].Tumor Biology, 2016, 37(3):306.
Expression of Hepatocyte Growth Factor-1 in Human Glioma and Effect on Apoptosis of Glioma Cells
QUANJunjie,QUJianqiang,ZHOULe,etal
(TheSecondAffiliatedHospitalofXi'anJiaotongUniversity,ShanxiXi'an710004,China)
Objective:To investigate the expression of hepatocyte growth factor -1 (PTP4A1) in glioma and effect on the apoptosis of glioma cells. Methods: Tissue protein in brain glioma and tumor adjacent tissues were extracted by total protein extraction kit; PTP4A1 protein expression were detected by western blot; siRNA-NC and PTP4A1-siRNA was transfected into the human glioma U251 cells of the logarithmic growth phase, and without any siRNA transfection as the control group, each group of cells transfected for 48h, expression of PTP4A1, Ki67, PCNA, Cleaved, Caspase3, β-catenin, CyclinD1, C-myc protein were detected by Western blot; cell proliferation was detected by CCK8 assay; cell apoptosis was detected by flow cytometry. Results: The expression of PTP4A1 protein in gliomas was significantly higher than that in the tumor adjacent tissues (P<0.01); the expression of PTP4A1 protein in siRNA-NC group and control group had no significant difference (P>0.05), expression of PTP4A1 protein in PTP4A1-siRNA group were significantly lower than the control group (P<0.01); compared with the control group and siRNA-NC group, the cell survival rate and the expression of Ki67, PCNA, β-catenin, CyclinD1, C-myc protein in PTP4A1-siRNA group were significantly decreased, cell apoptosis rate and expression of Cleaved Caspase3 protein was significantly increased (P<0.01). Conclusion: PTP4A1 is higher expression in glioma tissues. And silented PTP4A1 expression can inhibit the proliferation and induce apoptosis of human glioma U251 cells by down regulating the Wnt/β -catenin signaling pathway.
PTP4A1; Glioma; Apoptosis; Wnt/ β-catenin signaling pathway
1006-6233(2017)05-0724-05
陕西省重点科技创新团队计划项目,(编号:2012KCT-18)
A
10.3969/j.issn.1006-6233.2017.05.006

