羊蹄根对免疫性血小板减少性紫癜模型小鼠转化生长因子-β1及其受体的影响
高 飏, 蒋祖军
(广州军区广州总医院血液科, 广东 广州 510010)
羊蹄根对免疫性血小板减少性紫癜模型小鼠转化生长因子-β1及其受体的影响
高 飏, 蒋祖军
(广州军区广州总医院血液科, 广东 广州 510010)
目的:通过建立免疫性血小板减少性紫癜模型(ITP)小鼠,观察羊蹄根提取物对小鼠外周血转化生长因子(TGF-β1)以及受体的影响,对羊蹄根提取物的免疫调节机制进行探讨。方法:将40只BALB/C小鼠随机分为4组,分别是阳性对照组、模型组、羊蹄根提取物组、阴性对照组。除阴性对照组外,其余各组均采用腹腔注射豚鼠抗小鼠血小板血清(APS)的免疫造模方法进行ITP造模。采用实时PCR方法及Western Blot法检测给药前与给药14d后各组小鼠的TGF-β1、受体TGF-βR表达量的变化。结果:与阴性对照组比较,模型组TGF-β1的表达量明显升高(P<0.05);TGF-β1mRNA以及TGF-β1蛋白表达量明显降低(P<0.05)。与模型组比较,羊蹄根提取物组TGF-β1的表达量明显偏低(P<0.05);TGF-β1mRNA以及TGF-β1蛋白表达量明显偏高(P<0.05)。结论:羊蹄根提取物对ITP造模小鼠免疫功能具有调节作用,具体通过影响TGF-β1以及受体实现。
羊蹄根提取物; 血小板减少性紫癜; 模型小鼠; 转化生长因子-β1; 受 体
免疫性血小板减少性紫癜是自身免疫性疾病,主要是一种由于抗血小板抗体介导的网状内皮系统破坏引发的出血现象,与机体自身免疫系统失调引起血小板数目减少有关[1]。ITP的发病机制尚未阐明,但目前普遍认为与某些影响免疫活性细胞因子的作用有关[2]。转化生长因子β1是一种影响细胞分化、生长、凋亡以及免疫的多功能蛋白,可以通过结合于细胞表面或该蛋白的受体发挥其作用,据报道,TGF-β1及其受体的表达量会影响ITP的发病[3,4]。据报道,羊蹄根提取物具有治疗小鼠血小板减少症的作用[5]。本研究采用RT-PCR检测给药前与给药14d后各组小鼠的TGF-β1、受体TGF-βR表达量的变化,Western Blot检测TGF-β1受体蛋白表达,探讨羊蹄根提取物对ITP小鼠的免疫调节作用。
1 材料与方法
1.1 实验动物:SPF级BALB/C小鼠40只,体重范围18~22g,雌雄各半。普通级豚鼠4只,体重范围300~350g,由山东大学实验动物中心提供,合格证号SCXK-(鲁)20140011。
1.2 主要试剂:完全福氏佐剂和不完全福氏佐剂(美国Sigma公司产品);羊蹄根提取物采自于吉林市郊区,经粉碎采用乙醚,提取后使用浓度为0.5g生药/kg;醋酸泼尼松片(天津太平洋制药有限公司)。
1.3 豚鼠抗血小板抗血清的制备[6]:采用乙醚麻醉BALB/C小鼠后用EDTA-Na 2进行抗凝,于小鼠心脏取血并分离血小板、洗涤,用生理盐水进行稀释,并与等量完全福氏佐剂混合,注射于豚鼠皮下、足掌及背。采用不完全福氏佐剂于1、2、4周重复上述操作,第5周开始进行豚鼠心脏采血,分离抗血小板抗血清(APS)。
1.4 造模[7]:采用注射APS方法建立小鼠ITP模型,于本个月内隔天腹腔注射1:4稀释的APS,剂量为100μL/20g。
1.5 试验分组方法:40只BALB/C小鼠随机分为4组,每组10只,分别阳性对照组、模型组、羊蹄根提取物组、阴性对照组。除阴性对照组外,其余均进行ITP造模。其中阴性对照组与模型组小鼠灌胃给予等量0.9%氯化钠溶液;阳性对照组小鼠灌胃给予醋酸泼尼松,剂量为5mg/kg;羊蹄根提取物组小鼠灌胃给予羊蹄根提取物提取物,剂量为0.5g(生药)/kg。
1.6 TGF-β1及TGF-β受体(TGF-βR)mRNA表达的RT-PCR法检测:细胞中TGF-β1及其受体提取方法依照TRIzol说明书进行,采用紫外分光光度仪进行纯度与浓度的检测,A 260 nm /A 280 nm> 1.8。PCR 引物由上海生物工程有限公司合成(见表 1)。cDNA 的合成方法参照M-MLV 逆转录酶的说明书。PCR 反应体系 20 μL。
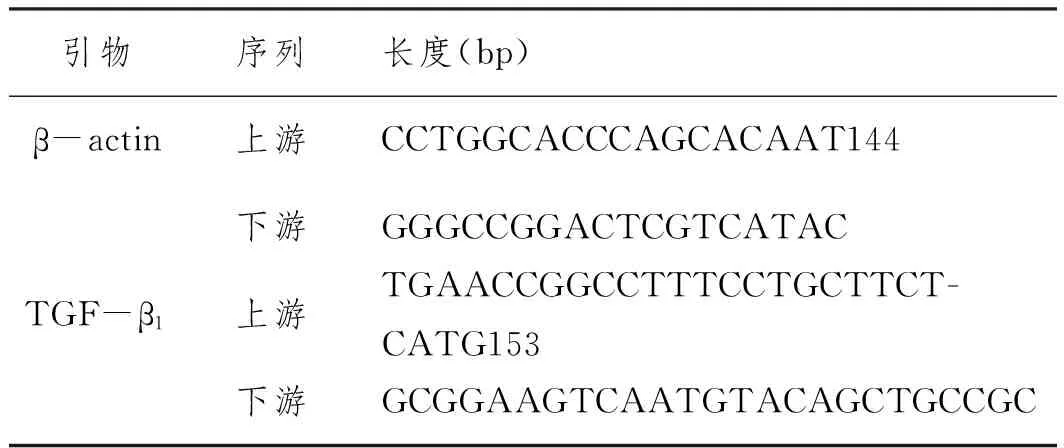
表1 PCR 检测TGF-β1及其受体的引物
1.7 Western Blot检测TGF-β1受体蛋白表达:提取脾组织蛋白后使用酚试剂测定蛋白浓度。将制备的4%浓缩胶以及10%分离胶、marker和待测样品各50μL上样。于硝酸纤维素膜上转印,且先后与一抗和二抗孵育、显色剂显色后用FlourChem V 2.0凝胶成像软件分析结果,分析条带吸光度相对值进行比较。
1.8 统计学方法:采用SPSS 19.0统计分析软件对数据进行处理分析,其中计量数据用均值±标准差表示,比较可采用两独立样本t检验,组间比较采用Q检验,血小板计数采用重复方差检验。认为P<0.05时,具有统计学意义。
2 结 果
2.1 ITP模型的评价:根据上述方法进行小鼠造模,由图1可见,造膜前后模型组小鼠血小板数目持续减低,与造模前相比具有统计学差异(F=7.462, P<0.01),说明造模成功,可用于后续研究,见表1。
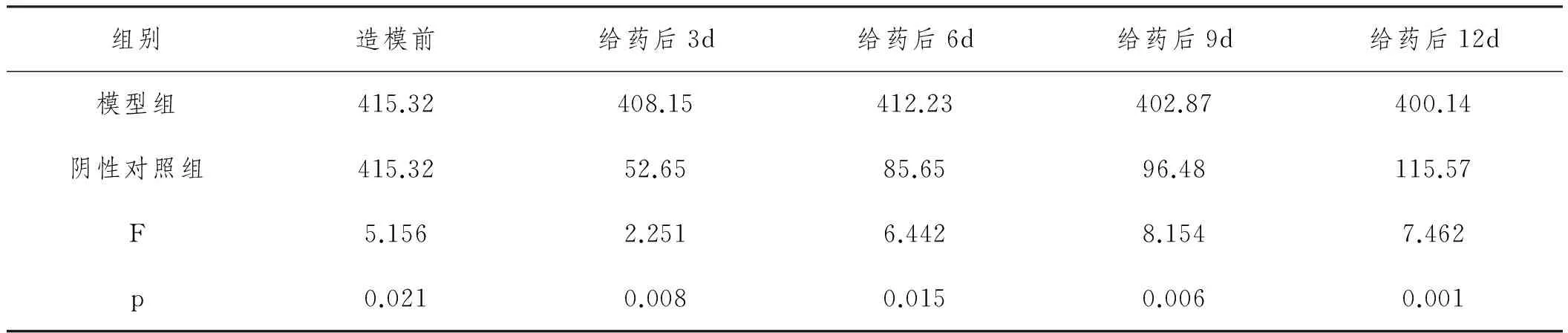
表2 造膜前后模型组小鼠血小板数目对比

表3 不同组别间ITP模型小鼠转化生长因子-β1(TGF-β1)及其受体含量变化
注:与阴性对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01
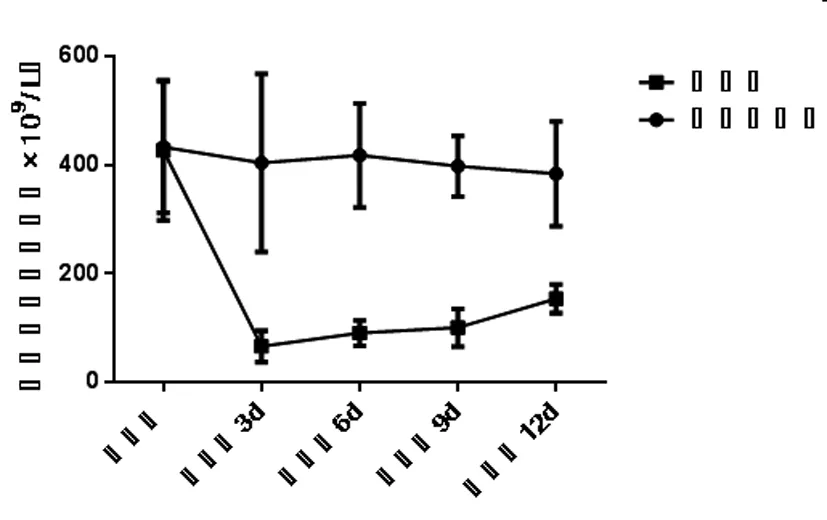
图1 ITP模型小鼠外周血血小板数量的变化
2.2 羊蹄根提取物对ITP模型小鼠转化生长因子-β1(TGF-β1)及其受体含量变化的影响:经研究发现,模型组小鼠的TGF-β1水平高于阴性对照组,且具有统计学差异(P<0.05)。采用阳性对照药及羊蹄根提取物给药治疗后,阳性对照组及羊蹄根提取物组小鼠血清TGF-β1水平较模型组相比明显降低,且具有统计学差异(P<0.05)。且羊蹄根提取物组降低TGF-β1作用较阳性对照组明显(P<0.01),说明羊蹄根提取物对ITP模型小鼠TGF-β1水平作用明显,可以有效促进血小板的生成。具体结果见表2。Western Blot检测TGF-β1受体蛋白表达图见图2。

图2 不同组TGF-β受体的表达电泳图
3 讨 论
免疫性血小板减少性紫癜是一种无明显外因导致血小板数目减少以及皮肤黏膜出血的获得性免疫疾病。数年来人们对该病发病机制不断进行研究,结果发现ITP病因可能是T细胞亚群功能改变、T细胞的异常激活、血小板膜糖蛋白的结构的改变以及的巨核细胞及血小板成熟障碍等,但具体发病机制尚未阐明。
近年来,随着人们对转化生长因子β1的不断研究与认识,认为该因子及其受体体内表达量的差异会对ITP的发病有所影响[8,9]。主要表现为对巨核细胞及血小板在增殖、分化以及成熟阶段的负性作用影响[10]。本研究中也同样得到证实,ITP模型组小鼠体内TGF-β1的表达量明显高于阴性对照组小鼠,TGF-β1mRNA以及TGF-β1蛋白的表达量明显低于阴性对照组小鼠,且均具有统计学意义,说明TGF-β1及其受体的表达量的变化为一种ITP的发病机制。模型小鼠的TGF-β1及其受体的表达量会受到病情变化影响。
研究表明[11]羊蹄跟中含有的大黄酚能够对家兔以及小鼠的血凝时间具有缩短作用,且可以增强促进骨髓制造血小板,提高体内血小板含量。同时羊蹄根提取物因其清热解毒的作用,可以有效缓解激素引起的不良反应,降低毒副作用,提高疗效。本研究针对羊蹄根提取物的抗凝特性,通过在ITP小鼠模型上采用羊蹄根提取物干预治疗,从转化生长因子-β1变化机制方面对羊蹄根提取物治疗ITP小鼠的疗效进行探讨。据文献报道,泼尼松对TGF-β1及其受体有明确作用,因此研究中采用该药作为阳性对照药[12]。结果表明,羊蹄根提取物通过影响转化生长因子-β1及其受体的表达量,对ITP小鼠免疫功能具有一定恢复作用,且与阳性药醋酸泼尼松相比效果更为明显,因此可以作为ITP治疗的新型手段。
[1] Cooper N,Bussel J.The pathogenesis of immune thrombocytopaenic purpura[J].Br Haematol,2006,133(4):364~374
[2] Shan NN,Ji XB,Wang X,et al.In vitro recovery of Th1/Th2 balance in PBMCs from patients with immune thrombocytopenia through the actions of IL-18BPa/Fc[J].Thromb Res,2011,128(6):119~24.
[3] Wang J D,Chang T K,Lin H K,et al.Reduced expression of transforming growth factor-β1and correlated elevation of interleukin-17 and interferon-γ in pediatric patients with chronic primary immune thrombocytopenia(ITP)[J].Pediatr Blood Cancer,2011,57(4):636~640.
[4] Zver S,Zupan IP,Cernelc P.Cyclosporin A as an immunosuppressive treatment motality for patients with refractory autoimmune thrombocytopenic purpura after splenectomy failure[J].Int Hematol,2006;83(3):238-242.
[5] 马健康,姜艳霞,马洪波,等.羊蹄根提取物提取物对血小板减少症模型小鼠造血系统的作用[J].吉林大学学报,2009,35(1):82~86.
[6] 杨宇飞,周霭祥,麻柔.免疫性血小板减少性紫癜动物模型的建立[J].中华血液学杂志,1994,15(3):160~161.
[7] 中华医学会血液学分会血栓与止血学组.成人原发免疫性血小板减少症诊治的中国专家共识(修订版)[J].中华血液学杂志,2011,32(3.):214~216.
[8] Sun T,Zhang D,Yang Y,et al.Interleukin 35 may contribute to the loss of immunological self-tolerance in patients with primary immune thrombocytopenia[J].Br Haematol,2015,169(2):278~285.
[9] Xiao J,Zhang C,Zhang X,et al.Transplantation of adipose-derived mesenchymal stem cells into a murine model of passive chronic immune thrombocytopenia[J].Transfusion,2012,52(12):2551~2558.
[10] Lu L,Wang LS,Cooper RJ,et al.Suppressive effects of TNF-alpha,TGF-beta 1,and chemokines on megakaryocytic colony formation in CD+34 cells derived from umbilical cord blood compared with mobilized peripheral blood and bone marrow[J].Hematother Stem Cell Res,2000,9(2):195.
[11] 马金华,王晖.羊蹄根提取物汤与西药合用治疗原发性血小板减少性紫癜28例[J].中国药师,2003,6(5):292~293
[12] Hartel JV,Granchelli JA,Hudecki MS,et al.Impact of prednisone on TGF-beta1 and collagen in diaphragm muscle from mdx mice[J].Muscle Nerve,2001,24(3):428~432.
Effects of Rumex Japonicus Houttextract on Transforming Growth Factor-β1and Receptors in Thrombocytopenic Purpura Mice
GAOYang,JIANGZujun
(TheGenenralHospitalofPLAinGuangzhouMilitaryArea,GuangdongGuangzhou, 510010China)
Objective:To observe the effects of Rumex japonicus Houtt extract on transforming growth factor-β1and its receptors in thrombocytopenic purpura mice model. Methods: 40 BALB/C mice were randomly divided into positive control group, model group, rumex japonicus houtt extract group and negative control group. All ITP mouse model were made by injected guinea pig-antimouse platelet serum (GP-APS) except negative control group. The expressions of TGF-β1and their receptors TGF-βR in the peripheral blood of mice were detected by the real-time PCR and Western Blot, and differences of their expression levels were analyzed. Results: The expression of TGF-β1in ITP model group was significantly higher than that in the negative control group (P<0.05), while the TGF-β mRNA and TGF-β protein expression in ITP model group were significantly lower than that in the negative control group (P<0.05). The expression of TGF-β1in rumex japonicus houtt extract group was significantly lower than that in the ITP model group (P<0.05), while the TGF-β mRNA and TGF-β protein expression in rumex japonicus houtt extract group were significantly higher than that in the ITP model group (P<0.05). Conclusion: Rumex japonicus houtt extract can regulate the immune function of ITP by in fluencing the expression of transforming growth factor-β1and its receptors.
Rumex japonicus houtt extract; Immune thrombocytopenic purpura; Model mouse; Transforming growth factor-β1; Receptors
1006-6233(2017)05-0741-04
广东省科技计划项目,(编号:2013B0313441)
蒋祖军
A
10.3969/j.issn.1006-6233.2017.05.011

