PdSn/Fe3O4-C催化剂的制备及其对乙醇氧化的电催化性能
邹 涛, 易清风*, 张媛媛, 向柏霖, 周秀林
(1. 湖南科技大学 化学化工学院,湖南 湘潭 411201; 2. 怀化学院 化学与材料工程学院,湖南 怀化 418000)
·研究论文·
PdSn/Fe3O4-C催化剂的制备及其对乙醇氧化的电催化性能
邹 涛1, 易清风1*, 张媛媛1, 向柏霖2, 周秀林1
(1. 湖南科技大学 化学化工学院,湖南 湘潭 411201; 2. 怀化学院 化学与材料工程学院,湖南 怀化 418000)
采用包覆法制得不同Fe3O4含量的载体Fe3O4-C(1),以PdCl2和SnCl2·2H2O为金属前驱体, 采用化学还原法制得催化剂(PdSn/1),其结构和性能经TEM, XRD和EDS表征。采用循环伏安法(CV)、计时电流法(CA)和交流阻抗(EIS)技术研究了PdSn/1在碱性条件下对乙醇氧化的电催化性能。结果表明:PdSn/1(5%)表现出较高的电催化活性,乙醇氧化的峰电流密度达到147 mA·cm-2;相比于Pd/C, PdSn/1(5%)对乙醇氧化反应的电荷转移阻力也有大幅度下降。
钯催化剂; 乙醇氧化; 钯锡; 燃料电池; 制备; 电催化性能
直接醇类燃料电池(DAFC)是一种以甲醇、乙醇和丙醇等有机小分子为燃料,以氧气为氧化剂,以Pt或Pt基金属为催化剂,将燃料中的化学能直接转为电能的装置,具有结构简单、能量密度高、燃料环境友好、便于携带和储存等优点[1-4]。然而, Pt作为一种贵金属,价格昂贵,资源匮乏,同时醇氧化过程所产生的中间产物CO对Pt基催化剂有毒化作用[5-8]。虽然Pt-Ru等催化剂对催化剂毒化效应有一定的抑制作用,但高昂的成本仍限制了Pt基催化剂的应用[9-10]。
研究表明,在碱性条件下Pd及Pd基催化剂对醇氧化具有较强的电催化活性,而且成本远低于Pt,且Pd储量远大于Pt[11-15]。Pd与其他金属或材料形成的合金或复合物对Pd基催化剂电催化性能有大幅度的提升[16-18]。Pd基催化剂中Sn的加入对电催化效果有明显提高,这是由于Sn进入Pd的晶格形成Pd-Sn合金,产生晶格应变,使Pd的晶格参数增大,进而诱发产生电子效应,这种电子效应会增强Pd催化剂的催化性能[19]。纳米金属氧化物也能促进Pd基催化剂对醇氧化的电催化活性,如CeO2、 Co3O4、 Mn3O4和NiO[21]。 Fe3O4具有特殊的催化性能且绿色安全,应用非常广泛,但容易发生聚集和沉降,且自身容易被氧化,因此,需要对磁性材料进行改性。最直接的方法就是对磁性纳米粒子进行包覆,形成磁性纳米复合材料,以降低纳米粒子的表面能和提高其抗氧化能力。将贵金属纳米粒子负载在磁性复合材料上,制得纳米尺度的磁性催化剂既可以保持高的催化活性,防止了纳米粒子出现团聚,同时还可以利用外加磁场方便回收催化剂[20]。
Huang等[22]制备了一种核壳结构的Fe3O4-聚多巴胺-石墨烯-Pt的催化剂,相比于Pt/石墨烯,该催化剂对醇的氧化有较低的开路电压、较高的电化学催化活性和显著的稳定性。洪春艳等[23]用Fe3O4作为载体,用NaBH4化学还原法合成Au和Pt颗粒,制备了Au/Pt/Fe3O4催化剂,相比于Au/Pt/C催化剂, Au/Pt/Fe3O4催化剂对醇氧化的电化学活性有显著的提高。此外,在微生物电池的阴极活性炭中添加Fe3O4,也有利于提高氧化还原反应的电荷转移速度[24]。
本文采用包覆法制备了不同Fe3O4含量的载体Fe3O4-C(1),以PdCl2和SnCl2·2H2O为金属前驱体, 采用化学还原法制备催化剂(PdSn/1),其结构和性能经TEM, XRD和EDS表征。采用循环伏安法(CV)、计时电流法(CA)和交流阻抗(EIS)技术研究了PdSn/1在碱性条件下对乙醇氧化的电催化性能。
1 实验部分
1.1 仪器与试剂
JEM-2100F型透射电镜; AutolabPGSTA30型电化学分析仪[工作电极为涂覆催化剂的玻碳电极,参比电极为银/氯化银(Ag/AgCl,饱和KCl)电极,扫描速率50 mV·S-1]; Ultima Ⅳ型X-射线粉末衍射仪。
1按文献[25]方法制备;碳粉(Vulan XC-72), 5%Nafion溶液(杜邦D520), 四氧化三铁(≥99.5, 20 nm球形),水为自制二次蒸馏水;其余所用试剂均为分析纯。
1.2 制备
(1) PdSn/1催化剂的制备[以1(含量5%,下同)为例]
在乙二醇溶剂中加入1 10 mg, PdCl28.9 mg和SnCl2·2H2O 4.9 mg,超声分散30 min,形成均匀的分散液;搅拌下滴入含NaBH41.0 mg的乙二醇溶液(20 mL),滴毕,反应4 h。抽滤,滤饼用二次蒸馏水洗至中性,于40 ℃真空干燥10 h得PdSn/1(5%)催化剂。
用类似的方法制得PdSn/1(2%)和PdSn/1(10%)催化剂。作为对比,分别制备了以碳粉为载体的PdSn/C和Pd/C催化剂。
1.3 电化学测试
玻碳(GC,Φ3 mm)电极首先按通常方法进行预处理,即先用0.5m的Al2O3抛光粉进行抛光,再用蒸馏水洗净电极表面,最后将GC电极置于乙醇和蒸馏水中超声清洗3 min,自然烘干。将5 mg待测催化剂样品加入至乙醇(0.94 mL)和5%Nafion(0.06 mL)的混合溶液中,超声分散1 h形成均匀悬浊液,随后用移液枪移取15L上述悬浊液加入到预处理过GC电极上,室温晾干即得到工作电极。
2 结果与讨论
2.1 表征
(1) TEM
图1为两个典型的催化剂Pd/C和PdSn/1(5%)的TEM图。由图1可见,灰色的大颗粒物质为碳粉,粒径30~50 nm。图1(a)中黑色小颗粒为纳米金属Pd,部分均匀分布在碳粉上,其粒径在4.9 nm左右,但仍然有小部分团聚;图1(b)中较大的黑色颗粒为Fe3O4,粒径约为21 nm,分布在载体上的黑色小点为Pd-Sn纳米颗粒,平均粒径为5.8 nm,颗粒之间没有明显团聚现象出现。


图 1 Pd/C(a)和PdSn/1(5%)(b)的TEM图Figure 1 TEM images of Pd/C(a)and PdSn/1(5%)(b)
(2) XRD
图2为PdSn/1(5%), PdSn/C和Pd/C催化剂的XRD图。从图2(c)可以看出, Pd/C出现明显的Pd特征衍射峰,在2θ为39.5°、 46.3°和67.0°时分别对应Pd面心立方晶系的(111)、 (200)和(220)晶面的衍射峰,表明该催化剂的Pd粒子是以面心立方结构形式存在的。在PdSn/1(5%)和PdSn/C(b)的XRD图中,除了出现Pd的衍射峰之外,在2θ为33.5°和54.4°处还分别观察到Sn(101)和Sn(201)的特征峰,表明催化剂中有Sn存在。在PdSn/1(5%)中没有观察到Fe3O4的特征衍射峰,可能与其含量小有关。
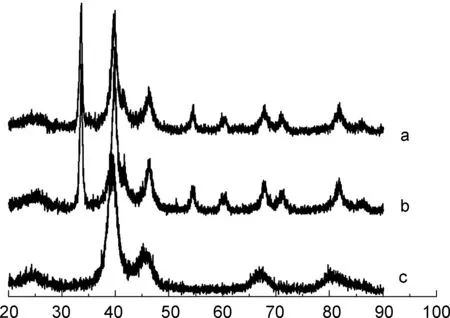
2θ/(°)图 2 PdSn/1(5%)(a), PdSn/C(b)和Pd/C(c)的XRD图Figure 2 XRD patterns of PdSn/1(5%)(a), PdSn/C(b) and Pd/C(c)
(3) EDS
图3为PdSn/1(2%)(a), PdSn/1(5%)(b), PdSn/1 (10%)(c)和Pd/C(d)的EDS图。2.8 keV处为Pd的能量峰,通过EDS分析发现双金属催化剂中Pd含量在15%~20%, Pd/C的Pd含量为31.8%,结果与催化剂制备的化学配比基本一致。Sn的能量峰与Pd接近,在3.0 keV附近与Pd的能量峰重合。通过EDS分析发现Pd与Sn的原子比接近5/1。 6.4 keV处是Fe的能量峰,但PdSn/1(2%)中Fe含量未检测到,可能是由于铁的含量较低所致。随着催化剂中Fe3O4含量的增加, Fe的特征峰也逐渐增强。
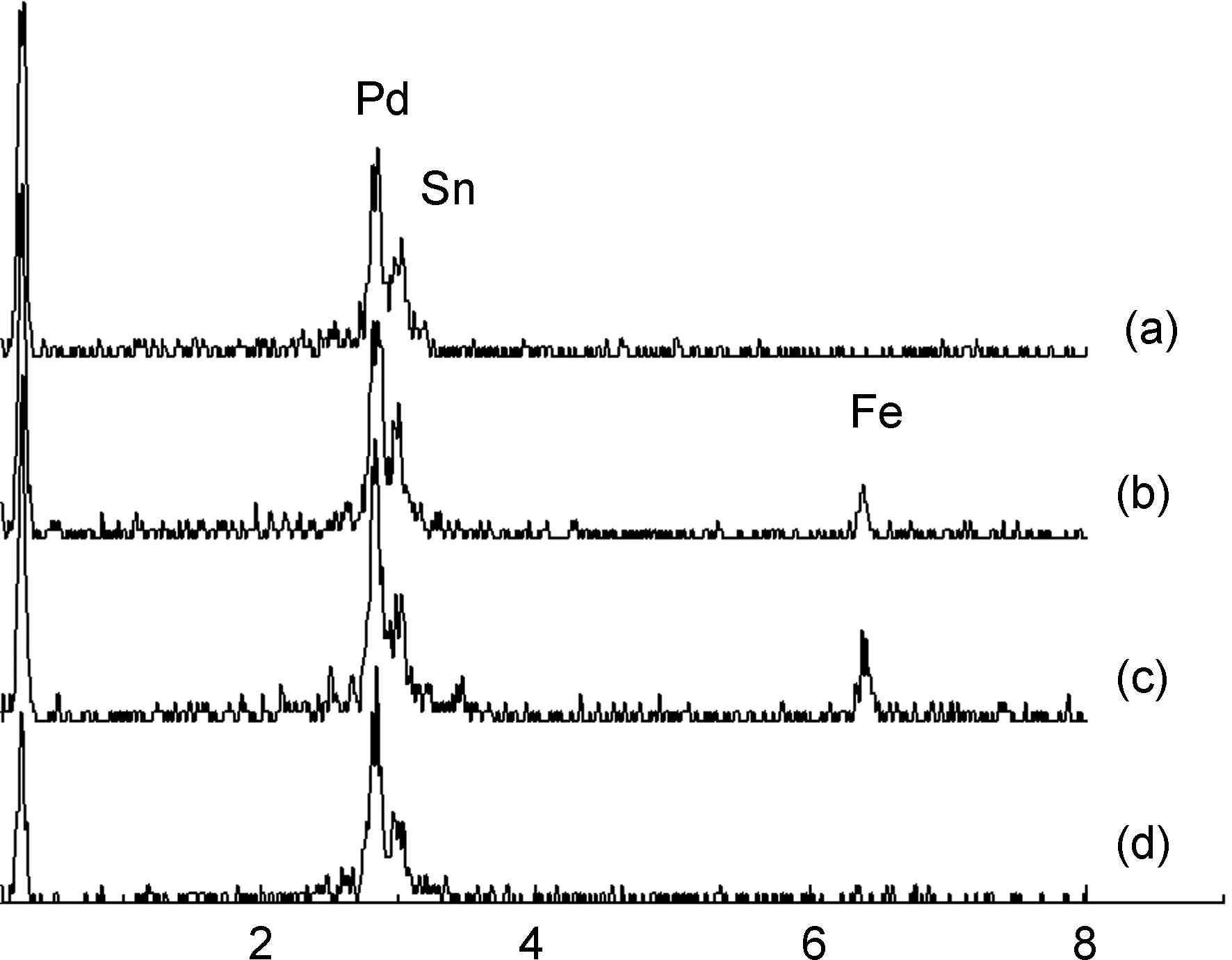
Energy/keV图 3 PdSn/1(2%)(a), PdSn/1(5%)(b), PdSn/1(10%)(c)和Pd/C(d)的EDS图Figure 3 EDS patterns of PdSn/1(2%)(a), PdSn/1(5%)(b), PdSn/1(10%)(c) and Pd/C(d)
2.2 电化学性能
图4为催化剂在1 mol·L-1NaOH溶液中的CV曲线。所有催化剂在-0.32 V附近出现了Pd的特征还原峰,这是Pd在正向扫描过程中形成的氧化物,在反向扫描的过程中发生还原反应所致,该还原峰的大小也反映了Pd颗粒的分散情况。由图4可以看出,在PdSn/1(2%), PdSn/1(5%), PdSn/1(10%)和Pd/C催化剂上,该还原峰的峰电流密度分别为28.1, 39.9, 18.3, 23.9 mA·cm-2。根据平滑的多晶钯电极在相同条件下形成该还原峰所需要的电量,可以计算出在PdSn/1(2%), PdSn/1(5%), PdSn/1(10%)和Pd/C催化剂中, Pd颗粒的活性表面积分别为2.8, 4.2, 1.9, 2.4 cm-2。远远大于电极的几何面积(0.071 cm-2)。结果表明:PdSn/1(5%)催化剂的Pd活性表面积最大,具有较好的电催化活性,说明在碳粉中加入适量的Fe3O4能促进Pd纳米粒子的分散。

E/V图 4 催化剂在1.0 mol·L-1NaOH溶液中的CV曲线Figure 4 CV curves of the catalysts in 1.0 mol·L-1NaOH solution
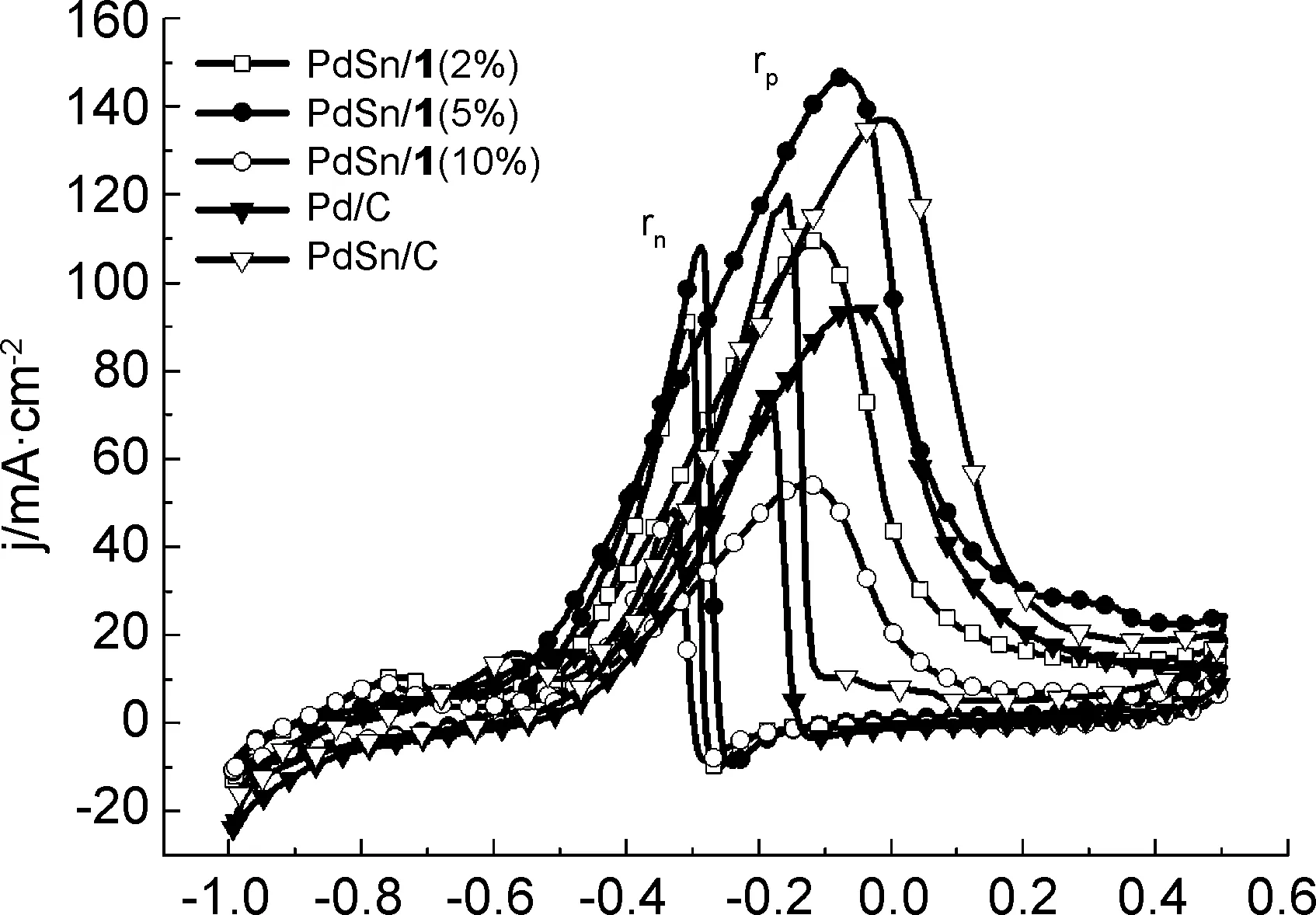
E/V图 5 催化剂在1.0 mol·L-1NaOH+0.5 mol·L-1EtOH溶液中的循环伏安曲线Figure 5 CV curves of the catalysts in 1.0 mol·L-1NaOH+0.5 mol·L-1 EtOH solution
图5是催化剂在1.0 mol·L-1NaOH+0.5 mol·L-1EtOH溶液中的CV曲线。由图5可见, 所有催化剂的CV曲线形状相似,即在正向扫描过程中,出现了明显的氧化峰(rp),在逆向扫描过程中,也出现了明显的氧化峰(rn)。与Pd/C催化剂相比, PdSn/1(2%), PdSn/1(5%)和PdSn/C峰rp电流密度明显大于Pd/C,而PdSn/1(10%)的峰rp电流密度小于Pd/C。在PdSn/1(5%)催化剂上的氧化峰rp电流密度为Pd/C的1.6倍。在PdSn/1(2%), PdSn/1(5%), PdSn/1(10%), Pd/C和PdSn/C催化剂上,乙醇氧化的起始电位分别为0.556 V, 0.593 V, 0.506 V, 0.505 V和0.503 V,进一步表明PdSn/1(5%)催化剂对乙醇氧化具有优异的电催化活性。一般认为,逆向扫描过程中出现的氧化峰rn是回扫过程中,钯电极表面重新活化,乙醇继续在其表面氧化所产生的。
图6为在1.0 mol·L-1NaOH+0.5 mol·L-1EtOH溶液中,催化剂在电位恒定为-0.3 V时的计时电流曲线。由图6可见,在电解开始阶段,电流密度迅速下降,这可能是由于双电层的充电、电极/溶液界面处乙醇浓度迅速下降而引起的。随着反应的进行,双电层充电的影响不明显,乙醇迁移到电极/溶液界面处的速度也趋于稳定,从而保持一个相对稳定的值。电解时间为1 800 s时,在PdSn/1(2%), PdSn/1(5%), PdSn/1(10%), PdSn/C和Pd/C上的电流密度分别为9.9, 25.1, 3.8, 19.9, 6.1 mA·cm-2,即在PdSn/1(5%)催化剂上,乙醇氧化的电流密度是Pd/C的4倍多,表明PdSn/1(5%)催化剂对乙醇氧化具有较高的稳态电流密度。
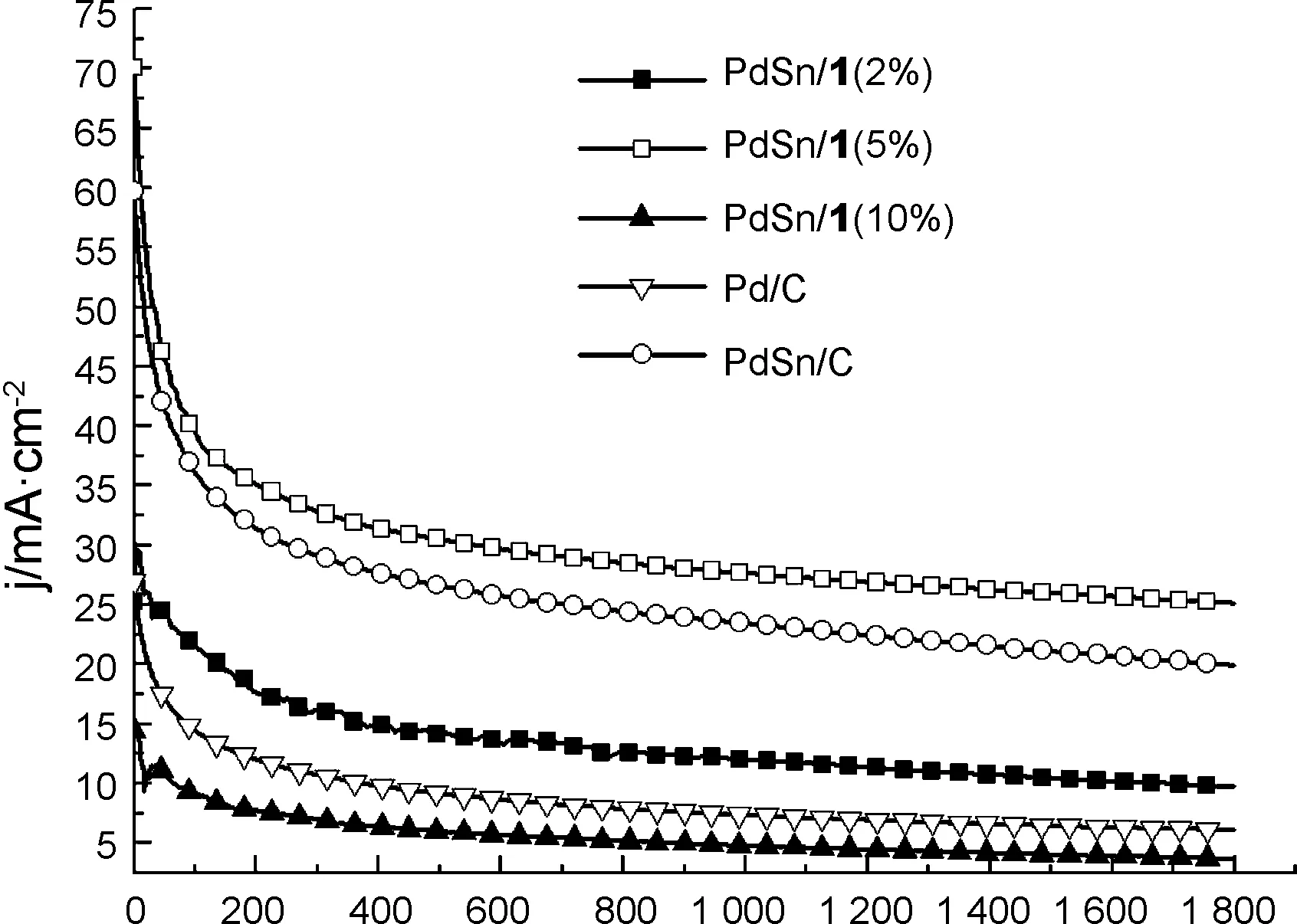
Time/s图 6 催化剂在1.0 mol·L-1 NaOH+0.5 mol·L-1EtOH溶液中的计时电流曲线,阶跃电位为-0.3 VFigure 6 Chronamperometric responses of the prepared catalysts in 1.0 mol·L-1 NaOH+0.5 mol·L-1 EtOH solution at -0.3 V
图7为PdSn/1(5%)和Pd/C在1.0 mol·L-1NaOH+0.5 mol·L-1EtOH溶液中,以100 mV·s-1的扫速循环400圈的循环伏安曲线。从图中可看出,经过400圈的循环扫描, CV图的形状保持不变。随着循环扫描次数的增加,乙醇氧化的峰电流密度也逐渐下降。在PdSn/1(5%)催化剂上,第一圈扫描时的峰电流密度为155 mA·cm-2,循环100圈之后的峰电流密度为141 mA·cm-2,仍然达到第一圈的90%之多。循环400圈之后峰电流密度为110 mA·cm-2, 降幅为29%;而在Pd/C催化剂上,第一圈扫描时的峰电流密度为120 mA·cm-2,循环100圈之后的峰电流密度只有第一圈时的78%。循环400圈之后峰电流密度下降至62 mA·cm-2,降幅达49%,在反复循环过程中峰电流密度的逐渐下降,其原因除了在反应中乙醇的不断消耗之外,还与电催化剂的稳定性下降有关。结果表明,PdSn/1(5%)催化剂对乙醇的催化氧化具有优异的稳定性。
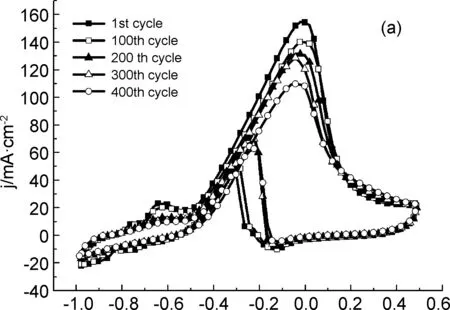
E/V
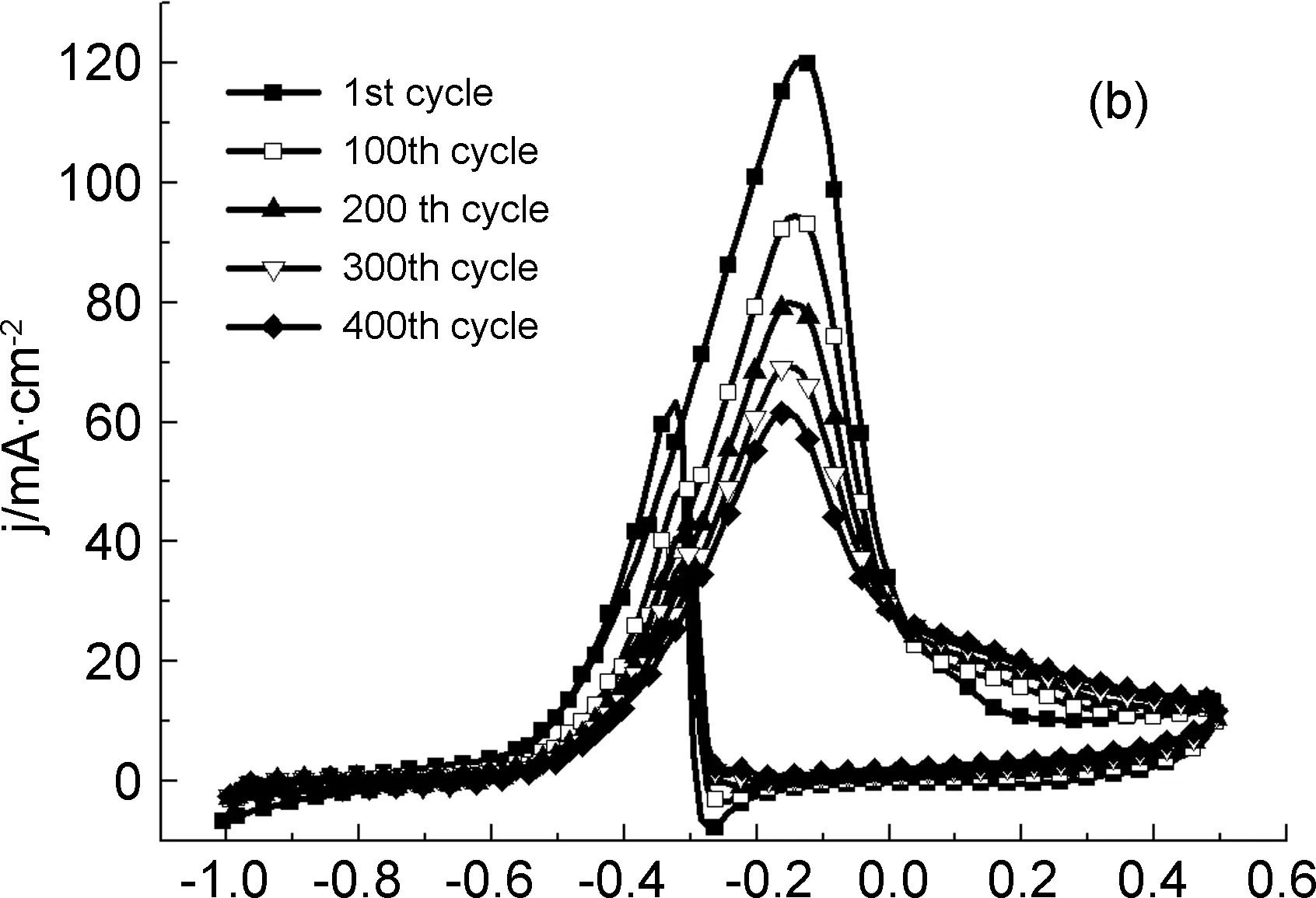
E/V图 7 催化剂PdSn/1(5%)(a) 和Pd/C(b)在 1.0 mol·L-1NaOH+0.5 mol·L-1 EtOH溶液 中连续扫描400圈的CV曲线,ν=100 mV·s-1Figure 7 CVs of the prepared catalysts PdSn/1(5%) (a) and Pd/C (b) in 1.0 mol·L-1NaOH+0.5 mol·L-1EtOH solution for consecutive 400 cycles at 100 mV·s-1
采用电化学交流阻抗(EIS)技术研究了PdSn/1(5%)和Pd/C催化剂对乙醇氧化的电催化活性,如图8所示。催化剂的EIS图都出现了明显的半圆,这是乙醇在催化剂上的电催化氧化形成的,相对于Pd/C催化剂, PdSn/1(5%)催化剂的半圆半径明显减小,表明在PdSn/1(5%)催化剂上乙醇氧化的动力学过程得到了显著改善。图8插图为模拟等效电路图,其中R1代表溶液电阻, R2表示乙醇电催化氧化的电荷转移阻力,相应的模拟数据见表1。由图8可见,等效模拟图实线与实验数据(点)能很好地吻合,说明等效电路图是合理的。由表1可见,在PdSn/1(5%)催化剂上,乙醇电催化氧化的阻力(R2)远远小于催化剂Pd/C,表明PdSn/1(5%)能有效地催化乙醇氧化的电化学过程,相比于Pd/C,其电化学活性有明显提高。
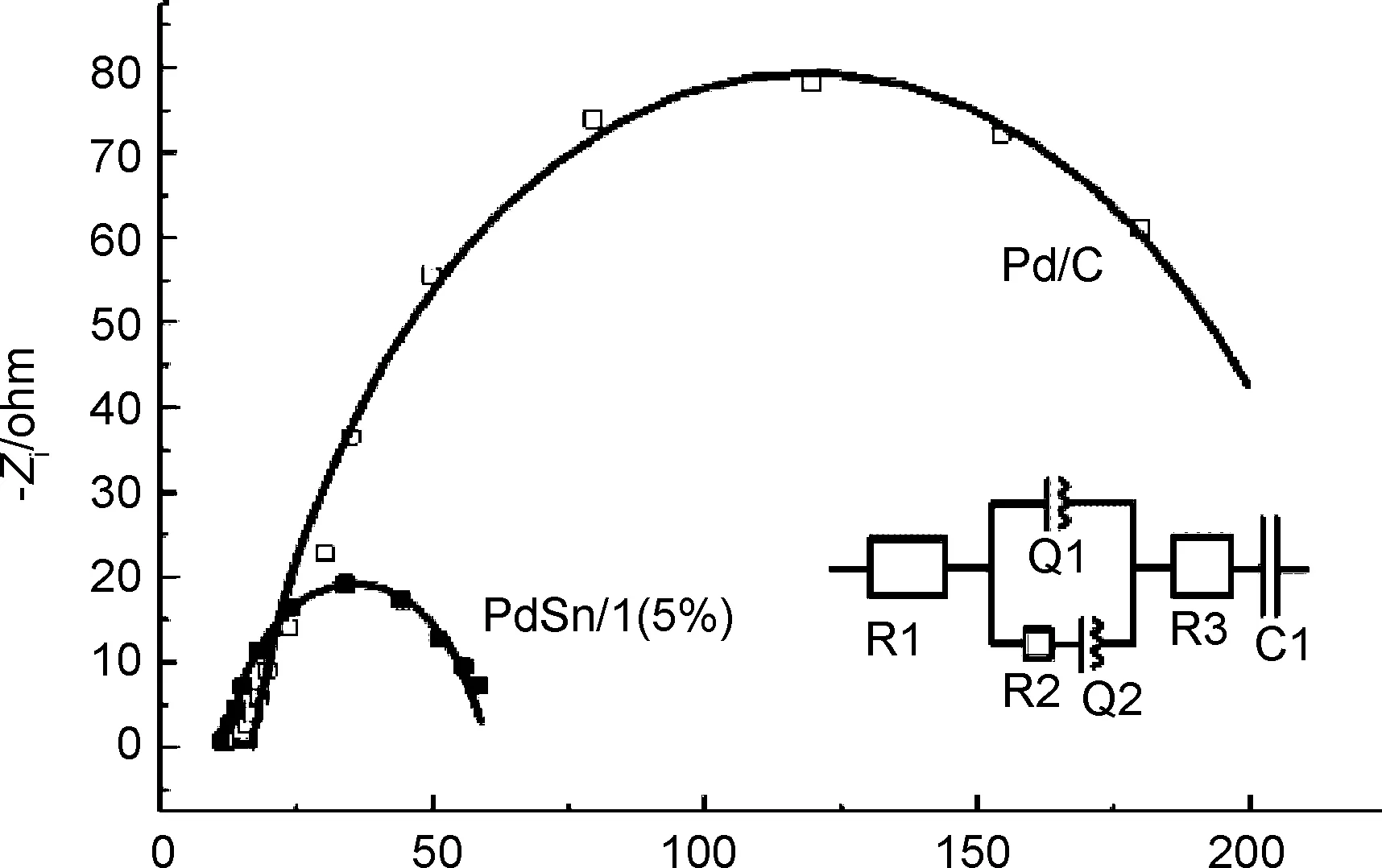
Zr/om图 8 -0.3 V时PdSn/1(5%)和Pd/C催化剂在 1.0 mol·L-1NaOH+0.5 mol·L-1 EtOH 溶液中交流阻抗图Figure 8 Electrochemical impedance spectra of the PdSn/1(5%) and Pd/C catalysts in 1.0 mol·L-1NaOH+ 0.5 mol·L-1CH3CH2OH solution at -0.3 V
乙醇在钯基催化剂上的电化学氧化机理一般包括三个步骤:(1)乙醇在催化剂表面上失去质子形成吸附态乙氧基(CH3COad); (2)催化剂表面上形成吸附态羟基(OHad); (3)CH3COad和OHad反应形成产物乙酸。这一过程没有CO等中间毒化物产生,所以也称为直接机理。锡的加入进一步强化了乙醇氧化按这个直接机理进行,从而提高了钯基催化剂的活性稳定性[26]。此外,Fe3O4的存在能够增加催化剂表面OHad的浓度,从而有利于乙醇转化为产物乙酸[27]。
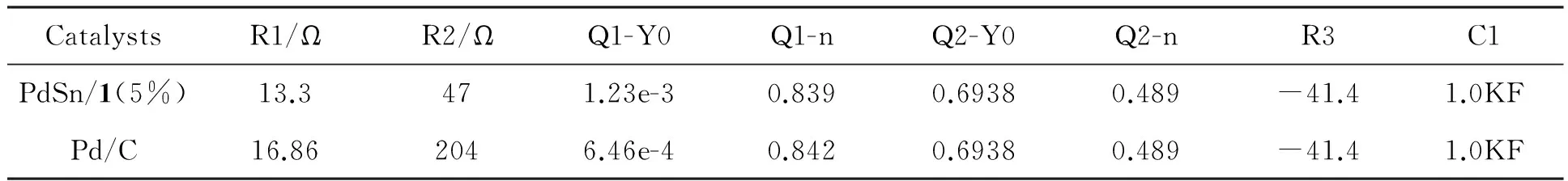
表1 图8交流阻抗的模拟数据Table 1 Simulation data of impedance spectra from Figure 8
3 结论
以PdCl2和SnCl2·2H2O为金属前驱体, Fe3O4-C(1)为载体,乙二醇为溶剂,制备了不同Fe3O4含量的催化剂(PdSn/1)。表面形貌分析表明, PdSn纳米颗粒均匀地分散在碳粉表面,平均粒径为5.8 nm;在循环伏安和计时电流测试中, PdSn/1(5%)催化剂对乙醇氧化具有较好的电催化活性,峰电流密度达到147 mA·cm-2, 且于-0.3 V下恒电位稳定放电30 min,电流密度仍达到25.1 mA·cm-2;与Pd/C相比, PdSn/1(5%)对乙醇氧化具有很小的电荷转移阻力。
[1] Reshetenko T V, St-Pierre J. Study of acetylene poisoning of Pt cathode on proton exchange membrane fuel cell spatial performance using a segmented cell system[J].J Power Sources,2015,287:401-415.
[2] Pedersen C M, Escudero-Escribano M, Velázquez-Palenzuela A,etal. Benchmarking Pt-based electrocatalysts for low temperature fuel cell reactions with the rotating disk electrode:Oxygen reduction and hydrogen oxidation in the presence of CO(review article)[J].Electrochim Acta,2015,79:647-657.
[3] Sekol R C, Li X, Cohen P,etal. Silver palladium core-shell electrocatalyst supported on MWNTs for ORR in alkaline media[J].Appl Catal B:Environ,2013,138:285-293.
[4] Ensafi A A, Jafari-Asl M, Rezaei B. A new strategy for the synthesis of 3-D Pt nanoparticles on reduced graphene oxide through surface functionalization,application for methanol oxidation and oxygen reduction[J].Electrochim Acta,2014,30:397-405.
[5] Zhang S X, Qing M, Zhang H,etal. Electrocatalytic oxidation of formic acid on functional MWCNTs supported nanostructured PdAu catalyst[J].Eletrochem Commun,2009,11:2249-2252.
[6] Holt-Hindle P, Yi Q F, Wu G,etal. Electrocatalytic activity of nanoporous Pt-Ir materials toward methanol oxidation and oxygen reduction[J].J Electrochem Soc,2008,155:K5-K9.
[7] Zhang L L, Tang Y W, Bao J C,etal. A carbonsupport PdP catalyst as the anodic catalyst in a direct formic acid fuel cell[J].J Power Sources,2006,162:177-179.
[8] Yi Q F, Zhang J J, Chen A C,etal. Activity of a novel titanium-supported bimetallic PtSn/Ti electrode for electrocatalytic oxidation of formic acid and methanol[J].J Appl Electrochem, 2008,38:695-701.
[9] Mao H, Huang T, Yu A S. Surface noble metal modified PdM/C(M=Ru, Pt, Au) as anode catalysts for direct ethanol fuel cells[J].J Alloys and Compounds,2016,676:390-395.
[10] Ren Y B, Zhang S C, Wei X. Ru effect on the catalytic performance of Pd@Ru/C catalysts for methanol electro-oxidation[J].J Energy Chem,2015,24(2):232-237.
[11] Wang J S, Cheng N C, Banis M N. Comparative study to understand the intrinsic properties of Pt and Pd catalysts for methanol and ethanol oxidation in alkaline media[J].Electrochim Acta, 2015,185:267-274.
[12] Ma L, Chu D, Chen R R. Comparison of ethanol electro-oxidation on Pt/C and Pd/C catalysts in alkaline media[J].Inter J Hydrogen Energy,2012,37(15):11185-11190.
[13] Mao H, Huang T, Yu A S. Surface Palladium rich alkaline media [J].Electrochim Acta,2015,174:1-7.
[14] Serov A, Martinez U, Atanassov P. Novel Pd-In catalysts for alcohols electrooxidation in alkaline media[J].Electrochem Commun,2013,34:185-191.
[15] Yi Q F, Chen Q H, Yang Z. A novel membrane-less direct alcohol fuel cell [J].J Power Sources, 2015,298:171-178.
[16] Jurzinsky T, Bär R, Cremers C,etal. Highly active carbon supported palladium-rhodium PdXRh/C catalysts for methanol electrooxidation in alkaline media and their performance in anion exchange direct methanol fuel cells (AEM-DMFCs) [J].Electrochim Acta,2015,176:1191-1197.
[17] Cui R J, Gu N, Shi J K. Fabrication of Pd/Mn3O4/plait-like carbon nanocoils catalyst:A highly active catalyst for ethanol electro-oxidation in alkaline media [J].Electrochim Acta,2014,147:778-784.
[18] Wang Y, Shi F F, Yan Y Y,etal. Carbon supported Pd-Ni-P nanoalloy as an efficient catalyst for ethanol electro-oxidation in alkaline media [J].J Power Sources,2013,243:369-376.
[19] Li Q X, Mao H M, Zhu P P,etal. Electrocatalytic performance of Pd-Sn /C catalyst prepared with different complexants for ethanol oxidation in alkaline solution [J].Chem J Chinese University,2014,35:602-607.
[20] 刘鸿飞. 磁性纳米催化剂的合成及其催化性能研究[D].北京:北京化工大学,2013.
[21] Ye K H, Zhou S A, Zhu X C,etal. Stability analysis of oxide (CeO2, NiO, Co3O4and Mn3O4) effect on Pd/C for methanol oxidation in alkaline medium [J].Electrochim Acta,2013,90:108-113.
[22] Huang Y Q, Liu Y J, Yang Z H,etal. Synthesis of yolk/shell Fe3O4-polydopamine-graphene-Pt nanocomposite with high electrocatalytic activity for fuel cells [J].J Power Sources, 2014,246:868-874.
[23] 洪春艳. Au/Fe3O4纳米颗粒及Pt/Au/Fe3O4催化剂的制备与表征[D].北京:北京化工大学,2013.
[24] Fu Z, Yan L T, Li K X. The performance and mechanism of modified activated carbon air cathode by non-stoichiometric nano Fe3O4in the microbial fuel cell [J].Biosensors and Bioelectronics,2015,74:989-995.
[25] 王海丽. Fe3O4改性Pt/C催化剂阴极氧还原活性的研究[D].大连:大连交通大学,2010.
[26] Vigier F, Rousseau S, Coutanceau C,etal. Electrocatalysis for the direct alcohol fuel cell [J].Topics in Catal,2006,40:111-121.
[27] Takahiro Y, Noriaki W, Hiroyuki U,etal. Adsorbed water for the electro-oxidation of methanol at Pt-Ru alloy [J].Chem Commun,2003,7:828-829.
Preparation of PdSn/Fe3O4-C Catalysts and Their Electro-catalytic Activities for The Oxidation of Ethyl Alcohol
ZOU Tao1, YI Qing-feng1*, ZHANG Yuan-yuan1, XIANG Bai-lin2, ZHOU Xiu-lin1
(1. School of Chemistry and Chemical Engineering, Hunan University of Science and Technology, Xiangtan 411201, China;2. Chemistry and Material Engineering Department, Huaihua University, Huaihua 418000, China)
Fe3O4-C (1) with different quantities of Fe3O4were prepared by coating method. The nano-catalysts(PdSn/1) were prepared by reduction method, using PdCl2and SnCl2·2H2O as metal precursor. The structures and properties were characterized by TEM, XRD and EDS. The electroactivity of PdSn/1 for ethanol oxidation in alkaline media were studied by cyclic voltammetry(CV), chronoamperometry(CA) and electrochemical impedance spectra(EIS). The results showed that PdSn/1(5%) showed the highest catalytic activity for ethanol oxidation wuth the ethanol oxidation peak current density of 147 mA·cm-2. Compared with Pd/C, PdSn/1(5%) presents the much lower charge transfer resistance for ethanol oxidation reaction.
palladium catalyst; ethanol oxidation; palladium tin; fuel cell; preparation; electro-catalytic activity
2016-09-13;
2017-03-27
国家自然科学基金资助项目(21376070); 湖南省研究生科研创新项目(CX2016B567)
邹涛(1992-),男,汉族,湖南汨罗人,硕士研究生,主要从事电化学的研究。
易清风,教授, E-mail: yqfyy2001@hnust.edu.cn
O614.82+3
A
10.15952/j.cnki.cjsc.1005-1511.2017.06.16233

