间质干细胞通过调控miR-92b修复顺铂诱导的急性肾损伤*
周颖,徐会涛,李伟,杨晋,钱晖
(1.连云港市第一人民医院检验科,江苏连云港 222001;2. 江苏大学医学院,江苏镇江 212013)
·临床实验研究·
间质干细胞通过调控miR-92b修复顺铂诱导的急性肾损伤*
周颖1,徐会涛1,李伟1,杨晋1,钱晖2
(1.连云港市第一人民医院检验科,江苏连云港 222001;2. 江苏大学医学院,江苏镇江 212013)
目的 探讨骨髓间质干细胞(BM-MSCs)修复顺铂诱导的急性肾损伤的分子机制。方法 以6 mg/kg顺铂的剂量经腹腔注射大鼠体内,24 h后经尾静脉输注BM-MSCs(BM-MSCs组)或PBS (PBS组),以未注射顺铂者作为正常对照组;HE染色及免疫组织化学染色法检测BM-MSCs对肾损伤的修复情况;体外培养NRK-52E细胞并经顺铂作用6 h后,继续培养48 h(顺铂组)或与BM-MSCs共培养48 h(细胞组),未用顺铂处理的NRK-52E细胞作为对照组; qRT-PCR检测其miR-92b及其靶基因PTEN的表达水平,western blot检测其p-Akt蛋白的表达水平。结果 HE染色结果显示,BM-MSCs组的肾小管蛋白质管型明显少于PBS组,肾小管结构明显改善;免疫组织化学染色结果表明,BM-MSCs组的增殖细胞核抗原(PCNA)阳性细胞数 [(131.0±14.4)个]明显高于PBS组[(42.2±6.1)个], 差异有统计学意义(t=11.28,P<0.01);qRT-PCR结果表明,体内试验中,与正常对照组miR-92b和PTEN基因的表达水平(1.11±0.78,1.01±0.21)相比,PBS组分别为4.64±1.06和0.61±0.2,差异有统计学意义(P<0.05),BM-MSCs组分别为2.27±0.81和1.1±0.1,差异亦有统计学意义(P均<0.05);体外实验中,与阴性对照组miR-92b和PTEN基因的表达水平(1.12±0.77,1.02±0.13)相比,顺铂组分别为7.64±0.72和0.58±0.2,差异有统计学意义(P均<0.05),细胞组分别为4.38±0.50和1.15±0.23,差异亦有统计学意义(P均<0.05);western blot检测结果显示,与顺铂组p-Akt蛋白的表达水平(0.96±0.18)相比,细胞组p-Akt蛋白表达水平为2.11±0.11,差异有统计学意义(P<0.01)。结论 BM-MSCs能够修复顺铂诱导的急性肾损伤, 可能通过下调miR-92b发挥作用。
miR-92b;急性肾损伤;骨髓间质干细胞
研究表明,间质干细胞能够修复顺铂及缺血再灌注导致的急性肾损伤[1-2],但其修复机制一直存在较大的争议。有学者认为间质干细胞可分化为肾小管样上皮细胞从而发挥修复功能[3];另有学者认为,间质干细胞通过旁分泌的作用(如炎症因子TNF-α、IL-1β等的减少,抗炎因子IL-10、bFGF等的上调)对受损的肾脏进行修复[4]。本课题组前期研究结果显示,人脐带间质干细胞(hUC-MSCs)分泌的外泌体(exosome)可修复顺铂诱导的大鼠急性肾损伤[5]。本实验通过建立顺铂诱导的急性肾损伤模型,进一步探讨BM-MSCs是否通过调控miR-92b的表达从而发挥修复功能。
1 材料与方法
1.1 主要材料 雌性SD大鼠,体重200±20 g,购自上海斯莱克动物中心;肾小管上皮细胞系NRK-52E购自中国科学院上海细胞库;顺铂(山东齐鲁制药公司),低糖DMEM及胰蛋白酶(美国Gibco公司),胎牛血清(上海依科赛公司),碱性磷酸酶试剂盒(南京碧云天公司),成脂诱导液(A+B,美国Cyagen公司),油红O染液(美国Sigma公司),Trizol试剂(美国Invitrogen公司),RNA提取试剂盒、逆转录试剂盒、miScript SYBR Green PCR试剂盒(美国Qiagen公司),逆转录及SYBR Green PCR试剂盒(杭州博日公司),Transwell嵌合板(8 μm)、细胞培养瓶及培养板(美国Corning公司),兔抗大鼠Akt、兔抗大鼠p-Akt单克隆抗体,HRP标记的山羊抗兔IgG二抗(美国Bioworld公司),免疫组织化学染色试剂盒、DAB显色试剂盒 (武汉博士德公司);超净工作台(苏州净化设备厂),CO2培养箱(美国Format Scientific公司),NanoDrop 2000 超微量分光光度计(Thermo公司),荧光定量PCR(美国ABI公司),凝胶成像分析系统(美国Syngene公司)。
1.2 细胞培养 参照文献[6]分离培养SD大鼠的BM-MSCs,加入含10%胎牛血清、100 U/mL青霉素、100 mg/mL链霉素的低糖DMEM培养基,置于37 ℃、5% CO2、饱和湿度的条件下常规培养。每隔3 d更换新鲜培养基,待细胞融合度达90%时,用2.5 g/L胰蛋白酶消化,以1∶3比例传代培养。
1.3 成骨、成脂诱导实验 取生长状态良好的第3代BM-MSCs,经2.5 g/L胰蛋白酶消化,用含10%胎牛血清的低糖DMEM培养基重悬计数,以5×104个细胞密度接种于35 mm细胞培养皿中,于37 ℃、5% CO2培养箱中培养。
1.3.1 成骨诱导实验 取上述细胞,常规培养24 h后加入成骨诱导液(取0.1 μmol/L地塞米松、50 mg/L 维生素C、10 μmol/L β-磷酸甘油,溶入含10%FBS的L-DMEM)2 mL,每3 d换液1次,诱导14 d后用4%多聚甲醛固定,加入碱性磷酸酶试剂2 mL染色,PBS洗涤2次,光学显微镜下观察并拍照。以胞浆内出现蓝色沉淀的细胞为阳性细胞。以仅加入L-DMEM培养基培养的细胞作为阴性对照组。实验重复3次。
1.3.2 成脂诱导实验 取上述细胞,待细胞融合度达100%时,加入2 mL成脂诱导液A,培养3 d后更换成2 mL成脂诱导液B,继续培养24 h后更换为成脂诱导液A,反复循环培养至21 d。4%多聚甲醛固定30 min,加入油红O试剂2 mL染色,PBS洗涤2次,光学显微镜下观察并拍照。以出现红色脂滴的细胞为阳性细胞。以仅加入L-DMEM培养基培养的细胞作为阴性对照组。实验重复3次。
1.4 急性肾损伤模型的构建 参照文献[6]构建大鼠急性肾损伤模型,以6 mg/kg剂量的顺铂经腹腔注射到肾损伤模型SD大鼠体内,24 h后经尾静脉注射2×106个BM-MSCs(BM-MSCs组)或PBS(PBS组), 输注细胞4 d后取出肾组织,4%多聚甲醛固定。以未注射顺铂的大鼠作为正常对照组。实验重复3次。
1.5 病理切片及苏木素-伊红(HE)染色 取上述经4%多聚甲醛固定的正常对照组、PBS组及细胞组的肾脏组织标本,制备石蜡组织切片,经二甲苯脱蜡30 min,分别用100%乙醇、95%乙醇和70%乙醇脱水各2 min,ddH2O洗涤2~3 min;苏木素染色15 min,自来水冲洗2 min,经1%盐酸乙醇分化2~3 s,自来水冲洗10~20 min,蒸馏水冲洗2~3 s,1%伊红染液染色4~5 min,自来水冲洗2~3 min,经70%乙醇2 min、95%乙醇30 s和100%乙醇15 s脱水、透明,自来水冲洗2~3 min,二甲苯脱蜡30 min;中性树胶封固,凉干后光学显微镜下观察并拍照。实验重复3次。
1.6 免疫组织化学染色 取1.5中的各组经系列乙醇脱水的石蜡组织切片,ddH2O洗涤2~3 min,将切片浸入50 mL 3% H2O2中以灭活内源性过氧化物酶,室温温育10 min,蒸馏水洗涤3次;切片置于枸橼酸盐缓冲液中,加热至沸腾10 min,自然冷却后PBS洗涤2次;加入5% BSA封闭液室温封闭20 min,弃去封闭液;加入小鼠抗大鼠PCNA单克隆抗体(1∶100稀释),置于湿盒中37 ℃温育80 min,PBS洗涤2 min,重复3次,滴加生物素化山羊抗小鼠IgG,37 ℃温育20 min,PBS洗涤2 min,重复3次;加入链霉亲和素-生物素复合物(SABC)100 μL, 37 ℃温育20 min,PBS洗涤5 min,重复4次;DAB显色,蒸馏水终止反应,苏木素复染15 s;80%乙醇、95%乙醇和100%乙醇脱水各2 min,二甲苯透明2次,每次5 min,中性树脂封片,光学显微镜下观察,随机计数6个低倍镜视野下的阳性细胞数(染色呈棕褐色)。实验重复3次。
1.7 体外实验 取生长状态良好的肾小管上皮细胞NRK-52E,经2.5 g/L胰蛋白酶消化,并用含10%胎牛血清低糖DMEM培养基重悬并计数,以5×104个的细胞密度接种于6孔细胞培养板,于37 ℃、5% CO2培养箱中培养。待细胞融合度达60%时,加入7.5 μmol/L顺铂温育6 h;同时BM-MSCs以2×105/孔的细胞密度接种于Transwell小室中,贴壁6 h后将小室移至7.5 μmol/L顺铂+NRK-52E细胞的上层(细胞组),继续培养48 h。以上述7.5 μmol/L顺铂温育6 h的NRK-52E细胞继续培养48 h为顺铂组,阴性对照组为用含10%胎牛血清的低糖DMEM培养基培养的NRK-52E细胞。上述各组均置于37 ℃、5% CO2培养箱中培养。
1.8 RNA提取及逆转录反应 用Trizol试剂提取体内试验中正常对照组、PBS组与BM-MSCs组。及体外试验中阴性对照组、顺铂组与细胞组的总RNA,采用miRNA专用RNA提取试剂盒提取上述各组的总RNA, NanoDrop 2000 超微量分光光度计检测RNA的浓度及纯度,取吸光度(A260/280 nm)在1.8~2.0的标本,按照逆转录试剂盒及miScript Ⅱ逆转录试剂盒操作说明书将RNA逆转录为cDNA,样本置于-20 ℃保存。
1.9 qRT-RCR检测 内参照U6和miR-92b引物由Qiagen公司设计并合成。采用Primer Premier 5.0软件设计PTEN及β-Actin引物,引物由上海生工公司合成。PTEN上游引物序列(F):5′-AAGGACGGACTGGTGTAATG-3′,下游引物序列(R):5′-AGTGCCACTGGTCTGTAATC-3′;β-Actin上游引物序列(F):5′-CACGAAACTACCTTCAACTTC-3′,下游引物序列(R):5′-CATACTCCTGCTTGCTGATC-3′。miR-92b及U6反应体系均为10 μL,包括2× QuantiTect SYBR Green PCR Master Mix 5 μL;10×miScript Universal 引物1 μL;10×miScript 引物 1 μL;无RNA酶水 2 μL; cDNA 1 μL。反应条件:95 ℃ 15 min;94 ℃ 15 s,55 ℃ 30 s,63 ℃ 30 s,共40个循环。75~85 ℃采集荧光,用StepOneTM软件采集荧光信号并进行熔解曲线分析。PTEN反应体系为20 μL,包括ddH2O 8 μL,10 μmol/L上、下游引物各0.5 μL,2×SYBG Mix 10 μL,cDNA模板1 μL。反应条件:95 ℃ 5 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,共35个循环,75~85 ℃时收集荧光。使用StepOneTM软件采集荧光信号并进行熔解曲线分析,miR-92b和PTEN基因相对表达水平以2-ΔΔCt法计算,公式:△△Ct =[(实验组Ct目的基因-实验组Ct内参基因)-(对照组Ct目的基因-对照组Ct内参基因)]。每组设3个复孔,实验重复3次。
1.10 蛋白质提取 收集体内试验中正常对照组、PBS组与BM-MSCs组的肾组织标本,加入适量细胞裂解液RIPA与1%苯甲基磺酰氟(PMSF)混合液,冰上研磨肾组织并转移至1.5 mL EP管中。体外试验时收集对照组、顺铂组与细胞组的NRK-52E细胞(1×106个),PBS洗涤2次转移至1.5 mL EP管中,800×g离心5 min去除上清,加入适量细胞裂解液RIPA及1%PMSF混合液。将上述标本充分混匀后置冰上,每隔10 min剧烈震荡30 s, 重复3次后4 ℃、12 000×g离心15 min, 将上清液转移至另一1.5 mL EP管中。按照BCA法试剂盒操作说明书测定样品蛋白质浓度。加入1/4体积的5×蛋白质上样缓冲液,100 ℃煮沸5 min, 样本置于-80 ℃保存。
1.11 western blot 配制10% SDS-PGAE,将变性后的蛋白质裂解液按150 μg的蛋白质量进行聚丙烯酰胺凝胶电泳。电泳结束后再以350 mA恒流条件下电转移2 h,将蛋白质转移至聚偏氟乙烯(PVDF)膜上。将膜置于50 g/L脱脂牛奶中(TBST配制)室温封闭1 h;加入兔抗大鼠Akt抗体 (1∶500稀释)、兔抗大鼠p-Akt 抗体(1∶500稀释),4 ℃过夜,次日以TBST洗涤3次,每次10 min,加入HRP标记的羊抗兔二抗(1∶2 000稀释),37 ℃温育1 h,TBST洗涤3次,每次10 min。化学发光法(ECL)显色, 凝胶成像分析系统曝光分析。实验重复3次。
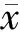
2 结果
2.1 骨髓MSCs成骨成脂分化能力分析结果 成骨诱导14 d后,BM-MSCs胞浆内呈现蓝紫色;成脂诱导21 d后,细胞中可见大量的油红O染色阳性的红色脂肪滴。见图1。
2.2 各组HE染色结果 正常对照组的肾小管结构完整,没有炎症细胞的浸润及蛋白质管型。PBS组肾小管结构不完整,出现大量炎症细胞的浸润,并且出现明显的蛋白质管型。而BM-MSCs组肾小管结构得到明显改善,炎症细胞及蛋白质管型减少。见图2。

注:A,成骨对照组;B,成骨诱导组;C,成脂对照组;D,成脂诱导组。
图1 成骨、成脂诱导BM-MSCs形态(×200)
注:A,正常对照组;B,PBS组;C,BM-MSCs组。
图2 各组HE染色分析结果(×200)
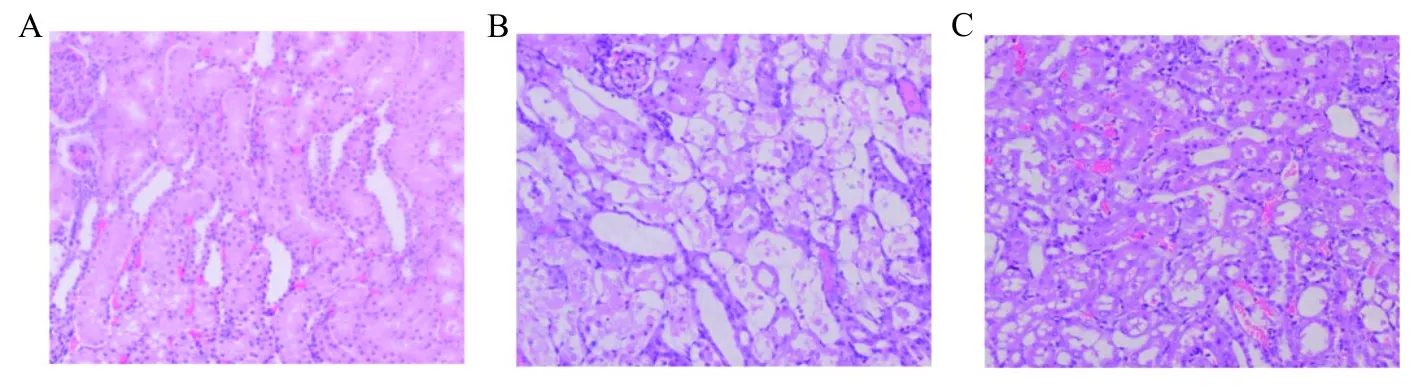
2.3 免疫组织化学染色结果 3组间PCNA阳性表达细胞数差异有统计学意义(F=154.6,P<0.01);组间两两比较结果表明,PBS组PCNA阳性表达细胞数 [(42.2±6.1)个]明显高于正常对照组[(4.0±1.6)个](t=8.41,P<0.01);而BM-MSCs组PCNA阳性表达细胞数[(131.0±14.4)个]较PBS组明显增多(t=11.28,P<0.01)。见图3。
注:A,正常对照组;B,PBS组;C,BM-MSCs组。
图3 免疫组织化学染色检测PCNA结果(×200)
2.4 qRT-RCR检测各组miR-92b及PTEN表达水平 与正常对照组或阴性对照组相比,PBS组及BM-MSCs组或顺铂组及细胞组miR-92b的表达水平均明显升高;而与PBS组或顺铂组相比,BM-MSCs及细胞组PTEN基因表达水平亦明显升高。见表1。
2.5 western blot检测p-Akt表达水平 与对照组(1.02±0.21)相比,顺铂组p-Akt蛋白表达水平(0.96±0.18)未见明显变化;而细胞组p-Akt的表达水平为2.11±0.11,差异有统计学意义(t=5.51,P<0.01)。
表1 miR-92b及PTEN基因的相对表达量
注:*,与正常对照组或阴性对照组相比,P<0.01;#,与PBS组或顺铂组相比,P<0.01。
3 讨论
研究表明,间质干细胞对损伤的肾组织起到保护和促进修复作用,但其作用机制并不十分明确[7]。本研究发现BM-MSCs能够修复顺铂诱导的急性肾损伤。HE染色结果表明移植BM-MSCs的肾脏组织结构明显改善,炎症细胞及蛋白质管型减少,肾小管结构趋于完整。免疫组织化学染色结果显示,未经顺铂损伤的正常肾组织中只有极少量的肾小管上皮细胞PCNA呈阳性,显示棕褐色的胞核。PBS组的肾组织中可见部分PCNA阳性肾小管上皮细胞,表明损伤的肾组织有一定的自我修复能力,而移植BM-MSCs的细胞组可见大量PCNA阳性肾小管上皮细胞,且阳性细胞数明显高于PBS组,表明BM-MSCs能够促进肾小管上皮细胞的增殖,从而对损伤的肾组织进行修复。以上结果说明BM-MSCs对顺铂诱导的急性肾损伤具有修复作用。
miRNA在组织损伤修复中扮演着极为重要的角色。为了进一步探讨BM-MSCs发挥作用的可能机制。我们检测了顺铂损伤的肾组织或NRK-52E细胞中miR-92b的表达水平,发现与未经顺铂损伤的肾组织或细胞相比,其表达水平明显升高,而经移植BM-MSCs的肾组织或与BM-MSCs共培养的NRK-52E细胞miR-92b的表达水平明显降低,说明BM-MSCs可以抑制miR-92b的表达。PTEN作为miR-92b的靶基因,在顺铂损伤的肾组织或细胞中的表达量增加,PTEN的表达被部分抑制,PTEN的下游通路蛋白—p-Akt蛋白的表达未见明显改变。BM-MSCs能够降低miR-92b的表达水平,从而促进PTEN基因的表达,进而活化p-Akt蛋白,促进细胞增殖。目前仅有少量报道miR-92b通过调控PTEN/Akt信号通路,从而调节神经胶质瘤细胞及非小细胞肺癌细胞的增殖与凋亡[8],表明miR-92b能抑制肿瘤细胞增殖,促进凋亡;当miR-92b的表达水平升高时,促进细胞增殖并减少其凋亡,与本实验中miR-92b的作用较为一致。本研究不足之处在于仅证实顺铂诱导的肾损伤过程中miR-92b表达水平升高,可能促使肾损伤的进展,BM-MSCs能够降低miR-92b的表达水平从而达到修复肾损伤的目的,尚未证实miR-92b能否导致肾损伤的发生。为了明确miR-92b在肾损伤中的作用机制,今后需将miR-92b-mimics转染NRK-52E细胞并用miR-92b 抑制剂转染顺铂损伤的NRK-52E细胞,进一步深入分析miR-92b在急性肾损伤中的作用,以明确BM-MSCs发挥损伤修复的分子机制。
[1]Peng X, Xu H, Zhou Y,etal. Human umbilical cord mesenchymal stem cells attenuate cisplatin-induced acute and chronic renal injury [J]. Exp Biol Med, 2013, 238(8):960-970.
[2]Rosselli Desiree D, Mumaw Jennifer L, Dickerson Vanna,etal. Efficacy of allogeneic mesenchymal stem cell administration in a model of acute ischemic kidney injury in cats [J]. Res Vet Sci, 2016, 108:18-24.
[3]Shalaby RH, Rashed LA, Ismaail AE,etal. Hematopoietic stem cells derived from human umbilical cord ameliorate cisplatin-induced acute renal failure in rats[J]. Am J Stem Cells, 2014,3(2):83-96.
[4]Luo J, Zhao X, Tan Z,etal. Mesenchymal-like progenitors derived from human embryonic stem cells promote recovery from acute kidney injury via paracrine actions [J]. Cytotherapy, 2013,15(6):649-662.
[5]Zhou Y, Xu H, Xu W,etal. Exosomes released by human umbilical cord mesenchymal stem cells protect against stem cells protect against cisplatin-induced renal oxidative stress and apoptosis in vivo and in vitro [J]. Stem Cell Research & Therapy, 2013,4(2):34.
[6]Qian H, Yang H, Xu W,etal. Bone marrow mesenchymal stem cells ameliorate rat acute renal failure by differentiation into renal tubular epithelial-like cells [J]. Int J Mol Med, 2008, 22(3):325-332.
[7]Lim CY, Han JI, Kim SG,etal. Evaluation of autologous bone marrow-derived mesenchymal stem cells on renal regeneration after experimentally induced acute kidney injury in dogs [J]. Am J Vet Res, 2016, 77(2):208-217.
[8]Li Y, Li L, Guan Y,etal. MiR-92b regulates the cell growth, cisplatin chemosensitivity of A549 non small cell lung cancer cell line and targetPTEN[J]. Biochem Biophys Res Commun, 2013, 440(4):604-610.
(本文编辑:许晓蒙)
Mesenchymal stem cells repair cisplatin-induced acute kidney injury via regulating miR-92b
ZHOUYing1,XUHui-tao1,LIWei1,YANGJin1,QIANHui2
(1.DepartmentofClinicalLaboratory,theFirstPeople′sHospitalofLianyungang,Lianyungang222001,Jiangsu; 2.SchoolofMedicine,JiangsuUniversity,Zhenjiang212003,Jiangsu,China)
Objective To investigate the molecular mechanism of bone marrow mesenchymal stem cells (BM-MSCs) in repairing cisplatin-induced acute renal injury. Methods The rats were injected 6 mg/kg of cisplatin intraperitoneally, and bone marrow mesenchymal stem cells (BM-MSCs group) or PBS (PBS group) were injected respectively via tail vein after 24 hours. The rats without injecting cisplatin were selected as a normal control group. The repair effect of BM-MSCs on renal injury was observed by HE staining and immunohistochemistry. In addition, NRK-52E cells were cultured in vitro and treated with cisplatin for 6 hours. Then, NRK-52E cells were continued to culture for 48 hours or co-cultured with BM-MSCs for 48 hours, and NRK-52E cells untreated with cisplatin were used as a control. The expression levels of miR-92b and its target genePTENwere detected by qRT-PCR, and the expression level of p-Akt by western blot. Results HE staining showed that the tubular protein casts in BM-MSCs group were significantly less than that in PBS group, and that the renal tubular structure was significantly improved in BM-MSCs group. Immunohistochemical staining indicated that the number of cells expressing proliferating cell nuclear antigen (PCNA) in BM-MSCs group (131.0±14.4) was significantly higher than that in PBS group (42.2±6.1,t=11.28,P<0.01). qRT-PCR results showed that in the vivo experiment, compared with the expression level of miR-92b andPTENin the normal control group (1.11±0.78,1.01±0.21), PBS group were (4.64±1.06) and (0.61±0.2),respectively (allP<0.05); BM-MSCs group were (2.27±0.81) and (1.1±0.1),respectively(allP<0.05). In vitro experiment, compared with the expression level of miR-92b andPTENin the negative control group (1.12±0.77,1.02±0.13), cisplatin group were (7.64±0.72) and (0.58±0.2),respectively (allP<0.05), cell group were (4.38±0.50) and (1.15±0.23),respectively(allP<0.05). Western blot results showed that compared with the expression level of p-Akt in cisplatin group (0.96±0.18), p-Akt expression in cell group was (2.11±0.11,P<0.01).Conclusion BM-MSCs may repair the cisplatin-induced acute renal injury via down-regulating the expression level of miR-92b.
miR-92b; acute kidney injury; bone marrow mesenchymal stem cell
10.13602/j.cnki.jcls.2017.05.01
国家自然科学基金(81272481);江苏高校优秀科技创新团队(苏教科(2013)10号);江苏省“333工程”科研项目(BRA2015399);连云港市“科教兴卫工程”青年科技项目(QN1404)。
周颖,1987年生,女,硕士,从事干细胞与损伤修复研究。
钱晖,教授, 博士研究生导师,E-mail:lstmmmlst@163.com。
R332
A
2017-02-04)

