MPC30-DEA70载AMO-miR-146a对大鼠颈总动脉球囊损伤后血管内膜增生的影响
李志,陆远,冯辉,张敏,张卓琦,王志荣,杨煜,徐晤
(徐州医科大学附属医院心内科,江苏徐州221000)
MPC30-DEA70载AMO-miR-146a对大鼠颈总动脉球囊损伤后血管内膜增生的影响
李志,陆远,冯辉,张敏,张卓琦,王志荣,杨煜,徐晤
(徐州医科大学附属医院心内科,江苏徐州221000)
目的阳离子磷酸胆碱聚合物(MPC30-DEA70)负载反义miR-146a寡核苷酸(AMO-miR-146a)转染大鼠颈总动脉球囊损伤处血管平滑肌细胞(VSMC),观察其对血管内膜增生的影响。方法60只SD大鼠完全随机化分为未损伤组、单纯损伤组、多聚赖氨酸(PLL)组、AMO-miR-146a组、PLL载MPC30-DEA70/AMO-miR-146a复合物(P/M=3:1组和P/M=5:1组),每组10只。通过光学显微镜观察4周后大鼠颈总动脉组织形态学变化,q-PCR法检测miR-146a的表达以及应用Western blot法检测增殖细胞核抗原蛋白(PCNA)、NFκBp65的表达情况。结果苏木精-伊红染色,光镜下显示,除未损伤组外,单纯损伤组、PLL组、AMO-miR-146a组、P/M=3:1组、P/M=5:1组大鼠颈总动脉血管新生内膜有不同程度的增生,而中膜面积无明显改变;与单纯损伤组比较,PLL组、AMO-miR-146a组新生内膜面积差异无统计学意义(P>0.05),P/M=3:1组和P/M=5:1组新生内膜面积明显减少,差异有统计学意义(P<0.05),后两组组间比较差异无统计学意义(P>0.05);q-PCR及Western blot检测显示P/M=3:1组和P/M=5:1组miR-146a及目的蛋白PCNA、NFκBp56的表达较未损伤组高,差异有统计学意义(P<0.05),但明显低于单纯损伤组、PLL组、AMO-miR-146a组,差异有统计学意义(P˂0.05),而P/M=3:1组和P/M=5:1组组间miR-146a、PCNA、NF κBp56的表达差异无统计学意义(P>0.05);单纯损伤组、PLL组、AMO-miR-146a组组间miR-146a、PCNA、NFκBp56的表达差异无统计学意义(P>0.05)。结论MPC30-DEA70可与AMO-miR-146a络合,借助PLL进入VSMC,有效抑制球囊损伤后VSMC的miRNA-146a的表达,使PCNA、NFκBp56下调,抑制新生内膜增生,防止血管狭窄。
阳离子磷酸胆碱聚合物;反义寡核苷酸;miR-146a;血管狭窄;基因载体
冠心病已经成为全球主要的死亡原因之一[1],目前的治疗方法主要包括药物治疗、经皮冠状动脉成形术,支架植入术以及冠状动脉旁路移植术。药物涂层支架植入术已经被医务人员和患者广泛接受和认可,其降低了早期支架内血栓形成及再狭窄的发生率[2-3],但仍面临药物涂层支架植入后晚期支架内血栓形成、内膜增生等需要迫切解决的问题[4]。研究发现,在球囊损伤再狭窄的动物模型中,miR-146a的表达水平显著上调[5],通过基因沉默技术减少血管平滑肌细胞中miR-146a的表达,可以抑制血管平滑肌细胞增殖[6]。阳离子聚合物作为一类易于制备的新型非病毒类转基因载体,与其他非病毒载体相比,具有结构稳定、性能易于调整、目的基因容量大、合成简便及良好的生物相容性等优点。故本实验采用阳离子磷酸胆碱聚合物MPC30-DEA70作为非病毒载体,建立大鼠颈总动脉球囊损伤模型,通过多聚赖氨酸的粘附将AMO-miR-146a转入损伤后的大鼠颈总动脉血管壁,探讨其对大鼠颈总动脉内膜增生的影响。
1 材料与方法
1.1 实验动物及主要材料健康雄性SD大鼠60只,体质量150~200 g,由徐州医科大学实验动物中心提供,普通饲料分笼饲养。RT-PCR试剂盒(Promega,USA),大鼠miR-146a反义寡核苷酸(苏州吉玛生物技术有限公司),miR-146a茎环引物、5S茎环引物(上海捷瑞公司),0.1%的PLL(上海生工生物工程公司),PCNA兔多克隆蛋白抗体(Santa Cruz公司),Anti-NFκBP65兔单克隆蛋白抗体(Abcam USA),GAPDH蛋白一抗(北京巴戊德生物技术有限公司),FITC标记的山羊抗兔IgG (北京中杉金桥科技有限公司),MPC30-DEA70由中国矿业大学曹希传博士惠赠,1.25 mm×6 mm球囊导管等介入器材由美敦力公司提供。
1.2 基因球囊的制备取0.1%PLL溶液30 μL,以去离子水稀释成100 μL,均匀涂抹于球囊导管的球囊表面,后反复吹干备用。取90 μL、150 μL的MPC30-DEA70溶液(1 g/L)分别加入到两组30 μL的AMO-miR-146a的溶液中,形成P/M比值为3:1、5:1的MPC30-DEA70/AMO-miR-146a复合溶液,室温下静置30 min。以去离子水补充体积至200 μL,涂抹于PLL球囊表面,干燥备用。上述操作均在无菌环境中进行。
1.3 动物模型的制备60只SD雄性大鼠随机化分为6组,即未损伤组、单纯损伤组、多聚赖氨酸(PLL)组、AMO-miR-146a组,以及PLL载AMO-miR-146a基因复合物P/M=3:1组与P/M=5:1组,每组10只。未损伤组仅切开分离颈总动脉,不予球囊损伤处理;单纯损伤组仅给予球囊损伤;其余各组不仅给予球囊损伤,而且将涂有干预成分的球囊导管送至大鼠颈总动脉损伤血管段。使用3%戊巴比妥钠按照体重30 mg/kg经腹腔注射麻醉。常规备皮、消毒、铺巾,沿颈部正中剪开皮肤,钝性分离筋膜、肌肉等皮下组织,暴露颈总动脉,及其颈内动脉和颈外动脉,长度约1.5 cm。颈内动脉血管近心端给予缝线穿过备用,远心端结扎,颈总动脉近心段予以血管夹夹闭,用虹膜剪在颈内动脉正中剪“V”型切口,直视下将插入0.014英寸(大约0.355 6 mm)引导导丝的1.25×6 mm美敦力球囊送入大鼠颈总动脉约1 cm,压力泵给予4 kPa压力,缓慢回拉球囊至切口处,再次将球囊送至原处,重复上述过程5次后,制作大鼠颈总动脉球囊损伤模型。各干预组均给予涂有干预成分的球囊于损伤处以4 kPa保持10 min,结束后撤出球囊导管及导丝,结扎近心端颈内动脉并逐层缝合及碘伏消毒,普通饲料喂养。所有SD大鼠术后肌内注射青霉素40万U(2次/d,5 d)以预防感染,普通饲料喂养。
1.4 动物取材每组大鼠饲养48 h后随机取出7只用3%戊巴比妥钠经腹腔麻醉,延颈部正中切口逐层分离筋膜与组织,暴露颈总动脉血管,取出颈总动脉局部药物转运段血管,将其放入提前预冷并放置肝素水的培养皿中,用无齿镊小心轻压管腔,排出管腔内血液并去除管腔上残留的脂肪组织,用锡纸标记包好放入液氮罐中,48 h后转移至-80℃冰箱保存,用于提取总蛋白及总RNA。
1.5 组织病理形态检测术后4周处死大鼠,取转基因血管段制作病理标本,苏木精-伊红染色,光镜下观察各组内膜增生及血管管腔狭窄程度,采用Image-pro-plus 6.0软件进行图像分析,测量新生内膜面积(NIA)、中膜面积(MA),并计算新生内膜面积(NIA)/中膜面积(MA)面积比。
1.6 q-PCR检测大鼠颈总动脉miR-146a的表达采用Trizol试剂一步法提取SD大鼠颈总动脉RNA。采用两步法进行RT-qPCR反应,反转录反应:反应体系为RNA 2 μL、miR-146a茎环引物1 μL、5S茎环引物1 μL、Super Pure dNTP 2 μL,RNase-Free ddH2O 8.5 μL;5×First-Strand Buffer(含有DTT)4 μL;RNasin 0.5 μL;反应条件为42℃50 min,95℃5 min。PCR反应:反应体系为:2×SuperReal PreMix Plus 10 μL、上游引物0.6 μL、下游引物0.6 μL、cDNA模板2 μL、50×ROX Reference Dye 1 μL、RNase-Free ddH2O 5.8 μL;反应条件:95℃15 min,循环1次;95℃10 s,58℃30 s 72℃32 s,循环40次。miR-146a茎环引物、上下游引物、内参5S等均由上海捷瑞公司设计与合成。结果采用△△Ct值法进行相对定量分析。
1.7 Western blot检测PCNA、NFκBp56蛋白的表达取各实验组损伤处转基因段血管,严格按照组织提取试剂盒操作步骤提取总蛋白,应用BCA蛋白检测试剂盒进行蛋白浓度测定,应用Western blot法检测各组血管PCNA、NFκBp56蛋白的表达情况。利用Image J图像分析系统对Western blot结果进行灰度分析。
1.8 统计学方法应用Graphpad Prism 5软件进行统计学分析,计量资料以均数±标准差(x-±s)表示,样本的统计效能>0.8,计量资料满足正态性及方差齐性,应用单因素方差分析(ANOVA),两两组间比较采用q检验,以P<0.05为差异有统计学意义。
2 结果
2.1 病理形态学改变大鼠颈总动脉采用HE染色,光镜下观察,见图1:除未损伤组(图1A)外,所有实验组均呈现不同程度的内膜增生及血管管腔狭窄,中膜未见明显变化;单纯损伤组(图1B)、PLL组(图1C)、 AMO-miR-146a组(图1D)内膜增生明显,血管管腔明显狭窄,高倍镜下可见增生的内膜主要由平滑肌细胞和胶原纤维构成,平滑肌排列紊乱,形态不一(见图1b、1c、1d);P/M=3:1组(图1E)、P/M=5:1组(图1F)也可见到新生内膜增生,但内膜增生及管腔狭窄程度较单纯球伤组、PLL组、AMO-miR-146a组明显减轻。
2.2 各组新生血管的内膜面积、中膜面积及内中膜面积比较与单纯损伤组比较,PLL组、AMO-miR-146a组新生内膜面积差异无统计学意义(P>0.05),P/M=3:1组、P/M=5:1组新生内膜面积显著减少,差异有统计学意义(P˂0.05),而P/M=3:1组、P/M= 5:1组组间比较差异无统计学意义(P>0.05);各组中膜面积差异无统计学意义(P=0.756);与单纯损伤组相比,PLL组、AMO-miR-146a组新生内膜/中膜面积比(I/M)差异无统计学意义(P>0.05),P/M=3:1组、P/M= 5:1组新生内膜/中膜面积比(I/M)显著减少,差异有统计学意义(P˂0.05),而P/M=3:1组、P/M=5:1组组间比较差异无统计学意义(P>0.05),见表1。

图1 各组光镜下颈总动脉病理形态学改变(HE染色)注:A,未损伤组;B,单纯损伤组;C,PLL组;D,AMO-miR-146a组;E,P/M=3:1组;F,P/M=5:1组(均×100)。a、b、c、d、e、f为相应的高倍镜视野(×400)。

表1 各组新生血管内膜面积、中膜面积及内中膜面积的比较(n=3,x-±s)
2.3 q-PCR法检测球囊损伤后颈总动脉miR-146a的表达与未损伤组比较,大鼠颈总动脉经球囊损伤48 h后,miR-146a的表达显著升高,差异有统计学意义(P˂0.001);单纯损伤组、PLL组、AMO-miR-146a组miR146a的表达差异无统计学意义(P>0.05),表明裸PLL或AMO-miR-146a都不能影响颈总动脉血管平滑肌细胞miR-146a的表达;P/M=3:1与P/M=5:1组较单纯损伤组、PLL组、AMO-miR-146a组的miR-146a的表达明显减少,差异有统计学意义(P ˂0.001),表明MPC30-DEA70/AMO-miR-146a基因复合物借助PLL的粘附作用,可以成功转染颈总动脉的血管平滑肌细胞,降低miR-146a的表达,见图2。

图2 各组颈总动脉miR-146a的表达情况注:1,未损伤组,2,单纯损伤组;3,PLL组;4,AMO-miR-146a组;5,P/M=3:1组;6,P/M=5:1组;与未损伤组比较,aP˂0.001;与单纯损伤组比较,bP˂0.001。
2.4 Western blot法检测球囊损伤后血管壁PCNA与NFκBp56的表达与未损伤组比较,其余各组PCNA与NFκBp56蛋白的表达均明显升高,差异有统计学意义(P˂0.05),其中PLL载两种不同复合物P/M=3:1与P/M= 5:1组蛋白表达量升高程度低于单纯损伤组、PLL组、AMO-miR-146a组,差异有统计学意义(P˂0.05);P/M= 3:1与P/M=5:1组组间比较差异无统计学意义(P>0.05);单纯损伤组、PLL组、裸AMO-miR-146a组间比较差异无统计学意义(P>0.05),见图3。
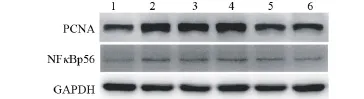
图3 各组PCNA、NFкBp56蛋白的表达注:1,未损伤组;2,单纯损伤组;3,PLL组;4,AMO-miR-146a组;5,P/M=3:1组;6,P/M=5:1组。
3 讨论
micro-RNAs(mi-RNAs)是一种内源性的、高度保守的、单链非编码小分子单链RNA,通过降解mRNA或抑制mRNA的翻译水平,从而调控靶基因表达[7-8]。MiR-146是第一个被发现在免疫系统中具有调节作用的miRNA,在固有免疫和炎症反应中发挥着重要作用,参与了自身免疫性疾病、脓毒血症、肿瘤等多种疾病的发展[9-10]。在球囊损伤再狭窄的动物模型中也发现miR-146a的表达水平显著上调[5]。熊玮等[6]证实了通过基因沉默技术,在血管平滑肌细胞中转入AMO-miR-146a基因,能够减少miR-146a的表达,进一步使NFκBp65、PCNA的表达量明显降低,血管平滑肌细胞增殖减少、凋亡增多。
随着基因治疗的发展和应用,借助基因载体,可将目的基因导入细胞或组织,抑制目的基因的表达,进一步产生特定的生物学效应。阳离子聚合物作为一类易于制备的新型非病毒类转基因载体,与脂质体及其他非病毒载体相比,具有结构稳定、性能易于调整、目的基因容量大、合成简便及良好的生物相容性等优点,成为当前基因载体研究方面的热点。实验组前期体外实验已证实新型阳离子磷酸胆碱聚合物MPC30-DEA70可以安全、有效地负载反义寡核苷酸进入VSMC内并发挥生物学功能[11]。
本研究以阳离子磷酸胆碱聚合物MPC30-DEA70作为转基因载体,利用多聚赖氨酸(PLL)涂层球囊将MPC30-DEA70/AMO-miR-146a基因复合物导入大鼠颈总动脉球囊损伤处。结果发现,球囊损伤后颈总动脉内膜增生明显,光镜下可见增生的内膜主要由平滑肌细胞和胶原纤维构成,但未见内膜损伤后的附壁血栓形成。可能的原因:首先,球囊损伤后,经过大鼠自身的凝血及纤容系统作用,4周后大鼠颈总动脉内膜损伤处形成的附壁血栓自行消失;其次,病理取材时,取出的颈总动脉,反复用预冷的肝素盐水冲洗,并用无齿镊小心轻压管腔,排出管腔内血液并去除管腔上残留的脂肪组织,可能会造成附壁血栓的消失。与未损伤组比较,球囊损伤后的各组大鼠颈总动脉均出现不同程度的管腔狭窄,新生内膜面积明显增加,miR-146a表达增加,同时NFκBp65和PCNA的蛋白表达水平也相应明显上升。而转染P/M=3:1和P/M= 5:1基因复合物治疗组血管管腔狭窄程度较其余各球囊损伤组有所减轻,新生内膜增生面积减少,miR-146a以及NFκBp65、PCNA的蛋白表达水平相对下降,证明AMO-miR-146a在无MPC30-DEA70的情况下几乎不能进人血管内膜发挥其作用,而在MPC30-DEA70转基因载体的作用下,利用PLL提高基因复合物在血管局部停留和转染时间,即可大量进入VSMC,通过反义作用与靶细胞内特异和互补的mRNA结合,通过某种信号通路,阻止NFκBp65和PCNA蛋白的表达,抑制VSMC增殖,从而缓解颈总动脉的狭窄程度。
经皮冠状动脉支架植入术是治疗冠心病重要的手段之一,但晚期支架内血栓形成、内膜增生的发生率仍然较高[4]。通过药物球囊与基因沉默技术相结合,以阳离子磷酸胆碱聚合物MPC30-DEA70作为转基因载体,利用MPC30-DEA70负载AMO-miR-146a,借助PLL的黏附作用,将MPC30-DEA70/AMO-miRNA-146a基因复合物导入VSMC,有效抑制miR-146a基因表达和VSMC增殖,防止血管狭窄,为一些支架置入患者防止术后再狭窄提供有益的治疗措施。
[1]Murray CJ,Lopez AD.Mortality by cause for eight regions of the world:Global Burden of Disease Study[J].Lancet,1997,349(9061):1269-1276.
[2]Serruys PW,de Jaegere P,Kiemeneij F,et al.A comparison of balloon-expandable-stent implantation with balloon angioplasty in patients with coronary artery disease.Benestent Study Group[J].N Engl J Med,1994,331(8):489-495.
[3]Mach F.Toward new therapeutic strategies against neointimal formation in restenosis[J].Arterioscler Thromb Vasc Biol,2000,20(7):1699-1700.
[4]张明逸,张福先,张欢,等.局部用药防治周围动脉腔内成形术后再狭窄应用进展[J].中华外科杂志,2015,53(3):237-240.
[5]Ji R,Cheng Y,Yue J,et al.MicroRNA expression signature and antisense-mediated depletion reveal an essential role of MicroRNA in vascular neointimal lesion formation[J].Circ Res,2007,100(11):1579-1588.
[6]熊玮,董少红,袁建辉,等.微小RNA-146a影响血管平滑肌细胞增殖和凋亡的机制[J].中国组织工程研究,2012,16(20):3715-3719.
[7]Bartel DP.MicroRNAs:genomics,biogenesis,mechanism,and function[J].Cell,2004,116(2):281-297.
[8]Ha M,Kim VN.Regulation of microRNA biogenesis[J].Nat Rev Mol Cell Biol,2014,15(8):509-524.
[9]Lu LF,Boldin MP,Chaudhry A,et al.Function of miR-146a in controlling Treg cell-mediated regulation of Th1 responses[J].Cell, 2010,142(6):914-929.
[10]Li Y,Vandenboom TG,2nd,Wang Z,et al.miR-146a suppresses invasion of pancreatic cancer cells[J].Cancer Res,2010,70(4):1486-1495.
[11]冯辉.磷酸胆碱聚合物载反义c-myc寡核苷酸对兔髂动脉球囊损伤后血管狭窄的影响[D].徐州:徐州医学院,2013.
EffectsofAMO-miR-146acarriedbycationicphosphorylcholinepolymerMPC30-DEA70onrats' neointimal hyperplasia after common arteria carotis balloon.
LI Zhi,LU Yuan,FENG Hui,ZHANG Min,ZHANG Zhuo-qi,WANG Zhi-rong,YANG Yu,XU Wu.
Department of Cardiology,the Affiliated Hospital of Xuzhou Medical University,Xuzhou 221000,Jiangsu,CHINA
ObjectiveTo investigate the influence of the delivery of phosphorylcholine copolymer MPC30-DEA70 carrying antisense mediated oligonucleotide miR-146a gene into vascular smooth muscle cells(VSMC) on the degree of neointimal hyperplasia after balloon injury in rats.MethodsA total of 60 rats were randomly divided into six groups as follows:no-injury group,pure balloon injury group,polylysine(PLL)group,AMO-miR-146a group, PLL-carrier P/M=3:1 group and P/M=5:1 group,with 10 rats in each group.The morphological changes of common carotid arteries in rats after 4 weeks were observed by optical microscope.q-PCR method was used to detect the expression of miR-146a,and Western blot was adopted to detect the expression of proliferating cell nuclear antigen protein(PCNA)and NFκBp65.ResultsExcept for the no-injury group,the other experimental groups showed varying degrees of neointimal hyperplasia and vascular stenosis with HE staining,but the medial area had no significant change.Compared with the pure balloon injury group,the polylysine group and AMO-miR-146a group had no significant difference in new neointima area (P>0.05);P/M=3:1 group and P/M=5:1 group were reduced significantly(P˂0.05),but there was no significant difference between P/M=3:1 group and P/M=5:1 group(P>0.05).The detection of q-PCR and Western blot methods showed the expressions of miR-146a and the protein expression contents of PCNA and NFκBp56 in the PLL-carrier P/M=3:1 and P/M= 5:1 groups were significant higher than those in the no-injury groups(P˂0.05),but significantly lower than those in the pure balloon injury group,polylysine(PLL)group,andAMO-miR-146a group(P˂0.05).There was no significant difference be-tween P/M=3:1 group and P/M=5:1 group in the expression of miR-146a,PCNA,NFκBp56(P>0.05).There was also no significant difference among pure balloon injury group,polylysine group and AMO-miR-146a group on the expressions of miR-146a,PCNA and NFκBp56(P>0.05).ConclusionMPC30-DEA70 can be integrated with the AMO-miR-146a and get into VSMC with the help of PLL to effectively inhibit the expression of vascular miRNA-146a after the balloon injury,which can make PCNA and NFκBp56 down-regulation and prevent the neointimal proliferation and the hemadostenosis.
MPC30-DEA70;AMO-miR-146a;miR-146a;Hemadostenosis;Gene carrier
R-332
A
1003—6350(2017)11—1724—04
2017-02-25)
10.3969/j.issn.1003-6350.2017.11.002
徐晤。E-mail:xzxuwu@163.com

