射频止血系统在肝切除术中的应用(附65例报告)
陈琳 董水林 陈姚 王陈维 陈义发 陈孝平
·论 著·(临床实践)
射频止血系统在肝切除术中的应用(附65例报告)
陈琳 董水林 陈姚 王陈维 陈义发 陈孝平
目的 介绍一种新的射频止血系统在肝切除术中的应用情况并评估其安全性及有效性。方法 2015年6月至2016年6月间11例病人单独使用射频止血系统行肝切除术,54例病例采用射频止血系统与其他肝切除设备[超声刀、双极电凝钳和超声吸引刀(cavitron ultrasonic surgical aspirator,CUSA)]配合使用行肝切除术。使用射频止血系统解剖第一肝门、离断肝周韧带,使用其他切肝设备离断肝脏实质,肝断面出血点采用射频止血系统止血。结果 11例单独使用射频止血切肝的病人中,有9例没有行肝脏血流阻断,1例左半肝切除病人预先结扎患侧入肝血流,1例左半肝切除术中行陈氏肝血流阻断(第一肝门阻断联合肝下下腔静脉阻断);中位出血量为150 ml(30~300 ml),中位手术时间为200 min(90~250 min)。射频止血系统配合使用其他切肝设备54例病例中:腹腔镜肝切除术33例,开腹手术21例;33例未采用任何血流阻断方法(59.3%),第一肝门联合下腔静脉阻断3例,第一肝门阻断5例,10例半肝切除及3例扩大左半肝切除均预先处理患侧血管;54例中有1例活体肝移植供肝手术未采用任何血流阻断技术;腹腔镜手术无中转开腹;中位出血量为230 ml(50~500 ml),中位手术时间为240 min(90~360 min)。所有病例均未输血,均恢复顺利,无严重术后并发症,无围手术期死亡。结论 在肝切除术中使用射频止血系统可减少术中出血量,避免肝血流阻断带来的缺血再灌注损伤,操作简单,值得推广。
肝切除; 肝血流阻断技术; 射频止血系统
肝切除是治疗肝脏肿瘤疾病最有效的方法[1-2]。控制术中出血是肝切除术中必须解决的首要问题。各种肝血流阻断技术可适用于不同部位的肝切除术,达到控制出血的目的[3-6]。但血流阻断技术均有以下缺点:①血流阻断有时间限制,特别是在肝硬化病人,过长的血流阻断会导致严重的缺血再灌注损伤,甚至导致术后肝衰竭[7-8];②部分血流阻断技术如全肝血流阻断、半肝血流阻断操作复杂,对手术者技术有较高要求,有损伤重要血管的可能[4]。肝脏手术器械的发展,使不阻断或缩短肝脏血流阻断时间成为可能[9]。本文我们报道了一种基于射频止血系统的肝切除方法,并对其应用效果进行分析。
资料与方法
一、一般资料
2015年6月至2016年6月,我们单独使用射频止血系统为11例病人行肝切除术。其中男性8例,女性3例;年龄30~65岁,平均50岁;HBsAg(+)8例;肝硬化病人9例,其中轻度肝硬化4例,中度肝硬化5例;病人术前肝功能Child-Pugh分级均为A级。疾病构成:肝细胞癌8例,肿瘤最大直径4~15 cm;胆管细胞癌1例,肿瘤最大直径9 cm;肝血管瘤1例,肿瘤最大直径8.5 cm;肝内胆管结石1例。
同期,射频止血系统与其他切肝设备配合使用54例[超声刀40例,双极电凝钳8例,超声吸引刀(cavitron ultrasonic surgical aspirator,CUSA) 6例],其中男性46例,女性8例;年龄25~70岁,平均53岁;HBsAg(+)50例;肝硬化病人49例,其中轻度肝硬化21例,中度肝硬化28例;病人术前肝功能Child-Pugh分级均为A级。疾病构成:肝细胞癌46例,肝海绵状血管瘤4例,胆管细胞癌3例,活体肝移植供肝切除1例。
二、手术方法
1.单独使用射频止血系统行肝切除 右上腹肋缘下斜切口,必要时切口向左侧延长,呈“/”形。根据肿瘤部位选择肝切除方式,并离断相应肝脏韧带,游离肝脏。血流阻断:除左外叶切除外,其他病例均在右肾静脉上方解剖肝下下腔静脉,并绕置阻断带;如行左半肝切除或右半肝切除,首先肝外解剖出患侧肝动脉及门静脉分支,结扎并切断。使用射频止血系统(美敦力公司aquamantase系统)离断肝实质。具体方法:根据病灶部位及术中超声定位确定预切除线,实用剪刀或电刀切开预切除线部位肝脏包膜。将射频止血系统的电极插入肝脏实质,短时间内肝实质固化变色,轻轻向前推移电极即可钝性分离凝固变性之肝实质,较为坚韧的管道系统如门静脉、肝动脉、肝静脉和胆管分支可以保留(图1)。小于3 mm的静脉血管可直接凝固封闭,较大的管道如门静脉、肝动脉以及胆管分支可使用钛夹夹闭后切断(图2)。遇到较大血管如肝静脉主干及门静脉左右分支主干,可使用射频止血系统沿血管壁分离肝实质而不损伤血管,待解剖结构完全显露后,再决定是否结扎切断或保留。沿血管壁固化离断肝实质过程中需注意电极不要接触血管壁,以免导致出血。如离断肝实质过程中出血较多可视情况行陈氏阻断法。肝断面少量出血点缝扎止血,不需采用褥式缝合压迫肝脏断面。
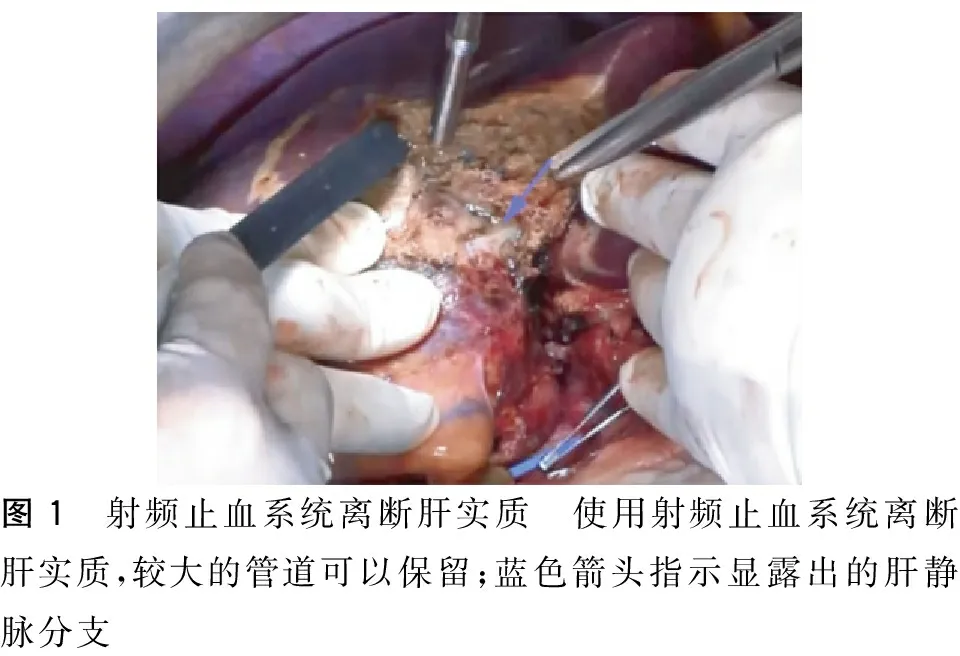
图1 射频止血系统离断肝实质 使用射频止血系统离断肝实质,较大的管道可以保留;蓝色箭头指示显露出的肝静脉分支

图2 钛夹夹闭肝静脉分支 钛夹夹闭显露出的血管,白色箭头标记已使用钛夹夹闭并切断后的血管
2.射频止血系统与其他肝切除设备配合使用 射频止血系统主要应用于:①肝十二指肠韧带静脉侧支丰富、肝周曲张血管较多时第一肝门的解剖和肝脏游离;②肝断面处理。射频止血系统直接接触曲张血管及周围组织,可使曲张静脉及周围结缔组织热变性,封闭血管,然后直接剪刀或电刀离断。一旦显露出胆管或门静脉、肝动脉轮廓,将射频止血系统电极沿管道壁纵行游离,周边结缔组织受热后自然收缩,显露管道侧壁。术中注意不要使电极直接接触管道壁,以免热损伤。超声刀及双极电凝钳断肝时,肝窦直径较小的血管出血可使用射频止血系统直接凝固封闭;与CUSA联用时,CUSA首先将肝实质粉碎,残留直径小于5 mm血管均可使用射频止血系统凝固封闭后切断。
结 果
单独使用射频止血系统行肝切除11例病例中:Ⅰ段切除1例,Ⅶ段切除1例,左外叶(Ⅱ、Ⅲ段)切除1例,左半肝切除(Ⅱ、Ⅲ、Ⅳ段)2例,Ⅴ、Ⅵ、Ⅶ段切除1例,Ⅳ、Ⅴ、Ⅷ段切除1例,Ⅴ、Ⅷ段切除4例。其中9例(81.8%)未采用任何肝血流阻断技术,1例左半肝切除术病人预先结扎患侧的入肝血流,1例左半肝切除术中使用第一肝门阻断联合肝下下腔静脉阻断。中位出血量为150 ml(30~300 ml),中位手术时间为200 min(90~250 min),所有病例均未输血。
射频止血系统配合使用其他切肝设备54例病例中:腹腔镜肝切除术33例,开腹手术21例;局部肝切除10例,肝段切除21例,联合肝段切除(<3个肝段)9例,左半肝切除6例,右半肝切除5例,扩大左半肝3例。33例未采用任何血流阻断方法(59.3%),第一肝门联合下腔静脉阻断3例,第一肝门阻断5例,6例左半肝切除、4例右半肝切除及3例扩大左半肝切除均预先处理患侧血管。1例活体肝移植供肝手术未采用任何血流阻断技术。腹腔镜手术无中转开腹;中位出血量为230 ml(50~500 ml),中位手术时间为240 min(90~360 min)。所有病例均未输血。
所有的病人康复顺利,术后3~5 d拔除腹腔引流管,术后5~7 d肝功能恢复正常,10~14 d出院,无手术并发症。无围手术期死亡。
讨 论
控制术中出血是肝切除需要解决的重要问题。20世纪初Pringle技术的提出,极大促进了肝脏外科的发展[10]。随后陆续发展出患侧入肝血流阻断[11]、全肝血流阻断[12]等肝脏血流控制方法,显著减少了术中出血。但其弊端是:①血流阻断会引起血流动力学不稳定,增加潜在的手术风险;②反复长时间血流阻断会引起肝脏的缺血再灌注损伤,影响肝功能的恢复[13];③缺血再灌注引发的炎症反应可能促进肿瘤的生长和复发[14],造成肠道上皮损伤,导致一系列并发症[15]。随着技术进步,肝脏血流阻断的范围逐渐缩小,阻断时间逐渐缩短。CUSA可以乳化粉碎柔软的肝实质,仅保留较为坚韧的胆管和血管,经钛夹夹闭或结扎后切断,可实现真正意义上的无血肝切除。但是其离断肝实质的速度较慢,显著延长手术时间。超声刀可以封闭3 mm以下的管道,但对肝实质渗血效果不佳,对硬化的肝脏止血效果更差。双极电凝钳可以封闭较大管道,减少创面渗血,但肝组织容易形成焦痂,黏附于器械,影响止血效果;电凝深度不可控,易造成不必要的热损伤。我们新近使用的射频止血系统,可以在钝性离断肝实质的同时封闭直径5 mm以下的管道,自动供水冷却系统避免了焦痂的产生,同时可控制热传导深度,避免医源性热损害。可显著减少术中出血,在很多情况下不需要阻断肝脏血流,同时显著缩短手术时间,降低术后并发症的发生。在断肝过程中,肝窦和小的管道均被封闭,不需后续处理,肝实质内解剖出较大的管道如肝段的肝蒂分支和肝静脉的主要分支,予以结扎切断,实现类似于CUSA的无血肝切除,但手术时间大大缩短。在1例预行右半肝切除的病例手术过程中,我们使用射频止血设备,直接离断肝实质,直至右侧肝蒂,并将其从肝实质中解剖出来,在此过程中发现解剖变异,肝脏Ⅳ段血供部分来自门静脉右前支(图3),为保留足够的肝脏体积,术中决定保留门静脉右前支及肝Ⅷ段,切除肝Ⅴ、Ⅵ、Ⅶ段(图4)。

图3 肝内解剖重要管道 紧贴门静脉右前支分离肝实质,完全显露肝内重要管道,发现左内叶血供部分来自门静脉右前支;白色箭头指示门静脉右前支,蓝色箭头指示供应左内叶的门静脉右前支分支
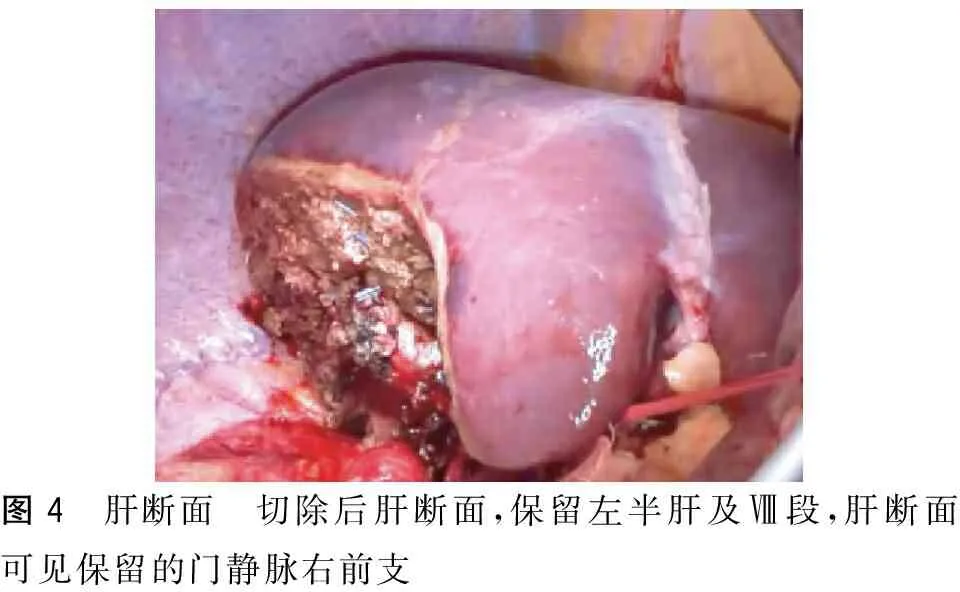
图4 肝断面 切除后肝断面,保留左半肝及Ⅷ段,肝断面可见保留的门静脉右前支
由于射频止血系统没有咬合结构,离断肝实质是通过使肝实质热变性后钝性分离,因而对于硬化肝脏效果不佳。为解决这一问题,我们将射频止血系统与其他切肝设备配合使用:离断肝实质采取超声刀、双极电凝钳、CUSA等设备,处理肝断面渗血、小血管出血则采用射频止血系统,如静脉曲张严重,第一肝门解剖及肝脏游离困难,也可采用射频止血系统。
射频止血系统在腹腔镜肝切除中具有较大优势:腹腔镜肝切除术中肝断面的止血是一大难题,即使是小血管出血,也会导致视野不清,缝合止血困难。射频止血系统的止血功能则可以很好地克服这一难题,我们腹腔镜肝切除术中采用超声刀与射频止血配合使用,无一例因发生出血而导致中转开腹。
综上所述,应用射频止血系统行肝切除,具有以下优点:①减少肝切除过程中的出血,特别是肝窦和小血管的渗血,减少肝脏血流阻断时间,甚至实现不阻断肝脏血流的无血肝切除;②断肝过程中视野清晰,在封闭肝窦和小血管渗血的同时保留重要管道,避免损伤重要结构;③缩短整体手术时间,减少缺血再灌注损伤,降低并发症的发生率。它从总体上降低肝脏手术难度,有利于肝脏手术在各级医院广泛开展。
1 陈孝平,杨甲梅,沈锋,等.原发性肝癌外科治疗方法的选择(2004年第一次修订).腹部外科,2004,27:254-255.DOI:10.3760/j.issn:0253-3766.2005.04.020.
2 陈孝平,张志伟.《肝细胞癌外科治疗方法的选择专家共识》解读.中华外科杂志,2017,55:7-10.DOI:10.3760/cma.j.issn.0529-5815.2017.01.003.
3 窦磊,刘洪亮,赵亚杰,等.个体化的“分步”血流阻断法在巨大肝癌切除术中的应用研究.腹部外科,2015,28:85-89.DOI:10.3969/j.issn.1003-5591.2015.02.005.
4 Chen XP,Qiu FZ.A simple technique ligating the corresponding inflow and outflow vessels during anatomical left hepatectomy.Langenbecks Arch Surg,2008;393:227-230.DOI:10.1007/s00423-007-0224-z.
5 Zhu P,Lau WY,Chen YF,et al.Randomized clinical trial comparing infrahepatic inferior vena cava clamping with low central venous pressure in complex liver resections involving the Pringle manoeuvre.Br J Surg,2012,99:781-788.DOI:10.1002/bjs.8714.
6 Chen XP,Zhang ZW,Zhang BX,et al.Modified technique of hepatic vascular exclusion:effect on blood loss during complex mesohepatectomy in hepatocellular carcinoma patients with cirrhosis.Langenbecks Arch Surg,2006,391:209-215.DOI:10.1007/s00423-006-0043-7.
7 Meguro M,Mizuguchi T,Kawamoto M,et al.Highest intraoperative lactate level could predict postoperative infectious complications after hepatectomy,reflecting the Pringle maneuver especially in chronic liver disease.J Hepatobiliary Pancreat Sci,2014,1:489-498.DOI:10.1002/jhbp.87.
8 Boyko VV,Pisetska ME,Tyshchenko OM,et al.Role of ischemic preconditioning in hepatic ischemia-reperfusion injury.Hepatobiliary Surg Nutr,2014,3:179-184.DOI:10.3978/j.issn.2304-3881.2014.06.03.
9 Maurer CA,Walensi M,Kaser SA,et al.Liver resections can be performed safely without Pringle maneuver:A prospective study.World J Hepatol,2016,8:1038-1046.DOI:10.4254/wjh.v8.i24.1038.
10Pringle JH.Notes on the arrest of hepatic hemorrhage due to trauma.Ann Surg,1908,48:541-549.DOI:10.1097/00000658-190810000-00005.
11D'Amico FE,Allen PJ,Eaton AA,et al.Vascular inflow control during hemi-hepatectomy:a comparison between intrahepatic pedicle ligation and extrahepatic vascular ligation.HPB (Oxford),2013,15:449-456.DOI:10.1111/j.1477-2574.2012.00618.x.
12Govil S.Central hepatic resection under hypothermic total vascular exclusion using ante-situm techniques while maintaining liver blood supply.Hepatogastroenterology,2014,61:1350-1352.DOI:10.5754/hge13149.
13Scatton O,Zalinski S,Jegou D,et al.Randomized clinical trial of ischaemic preconditioning in major liver resection with intermittent Pringle manoeuvre.Br J Surg,2011,98:1236-1243.DOI:10.1002/bjs.
14Hamaguchi Y,Mori A,Fujimoto Y,et al.Longer warm ischemia can accelerate tumor growth through the induction of HIF-1α and the IL-6-JAK-STAT3 signaling pathway in a rat hepatocellular carcinoma model.J Hepatobiliary Pancreat Sci,2016,23:771-779.DOI:10.1002/jhbp.406.
15Dello SA,Reisinger KW,van Dam RM,et al.Total intermittent pringle maneuver during liver resection can induce intestinal epithelial cell damage and endotoxemia.Plos One,2012,7:339-339.DOI:10.1371/journal.pone.0030539.
Clinical application of radiofrequency hemostatic system in liver resection
ChenLin,DongShuilin,ChenYao,WangChenwei,ChenYifa,ChenXiaoping.
HepaticSurgeryCentre,TongjiHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430030,China
Correspondingauthor:ChenXiaoping,Email:chenxp@medmail.com.cn
Objective We aimed to introduce a new method of liver resection using radiofrequency hemostatic system and evaluate the clinical safety and efficacy.Methods From June 2015 to June 2016,11 patients underwent anatomical hepatectomy using radiofrequency hemostatic system.Fifty-four patients were subjected to hepatectomy using radiofrequency hemostatic system in combination with other equipments (harmonic scalpel,BiClamp and CUSA).Results In patients using radiofrequency hemostatic system only,9 of 11 cases underwent hepatectomy without blood inflow occlusion.Hemihepatic blood flow occlusion was performed on 1 patient who was given left hemihepatectomy.Chen's occlusion method (Pringle maneuver combined within frahepatic inferior vena cava clamping) was performed on 1 patient.The median volume of intraoperative bleeding was 150 mL (30-300 mL),and the median of operative time was 200 min (90-250 min).For patients using radiofrequency hemostatic system plus other equipment,33 cases
hepatectomy without any blood inflow occlusion,3 cases Chen’s occlusion method and 5 cases Pringle maneuver.In 10 cases receiving hemihepatectomy and 3 cases extended hemiheatectomy,the corresponding inflow vessels were pre-ligated.One case of donor hepatectomy was not given any blood control technique.All cases recovered in two weeks without perioperative mortality and serious complication.The median of intraoperative blood loss was 230 mL (50-500 mL),and the median of operative time was 240 min (90-360 min).Conclusions The new method of liver resection using radiofrequency hemostatic system could minimize intraoperative bleeding,and avoid the ischemia-reperfusion injury caused by hepatic blood flow occlusion.This approach has bright prospects for clinical application in hepatic surgery.
Liver resection; Hepatic blood occlusion; Radiofrequency hemostatic system
“十二五”国家科技重大专项项目(2012ZX10002016-004);国家自然科学基金青年基金资助项目(81400653)
430030 武汉,华中科技大学同济医学院附属同济医院肝脏外科中心
陈孝平,Email:chenxp@medmail.com.cn
R657.3
A
10.3969/j.issn.1003-5591.2017.03.011
2016-12-12)

