大血藤原花色素抗氧化活性及酶抑制活性研究
李 彦, 李 鑫, 刘景玲, 邓凯航, 梁宗锁,2*
(1.西北农林科技大学 生命科学学院,陕西 杨凌 712100;2.浙江理工大学 生命科学学院,浙江 杭州 310018)
大血藤原花色素抗氧化活性及酶抑制活性研究
李 彦1, 李 鑫1, 刘景玲1, 邓凯航1, 梁宗锁1,2*
(1.西北农林科技大学 生命科学学院,陕西 杨凌 712100;2.浙江理工大学 生命科学学院,浙江 杭州 310018)

LI Yan
用70%乙醇从大血藤中提取原花色素,并对粗提物进行纯化和分离,采用香草醛-盐酸比色法测定各样品中原花色素含量,并测定各样品抗氧化活性和酶抑制活性。结果表明:大血藤乙醇粗提物(CE)、石油醚萃取物(PE)、乙酸乙酯与水两相不溶物(EIF)、乙酸乙酯萃取物(EF)、正丁醇萃取物(BF)和水相留余物(WR)中含原花色素分别为(36.03±0.40)%、(1.19±0.11)%、(57.99±0.22)%、(32.40±0.07)%、(25.03±0.08)%和(41.32±0.37)%。大血藤乙醇粗提物经葡聚糖凝胶LH-20 纯化后,含原花色素(98.35±0.72)%,约为粗提物的2.73倍;大血藤纯化物(PT)对二苯基苦基肼自由基(DPPH·)的半数抑制质量浓度(IC50)为(70.70±1.38) mg/L,是L-抗坏血酸的1.12倍;对α-葡萄糖苷酶的IC50为(4.37±0.17) mg/L是阿卡波糖的120.71倍。说明大血藤含有丰富的原花色素,大血藤原花色素具有较强的体外抗氧化活性和酶抑制活性。
原花色素;DPPH自由基清除活性;糖苷酶抑制活性;胆碱酯酶抑制活性
中药大血藤,为木通科植物大血藤属大血藤(Sargentodoxacuneata(Oliv) Rehd. et Wils.)干燥藤茎,具有淸热解毒、活血通经及祛风除湿等功效[1]。现代药理研究表明,大血藤提取物具有抗过敏[2]、抗氧化[3]、抗肿瘤[4]、保护心血管系统[5]及抗骨质疏松[6]等作用。原花色素是指从植物分离得到的一切无色的,在热酸处理下能产生花色素的物质,由不同数量的儿茶素和表儿茶素组成,具有广泛而强烈的生物活性[7]。研究表明:原花色素可通过抑制α-葡萄糖苷酶[8-9],α-淀粉酶[9-12]和蛋白酪氨酸磷酸酶1B(PTP1B)[13]等起到抗糖尿病的作用;通过抑制乙酰胆碱酯酶(AchE),丁酰胆碱酯酶(BuchE),β-淀粉样前体蛋白裂解酶1 (BACE1)[13],抑制β淀粉样肽自我聚集[14],提高突触可塑性[15],及改善大脑血流,提高血浆还原能力[16]等发挥抗阿尔茨海默病作用。袁贤达[17]、陈智仙等[18]和田瑛等[19]从大血藤干燥藤茎分离得到(-)-表儿茶素;毛水春[20]从正丁醇萃取物分离得到(-)-表儿茶素、原花色素B2、原花色素五聚体,其中原花色素B2 对小鼠乳腺癌(tsFTZ10)细胞和K562 细胞表现出显著的细胞周期抑制活性(G2/M期),原花色素五聚体对小鼠乳腺癌细胞表现出显著的周期抑制作用;李钧敏等[21]发现大血藤饮片抑菌活性与其总鞣质含量密切相关,而关于大血藤原花色素对糖苷酶和胆碱酯酶的抑制活性罕见报道。本研究用70%乙醇提取大血藤中的原花色素,并对粗提物采用不同极性溶剂萃取,以香草醛-盐酸比色法测定不同萃取部位原花色素含量,对各样品抗氧化活性和酶抑制活性进行测定;对比不同溶剂萃取物以及粗提物纯化前后大血藤原花色素和生物活性之间的相关性,以期为大血藤原花色素作为降糖药物和预防阿尔茨海默病提供参考数据。
1 实 验
1.1 材料、试剂与仪器
大血藤于2015年11月13日采自湖北宜昌,经西北农林科技大学生命科学学院梁宗锁教授鉴定为木通科大血藤属植物大血藤(Sargentodoxacuneata(Oliv) Rehd. et Wils.)。取新鲜茎藤,除去枝叶,切片阴干,粉碎后于 -20 ℃ 保存备用。
葡萄籽原花色素标准品(纯度95%),购于上海源叶生物科技有限公司; 1,1-二苯基-2-三硝基苯肼(DPPH)、α-葡萄糖苷酶(来源于酿酒酵母)、α-淀粉酶(来源于猪胰腺)、乙酰胆碱酯酶(AchE,来源于电鳗)、丁酰胆碱酯酶(BuchE,来源于马血清)、阿卡波糖、 4-氨基-1,2,3,4-四氢吖啶盐酸盐水合物(他克林)、L-抗坏血酸(Vc)、香草醛,对硝基苯酚-α-D-葡萄糖吡喃苷(p-NPG)、 2-氯-4-硝基苯-α-半乳糖-麦芽二糖苷(Gal-G2-α-CNP)、 5,5′-二硫代双(2-硝基苯甲酸)(DTNB),均购于美国Sigma-Aldrich公司;葡聚糖凝胶(Sephadex)LH-20,购于美国通用电气公司;乙腈,色谱纯;其余试剂均为国产分析纯,水为实验室自制一级水。
UV-1700紫外-可见分光光度计,日本岛津;SpectraMax M2多功能读板机,美国Molecular Devices公司;SB25-12DTD超声波清洗机,宁波新芝生物科技股份有限公司;RE-52AA旋转蒸发器;SHB-III循环水式多用真空泵;高效液相色谱仪(1525双元泵,Waters 2487 DAD检测器),色谱柱为XBridge®C18(4.6 mm×250 mm,5 μm),Waters中国有限公司。
1.2 原花色素的提取与分离
取大血藤粗粉1.2 kg,加入30 L 的70%乙醇,超声波辅助提取3 次,每次30 min,提取物减压浓缩后冻干,得到大血藤粗提物(CE)391.70 g。
从粗提取物中称取160 g,以少量水进行超声波分散处理,依次以适量石油醚、乙酸乙酯及正丁醇充分萃取,得到大血藤石油醚萃取物(PE)0.86 g,乙酸乙酯与水两相不溶物(EIF)25.86 g,乙酸乙酯萃取物(EF)18.62 g,正丁醇萃取物(BF)38.67 g及水相留余物(WR)65.04 g。其中EIF为乙酸乙酯萃取过程中存在于相界面,既不溶于乙酸乙酯相,又不溶于水相的膏状物质。
1.3 大血藤原花色素的纯化
[22]方法对大血藤原花色素粗提物进行纯化。取Sephadex LH-20,以50%甲醇充分溶胀,装柱(30 mm×450 mm),以1 000 mL的50%甲醇平衡柱床,取3 g经石油醚充分脱脂后的粗提物,以50%甲醇溶解后上样,先后以1 000 mL的50%甲醇和1 000 mL的70%丙酮洗脱,收集70%丙酮洗脱物,减压浓缩,冻干,获得大血藤纯化物(PT)1.10 g。得率(y)的计算公式如下:
(1)
式中:m1—提取或萃取后的样品质量,g;m2—提取或萃取前的样品干基质量(其中CE的得率是以大血藤原料的干基为基数,各萃取物均以CE为基数),g。
1.4 原花色素含量测定
1.4.1 标准溶液的配制 准确称取葡萄籽原花色素标准品,以甲醇溶解,配制成质量浓度为 10 g/L 的标准溶液,依次稀释至0、0.3、0.6、0.9、1.2、1.5和1.8 g/L。
1.4.2 回归方程的建立 大血藤原花色素含量测定使用改良的香草醛-盐酸法[23]。取10 g/L香草醛甲醇溶液和1 mol/L盐酸甲醇溶液,按体积比1 ∶1充分混匀即得香草醛-盐酸显色液。
取3 mL香草醛-盐酸显色液,分别加入100 μL标准溶液,混匀,室温下反应30 min,以甲醇调零,测定500 nm波长处吸光度(A500),绘制标准曲线。得到A500(Y)和葡萄籽原花色素标准品浓度(X)回归方程如下:Y=0.375X+0.008 5(R2=0.999 6)。
1.4.3 大血藤各萃取物中原花色素的测定 分别取各样品(粗提物、各萃取物,以70%乙醇作溶剂,配制10 g/L,再以甲醇稀释至待测浓度,下同)溶液100 μL,按前述方法测定并根据回归方程可计算得到大血藤各萃取物中原花色素质量分数(w),计算公式如下:
(2)
式中:m1—粗提物及各萃取物质量,g;m—原花色素质量,g。
1.5 提取物的体外抗氧化活性测定
1.5.1 DPPH自由基清除活性 DPPH自由基(DPPH·) 以甲醇溶解,配制成100 μmol/L工作液。各样品以甲醇溶解,稀释成0、25、50、100、200、400和800 mg/L待测溶液。取3 mL工作液,分别加入100 μL 待测溶液,混匀,室温下避光反应30 min,以甲醇调零,测定517 nm波长处吸光度(A517)[24],按式(3)计算DPPH·清除率(YDPPH·)。
(3)
式中:A0—空白溶液(0 mg/L)与工作液反应后的A517值;Ai—样品与工作液反应后的A517值。
以VC作对照,按照前述方法测定清除率,各样品对DPPH·清除活性以对DPPH·的半数抑制质量浓度(IC50)表示。
1.5.2 铁离子还原能力(FRAP) 分别配制300 mmol/L醋酸钠-醋酸缓冲液(pH值3.6),10 mmol/L 的2,4,6-三吡啶基三嗪(TPTZ)溶液(溶剂为40 mmol/L盐酸溶液)及20 mmol/L三氯化铁溶液,临用时将3者按体积比10 ∶1 ∶1充分混匀,配制成FRAP工作液。各样品以甲醇溶解,稀释成0、25、50、100和200 mg/L待测溶液。取3 mL工作液,分别加入100 μL待测溶液混匀,室温下反应30 min,以蒸馏水调零,测定593 nm波长处吸光度(A593)值[25]。以VC作对照,按照前述方法测定A593,各样品的FRAP值以样品所需要的VC的量(mg/g)来表示。
1.6 提取物的酶抑制活性测定
1.6.1 糖苷酶抑制活性
1.6.1.1α-淀粉酶α-淀粉酶以50 mmol/L的NaH2PO4-Na2HPO4缓冲液溶解(pH值6.86,含 6.7 mmol/L 的氯化钠),配制成1 250 U/L酶液;底物Gal-G2-α-CNP以缓冲液溶解,配制成5 mmol/L溶液;各样品以少量10% 二甲亚砜(DMSO)溶解,以缓冲液稀释成质量浓度为0、16、32、48、64、80、96、112、128、144和160 mg/L待测溶液。向96 孔酶标板中依次加入50 μL缓冲液、50 μL酶液以及50 μL待测溶液,混匀,37 ℃孵育10 min,迅速加入50 μL底物溶液,立即用SpectraMax M2 多功能读板机记录15 min内各孔405 nm波长处吸光度的增量[26],按式(4)计算α-淀粉酶抑制率(Yα-淀粉酶)。
(4)
式中: ΔA0—空白溶液(0 mg/L)孔的A405增量; ΔAi—各样品孔的A405增量。
各样品抑制活性以对α-淀粉酶的IC50表示。以阿卡波糖作对照,阿卡波糖质量浓度分别为0、0.2、0.4、1、2、3、4和10 mg/L。
1.6.1.2α-葡萄糖苷酶α-葡萄糖苷酶以100 mmol/L的NaH2PO4-Na2HPO4缓冲液溶解(pH值6.86),稀释成100 U/L酶液;底物p-NPG以缓冲液溶解,配制成5 mmol/L溶液;各样品以少量10% DMSO溶解,以缓冲液稀释成0、8、16、24、32、40、48、56、64、72和80 mg/L待测溶液。向96 孔酶标板中依次加入50 μL缓冲液、50 μL酶液以及50 μL待测溶液,混匀,37 ℃孵育10 min,迅速加入50 μL底物溶液,立即用SpectraMax M2 多功能读板机记录15 min内各孔405 nm处的吸光度的增量[27],按式(5)计算α-葡萄糖苷酶抑制率(Yα-葡萄糖苷酶)。
(5)
各样品抑制活性以对α-葡萄糖苷酶的IC50表示。以阿卡波糖作对照,阿卡波糖质量浓度分别为0、18.75、37.5、75、150、300、600、1 200和2 400 mg/L。
1.6.2 胆碱酯酶抑制活性 AchE和BuchE均以50 mmol/L的NaH2PO4-Na2HPO4缓冲液溶解(pH值8.0),配制成120 U/L酶液,底物碘代硫代乙酰胆碱以缓冲液溶解,配制成12 mmol/L溶液;各样品以少量10% DMSO溶解,以缓冲液稀释成质量浓度为0、40、120、160、200、240、280、320、360和400 mg/L溶液;DTNB以缓冲液溶解,配制成200 μmol/L溶液。向96 孔酶标板中依次加入50 μL DTNB、50 μL酶液以及50 μL待测溶液,混匀,37 ℃孵育10 min,迅速加入50 μL底物溶液,立即用SpectraMax M2 多功能读板机记录15 min内各孔412 nm处的吸光度的增量[28],按式(6)计算抑制率(Y)。
(6)
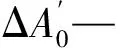
各样品抑制活性以对胆碱酯酶的IC50值表示。以他克林作对照,AchE中他克林质量浓度为0、1.95、3.90、7.81、15.63、31.25、62.50、125、250、500、1 000和2 000 μg/L;BuchE中他克林质量浓度为0、0.08、0.16、0.31、0.63、1.25、2.5、5、10、20、40和80 μg/L。
1.7 数据处理
2 结果与讨论

表1 各样品得率及原花色素含量
1)CE:粗提取物crude extract; PE:石油醚萃取物petroleum ether fraction;EIF:乙酸乙酯与水两相不溶物ethyl acetate insoluble fraction;EF:乙酸乙酯萃取物ethyl acetate fraction; BF:正丁醇萃取物n-butanol fraction; WR:水相留余物water residue; PT:纯化物purification,下同the same as in followings
2.1 大血藤各样品得率和原花色素含量
原花色素属于多酚类,选用50%~100%甲醇、乙醇或丙酮溶液对植物组织的原花色素具有较好的提取效果[22]。本实验从经济、安全的角度考虑,利用70%乙醇溶液超声波辅助提取3 次,粗提物中含原花色素约为36.03%,高于猕猴桃果皮[22]、葡萄籽[9]、龙眼果皮[10]以及人心果[11],表明大血藤含有丰富的原花色素。使用萃取剂对粗提物按照极性从低到高的顺序,依次萃取,对不同萃取部位的得率及原花色素含量测定结果见表1。由表1数据可知,石油醚萃取物(PE)的得率及含原花色素较低,其余部位得率和含量均较高,且各部位含量存在显著差异,利用Sephadex LH-20对粗提物纯化,纯化后原花色素质量分数可达(98.35±0.72)%,约为粗提物的2.73倍。
以乙腈和水为流动相,梯度洗脱,乙腈浓度(φ)5%(0 min),10%(4 min),15%(8 min),35%(30 min),70%(38 min),80%(50 min);流速1 mL/min;进样量20 μL;检测波长280 nm;各样品(以甲醇配制1 g/L的溶液)的HPLC结果如图1所示。大血藤粗提物(CE)、乙酸乙酯与水两相不溶物(EIF)、水相留余物(WR)、正丁醇萃取物(BF)、大血藤纯化物(PT)有明显的“包峰”(保留时间22~32 min之间),表明其中可能含有大分子物质[29]。

图1 大血藤粗提物、纯化物及不同萃取物的HPLC图谱(280 nm)
2.2 大血藤各样品的抗氧化活性
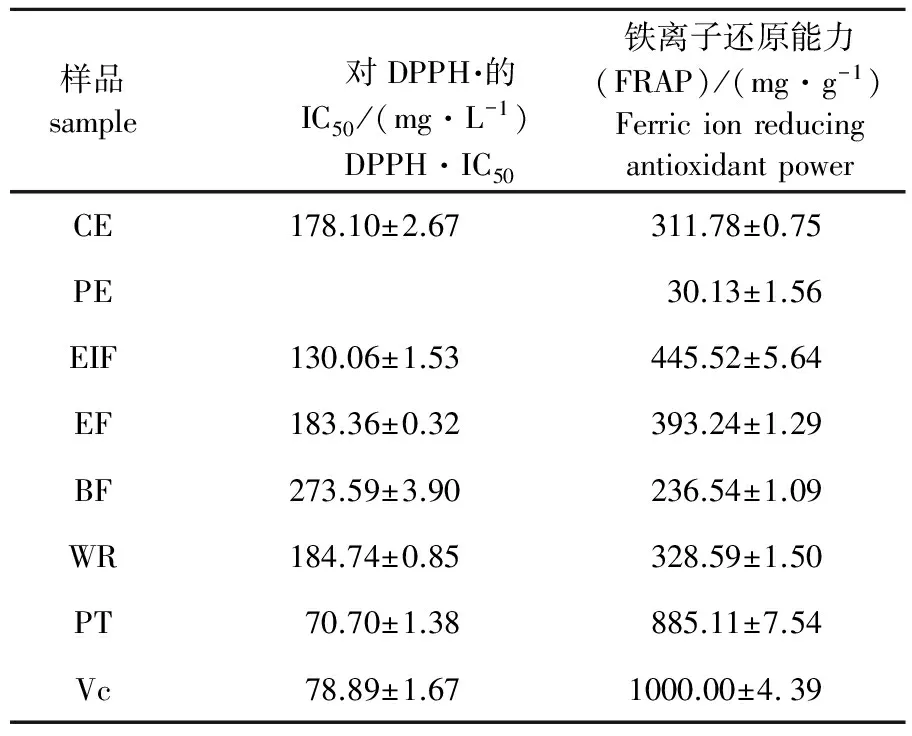
表2 大血藤粗提取物及不同萃取部位抗氧化活性
各样品清除DPPH·活性以对DPPH·的IC50表示,IC50越小,活性越强;样品铁还原离子能力FRAP值越大,活性越强。PE因抗氧化活性太低,未能测出对DPPH·的IC50。各样品清除DPPH·能力和铁离子还原能力的结果相似,具体见表2。各样品清除DPPH·活性从强到弱依次为PT>Vc>EIF>EF>WR>CE>BF>PE;铁离子还原能力从强到弱依次为PT>EIF>EF>WR>CE>BF>PE。说明大血藤中原花色素含量越高,抗氧化活性越强,其中纯化物的DPPH·清除活性(IC50=(70.70±1.38) mg/L) 高于对照样VC,约为粗提物(IC50=(178.10±2.67) mg/L) 的2.52倍,纯化物的铁离子还原能力((885.11±7.54) mg/g)是粗提物((311.78±0.75) mg/g) 的2.84倍。
2.3 大血藤各样品的酶抑制活性
2.3.1 糖苷酶抑制活性α-淀粉酶和α-葡萄糖苷酶可将进入消化道的碳水化合物水解成可被小肠吸收的单糖而被生物体利用。糖苷酶抑制剂通过抑制α-淀粉酶和α-葡萄糖苷酶活性,延缓碳水化合物消化和吸收,从而减低餐后血糖水平,减少糖尿病并发症的发生[8-12]。本实验条件下,各样品和阿卡波糖对α-淀粉酶抑制活性从强到弱依次为阿卡波糖>PT>EIF>WR>CE>BF>EF>PE;对α-葡萄糖苷酶抑制活性从强到弱依次为PT>EIF>WR>CE>BF>EF>PE>阿卡波糖。PE对两种糖苷酶抑制活性明显弱于其余样品,可能是PE原花色素含量太低,对糖苷酶抑制活性较差;EF原花色素含量虽高于BF,但抑制活性却显著弱于BF,原因可能是EF原花色素主要为单体及低聚体,对酶抑制能力弱于原花色素高聚体[22],结果如图2所示。

图2 大血藤粗提取物及不同萃取部位的糖苷酶抑制活性
阿卡波糖是临床常用口服降糖药,通过抑制肠道内糖苷酶水解、吸收达到降低餐后血糖的作用,但阿卡波糖可能导致肠道功能紊乱、肝损害、淋巴细胞性大肠炎等不良反应,一些植物源糖苷酶抑制剂具有高活性、低毒性特点,具有较大的开发利用前景[8]。由表3可知,大血藤粗提取物及其萃取物对α-葡萄糖苷酶抑制活性高于阿卡波糖,纯化物(IC50(4.37mg/L±0.17)mg/L)抑制活性为阿卡波糖(IC50(527.51±19.97)mg/L)的120.71倍;大血藤粗提取物及其各种萃取物对α-淀粉酶抑制活性均弱于阿卡波糖;大血藤原花色素含量越高,糖苷酶抑制活性越明显,其中纯化物对α-淀粉酶和α-葡萄糖甘酶的抑制活性IC50分别为(11.07±0.40)mg/L和(4.37±0.17)mg/L抑制活性分别为粗提取物的2.89倍和1.94倍。
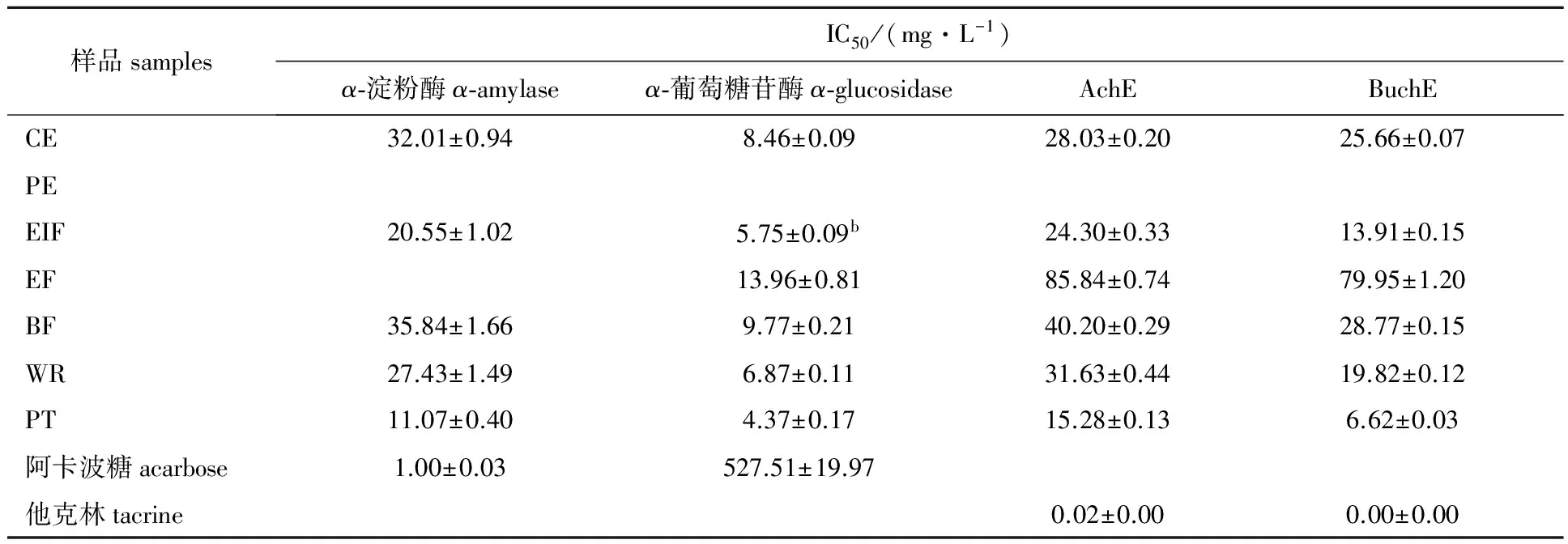
表3 大血藤粗提取物及不同萃取部位对4种酶的IC50
2.3.2 胆碱酯酶抑制活性 AchE抑制剂是临床治疗阿尔茨海默症的首选药物,研究表明BuchE抑制剂或者AchE和BuchE双重抑制剂对阿尔茨海默症具有更好的疗效和更低的毒副作用[13]。本实验条件下,各样品对AchE抑制活性具有显著性差异,从强到弱依次为他克林>PT>EIF>CE>WR>BF>EF>PE;对BuchE抑制活性从强到弱依次为他克林>PT>EIF>WR>CE>BF>EF>PE。和糖苷酶抑制活性相近似,PE和EF对两种胆碱酯酶抑制活性明显弱于其他样品,结果如图3所示。
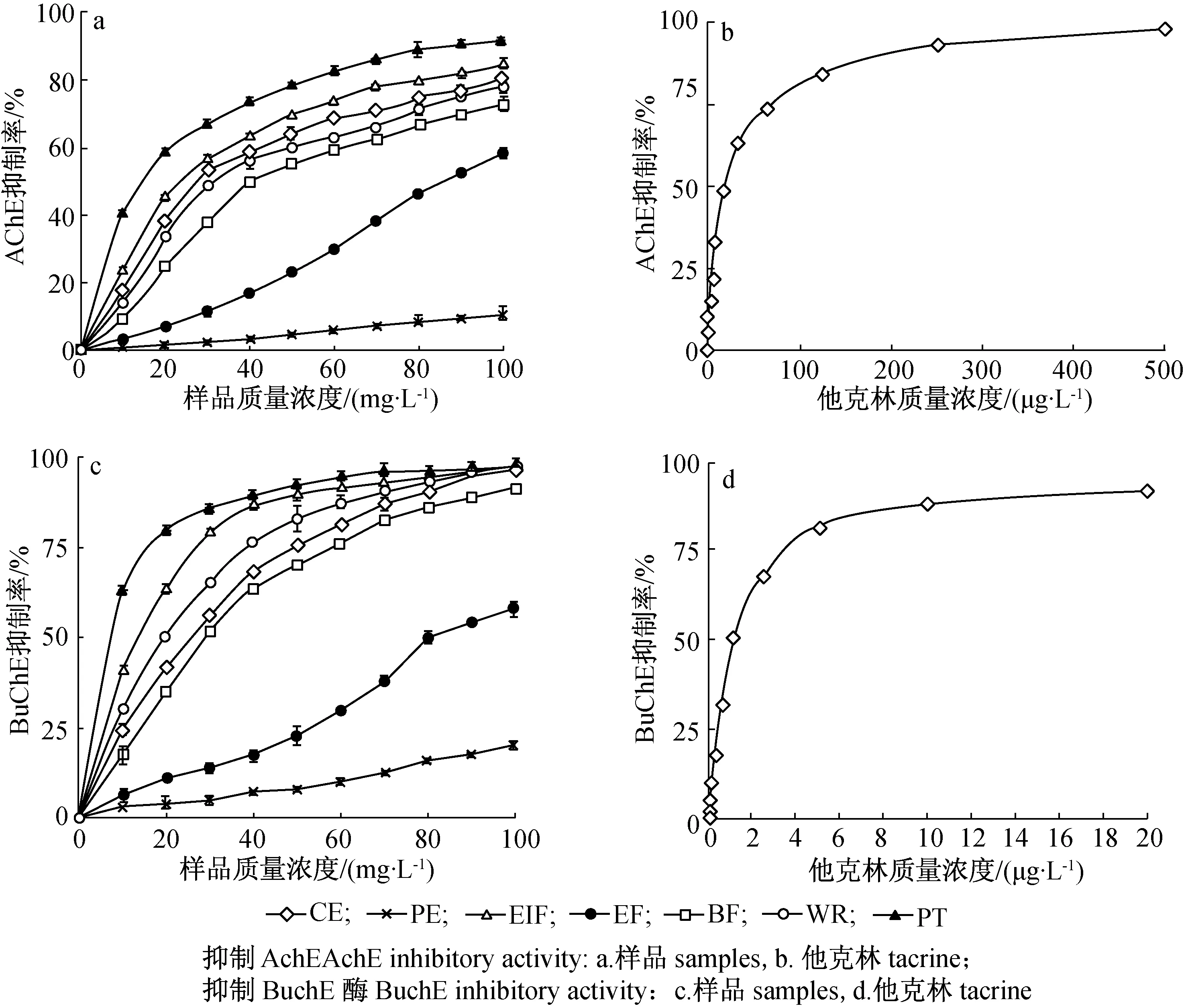
图3 大血藤粗提取物及不同萃取部位胆碱酯酶抑制活性
目前美国食品药品监督管理局(FDA)批准用于临床的5种治疗阿尔茨海默症药物主要有4种都是胆碱酯酶抑制剂,中国国家食品药品监督管理局(SDFA)批准用于治疗轻至中度阿尔茨海默症的石杉碱甲也属于胆碱酯酶抑制剂。这些药物虽然有效,但具有较大外周副作用,并且长期服用疗效不理想,如他克林具有肝毒性,可引起严重的消化道不良反应[13-15]。虽然抑制活性弱于他克林,但大血藤粗提取物及各萃取物可在较低浓度下抑制AchE和BuchE活性,属于AchE和BuchE的双重抑制剂,且对相同浓度的BuchE抑制活性强于AchE,结果如表3所示。大血藤原花色素含量越高,胆碱酯酶抑制活性越明显,其中纯化物对乙酰胆碱酯酶和丁酰胆碱酯酶抑制活性(IC50分别为(15.28±0.13)和(6.62±0.03) mg/L)分别为粗提取物的1.83倍和3.88倍。
2.4 大血藤原花色素与生物活性之间的相关性
为进一步探究大血藤原花色素与生物活性之间的相关性,本实验以Pearson相关系数衡量不同指标之间的相关性。由表4数据可以看出大血藤原花色素含量与DPPH·的IC50、α-葡萄糖苷酶的IC50和AchE的IC50都呈显著负相关(p<0.05),与α-淀粉酶的IC50和BuchE的IC50都呈极显著负相关(p<0.01),与FRAP值呈极显著正相关(p<0.01)。
抗氧化活性和酶抑制活性指标间均呈现不同程度的相关性。说明大血藤原花色素含量升高,DPPH·清除活性和铁离子还原能力增强,糖苷酶抑制活性和胆碱酯酶抑制活性也进一步提高。

表4 样品原花色素含量与生物活性的相关性
3 结 论
3.1 大血藤粗粉经70%乙醇超声波提取后得到粗提物,依次采用适量不同极性溶剂萃取得到石油醚萃取物(PE)、乙酸乙酯萃取物(EF)、乙酸乙酯与水两相不溶物(EIF)、正丁醇萃取物(BF)和水相留余物(WR),将大血藤粗提物经石油醚脱脂后再采用Sephadex LH-20进行纯化得到纯化物(PT)。采用改良的香草醛-盐酸比色法测定各样品中的原花色素质量分数,其中纯化物(98.35±0.72)%最高,乙酸乙酯与水两相不溶物部位(57.99±0.22)%次之,石油醚部位(1.19±0.11)%最低。
3.2 不同样品抗氧化活性差异显著,总体表现为原花色素含量越高,抗氧化活性越强,其中纯化物的DPPH·清除活性(IC50=(70.70±1.38) mg/L)高于L-抗坏血酸(IC50=(78.89±1.67) mg/L),约为粗提取物的2.52倍,铁离子还原能力(885.11±7.54 mg/g)约为粗提取物的2.84倍。
3.3 不同样品对酶抑制活性差异显著,表现为原花色素含量越高,酶抑制活性越强。纯化物对α-淀粉酶(IC50=(11.07±0.40) mg/L),α-葡萄糖苷酶(IC50=(4.37±0.17) mg/L),乙酰胆碱酯酶(IC50=(15.28±0.13) mg/L)和丁酰胆碱酯酶(IC50=(6.62±0.03) mg/L)抑制活性分别是粗提取物的2.89倍,1.94倍,1.83倍和3.88倍。
3.4 相关性分析表明原花色素含量与大血藤抗氧化,抑制酶活性呈现显著相关性,说明原花色素可能是大血藤发挥抗氧化活性和酶抑制活性的主要成分。本研究可为利用大血藤原花色素制备具有抗氧化、降糖及预防老年痴呆等药物提供参考。
参考文献:
[1]国家药典委员会.中华人民共和国药典:一部[M].2015年版.北京:中国医药科技出版社,2015:194. Chinese Pharmacopoeia Commission. Pharmacopoeia of China: 1 st section[M].Beijing:China Medical Science and Technology Press, 2015:194.
[2]WANG Q H, KUANG H X, SU Y, et al. Naturally derived anti-inflammatory compounds from Chinese medicinal plants[J]. Journal of Ethnopharmacology, 2013, 146(1): 9-39.
[3]KRISHNAIAH D, SARBATLY R, NITHYANANDAM R. A review of the antioxidant potential of medicinal plant species[J]. Food and Bioproducts Processing, 2011, 89(3): 217-233.
[4]ZENG X B, WANG H, GONG Z Q, et al. Antimicrobial and cytotoxic phenolics and phenolic glycosides fromSargentodoxacuneata[J]. Fitoterapia, 2015, 101: 153-161.
[5]SHAYGANNI E, BAHMANI M, ASGARY S, et al. Inflammaging and cardiovascular disease: Management by medicinal plants[J]. Phytomedicine, 2016, 23(1): 1119-1126.
[6]陈丽珍,周英,黄俊飞,等.大血藤对破骨细胞活性及成骨细胞增殖分化作用的研究[J].中国中药杂志,2015,40(22):4463-4468. CHEN L Z, ZHOU Y, HUANG J F,et al. Research on effect ofSargentodoxaecaulison activity of osteoclasts and proliferation differentiation of osteoblasts.[J].China Journal of Chinese Materia Medica, 2015, 40(22):4463-4468.
[7]孙达旺.植物单宁化学[M].北京:中国林业出版社,1992. SUN D W. Plant Tannins Chemical[M].Beijing: China Forestry Publishing House,1992.
[8]SCHAFER A, HOGGER P. Oligomeric procyanidins of French maritime pine bark extract (Pycnogenol®) effectively inhibitα-glucosidase[J].Diabetes Research and Clinical Practice, 2007, 77(1):41-46.
[9]LAVELLI V, SRI HARSHA P S C, FERRANTI P, et al. Grape skin phenolics as inhibitors of mammalianα-glucosidase andα-amylase-effect of food matrix and processing on efficacy[J]. Food & Function, 2016, 7(3): 1655-1663.
[10]FU C L, YANG X N, LAI S J, et al. Structure, antioxidant andα-amylase inhibitory activities of longan pericarp proanthocyanidins[J]. Journal of Functional Foods, 2015, 14:23-32.
[11]WANG H Y, LIU T T, SONG L X, et al. Profiles andα-amylase inhibition activity of proanthocyanidins in unripeManilkarazapota(chiku)[J]. Journal of Agricultural and Food Chemistry, 2012, 60(12): 3098-3104.
[12]GONÇALVES R, MATEUS N, DE FREITAS V. Inhibition ofα-amylase activity by condensed tannins[J]. Food Chemistry, 2011, 125(2): 665-672.
[13]CHOI J S, BHAKTA H K, FUJII H, et al. Inhibitory evaluation of oligonol onα-glucosidase, protein tyrosine phosphatase 1B, cholinesterase, andβ-secretase 1 related to diabetes and Alzheimer′s disease[J]. Archives of pharmacal research, 2016, 39(3): 409-420.
[14]WANG Y J, THOMAS P, ZHONG J H, et al. Consumption of grape seed extract prevents amyloid-βdeposition and attenuates inflammation in brain of an Alzheimer′s disease mouse[J]. Neurotoxicity Research, 2009, 15(1):3-14.
[15]WANG J, FERRUZZI M G, HO L, et al. Brain-targeted proanthocyanidin metabolites for Alzheimer’s disease treatment[J]. Journal of Neuroscience, 2012, 32(15): 5144-5150.
[16]FERRUZZI M G, LOBO J K, JANLE E M, et al. Bioavailability of gallic acid and catechins from grape seed polyphenol extract is improved by repeated dosing in rats: Implications for treatment in Alzheimer’s disease[J]. Journal of Alzheimers Disease, 2009, 18(1): 113-124.
[17]袁贤达.大血藤化学成分研究[D].北京:中国中医科学院中药研究所硕士学位论文,2013. YUAN X D. Study on the chemical ingredients inSargentodoxacuneata[D].Beijing: Master Degree Thesis of Chinese Materia Medica China Academy of Chinese Medical Science, 2013.
[18]陈智仙,高文远,刘岱琳,等.大血藤的化学成分研究[J].中草药,2010,41(6):867-870. CHEN Z X, GAO W Y, LIU D L,et al. Study on the chemical ingredients inSargentodoxacuneata[J].Chinese Traditional and Herbal Drugs,2010,41(6):867-870.
[19]田瑛,张慧娟,屠爱萍,等.中药大血藤的酚性化合物[J].药学学报,2005,40(7):628-631. TIAN Y, ZHANG H J, TU A P, et al.Phenolics from traditional Chinese medicineSargentodoxacuneata[J].Acta Pharmaceutica Sinica, 2005,40(7):628-631.
[20]毛水春.中药大血藤Sargentodoxacuneata抗癌活性成分的分离与鉴定:化合物的结构研究[D].青岛:中国海洋大学博士学位论文,2003. MAO S C. Isolation and identification of the anticancer active constituents ofSargentodoxacuneata,A Chinese herb[D].Qingdao: Doctoral Dissertation of Ocean University of China,2003.
[21]李钧敏,金则新,陈彤,等.红藤饮片提取物抑菌活性与次生代谢产物含量的相关性[J].浙江大学报:医学版,2006,35(3):273-280. LI J M, JIN Z X, CHEN T, et al. Correlation of anti-bacterial activity with secondary metabolites content inSargentodoxaCuneatatables[J].Journal of Zhe Jiang University:Medical Sciences,2006,35(3):273-280.
[22]CHAI W M, SHI Y, FENG H L, et al. Structure characterization and anti-tyrosinase mechanism of polymeric proanthocyanidins fractionated from kiwifruit pericarp[J]. Journal of Agricultural and Food Chemistry, 2014, 62(27):6382-6389.
[23]SUN B, RICARDO-DA-SILVA J M, SPRANGER I. Critical factors of vanillin assay for catechins and proanthocyanidins[J] Journal of Agricultural and Food Chemistry, 1998, 46(10): 4267-4274.
[24]SHARMA O P, BHAT T K. DPPH antioxidant assay revisited[J]. Food Chemistry, 2009, 113(4): 1202-1205.
[25]BENZIE I F F, STRAIN J J. The ferric reducing ability of plasma (FRAP) as a measure of ‘antioxidant power’: The FRAP assay[J]. Analytical Biochemistry, 1996, 239(1): 70-76.
[26]YAMAGUCHI M, WAKASUGI J, SAKAKIMA J. Competitive and product inhibition-basedα-amylase activity analysis method[J]. Clinical Biochemistry, 2008, 41(4/5): 325-330.
[27]DONG H Q, LI M, ZHU F, et al. Inhibitory potential of trilobatin from lithocarpus polystachyus rehd againstα-glucosidase andα-amylase linked to type 2 diabetes[J]. Food Chemistry, 2012, 130(2): 261-266.
[28]ELLMAN G L, COURTNEY K D, JR ANDRES V, et al. A new and rapid colorimetric determination of acetylcholinesterase activity[J]. Biochemical Pharmacology, 1961, 7(2): 88-95.
[29]程悦,符影,王志宇,等.鸡血藤提取物中缩合鞣质的含量测定及其抗肿瘤活性初步研究[J].中山大学学报:自然科学版, 2011,50(2): 75-80. CHENG Y, FU Y, WANG Z Y, et al. Determination on the contents of condensed tannins inSpatholobussuberectusDunn. extracts and primary study on their anti-tumor activities[J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2011,50(2): 75-80.
Antioxidant Activity and Enzyme Inhibitory Activity of Proanthocyanidins fromSargentodoxacuneata(Oliv) Rehd. et Wils.
LI Yan1, LI Xin1, LIU Jingling1, DENG Kaihang1, LIANG Zongsuo1,2
(1.College of Life Sciences, Northwest A&F University, Yangling 712100, China; 2.College of Life Sciences, Zhejiang Sci-Tech University, Hangzhou 310018, China)
Proanthocyanidins were extracted fromSargentodoxacuneata(Oliv) Rehd. et Wils., and the crude extract was purified and isolated. The content of proanthocyanidins was determined by an improved vanillin-HCl colorimetric method. Meanwhile, the antioxidant activity and enzyme inhibitory activity of each sample were measured. The results showed that the contents of proanthocyanidins in the crude extract(CE), petroleum ether fraction(PE), ethyl acetate insoluble fraction(EIF), ethyl acetate fraction(EF),n-butanol fraction(BF) and water residue(WR) were (36.03±0.40)%, (1.19±0.11)%, (57.99±0.22)%, (32.40±0.07)%, (25.03±0.08)% and (41.32±0.37)%, respectively. Moreover, the proanthocyanidin content of the sample purified by Sephadex LH-20 was (98.35±0.72)%, which was 2.73 times of that of the crude extract. The DPPH free radical scavenging activity of the crude extract(IC50=178.10±2.67 mg/L) was 1.12 times of that ofL-ascorbic acid(IC50=78.89±1.67 mg/L); theα-glucosidase inhibitory activity of purified sample was 120.71 times of that of acarbose and the corresponding acetylcholine inhibitory activity was 1.14 times of that of tacrine. It showed that there were abundant proanthocyanidins inS.cuneataand the proanthocyanidins had an obvious antioxidant activity and enzyme inhibitory activityinvitro.
proanthocyanidins; DPPH free radical scavenging activity; glycosidase inhibitory activity; cholinesterase inhibitory activity
10.3969/j.issn.0253-2417.2017.03.010
2016- 10-18
“十二五”国家科技支撑计划项目(2015BAC01B03);陕西省科技攻关计划(2015SF243)
李 彦(1992— ),女,河南驻马店人,硕士生,主要从事植物资源开发与利用研究
*通讯作者:梁宗锁,博士生导师,研究领域为植物资源开发与利用;E-mail: liangzs@ms.iswc.ac.cn。
TQ35
A
0253-2417(2017)03- 0073-09
李彦,李鑫,刘景玲,等.大血藤原花色素抗氧化活性及酶抑制活性研究[J].林产化学与工业,2017,37(3):73-81.

