芸豆芽菜多酚对D-半乳糖致小鼠机体氧化及肾脏损伤的修复作用
王 颖,王欣卉,徐炳政,朱 磊,佐兆杭,刘淑婷,宫 雪(.黑龙江八一农垦大学食品学院,黑龙江 大庆 69;2.国家杂粮工程技术研究中心,黑龙江 大庆 69;.青岛琅琊台集团股份有限公司,山东 青岛 266400)
芸豆芽菜多酚对D-半乳糖致小鼠机体氧化及肾脏损伤的修复作用
王 颖1,2,王欣卉1,徐炳政3,朱 磊1,佐兆杭1,刘淑婷1,宫 雪1
(1.黑龙江八一农垦大学食品学院,黑龙江 大庆 163319;2.国家杂粮工程技术研究中心,黑龙江 大庆 163319;3.青岛琅琊台集团股份有限公司,山东 青岛 266400)
为探究芸豆芽菜多酚对D-半乳糖致小鼠机体氧化及肾脏损伤的修复作用,通过腹腔注射D-半乳糖溶液构建小鼠损伤模型,连续灌胃不同剂量(低、中、高分别为20、40、60 mg/(kg·d)芸豆芽菜多酚及抗坏血酸(VC)28 d后,测定小鼠体质量、肾脏脏器系数、血清谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活力、超氧化物歧化酶(superoxide dismutase,SOD)活力、丙二醛(malondialdehyde,MDA)、尿素氮(blood urea nitrogen,BUN)及血肌酐(creatinine,CR)含量,并取肾脏制作苏木精-伊红染色(hematoxylineosin staining,HE)病理学组织切片,观察小鼠肾脏损伤及灌胃给药后的恢复情况。结果发现,相较于模型对照组小鼠,除芸豆芽菜多酚低剂量组外,其他灌胃给药组小鼠体质量及肾脏系数均有所升高,但组间并无显著性差异(P>0.05);其他灌胃给药组小鼠血清GSH-Px活力显著上升(P<0.05),MDA含量显著下降(P<0.05);各灌胃给药组小鼠血清SOD活力均较模型对照组显著上升(P<0.05)。各灌胃给药组(除芸豆芽菜多酚低剂量组)小鼠肾脏功能指示指标BUN及CR含量均较模型对照组小鼠显著下降(P<0.05);肾脏HE病理学组织切片显示,模型对照组小鼠肾脏严重受损、肾小球及肾小球囊肿大并伴有间质渗血及炎性细胞浸润现象,灌胃给药后,各灌胃给药组小鼠肾脏肾小球及肾小球囊恢复正常形态,间质渗血及炎性细胞浸润现象减少。结合各灌胃给药组检测指标及HE病理学组织切片分析得知,芸豆芽菜多酚对小鼠机体氧化及肾脏损伤修复作用与剂量呈正相关。
芸豆芽菜多酚;D-半乳糖;氧化损伤;肾脏损伤;修复
随大气环境污染的日益加剧、化学药剂的滥用以及生活压力的不断加大,机体会在一定程度上产生氧化应激反应,产生如羟自由基(•OH)和超氧阴离子自由基(O2-•)在内的活性氧(reactive oxygen species,ROS)[1-5],此种状态下,过多的ROS会造成机体抗氧化功能失衡,机体无法抵御大量ROS的侵袭,最终出现细胞损伤,蛋白质、脂质以及DNA生物大分子生理功能丧失,炎症、衰老及机体脏器氧化损伤的现象[6-10]。
芸豆又名四季豆,含有丰富的营养物质和人体所必需的8 种氨基酸,并且芸豆中还含有较高含量的多酚类物质[11-12],以其生发出的芽菜多酚类物质的含量更是近芸豆的5倍,是植物来源中人们摄取酚类化合物的重要来源之一[13-14],植物来源的酚类化合物具有较高的抗氧化及抗癌活性,并可通过信号转导途径调控机体氧化酶基因表达[15-17]。芸豆芽菜中虽含有较高的多酚类化合物,但对其多酚类化合物抗氧化活性研究甚少,本实验通过D-半乳糖致小鼠氧化损伤的方式,探究芸豆芽菜多酚对D-半乳糖所致的氧化损伤小鼠的体内抗氧化和肾脏损伤的修复作用,旨在为芸豆芽菜多酚体内抗氧化及对肾脏损伤的修复作用提供参考。
1 材料与方法
1.1 动物、材料与试剂
SPF级昆明种鼠(雄性):SCXK-(吉)2011-0003,体质量(20±2)g,由长春生物制品研究所提供。
芸豆芽菜多酚由黑龙江八一农垦大学食品学院实验室制备。
抗坏血酸(VC)、D-半乳糖 上海源叶生物科技有限公司;二甲苯氨水、苏木精-伊红(hematoxylineosin staining,HE)染液 上海研臣实业有限公司;谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒南京建成生物工程研究所;尿素氮(blood urea nitrogen,BUN)试剂盒、血肌酐(creatinine,CR)试剂盒中生北控生物科技股份有限公司。
1.2 仪器与设备
YB-P50001型电子天平 北京长拓锐新科技发展有限公司;KD-P型摊片机、KD-BM型生物组织包埋机浙江省金华市科迪仪器设备有限公司;XD811F型快速生化分析仪 武汉三丰医疗设备有限公司;1805型切片机(石蜡)、CM1950型组织包埋机 德国Leica公司;CK40型光学显微镜 日本Olympus公司。
1.3 方法
1.3.1 动物分组与饲养
SPF级雄性昆明种鼠60 只,适应性饲养7 d后称体质量并随机分为正常对照组(NOR)、模型对照组(MOD)、阳性对照组(VC)和芸豆芽菜多酚低、中、高剂量组(DF-L、DF-M、DF-H),每组10 只。建模后实验小鼠食用标准饲料,自由饮水,并于专用塑料鼠笼饲养,无菌碎木屑每日更换,室温(22±2) ℃,每日光照12 h。
1.3.2 模型建立及给药
除正常对照组外,其余各组小鼠每日腹腔注射D-半乳糖生理盐水溶液120 mg/(kg•d)(以体质量计,下同),正常对照组注射等容量生理盐水,连续14 d。建模后实验期间,按表1剂量对各组小鼠进行灌胃给药,灌胃给药28 d。腹腔注射及灌胃给药剂量根据小鼠每日空腹体质量进行调整。

表1 实验给药剂量Table 1 Doses of drugs administrated
1.3.3 指标测定
实验期间,每日测量小鼠体质量并观察其形态特征变化,末次给药并禁食24 h后,摘除眼球取血分离血清,XD811F型快速生化分析仪测定小鼠血清中GSH-Px、SOD活力,MDA、BUN及CR含量,取小鼠肾脏称质量后,按照下式计算肾脏脏器系数,并制作HE病理学组织切片,用以观察小鼠肾脏损伤及芸豆芽菜多酚对小鼠肾脏损伤修复情况。

式中:m1为肾脏湿质量/g;m为小鼠体质量/g。
1.4 数据统计分析
数据采用±s表示,SAS 9.1统计学软件进行统计学分析(t检验),P<0.05有统计学意义,Excel软件绘制相关图表。
2 结果与分析
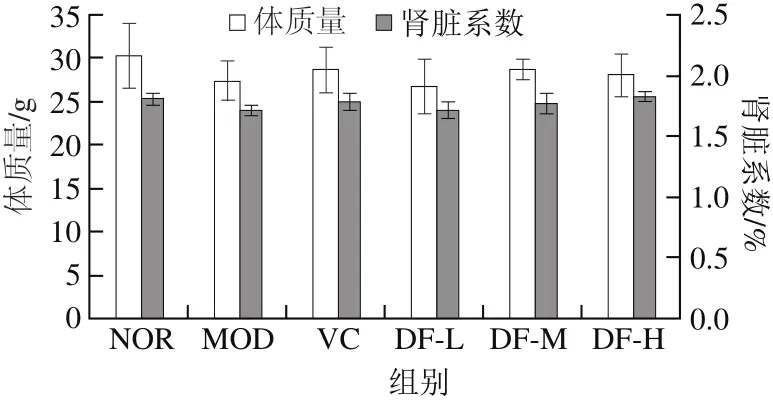
图1 芸豆芽菜多酚对小鼠体质量及肾脏系数的影响Fig. 1 Effect of kidney bean sprout polyphenols on body weight and kidney index in mice
2.1 芸豆芽菜多酚对小鼠体质量及肾脏系数的影响由图1可知,与正常对照组小鼠相比,模型对照组小鼠体质量及肾脏系数均有所下降,但未呈现显著性差异(P>0.05)。灌胃给药后,除芸豆芽菜多酚低剂量组外,阳性对照组及芸豆芽菜多酚中、高剂量组小鼠体质量及肾脏系数与模型对照组相比均有所升高,阳性对照组与芸豆芽菜多酚中剂量组结果相近,组间并无显著性差异(P>0.05)。
2.2 芸豆芽菜多酚对小鼠血清GSH-Px、SOD活力及MDA含量的影响

表2 实验动物血清GSH-Px、SOD活力及MDA含量Table 2 Effect of kidney bean sprout polyphenols on GSH-Px, SOD and MDA levels in serum of mice
由表2可知,腹腔注射D-半乳糖溶液造模后,相较于正常对照组小鼠,模型对照组小鼠血清GSH-Px与SOD活力显著下降(P<0.05),血清MDA含量显著上升(P<0.05)。经灌胃给药28 d后,除芸豆芽菜多酚低剂量组外,其他给药组小鼠血清GSH-Px活力较模型对照组显著上升(P<0.05),MDA含量显著下降(P<0.05);所有给药组血清SOD活力均显著上升(P<0.05)。灌胃给药组间,阳性对照组与芸豆芽菜多酚中、高剂量组无显著性差异(P>0.05);综合芸豆芽菜多酚低、中、高剂量组各组小鼠血清GSH-Px、SOD活力及MDA含量,芸豆芽菜多酚对小鼠血清GSH-Px、SOD活力及MDA含量的影响与剂量呈正相关。
2.3 芸豆芽菜多酚对小鼠血清BUN及CR含量的影响

图2 芸豆芽菜多酚对小鼠血清BUN、CR含量的影响Fig. 2 Effect of kidney bean sprout polyphenols on BUN and CR contents in serum of mice
血清中BUN和CR分别为含氮有机物和蛋白质代谢终末产物,由肾小球滤过透出,通常血清BUN、CR可作为诊断肾小球功能及肾脏器质性功能损害的指标,可充分反映肾脏功能的基本情况。由图2可知,与正常对照组小鼠比较,模型对照组小鼠血清BUN及CR含量显著上升(P<0.05),灌胃给药后,血清BUN指标除芸豆芽菜多酚低剂量组外,其他给药组均较模型对照组显著下降(P<0.05),其中阳性对照组与芸豆芽菜多酚高剂量组血清BUN含量无显著性差异(P>0.05);各灌胃给药组小鼠血清CR含量均较模型对照组小鼠显著下降(P<0.05),各给药组间无显著差异(P>0.05)。综合两项指标,芸豆芽菜多酚对肾脏损伤小鼠两项肾脏功能指示指标BUN及CR有显著的改善作用,且其改善效果与剂量呈正相关。
2.4 芸豆芽菜多酚对小鼠肾脏损伤的修复情况
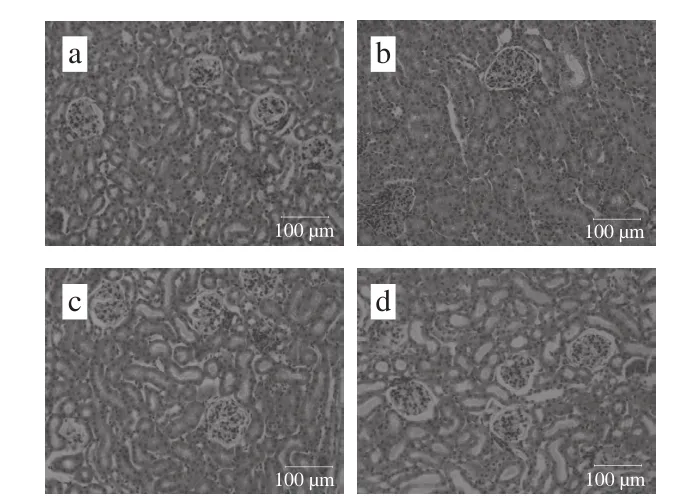

图3 实验小鼠肾脏组织病理学观察(×200)Fig. 3 Histopathological observations of kidney section (× 200)
各组小鼠肾脏组织病理学染色切片如图3所示,相较于正常对照组小鼠,模型对照组小鼠肾小球肿胀并伴有大量炎性细胞浸润现象,肾小球囊扩张变形,肾小管内玻璃样絮状物产生,间质血管出现扩张淤血现象。灌胃给药后,阳性对照组小鼠肾小球肿胀程度有所减轻,但间质血管间仍存在炎性细胞团块。芸豆芽菜多酚各剂量组小鼠肾脏切片显示肾小球均不同程度恢复其正常形态,肾小球囊扩张情况有所减轻,肾小管内絮状物减少,但芸豆芽菜多酚低、中剂量组小鼠肾脏仍有少量炎性细胞浸润现象。结果表明,芸豆芽菜多酚对小鼠肾脏肾小球肿胀及肾小管官腔内容物具有一定的修复及清除作用。
3 讨 论
本实验以抗氧化活性物质抗坏血酸(VC)做对照,通过腹腔注射D-半乳糖溶液构建氧化及肾脏损伤小鼠模型,探究了芸豆芽菜多酚对氧化损伤小鼠体内抗氧化及修复受损肾脏的作用。研究表明过量的D-半乳糖可参与机体代谢,在糖氧化酶催化作用下生成乙醛糖,并产生H2O2、O2-•,使机体活性氧含量骤增[18-19],ROS是极为活跃的离子基团,其可损伤蛋白质、核酸等生物大分子的生理功能[20];导致体内氧化酶中心结构的改变,从而使氧化酶失去其原有活性[21-22];造成脂质过氧化,破坏细胞膜的氧化还原性,导致物质运输代谢失衡,最终形成脂质过氧化终产物MDA[23-24],同时在醛糖还原酶的催化下过量的D-半乳糖会被还原成半乳糖醇,堆积在细胞内,影响细胞正常渗透压,使细胞水肿,最终导致细胞炎症或细胞凋亡[18]。实验结果表明,与正常对照组比较,D-半乳糖模型对照组小鼠血清抗氧化酶GSH-Px及SOD活力显著下降(P<0.05),MDA含量显著上升(P<0.05),肾脏功能指示指标BUN及CR含量显著上升(P<0.05),肾脏HE染色病理学切片显示,肾小球肿胀并伴有大量炎性细胞浸润现象,肾小球囊扩张变形,肾小管内玻璃样絮状物产生,间质血管出现扩张淤血现象。说明经造模后D-半乳糖对模型小鼠造成了一定的氧化及肾脏损伤。
灌胃给药后,与模型对照组小鼠比较,除芸豆芽菜多酚低剂量组外,其他各灌胃给药组小鼠体质量及肾脏系数均有所升高,但组间并无显著性差异(P>0.05);除芸豆芽菜多酚低剂量组外,其他灌胃给药组小鼠血清GSH-Px活力显著上升(P<0.05),MDA含量显著下降(P<0.05);各灌胃给药组小鼠血清SOD活力均较模型对照组显著上升(P<0.05)。各灌胃给药组小鼠,肾脏功能指示指标BUN(除芸豆芽菜多酚低剂量组)及CR含量均较模型对照组小鼠显著下降(P<0.05);肾脏HE病理学组织切片显示,各灌胃给药组小鼠肾脏肾小球及肾小球囊恢复正常形态,间质出血点及炎性细胞浸润现象减少,结合各灌胃给药组HE染色切片和其小鼠指标显示,芸豆芽菜多酚对于氧化及肾脏损伤小鼠血清GSH-Px活力、SOD活力、MDA、BUN及CR含量的改善效果及对受损肾脏的修复情况与剂量呈正相关。其原因可能为芸豆芽菜中含有的多酚类物质对D-半乳糖造模小鼠的氧化及肾脏损伤起到了一定的修复作用,并且其修复作用与剂量呈正相关。多酚是存在于植物中的一类次生代谢产物[25-26],研究表明,植物来源的多酚含有大量的酚羟基,其酚羟基中的临位酚羟基具有较高的生物活性极易被氧化,可提供单体氢(•H)从而对ROS有较强的捕捉能力,可有效地清除和淬灭活性氧[27],并且其可将单线态氧还原成活性较低的三线态,从而减少自由基的产生[28];•H可与不饱和脂肪酸和由过氧化游离基形成的氢氧化物结合,从而阻止脂肪酸形成新的ROS,并可阻断脂质过氧化的产生。Nrf2(NF-E2-related factor 2)是调节细胞氧化应激的重要的转录因子,在机体氧化应激条件的刺激下,Nrf2可转移入细胞核内,激活调控因子,使GSH-Px及SOD等氧化酶的基因表达,从而使机体内氧化酶含量增加,而多酚类物质可参与Nrf2激活氧化酶基因表达通路,提高Nrf2因子活性,从而可增强机体对氧化应激的抵抗能力[29-30]。
本实验中,芸豆芽菜多酚可提高氧化损伤小鼠体内抗氧化酶活性并降低脂质过氧化产物的产生,同时可修复受损的肾脏组织及细胞,显示了较为突出的体内抗氧化能力,并且芸豆芽菜多酚具有易提取,原材料丰富易得的优点,这将使芸豆芽菜多酚在体内抗氧化及修复机体脏器氧化损伤方面具有广阔的市场前景及应用价值。
[1] 晋乐飞, 冯斐斐, 吴卫东. 大气细颗粒污染物对呼吸系统危害研究进展[J]. 新乡医学院学报, 2015, 32(2): 91-95. DOI:10.7683/ xxyxyxb.2015.02.001.
[2] 李桃园, 王昕, 赵丹, 等. 柚皮素对四氯化碳致小鼠化学性肝损伤中氧化应激介质生成影响的实验研究[J]. 中国临床药理学杂志, 2010, 26(6): 420-423. DOI:10.3969/j.issn.1001-6821.2010.06.006.
[3] DOMINGUEZ R A, RODRIGUEZ S, ABREU G P, et al. Impact of air pollution on inflammation, oxidative stress and 1-year prognosis in patients hospitalized for acute coronary syndrome: design of the AIRACOS study[J]. Medicina Clínica, 2013, 141(12): 29-32. DOI:10.1016/j.medcli.2013.05.024.
[4] DASGUPTA A, KLEIN K. Oxidative stress induced by air pollution and exposure to sunlight[M]// Antioxidants in food vitamins and supplements. Amsterdam: Elsevier Inc, 2014: 41-57. DOI:10.1016/ B978-0-12-405872-9.00003-3.
[5] 白玉婷, 周白丽. 氧化应激与心血管疾病关系的研究进展[J]. 医学综述, 2012, 18(2): 192-194. DOI:10.3969/j.issn.1006-2084.2012.02.012.
[6] 相启森, 孟旭, 乔燕, 等. 鼠尾草酸对自由基诱导蛋白质氧化损伤的保护作用[J]. 食品科学, 2013, 34(15): 281-284. DOI:10.7506/ spkx1002-6630-201315058.
[7] PATETSINI E, DIMITRIADIS B K, KALOYIANNI M. Exposure of mussels Mytilus galloprovinciallis, to environmental pesticides. Study of LMS, ROS, DNA damage, protein carbonylation and antioxidant capacity for their use as biomarkers[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2012, 163(3): 2985-3023. DOI:10.1016/j.cbpa.2012.05.082.
[8] DARZYNKIEWICZ Z, ZHAO H, HALICKA H D, et al. In search of antiaging modalities: evaluation of mTOR- and ROS/DNA damage-signaling by cytometry[J]. Cytometry, 2014, 85(5): 386-399. DOI:10.1002/cyto.a.22452.
[9] 陈婕, 赵茜, 刘贝贝, 等. 交通来源大气污染对慢性阻塞性肺部疾病患者呼吸道氧化应激和炎性反应的影响[J]. 中华预防医学杂志, 2016, 50(5). DOI:10.3760/cma.j.issn.0253-9624.2016.05.005.
[10] LEE M S, EUM K D, FANG S C, et al. Oxidative stress and systemic inflammation as modifiers of cardiac autonomic responses to particulate air pollution[J]. International Journal of Cardiology, 2014, 176(1): 166-170. DOI:10.1016/j.ijcard.2014.07.012.
[11] 杜双奎, 王华, 聂丽洁. 芸豆淀粉理化特性研究[J]. 中国粮油学报, 2012, 27(8): 31-35. DOI:10.3969/j.issn.1003-0174.2012.08.007.
[13] 梁亚静, 韩飞, 梁盈, 等. 萌发对芸豆酚类物质及抗氧化活性的影响[J]. 食品工业科技, 2015, 36(16): 142-146. DOI:10.13386/ j.issn1002-0306.2015.16.021.
[14] 王颖, 陈纯琦, 朱磊, 等. 红小豆芽菜酚类化合物提取工艺的研究[J]. 黑龙江八一农垦大学学报, 2015(5): 69-73. DOI:10.3969/ j.issn.1002-2090.2015.05.016.
[15] 李军, 熊琨, 龚元, 等. 基于信号转导通路的姜黄素抗氧化机制研究进展[J]. 中草药, 2016, 47(13): 2373-2380. DOI:10.7501/ j.issn.0253-2670.2016.13.028.
[16] KIM M H, HA S Y, OH M H, et al. Anti-oxidative and antiproliferative activity on human prostate cancer cells lines of the phenolic compounds from Corylopsis coreana Uyeki[J]. Molecules, 2013, 18(5): 4876-4886. DOI:10.3390/molecules18054876.
[17] BIRASUREN B, NA Y K, JEON H L, et al. Evaluation of the antioxidant capacity and phenolic content of Agriophyllum pungens seed extracts from Mongolia[J]. Preventive Nutrition & Food Science, 2013, 18(3): 88-95. DOI:10.3746/pnf.2013.18.3.188.
[18] 雷鸣, 朱祖健. D-半乳糖致衰老的研究进展[J]. 解剖科学进展, 2011, 17(1): 83-85.
[19] 郭育. 太白楤木皂苷抗衰老作用及机制研究[D]. 西安: 陕西师范大学, 2013: 24-32.
[20] 程翠林. 5'-腺苷酸对辐射诱导细胞损伤的防护及其机制研究[D]. 哈尔滨: 哈尔滨工业大学, 2013: 1-3.
[21] ZHANG X, NG W L, WANG P, et al. MicroRNA-21 modulates the levels of reactive oxygen species by targeting SOD3 and TNF[J]. Cancer Research, 2012, 72(18): 7-13. DOI:10.1158/0008-5472.CAN-12-0639. [22] STANLEY A, THOMPSON K, HYNES A, et al. NADPH oxidase complex-derived reactive oxygen species, the actin cytoskeleton, and Rho GTPases in cell migration[J]. Antioxidants & Redox Signaling, 2014, 20(13): 36-42. DOI:10.1089/ars.2013.5713.
[23] ZHAO J, XU F, HUANG H, et al. Evaluation on bioactivities of total flavonoids from Lavandula angustifolia[J]. Pakistan Journal of Pharmaceutical Sciences, 2015, 28(4): 1245-1251.
[24] TOUYZ R M. Reactive oxygen species in vascular biology: role in arterial hypertension[J]. Expert Review of Cardiovascular Therapy, 2014, 1(1): 91-106. DOI:10.1586/14779072.1.1.91.
[25] 陈亮, 李医明, 陈凯先, 等. 植物多酚类成分提取分离研究进展[J]. 中草药, 2013, 44(11): 1501-1507. DOI:10.7501/ j.issn.0253-2670.2013.11.027.
[26] SAHU S K, THANGARAJ M, KATHIRESAN K. DNA extraction protocol for plants with high levels of secondary metabolites and polysaccharides without using liquid nitrogen and phenol[J]. Molecular Biology, 2012, 6(4): 1-6. DOI:10.5402/2012/205049.
[27] 左玉. 多酚类化合物研究进展[J]. 粮食与油脂, 2013(4): 6-10. DOI:1008-9578(2013)04-0006-05.
[28] 张清安, 范学辉. 多酚类物质抗氧化活性评价方法研究进展[J]. 食品与发酵工业, 2011, 37(11): 169-172. DOI:10.13995/j.cnki.11-1802/ ts.2011.11.005.
[29] 薛传静. Prelamin A调节Narf及活性氧影响衰老机制的初步研究[D].湛江: 广东医学院, 2013: 8-10.
[30] 廖霞, 郑少杰, 卢可可, 等. 植物多酚通过Nrf2/ARE信号通路抗氧化作用研究进展[J]. 食品科学, 2016, 37(7): 227-232. DOI:10.7506/ spkx1002-6630-201607041.
Repairing Effect of Kidney Bean Sprout Polyphenols on D-Galactose-Induced Oxidation and Kidney Injury in Mice
WANG Ying1,2, WANG Xinhui1, XU Bingzheng3, ZHU Lei1, ZUO Zhaohang1, LIU Shuting1, GONG Xue1
(1. College of Food Science, Heilongjiang Bayi Agricultural University, Daqing 163319, China; 2. National Coarse Cereals Engineering Research Center, Daqing 163319, China; 3. Qingdao Langyatai Co. Ltd., Qingdao 266400, China)
This study attempted to explore the repairing effect of kidney bean sprout polyphenols on D-galactose-induced oxidation and kidney injury in mice. For this purpose, a mouse model of oxidative injury was established by intraperitoneal injection of D-galactose solution, and the mice were gavaged with three different doses of kidney bean sprout polyphenols (20, 40, 60 mg/(kg·d)) or VC for 28 continuous days and then they were sacrificed after administration for the measurement of body weight, kidney coefficient, glutathione peroxidase (GSH-Px) and superoxide dismutase (SOD) activities, and malondialdehyde (MDA), blood urea nitrogen (BUN) and creatinine (CR) concentrations in serum as well as the histopathological examination of kidney section using HE staining. It turned out that all the treatment groups exhibited an elevation in body weight and kidney coefficient compared with the model control group, but no significant difference was observed among the treatment groups (P > 0.05). The middle-dose and high-dose groups showed a significant increase in serum GSH-Px activity (P < 0.05) and a significant reduction in MDA concentration (P < 0.05), which was not observed for the low-dose group. The administration of kidney bean sprout polyphenols resulted in a significant increase in serum SOD activity and a significant decline in BUN (as an indicator of kidney function) and CR levels except at the low dose compared with the model control group (P < 0.05). Histopathological observation showed that the kidney of mice in the model control group was severely damaged, as indicated by enlarged glomeruli and glomerular cysts together with interstitial bleeding and inflammatory cell infiltration.The enlarged glomeruli and glomerular cysts were restored to normal morphology by kidney bean sprout polyphenols, which also mitigated interstitial bleeding and inflammatory cell infiltration. Taken together, kidney bean sprout polyphenols could dose-dependently repair oxidative stress and renal injury in mice.
kidney bean sprouts polyphenols; D-galactose; oxidative damage; kidney damage; recovery
张丽萍. 芸豆的高产栽培技术[J]. 农民致富之友, 2015(7): 52.
10.3969/j.issn.1003-1650.2015.07.049.
2016-10-27
大庆市科技局创新项目(sjh-2013-65);国家星火计划项目(2015GA670008);黑龙江省应用技术研究与开发计划重大项目(GA15B301)
王颖(1979—),女,副教授,博士,研究方向为农产品加工与贮藏工程及食品质量安全。E-mail:wychen156@163.com
DOI:10.7506/spkx1002-6630-201713036
TS202.3
A
1002-6630(2017)13-0219-05
王颖, 王欣卉, 徐炳政, 等. 芸豆芽菜多酚对D-半乳糖致小鼠机体氧化及肾脏损伤的修复作用[J]. 食品科学, 2017, 38(13): 219-223. DOI:10.7506/spkx1002-6630-201713036. http://www.spkx.net.cn
WANG Ying, WANG Xinhui, XU Bingzheng, et al. Repairing effect of kidney bean sprout polyphenols on D-galactoseinduced oxidation and kidney injury in mice[J]. Food Science, 2017, 38(13): 219-223. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201713036. http://www.spkx.net.cn

