柚皮素通过环核苷酸通路拮抗血小板聚集的体外研究*
黄曼婷, 吴焕林, 徐丹苹△
(1广州中医药大学第二临床医学院, 2广东省中医院, 广东 广州 510020)
柚皮素通过环核苷酸通路拮抗血小板聚集的体外研究*
黄曼婷1, 吴焕林2, 徐丹苹2△
(1广州中医药大学第二临床医学院,2广东省中医院, 广东 广州 510020)
目的: 探讨柚皮素拮抗二磷酸腺苷(ADP)诱导血小板聚集的作用机制。方法: 采用ELISA检测柚皮素对ADP诱导的大鼠血小板内环磷酸腺苷(cAMP)、环磷酸鸟苷(cGMP)水平的影响。采用高效液相法检测柚皮素对血小板磷酸二酯酶(PDE)活性影响。采用Western blot检测柚皮素对ADP刺激的血小板内血管扩张刺激磷蛋白(VASP)磷酸化形式p-VASP(Ser157)、p-VASP(Ser239)的蛋白水平的影响。分别给予蛋白激酶A(PKA)抑制剂H89、蛋白激酶G(PKG)抑制剂Rp-8-Br-PET-cGMPS和蛋白激酶C(PKC)抑制剂GF109203X预先孵育血小板后,再用柚皮素处理,然后给予ADP刺激,Western blot检测p-VASP(Ser239)蛋白水平。采用血小板聚集仪进一步观察PKA抑制剂、PKG抑制剂预先孵育血小板是否影响柚皮素对ADP诱导血小板聚集的抑制作用。结果: 柚皮素剂量依赖性地升高ADP抑制的血小板内cGMP水平,而并不改变cAMP水平。柚皮素还能显著升高血小板PDE活性。Western blot结果显示,柚皮素可明显升高由ADP抑制的p-VASP(Ser239)水平,但不影响p-VASP(Ser157)的蛋白水平,预先孵育PKG或PKC抑制剂并不影响柚皮素对p-VASP(Ser239)蛋白表达的作用,而预先孵育PKA抑制剂后,则能抑制柚皮素对p-VASP(Ser239)蛋白表达的作用。PKA抑制剂能阻断柚皮素对血小板聚集的拮抗作用,而PKG抑制剂并不影响其作用。结论: 柚皮素可能通过升高血小板内cGMP水平和激活PKA依赖的信号通路来介导VASP的磷酸化,从而发挥抗血小板聚集的作用。
柚皮素; 血小板聚集; 环磷酸腺苷; 环磷酸鸟苷; 磷酸二酯酶; 血管扩张刺激磷蛋白
血小板活化过度,例如在内皮受损部位的过度活化,成为许多心血管疾病比如心肌梗死、不稳定型心绞痛和卒中等的发病基础,其中血小板聚集是血小板活化过程中不可缺少的环节。血小板活化是一个复杂的过程,涉及多个血小板激动剂和信号转导通路。环核苷酸包括环磷酸腺苷(cyclic adenosine monophosphate, cAMP)和环磷酸鸟苷(cyclic guanosine monophosphate, cGMP),是血小板信号转导中重要的第二信使系统,可以将胞外信息转导、放大,转变为胞内信息,在血小板活化过程中发挥着重要的作用。血小板激活剂作用于血小板时首先与细胞膜受体结合,通过与膜受体偶联的G蛋白抑制腺苷酸环化酶(adenylate cyclase, AC)或鸟苷酸环化酶(guanylate cyclase, GC),使cAMP、cGMP的生成,cAMP、cGMP再通过cAMP依赖性蛋白激酶A(protenin kinase A, PKA)、cGMP依赖性蛋白激酶G(protein kinase G, PKG)介导一系列的蛋白磷酸化反应[1]。cAMP和cGMP能够抑制G蛋白偶联受体配体(如凝血酶、二磷酸腺苷)、胶原、血栓素、血管性血友病因子(von Willebrand factor, vWF)和纤维蛋白原诱导的血小板激活。当血小板内cAMP、cGMP水平升高时,可以抑制血小板的活化,其中包括:抑制激活剂诱导的Ca2+动员,抑制G蛋白的激活,抑制血小板黏附、颗粒分泌、纤维蛋白原结合和血小板聚集[2-4]。最近,有学者研究发现,一系列具有抑制GC作用而促进血小板内cGMP生成的化合物,已经被证实在动物体内具有明显的抗血栓形成的作用[5]。目前研究表明,提升血小板胞内cAMP、cGMP水平能抑制诱导剂诱导的血小板聚集[1]。
柚皮素(naringein)是广泛存在于芸香科植物葡萄、葡萄柚、西红柿以及柑橘类水果中的二氢黄酮类化合物,也是中药化橘红的主要有效成分。我们前期体外、体内研究发现[6],柚皮素具有显著的抗血小板聚集作用,能通过PI3K/Akt途径拮抗二磷酸腺苷(adenosine diphosphate,ADP)诱导的血小板聚集,很可能开发为一种理想的抗血小板聚集药物,但其抗血小板聚集的作用机制还有待更深入的研究。因此,本研究通过柚皮素对血小板环核苷酸通路的影响,进一步研究柚皮素拮抗血小板聚集作用的机制。
材 料 和 方 法
1 主要材料与仪器
柚皮素购自成都曼思特生物科技有限公司,纯度大于98.0%;ADP、前列腺素 E1(prostaglandin E1,PGE1)、纤维蛋白原、三磷酸腺苷双磷酸酶(apyrase)、cAMP、 cGMP和Rp-8-Br-PET-cGMPS购自Sigma-Aldrich;GF109203X和H89购自Selleck;抗磷酸化(Ser157)血管扩张刺激磷蛋白[phosphorylated vasodilator-stimulated phosphoprotein,p-VASP (Ser157)]抗体、抗p-VASP (Ser239) 抗体、抗GAPDH 抗体和辣根过氧化酶标记的山羊抗兔IgG均购自Cell Signaling Technology;cGMP ELISA 试剂盒购自Cayman;cAMP ELISA 试剂盒购自上海源叶公司; Western blot化学发光 HRP 底物和PVDF膜购自Millipore。LC-20A高效液相色谱仪及配套的四元泵、SPD-M20A检测器、SIL-20A自动进样器和柱温箱均为SHIMADZU产品;LBY-NJ4血小板聚集仪均购自北京普利生仪器有限公司。
2 方法
2.1 洗涤血小板的制备[7-8]正常SD大鼠以10%水合氯醛(0.35 g/kg)腹腔注射麻醉,腹主动脉穿刺取血,用3.2%枸橼酸钠溶液以1∶9(抗凝剂∶血)的比例抗凝,向混匀的全血中加入PGE1(终浓度0.1 mg/L),将全血混匀后,300×g离心6 min。吸取上层富血小板血浆(platelet-rich plasma,PRP),加入PGE1(终浓度0.1 mg/L),900×g离心10 min,弃去上清液;得到的浓缩血小板团块,加入适量Tyrode buffer (12 mmol/L NaHCO3、138 mmol/L NaCl、5.5 mmol/L glucose、2.9 mmol/L KCl、2 mmol/L MgCl2、0.42 mmol/L NaH2PO4、10 mmol/L HEPES,pH 7.4)及PGE1(终浓度为0.1 mg/L),巴氏吸管轻柔吹打,重悬血小板,900×g离心6 min,弃去上清液,得到血小板团块;重新将血小板沉淀于含2×10-5U/L apyrase的Tyrode buffer 中,血小板终浓度调整至4×1011/L。
2.2 血小板内cAMP、cGMP含量的检测 取洗涤血小板300 μL,加入不同浓度柚皮素和同等体积的4% DMSO为溶剂对照,37 ℃孵育5 min后加入诱导剂ADP(终浓度10 μmol/L),于血小板聚集仪上进行血小板聚集反应,同时取未经处理的血小板作为对照(用ADP诱导洗涤血小板聚集,必须加入2 mmol/L CaCl2和0.3 g/L人纤维蛋白原)。聚集反应结束后,立即加入10 mmol/L乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)终止反应,随后100 ℃煮沸5 min,4 ℃冷却,13 000×g离心5 min,取上清进行ELISA检测。
2.3 高校液相色谱法检测血小板内cAMP/cGMP的减少量判断血小板磷酸二酯酶(phosphodiesterase,PDE)活性[9]SD大鼠腹主动脉取血,用3.2%枸橼酸钠溶液以1∶9(抗凝剂∶血)的比例抗凝,300×g离心6 min获得PRP,PRP以900×g离心10 min得血小板沉淀,加入预冷的PBS(含0.1% Triton X-100)重悬血小板,冰上超声破碎血小板(50 Hz,每次5 s、10次,每次间隔停顿5 s),4 ℃低温12 000×g离心20 min 去除血小板碎片沉淀,获取含有大鼠血小板PDE的提取物。
采用高效液相色谱法检测cAMP和cGMP在与PDE反应后的减少量,计算PDE活性。用LC-20A高效液相色谱仪,色谱柱采用依利特C18反相色谱柱(4.6 mm×150 mm,5 μm)。cAMP测定流速为1.0 mL/min,cGMP测定流速为0.6 mL/min,检测波长为254 nm,柱温为室温。流动相由甲醇和50 mmol/L磷酸缓冲液(pH 6.6)组成,容积比为1∶9。进样量为100 μL。

2.4 血小板聚集测定 采用Born比浊法进行血小板聚集性测定[10]。用300 μL Tyrode buffer 作为参比,于比浊管中加入洗涤血小板300 μL,分别加入H89(PKA抑制剂,终浓度5 μmol/L)和Rp-8-Br-PET-cGMPS(PKG抑制剂,终浓度30 μmol/L),37 ℃孵育5 min后,加入终浓度为200 μmol/L的柚皮素,37 ℃孵育5 min后,加入诱导剂ADP(终浓度10 μmol/L)并记录300 s 内最大聚集率(用ADP诱导洗涤血小板聚集,必须加入2 mmol/L CaCl2和0.3 g/L人纤维蛋白原)。
2.5 Western blot 检测蛋白水平 血小板聚集反应结束后,立即加入10 mmol/L EDTA终止反应。3 000×g离心3 min,得血小板沉淀,用PBS洗2次,加入适量细胞裂解液,置冰上裂解30 min,12 000×g离心10 min,所得上清即为细胞总蛋白。留取20 μL裂解后的样本进行BCA蛋白定量,剩下的样本加入5×loading buffer,100 ℃煮5 min,分装,-80 ℃保存。取30 μg样本上样,将样本电泳、转膜,用5% 牛血清白蛋白溶液室温封闭1 h,洗膜3次。分别加入1∶1 000工作浓度的特异性抗体[p-VASP(Ser157)、p-VASP(Ser239)和GAPDH],室温轻柔振动孵育1 h后,放入4 ℃冰箱孵育过夜。洗膜3次后加入II抗,室温孵育1 h,洗膜3次。使用ECL化学发光法显色,用凝胶成像仪成像并分析定量。
3 统计学处理
采用SPSS 17.0统计软件对实验数据进行统计分析,结果用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析,两两比较用最小显著性差异法(least-significant difference,LSD)-t检验或Student-Newman-Keuls(SNK)-q检验,以P<0.05为差异有统计学意义。
结 果
1 柚皮素对血小板内cAMP和cGMP生成的影响
图1显示,与静息血小板相比,ADP刺激后,血小板内cGMP的含量显著降低(P<0.05),不同浓度柚皮素处理可以呈剂量依赖性地增加血小板内cGMP的含量,与ADP组比较,差异有统计学意义(P<0.05)。而柚皮素对cAMP水平无明显影响。

Figure 1.Naringenin elevated cGMP levels but not cAMP levels significantly in ADP-stimulated platelets. Mean±SD.n=4.*P<0.05,**P<0.01vsADP group.
图1 柚皮素对ADP诱导血小板cAMP、cGMP生成的影响
2 柚皮素对血小板PDE活性的影响
我们从大鼠血小板中制备了PDEs酶,通过使用高效液相色谱法检测酶反应体系中PDEs酶底物cAMP/cGMP的剩余量,即计算峰面积,来反映柚皮素处理对PDE活性的抑制作用。对照品及样品的高效液相色谱图见图2。在200、400和800 μmol/L 3个反应液浓度时,柚皮素均可显著抑制血小板PDE活性,见图3。
3 柚皮素对VASP磷酸化的影响
柚皮素可明显升高由ADP抑制的p-VASP(Ser239)水平(P<0.01);柚皮素有增加p-VASP(Ser157)蛋白水平的趋势,但与ADP组比较,差异没有统计学显著性,见图4。预先孵育PKG或PKC抑制剂并不影响柚皮素对p-VASP(Ser239)蛋白水平的影响,而预先孵育PKA抑制剂后,则能抑制柚皮素诱导的p-VASP(Ser239)蛋白水平(P<0.05),见图5。
4 柚皮素与PKA、PKG抑制剂合用对ADP诱导的血小板聚集的作用
单独给予PKA抑制剂H89和PKG抑制剂Rp-8-Br-PET-cGMPS均不影响ADP诱导的血小板聚集。200 μmol/L柚皮素能明显抑制ADP诱导的血小板聚集,但用PKA抑制剂H89预先处理血小板后再给予终浓度200 μmol/L柚皮素处理,其血小板聚集率升高,从(19.5±6.7)%升高到(26.0±3.6)% (P<0.05)。而PKG抑制剂Rp-8-Br-PET-cGMPS和柚皮素合用组血小板聚集率为(17.7±4.9)%,与单纯柚皮素处理组比较,差异没有统计学显著性,见图5。

Figure 2.The high efficiency liquid chromatogram of reference substance and samples.
图2 对照品及供试品的高效液相色谱图
讨 论
cAMP和cGMP是血小板胞内信号传递的第二信使,各种激活剂作用于血小板时首先与细胞膜受体结合,通过第二信使的作用,促使血小板聚集,引起血小板活化。cAMP和cGMP增加时通过以下机制抑制血小板活化[1, 11]:(1)抑制Ca2+动员、内流,降低血小板内Ca2+水平。血小板内60%以上 Ca2+在静息状态下储存在致密管道中,当诱导剂如ADP、胶原、凝血酶通过各自受体,使Ca2+从致密管道释放到胞浆,胞浆Ca2+水平增加,血小板激活,提高胞内cAMP和cGMP水平,继而降低Ca2+水平来抑制血小板激活。(2)抑制诱导剂类物质如磷酸肌醇的降解,抑制肌球蛋白与激动蛋白的结合,进而抑制血小板活化。(3)抑 制Ca2+敏感性蛋白激酶C的磷酸化。
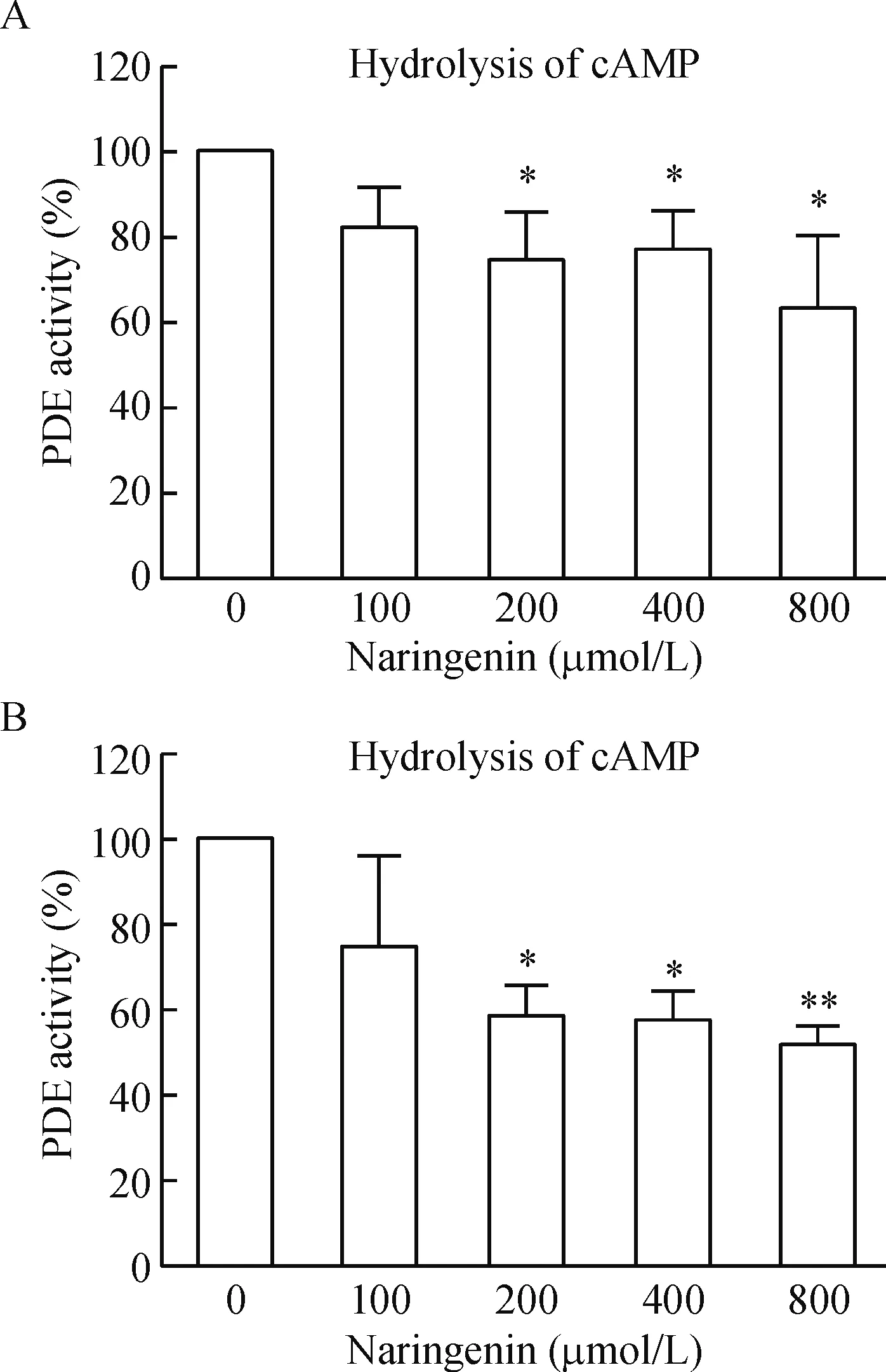
Figure 3.Naringenin inhibited PDE activity in the rat platelets extracts. A: naringenin inhibited cAMP-phosphodiesterase activity in platelets; B: naringenin inhibited cGMP-phosphodiesterase activity in platelets. Means±SD.n=3.*P<0.05,**P<0.01vs0 μmol/L naringenin group.
图3 柚皮素抑制PDE活性
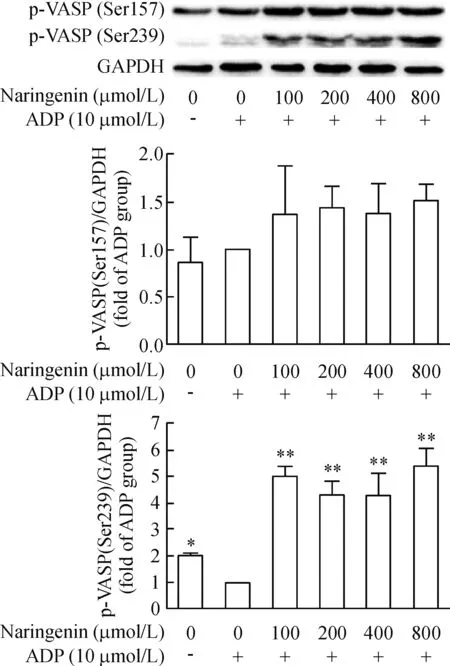
Figure 4.The effect of naringenin on VASP phosphorylation in ADP-stimulated platelets. Mean±SD.n=3.*P<0.05,**P<0.01vsADP group.
图4 柚皮素对ADP诱导的血小板VASP磷酸化的影响
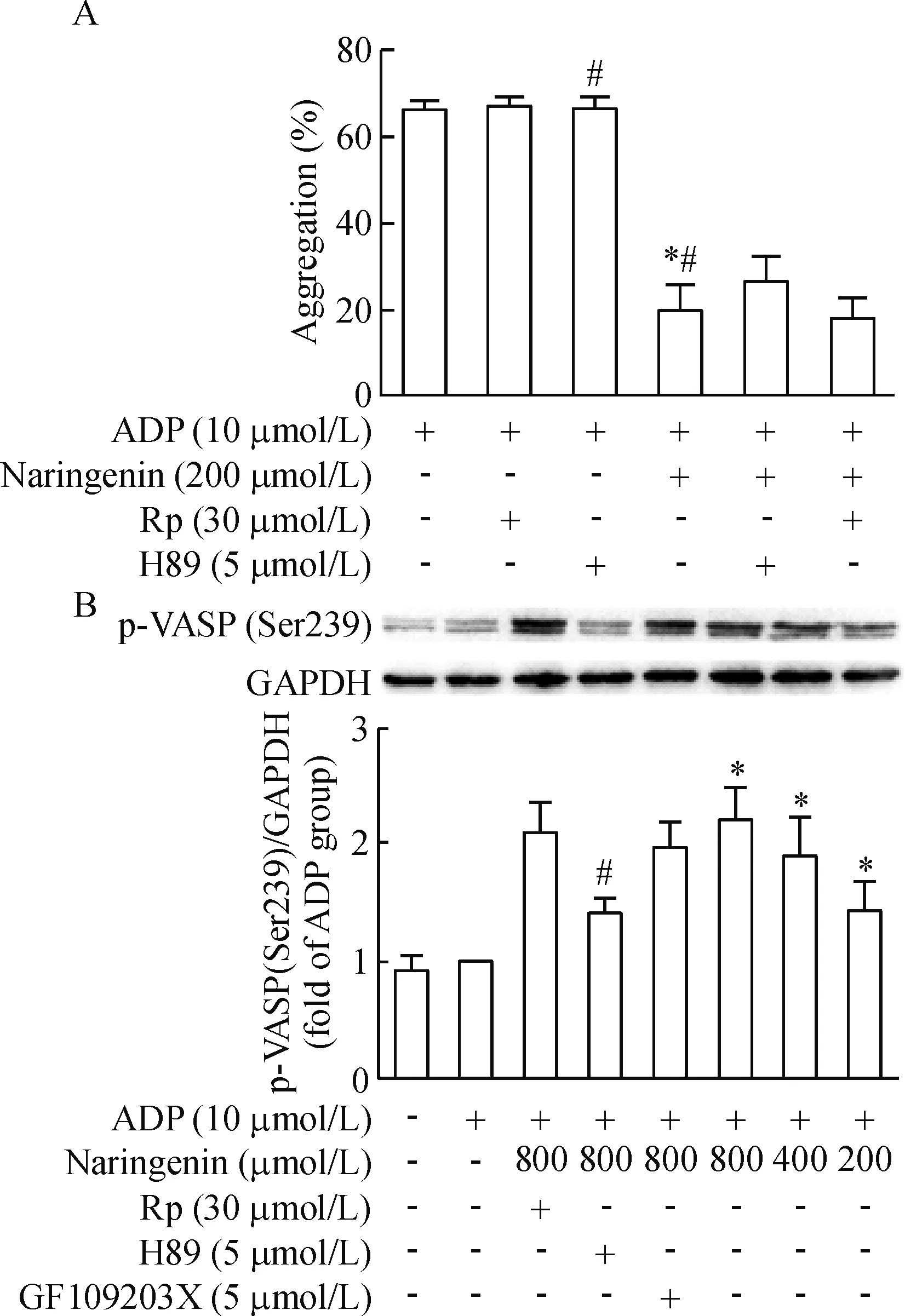
Figure 5.The effect of naringenin on platelet aggregation and the phosphorylation of VASP at S239 in the presence of PKA, PKG and PKC inhibitors before incubation with naringenin. Rp:Rp-8-Br-PET-cGMPS. A: platelet aggregation was measured in the presence of PKA and PKG inhibitors before incubation with naringenin. Mean±SD.n=6.*P<0.05vsADP group;#P<0.05vsADP+ naringenin+H89 group. B: VASP phosphorylation at S239 was analyzed in the presence of PKA, PKG and PKC inhibitors before incubation with naringenin. Mean±SD.n=3.*P<0.05vsADP group;#P<0.05vsADP+naringenin (800 μmol/L).
图5 柚皮素与PKA、PKG、PKC抑制剂联用对ADP诱导的血小板聚集率和p-VASP(Ser239)表达的影响
诱导剂诱导血小板产生的反应如形态改变、黏附、聚集、颗粒内容物的释放等均是胞内Ca2+水平增加的结果,均可通过增加胞内cAMP和cGMP水平来抑制胞浆Ca2+水平,因此近年来调节cAMP和cGMP的物质被发展为抗血小板药物[12]。在我们的研究中,血小板经ADP激活后,cGMP生成减少,经柚皮素预处理后,胞内cGMP含量增加,能逆转ADP诱导的cGMP减少,而柚皮素对cAMP含量改变不大。提示柚皮素极有可能是通过影响血小板cGMP途径来发挥抗血小板聚集的作用。
血小板的cAMP和cGMP水平主要受两类酶调控,AC或GC负责其合成,PDE负责其降解[13]。PDE和AC、GC一起共同调节环核苷酸水平。AC催化三磷酸腺苷(adenosine triphosphate,ATP)合成cAMP,GC催化三磷酸鸟苷(guanosine triphosphate,GTP)合成cGMP,PDE则选择性作用于3’, 5’-磷酸二酯键,将cAMP和cGMP裂解我5’-cAMP和5’-cGMP[14]。PDE分布广泛,在血小板、心脏、单核细胞、血管平滑肌细胞内均有存在,目前分为11个亚型,每一亚型又包括不同的亚亚型。PDEs在血小板中表达的种类有PDE2A、PDE3和PDE5,其中PDE3能水解cAMP和cGMP,而PDE5能水解cGMP[13]。我们的研究结果显示200 μmol/L柚皮素即可显著抑制血小板提取的PDEs活性,柚皮素在同样浓度范围内剂量依赖性增加cGMP水平,抑制ADP诱导的血小板聚集,说明柚皮素对血小板聚集的抑制与其抑制PDE活性继之提升cGMP有关。
cAMP和cGMP生理作用的发挥是通过PKA和PKG介导的蛋白磷酸化级联反应实现的。Walter等[15]纯化出一个46/50 kD的血小板蛋白,称之为血管扩张刺激磷蛋白,是cGMP和cAMP依赖的激酶的一个底物。环核苷酸活化的蛋白激酶A在3个位点上使VASP磷酸化,而磷酸化与血小板活化的抑制有关[16-17]。相应地,脱磷酸作用则与活化有关。静息下,血小板内VASP以磷酸化的非活化形式存在,当细胞受体接收刺激活化或抑制AC、GC活化偶联Gi蛋白时,引起下游cAMP、cGMP水平升高或降低,抑制p-VASP去磷酸化或促使其去磷酸化[18-19]。VASP的3个磷酸化位点Ser157、Ser239和Thr278已经被鉴定。Ser239位点是主要的PKG磷酸化位点,而Ser157位点是主要的PKA磷酸化位点。当血小板内cAMP水平升高,VASP磷酸化位点Ser157被PKA激活,而胞内cGMP水平升高,PKG则激活VASP磷酸化位点Ser239[20]。为了进一步考察柚皮素是否通过cGMP或cAMP介导的信号通路抑制血小板活化,我们利用Western blot技术检测柚皮素对p-VASP(Ser239)和p-VASP(Ser157)的影响。研究结果显示,柚皮素呈剂量依赖性增加p-VASP(Ser239)的蛋白水平,升高由ADP抑制的p-VASP(Ser239)水平,而柚皮素并不改变p-VASP(Ser157)的蛋白水平。这与我们前面发现柚皮素能逆转ADP诱导的cGMP减少,而对cAMP含量改变不大的实验结果是一致的。为了证实柚皮素是否通过cGMP/PKG通路来介导VASP(Ser239)的磷酸化,我们分别采用PKA抑制剂H89、PKG抑制剂Rp-8-Br-PET-cGMPS和PKC抑制剂GF109203X预先孵育血小板后,再用柚皮素处理,观察抑制剂是否影响柚皮素对p-VASP(Ser239)的表达。研究结果显示,预先孵育PKG或PKC抑制剂并不影响柚皮素对p-VASP(Ser239)的表达,而预先孵育PKA抑制剂后,则能降低柚皮素对p-VASP(Ser239)的蛋白水平,这表明柚皮素并不是通过cGMP/PKG通路来介导VASP(Ser239)的磷酸化,而是通过升高胞内cGMP水平和PKA依赖的信号通路来介导VASP(Ser239)的磷酸化。此外,我们进一步采用PKA抑制剂、PKG抑制剂预先孵育血小板后,再用柚皮素处理,观察抑制剂是否影响柚皮素抑制血小板聚集作用。实验结果显示,PKA抑制剂能逆转柚皮素抑制的血小板聚集,而PKG抑制剂并不影响其作用。这些研究结果进一步表明cGMP-介导的PKA激活在柚皮素抑制的血小板聚集作用中起重要作用。虽然大多数学者认为cGMP诱导的VASP磷酸化是由PKG介导的,但近年来有研究发现cGMP能通过抑制PDE3激活cAMP-PKA通路[21],Li等[22]也发现PKA在cGMP诱导的VASP磷酸化和血小板聚集中扮演了重要作用,我们的研究结果与其发现是一致的。
综上所述,柚皮素拮抗ADP诱导血小板聚集作用的潜在分子机制可能是通过升高血小板内cGMP水平和激活PKA依赖的信号通路来介导VASP磷酸化实现的。
[1] Smolenski A. Novel roles of cAMP/cGMP-dependent signaling in platelets[J]. J Thromb Haemost, 2012, 10(2):167-176.
[2] Rukoyatkina N, Walter U, Friebe A, et al. Differentiation of cGMP-dependent and -independent nitric oxide effects on platelet apoptosis and reactive oxygen species production using platelets lacking soluble guanylyl cyclase[J]. Thromb Haemost, 2011, 106(5):922-933.
[3] Schwarz UR, Walter U, Eigenthaler M. Taming platelets with cyclic nucleotides [J]. Biochem Pharmacol, 2001, 62(9):1153-1161.
[4] Münzel T, Feil R, Mülsch A, et al. Physiology and pathophysiology of vascular signaling controlled by guanosine 3′, 5′-cyclic monophosphate-dependent protein kinase[J]. Circulation, 2003, 108(18):2172-2183.
[5] Stasch JP, Pacher P, Evgenov OV. Soluble guanylate cyclase as an emerging therapeutic target in cardiopulmonary disease[J]. Circulation, 2011, 123(20): 2263-2273.
[6] 黄曼婷, 吴焕林, 徐丹苹. 柚皮素通过PI3K/Akt通路拮抗血小板聚集的体外研究[J]. 中国病理生理杂志,2017,33(3):517-522.
[7] Boylan B, Gao C, Rathore V, et al. Identification of Fc gamma RIIa as the ITAM-bearing receptor mediating alphaIIbbeta3 outside-in integrin signaling inhuman platelets[J]. Blood, 2008, 112(7):2780-2786.
[8] Liu J, Pestina TI, Berndt MC, et al. Botrocetin/VWF-induced signaling through GPIb-IX-V produces TxA2 in an alphaIIbbeta3- and aggregation-independent manner[J]. Blood, 2005, 106(8):2750-2756.
[9] 刘 旭, 程玉芳, 张汉霆, 等. 咯利普兰对局灶性脑缺血-再灌注损伤大鼠 学习记忆及海马 PDE4活性的影响[J]. 中国病理生理杂志,2008, 24(6): 1096-1100.
[10]Born GV. Aggregation of blood platelets by adenosine diphosphate and its reversal[J]. Nature, 1962, 194:927-929.
[11]Lee DH, Kim HH, Cho HJ, et al. Antiplatelet effects of caffeic acid due to Ca2+mobilizationinhibition via cAMP-dependent inositol-1, 4, 5-trisphosphate receptor phosphorylation[J]. J Atheroscler Thromb, 2014, 21(1): 23-37.
[12]Hayashi H, Sudo T. Effects of the cAMP-elevating agents cilostamide, cilostazol and forskolin on the phosphorylation of Akt and GSK-3beta in platelets[J]. Thromb Haemost, 2009, 102(2): 327-335.
[13]Omori K, Kotera J. Overview of PDEs and their regulation[J]. Circ Res, 2007, 100(3): 309-327.
[14]Zhao CY, Greenstein JL, Winslow RL. Roles of phosphodiesterases in the regulation of the cardiac cyclic nucleotide cross-talk signaling network[J]. J Mol Cell Cardiol, 2016, 91:215-227.
[15]Walter U, Eigenthaler M, Geiger J, et al. Role of cyclic nucleotide-dependent protein kinases and their common substrate VASP in the regulation of human platelets[J]. Adv Exp Med Biol, 1993, 344:237-249.
[16]Harbeck B, Hüttelmaier S, Schluter K, et al. Phosphorylation of the vasodilator stimulated phosphoprotein regulates its interaction with actin[J]. J Biol Chem, 2000, 275(40): 30817-30825.
[17]Lambrechts A, Kwiatkowski AV, Lanier LM, et al. cAMP-dependent protein kinase phosphorylation of EVL, a Mena/VASP relative, regulates its interaction with actin and SH3 domains[J]. J Biol Chem, 2000, 275(46):36143-36151.
[18]Aszódi A, Pfeifer A, Ahmad M, et al. The vasodilator-stimulated phosphoprotein (VASP) is involved in cGMP- and cAMP-mediated inhibition of agonist-induced platelet aggregation, but is dispensable for smooth muscle function[J]. EMBO J, 1999, 18(1):37-48.
[19]Wentworth JK, Pula G, Poole AW. Vasodilator-stimulated phosphoprotein (VASP) is phosphorylated on Ser157 by protein kinase C-dependent and independent mechanisms in thrombin-stimulated human platelets[J]. Biochem J, 2006, 393(Pt 2): 555-564.
[20]Vaiyapuri S, Ali MS, Moraes LA, et al. Tangeretin regulates platelet function through inhibition of phosphoinositide 3-kinase and cyclic nucleotide signaling[J]. Arterioscler Thromb Vasc Biol, 2013, 33(12): 2740-2749.
[21]Jang EK, Azzam JE, Dickinson NT, et al. Roles for both cyclic GMP and cyclic AMP in the inhibition of collagen-induced platelet aggregation by nitroprusside[J]. Br J Haematol, 2002, 117(3): 664-675.
[22]Li Z, Ajdic J, Eigenthaler M, et al. A predominant role for cAMP-dependent protein kinase in the cGMP-induced phosphorylation of vasodilator-stimulated phosphoprotein and platelet inhibition in humans[J]. Blood, 2003, 101(11): 4423-4429.
(责任编辑: 陈妙玲, 余小慧)
Antiplatelet aggregation of naringenin via cyclic nucleotide signaling: in vitro studies
HUANG Man-ting1, WU Huan-lin2, XU Dan-ping2
(1TheSecondClinicalCollege,GuangzhouUniversityofChineseMedicine,2GuangdongProvincialHospitalofTraditionalChineseMedicine,Guangzhou510020,China.E-mail:danpingxu@hotmail.com.cn)
AIM: To investigate effect of naringenin on ADP-induced platelet aggregation and its possible mechanism. METHODS: The levels of cyclic adenosine monophosphate (cAMP) and cyclic guanosine monophosphate (cGMP) were measured in the platelets with ADP stimulation using ELISA in the presence or absence of different concentrations of naringenin. The effect of naringenin at different concentrations on the change of phosphodiesterase (PDE) activity was measured by high efficiency liquid chromatography. The effects of naringenin at different concentrations on phosphorylation of vasodilator-stimulated phosphoprotein (VASP) at positions Ser157 and Ser239 in washed platelets with ADP stimulation were analyzed by Western blot. The phosphorylation of VASP at Ser239 was also analyzed in the presence of protein kinase A (PKA), protein kinase G (PKG), or protein kinase C (PKC) inhibitors before incubation with naringenin. The platelet aggregation was measured in the presence of PKA or PKG inhibitors before incubation with naringenin. RESULTS: Naringenin elevated cGMP levels significantly but not cAMP levels in the platelets with ADP stimulation in a dose-dependent manner. Naringenin inhibited PDE activity. Naringenin increased the phosphorylation of VASP at Ser239 in a dose-dependent manner in the platelets with ADP stimulation but only modest changes in the phosphorylation at position Ser157. The phosphorylation level of VASP at Ser239 position was inhibited when the platelets were treated with PKA inhibitor before incubation with naringenin. Incubation of platelets with neither PKG nor PKC inhibitors before treatment with naringenin affect the phosphorylation of VASP at Ser239. Pretreatment with PKA inhibitor but not PKG inhibitor significantly reversed the antiplatelet aggregation by naringenin in ADP-stimulated platelets. CONCLUSION: Naringenin may inhibit platelet activation through the elevation of cGMP- and PKA- mediated VASP phosphorylation.
Naringenin; Platelet aggregation; Cyclic adenosine monophosphate; Cyclic guanosine monophosphate; Phosphodiesterase; Vasodilator-stimulated phosphoprotein
1000- 4718(2017)07- 1306- 07
2016- 12- 05
2017- 04- 10
国家自然科学基金资助项目(No. 81403341);广东省中医药管理局科技专项(No. 20141093);广东省科技计划(No. 2016A020226011)
R285.5; R363.2+1
A
10.3969/j.issn.1000- 4718.2017.07.025
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 020-39318374; E-mail: danpingxu@hotmail.com.cn

