小鼠11β-1基因真核表达载体的构建及应用
辛婧,叶磊,杨可,沈亚非,邓飞
[1.河南省漯河市中心医院(漯河市医学高等专科学校第一附属医院)内分泌科,河南 漯河 462000;2.河南省漯河市召陵区人民医院神经内科,河南 漯河 462000]
辛婧1,叶磊2,杨可1,沈亚非1,邓飞1
[1.河南省漯河市中心医院(漯河市医学高等专科学校第一附属医院)内分泌科,河南 漯河 462000;2.河南省漯河市召陵区人民医院神经内科,河南 漯河 462000]
目的构建小鼠11β-羟类固醇脱氢酶基因的慢病毒真核表达载体PLJM1-11β-HSD1-GFP,建立小鼠前体脂肪细胞(3T3-L1)高表达基因的稳定感染细胞株,为基因的功能研究奠定基础。方法利用逆转录聚合酶链反应(RT-PCR)从小鼠肝脏cDNA中扩增11β-HSD1开放阅读框ORF,构建针对基因的真核表达载体,转化感受态DH5α菌株,抽提质粒并进行测序鉴定。用测序成功的质粒和慢病毒包装质粒共同转染293T细胞,产生慢病毒并转染3T3-L1细胞。根据绿色荧光效率挑取单克隆细胞团筛选出稳定细胞株,通过Western blot鉴定PLJM1-11β-HSD1-GFP转染成功。结果经酶切、PCR及测序验证,PLJM1-11β-HSD1-GFP真核表达载体构建成功,并包装慢病毒,绿色荧光效率90%以上,并利用其慢病毒悬液成功感染3T3-L1细胞,筛选出的稳定感染细胞株的3T3-L1细胞成功高表达11β-HSD1蛋白。结论成功构建了基因的真核表达载体,并建立高表达的稳定感染细胞株PLJM1-11β-HSD1-GFP-3T3-L1,为进一步研究基因的功能,特别是在肥胖中的研究奠定了基础。
基因;真核表达载体;前体脂肪细胞;肥胖
11β-羟类固醇脱氢酶(11beta-hydroxysteriod dehydrogenase,11β-HSD1)在体内广泛分布,表达于脂肪、肝脏、肌肉、性腺及中枢神经系统等,以脂肪组织和肝脏中的含量最高[1]。它是糖皮质激素的代谢酶,有重要的生物学活性,有还原酶与氧化酶的双重作用,但以还原酶作用为主,需要烟酰胺腺嘌呤二核苷磷酸(NADP+)参与,有活化糖皮质激素的作用,可以使人体无活性的可的松(动物的皮质酮)转化为有活性的氢化可的松(皮质醇)[2]。资料显示,11β-HSD1的转基因小鼠显示内脏脂肪组织肥厚;在代谢综合征患者脂肪库中细胞内11β-HSD1的活性是普遍增加的[3]。这可能与糖皮质激素能增加脂肪细胞内合成代谢有关,而11β-HSD1主要使糖皮质激素活化,提示其可能与向心性肥胖、胰岛素抵抗及糖尿病有关[4]。本研究拟构建基因的真核表达载体,并建立高表达该基因的稳定感染细胞株,以进一步研究该基因与肥胖、胰岛素抵抗及糖脂代谢相关性。
1 材料与方法
1.1 材料
PolyATtract_Series9600TMmRNA Isolation System试剂盒、末端转移酶(TdT)、逆转录酶(AMV)及Taq DNA聚合酶均购自美国Promega公司,焦碳酸二乙酯(DEPC)及ExpandTMTemplate PCR System购自日本TaKaRa公司,DH5α菌株及PLJM1-NRG1-GFP载体由南京医科大学分子遗传研究室李建民教授馈赠,Lipofectamine 2000细胞转染试剂盒购自美国Invitrogen公司,3T3-L1前体脂肪细胞株、293T细胞购自上海细胞生物研究所,DMEM培养液、10%胎牛血清购自南京生兴公司,3-异丁基-1-甲基磺嘌呤(MIX)、胰岛素及地塞米松购自美国Sigma公司,11β-HSD1兔源抗体购自美国Research Genetics公司,二抗羊抗兔IgG-辣根过氧化物酶及β-actin抗体购自武汉生物有限公司。
1.2 方法
1.2.1 引物设计根据GenBank登录号NM_008288 mRNA序列设计引物,由上海华大基因科技有限公司合成。正向引物:GGGGCTAGCGGATCCGCCACC ATGGCAGTTATGAAAAATTACC;反向引物:GGGG AATTCCTCGAGCCTAGTTACTTACAAACATGTCC。正向引物酶切位点为,反向引物酶切位点为扩增目的片段大小881 bp。
1.2.2 小鼠肝脏总RNA的抽提用PolyAT-tract_Series9600TMmRNA Isolation System试剂盒提取BABL/C 8周的小鼠肝脏组织总RNA,提取2μl经琼脂糖凝胶电泳观察总RNA完整性,并用紫外分光光度计分别测定260 nm、280 nm波长下的光密度(OD)值,并检测总RNA的纯度,其余RNA于-70℃冰箱冷冻保存。
1.2.3 逆转录聚合酶链反应(RT-PCR)扩增目的基因取2μg mRNA加入PrimeSriptTMRT reagent Kit逆转录反应体系中,42℃孵育90 min,逆转录合成cDNA,结束后加入RNAase H内切酶,37℃孵育30 min,降解RNA。以上述小鼠的cDNA为模板扩增目的片段。PCR的反应条件为:94℃预变性5 min,94℃30 s,54℃30 s,72℃延伸1 min,35个循环,72℃10 min,4℃2 min,获取小鼠基因全长开放阅读框ORF。
1.2.4 真核表达质粒PLJM-11β-HSD1-GFP制备以上述小鼠3T3-L1细胞的cDNA为模板,相应引物扩增11β-HSD1全长ORF,用TaKaRa DNA Fragment Purification Kit纯化靶DNA片段。将纯化后的PCR产物行双酶切。对酶切后产物用1%琼脂糖凝胶行电泳检测。并在切胶仪上切下目的片段。用Ultra-Sep Gel Extraction Kit(OMEGA)纯化切胶产物。将酶切纯化后的目的片段11β-HSD1连接至PLJM1-NRG1(NheI/EcoRI)载体(10μl体系:目的片段2μl,载体1μl,2×Ligase buffer 5μl,T4连接酶1μl,ddH2O 1μl;条件22℃1 h)。用连接产物转化大肠杆菌DH5α菌株,在氨苄青霉素(Ampicillin,Amp)抗性的LB固体平板上生长过夜(37°孵箱16~18 h)。在过夜后的固体平板上挑取5个单克隆,分别加至Amp抗性的5 ml LB培养基里摇菌过夜并做好标记,次日以菌液为模板,以11β-HSD1-F/R为引物作PCR并行1%琼脂糖凝胶电泳鉴定。对获取的阳性克隆进行保种,同时经碱裂解法提取质粒DNA,以CMV-F和11β-HSD1-R为测序引物并送上海华大基因科技有限公司进行测序。
1.2.5 序列分析应用NCBI网站BLAST分析软件,对上述测序结果进行序列比对,鉴定PLJM1-11β-HSD1-GFP载体多克隆位点区表达序列的可靠性和准确性。
1.2.6 PLJM1-11β-HSD1-GFP-3T3-L1慢病毒细胞株的构建用中抽试剂盒抽取质粒PLJM1-11β-HSD1-GFP及空载对照质粒PLJM.1,保证OD值1.8~1.9,浓度在1 000μg/ml以上。转染前24 h将处于对数生长期的293T细胞铺6 cm培养皿,2×106~4×106个/皿。转染体系如下:质粒PLJM1-11β-HSD1-GFP(或空载对照质粒PLJM.1)4μg,包装质粒PVSVG 2μg,delta 8.91 3μg,与Lipofectamine 2000 20μl混合共同孵育形成复合物,然后转染293T细胞。转染后24 h换液3 ml,并用荧光显微镜观察拍照。转染后48和72 h收集包装产生的病毒上清,经0.45μm滤膜过滤后加入polybrene(Millipore),使终浓度为10μg/ml。感染前24 h将3T3-L1细胞接种至6 cm培养皿,使感染前细胞密度为10%~20%。24 h后弃去培养液,用上述病毒上清3 ml感染靶细胞,37℃培养6 h后换液加入3 ml完全培养液DMEM。感染48 h后观察荧光表达情况。根据荧光效率挑单克隆筛选稳定转染株,并进行冷冻保存。
1.2.7 Western blot检测分别提取正常3T3-L1细胞、高表达11β-HSD1的3T3-L1及转入空载质粒的3T3-L1细胞的总蛋白质,用考马斯亮蓝法测定蛋白质浓度,制备14.7%分离胶和5%浓缩胶,60 V稳压电泳;半干转膜,封闭,按Western blot检测试剂盒说明书进行操作。一抗为11β-HSD1多克隆抗体(抗体浓度为1∶200),二抗为羊抗兔IgG-辣根过氧化物酶,(抗体浓度为1∶800),用免疫印迹增强化学发光法分别检测3组细胞株的11β-HSD1蛋白表达水平。实验所得的Western blot条带经Photoshop软件处理,在Bandscan分析软件中测得各自总度值,采用自身β-actin灰度值校正并进行定量分析。实验数据输入Excel数据库用Excel软件进行作图。
1.3 统计学方法
采用SPSS 14.0统计学软件对本研究中的数据进行分析和处理,计量资料应用均数±标准差(±s)表示,采用配对检验,<0.05为差异有统计学意义。
2 结果
2.1 小鼠11β-HSD1 ORF片段扩增及载体克隆
以小鼠肝脏cDNA为模板,用正向引物和反向引物进行PCR扩增,得到小鼠11β-HSD1 ORF片段,目的片段为881 bp(见图1)。
2.2 PLJM1-11β-HSD1-GFP重组载体的鉴定
以正向引物与反向引物进行PCR扩增,用Promega PCR纯化试剂盒进行纯化,酶切产物(见图2)行切胶纯化,将纯化后产物连接至PLJM1-NRG1-GFP载体。随机选取5个阳性克隆,行PCR鉴定(见图3),获取的阳性克隆经碱裂解法提取质粒DNA测序(见图4),测序结果经序列比对分析确认无任何突变、插入等异常,慢病毒载体PLJM1-11β-HSD1-GFP构建成功(见图5)。
2.3 慢病毒载体转染293T细胞

图1 小鼠11β-1基因ORF扩增片段

图2 小鼠11β-1基因PCR酶切产物
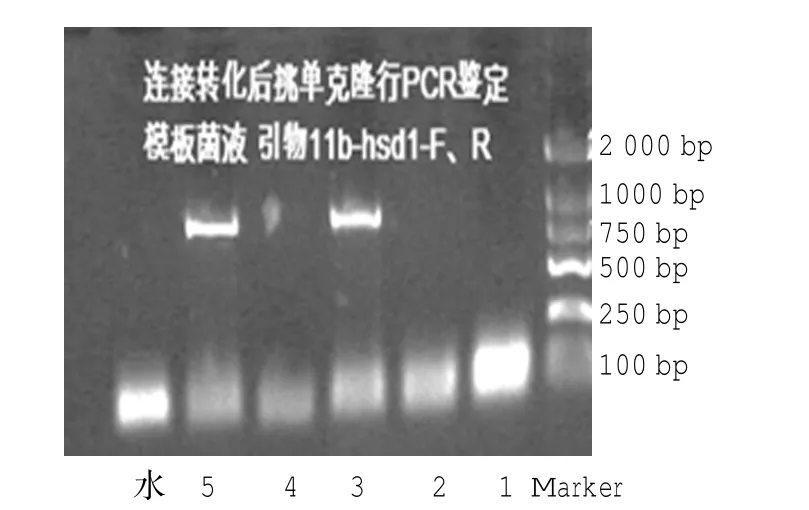
图3 小鼠11β-基因ORF片段单克隆PCR结果
慢病毒载体PLJM1-11β-HSD1-GFP转染293T细胞24 h后荧光显微镜拍照见图6,绿色荧光效率90%以上。
2.4 收取病毒上清感染3T3-L1细胞
收取293T细胞病毒上清感染3T3-L1细胞,48 h后荧光显微镜拍照结果见图7。
2.53 T3-L1单克隆细胞株绿色荧光蛋白的表达
根据荧光情况挑单克隆并筛选稳定感染细胞株,3T3-L1单克隆细胞株绿色荧光蛋白的表达见图8。

图4 PLJM1-11β-HSD1-GFP质粒测序图

图5 PLJM1-11β-HSD1-GFP质粒序列比对图
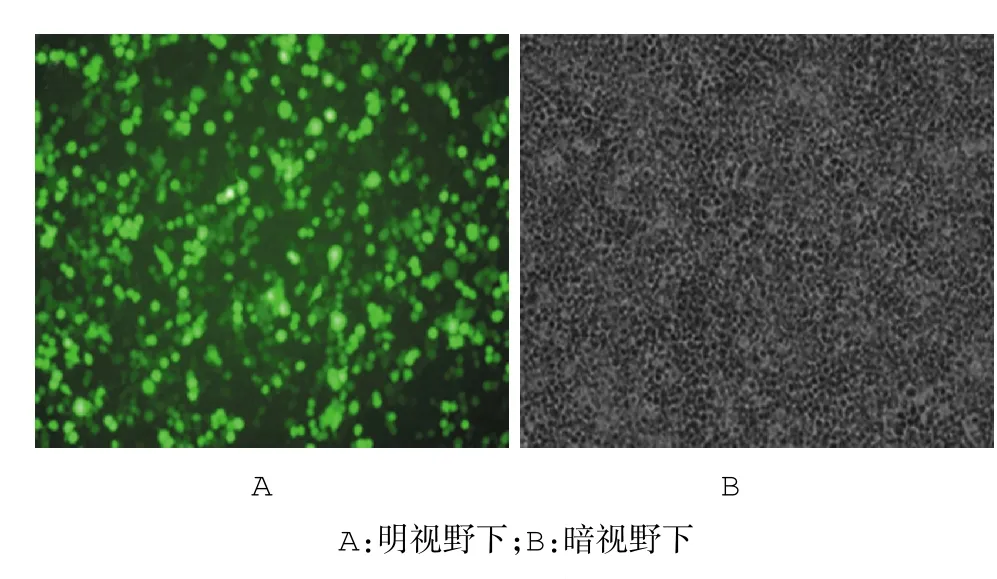
图6 重组质粒转染293T细胞后绿色荧光蛋白的表达(荧光显微镜×100)

图7 重组质粒转染3T3-L1细胞后绿色荧光蛋白的表达(荧光显微镜×100)
2.6PLJM1-11β-HSD1-GFP质粒转染3T3-L1细胞蛋白水平验证
分别提取3T3-L1、PLJM1-3T3-L1及PLJM1-11β HSD1-GFP-3T3-L1细胞组蛋白进行Western blot检测,结果提示PLJM1-11βHSD1-GFP质粒转染成功,PLJM1-11β-HSD1-GFP-3T3-L1组11β-HSD1蛋白表达水平明显升高,见图9。
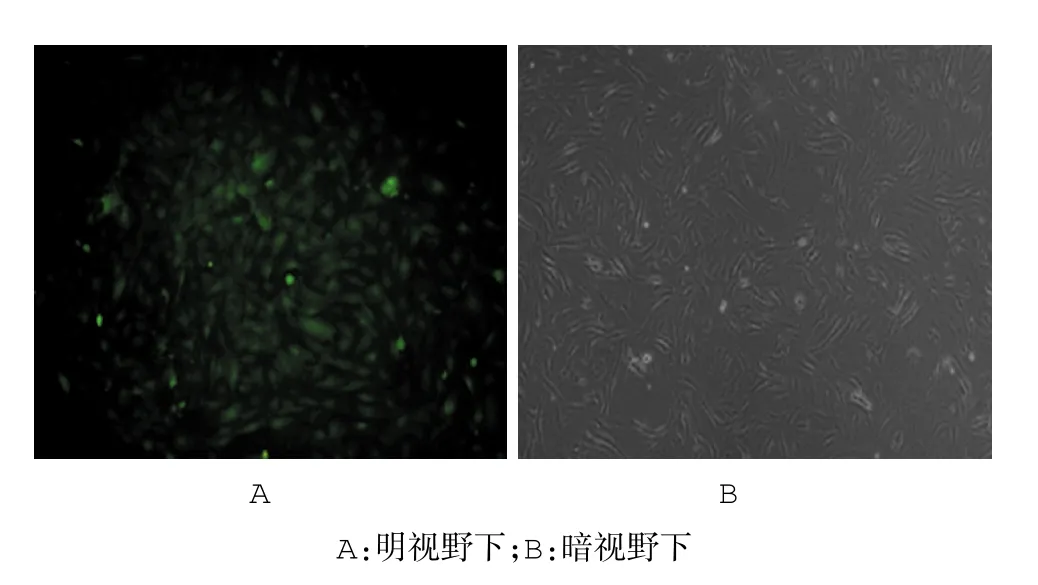
图83 T3-L1单克隆细胞株绿色荧光蛋白的表达(荧光显微镜×100)
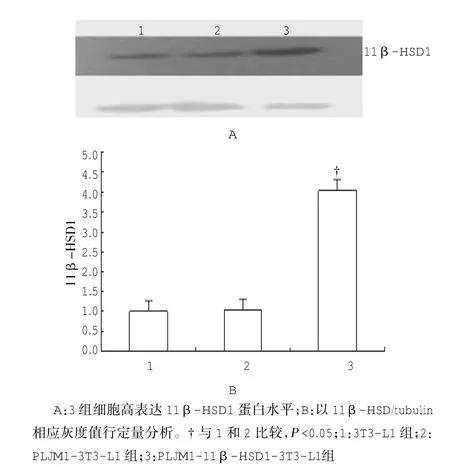
图9 各组细胞11β-HSD1蛋白表达情况
3 讨论
11β-HSD1作为一种微线粒体酶,主要负责有活性与无活性的糖皮质激素之间的互相转化,通过控制底物即糖皮质激素的利用率,从而调控组织特异性糖皮质激素受体的活性[5-6]。11β-HSD有2种同工酶。其中11β-HSD2是辅酶Ⅰ(NAD)依赖性脱氢酶,主要使活性的可的松变为无活性的氢化可的松。主要作用于盐皮质激素敏感的靶组织如肾脏,结肠,唾液腺,胎盘等[7]。11β-HSD1直到最近才被发现并认为是重要的生物酶,是还原型辅酶Ⅱ(NADPH)依赖性的还原酶,与11β-HSD2作用相反,主要负责将无活性的氢化可的松转化为有活性的可的松[8]。它广泛分布于各组织,主要分布于肝脏、脂肪、性腺、脑、脉管系统等,这些组织则以糖皮质激素受体占优势。研究表明,11β-HSD1调节糖皮质激素受体与配体的结合,参与了库欣综合征相似的疾病的发生发展,如向心性肥胖、糖尿病、多囊卵巢综合征以及痴呆[9-10]。
慢病毒(Lentivirus)载体是以人类免疫缺陷病毒-1(HIV-1)为基础发展起来的基因治疗载体[11]。携带有目的基因的慢病毒载体在慢病毒包装质粒及细胞系的辅助下,经过病毒包装成为有感染力的病毒颗粒,通过感染细胞或组织,实现目的基因在宿主细胞中得到长期而稳定的表达[12]。经过改建后的慢病毒载体能够容纳约10 kb左右的外源基因,因此大多数的cDNA都能够被克隆入慢病毒载体。293T细胞由293细胞派生,属人肾上皮细胞系,作为包装细胞,在包装后产生了高滴度的病毒颗粒,同时表达目的基因。
本文利用慢病毒载体技术成功构建了带有GFP目的基因HSD1的慢病毒载体PLJM1-HSD1-GFP,同时建立了3T3-L1稳定感染细胞株PLJM1-HSD1-GFP-3T3-L1,为进一步研究HSD1的生物学功能奠定了必要的基础。
[1]CHAPMAN K E,COUTINHO A E,ZHANG Z,et al.Changing glucocorticoid action:11β-hydroxysteroid dehydrogenase type 1 in acute and chronic inflammation[J].J Steroid Biochem Mol Biol,2013,137(100):82-92.
[2]LIU J,KONG X,WANG L,et al.Essential roles of 11β-HSD1 in regulating brown adipocyte function[J].J Mol Endocrinol,2013,50(1):103-113.
[3]HONGSP,NAMKY,SHINYJ,etal.Discoveryof 11β-hydroxysteroid dehydrogenase type 1 inhibitor[J].Biboorg Med Chem Lett,2015,25(17):3501-3506.
[4]MORGAN S A,GATHERCOLE L L,SIMONET C,et al.Regulation of lipid metabolism by glucocorticoids and 11β-HSD1 in skeletal muscle[J].Endocrinology,2013,154(7):2374-2384.
[5]DUBE S,SLAMA M Q,BASU A,et al.Glucocorticoid excessincreases hepatic 11β-HSD-1 activity in humans:implications in steroid-induced diabetes[J].Journal of Clinical Endocrinology Metabolism,2015,100(11):4155-4162.
[6]PAUL P,FREDIRK R,DAVID E,et al.Saturated fatty acids in humanvisceraladiposetissueareassociatedwithincreased 11β-hydroxysteroid dehydrogenase type 1 expression[J].Lipids in health Disease,2015,14(1):1-5.
[7]KOH E H,KIM A R,KIM H,et al.11β-HSD1 reduces metabolicefficacyandadiponectinsynthesisinhypertrophic adipocytes[J].J Endocrinol,2015,225(3):147-158.
[8]WOODS C,TOMLINSON J W.The dehydrogenase hypothesis[J].Advances inExperimentalMedicineandBiology,2015,872:353-380.
[9]LAVERY G G,ZIELINSKA A E,GATHERCOLE L L,et al.Lack of significant metabolic abnormalities in mice with liver-specific disruption of 11β-hydroxysteroid dehydrogenase type 1[J].Endocrinology,2012,153(7):3236-3248.
[10]ABRAHAMS L,SEMJONOUS N M,GUEST P,et al.Biomarkers of hypothalamic-pituitary-adrenal axis activity in mice lacking 11β-HSD1 and H6PDH[J].J Endocrinol,2012,214(3):367-372.
[11]WANG N,RAJASEKARAN N,HOU T,et al.Comparison of transductionefficiencyamongvariouslentivirusescontaining GFP reporter in bone marrow hematopoietic stem cell transplantation[J].Experimental Hematology,2013,41(11):934-943.
[12]GENG X,DOITSH G,YANG Z,et al.Efficient delivery of lentiviral vectors into resting human CD4 T cells[J].Gene Therapy,2014,21(4):444-449.
(张蕾编辑)
Construction and role of mouse PLJM1-11β-HSD1-GFP plasmid
Jing Xin1,Lei Ye2,Ke Yang1,Ya-fei Shen1,Fei Deng1
(1.Department of Endocrinology,Luohe Central Hospital,Luohe,Henan 462000,China;2.Department of Neurology,the People's Hospital of Shaoling District,Luohe,Henan 462000,China)
ObjectiveTo construct a lentiviral vector of PLJM1-11β-HSD1-GFP and establish a stable cell line of 3T3-L1 with high expression of mousegene,and lay the foundation for the research ofgene.MethodsOpen reading frame(ORF)fragment of mouse tissues by RT-PCR,then inserted into the PLJM1-NRG1-GFP vector and transformed into competent DH5α strain ofThe plasmid was extracted and used for sequencing.The successfully-sequenced plasmid PLJM1-11β-HSD1-GFP and the packaging plasmid were transfected to 293T cell line to produce recombinant lentivirus.3T3-L1 cell line was transfected by recombinant virus and the stable cell line was isolated by selecting the single clone with GFP,and high expression of 11β-HSD1 was identified by Western blot.ResultsThe eukaryotic expression vector of PLJM1-11β-HSD1-GFP was constructed and confirmed by DNA sequencing.The lentivirus vector ofnamed PLJM1-11β-HSD1-GFP was successfully constructed and the virus was packaged in 293T cells.3T3-L1 cells were transfected by recombinant virus and the stable cell line was selected by green fluorescence efficiency,which showed that the lentivirus vector transfection rate was over 90%.A dramatically elevated protein level of 11β-HSDl was expressed in the positive clones of 3T3-L1 cells compared with the control group.Conclusions Mouse PLJM1-11β-HSD1-GFP plasmid has been successfully constructed.The 3T3-L1 cellsgene was amplified from mouse livertransfected by PLJM1-11β-HSD1-GFP could effectively elevate the expression ofgene,and can be used in the functional researches of mousegene,especially those related to obesity.
gene;eukaryotic expression vector;3T3-L1 cell;obesity
10.3969/j.issn.1005-8982.2017.16.003
1005-8982(2017)16-0012-06
Q782
A
2016-11-28
——一道江苏高考题的奥秘解读和拓展

