Halobacteriumsalinarium 5 L发酵罐中产细菌视紫红质(BR)发酵条件优化
董菲菲,张永杰,穆航帆,张 洪
(河南大学生命科学学院,生物工程研究所,河南开封 475004)
Halobacteriumsalinarium5 L发酵罐中产细菌视紫红质(BR)发酵条件优化
董菲菲,张永杰,穆航帆,张 洪*
(河南大学生命科学学院,生物工程研究所,河南开封 475004)
优化盐沼盐杆菌(Halobacteriumsalinarium)在5 L发酵罐中的生物量及细菌视紫红质含量的发酵条件,为该菌株的进一步应用提供依据。通过单因素实验考察温度、pH、搅拌转速、通气量和不同流速的玉米浆对盐沼盐杆菌的影响。优化后发酵条件为:温度37 ℃,转速250 r/min,通气量1.3 vvm,pH在发酵的过程中不用酸液和碱液调节,补加玉米浆的流速为0.2 mL/min。在此条件下,菌体的生物量(用OD600表示)达到4.531,细菌视紫红质的含量达到90.86 mg/L,与未优化的条件相比分别提高了43.8%、36%。
细菌视紫红质,培养条件,盐沼盐杆菌
盐沼盐杆菌(Halobacteriumsalinarium)生长于盐湖、晒盐场、海洋和盐渍品等环境中[1-3],它们需要NaCl的浓度为20%~30%[4-5]。盐沼盐杆菌属于嗜盐菌,嗜盐菌常被用于细菌视紫红质的生产[6]。
细菌视紫红质(bacteriorhodopsin,BR)简称BR,每个BR均是一个光驱的质子泵,被光子激发之后,能够将光能转化为化学能[7]。BR的这种性能被应用在光学设备、电子设备、化学传感、过滤装置中[8-9]。BR应用广泛,包括视网膜退化引起的失明、眼科疾病、疫苗疗法、恶性肿瘤以及其他疾病的治疗,除此之外还有基因转录调控、药物的缓释、传递和释放、诱导肿瘤细胞的凋亡或死亡[10-12]。
近些年来国内外学者对BR的应用进行了大量的研究,并取得了不少成果[13-14]。但对利用微生物发酵法生产BR的研究较少。发酵条件的优化对微生物的生长发育、繁殖及其代谢产物的合成起着重要的作用[15-18]。研究报道在一些培养条件下可以诱导紫膜的合成,使得细胞膜上的紫膜碎片的覆盖率超过50%[19]。
本文在摇瓶实验研究的基础上,得到最佳培养基配方后,进一步探究了温度、转速、通气量、pH及补料流速对H.salinarium在5 L发酵罐中菌体生物量及BR含量的影响,为该菌进一步扩大生产提供理论依据。
1 材料与方法
1.1 材料与仪器
菌株:盐沼盐杆菌(H.salinarium)CGMCC1.2368,系产紫膜菌株 中国微生物菌种保藏中心。酸水解酪蛋白、酵母浸粉 北京奥博星生物技术有限责任公司;MgSO4·7H2O、KCl 天津市科密欧化学试剂有限公司;NaCl 天津基准化学试剂有限公司;柠檬酸三钠 国药集团化学试剂有限公司;(NH4)2Fe(SO4)2·6H2O 天津市风船化学试剂科技有限公司;NaOH 天津市恒兴化学试剂制造有限公司;NH4OH 中平能化集团开封东大化工有限公司试剂厂;DNA酶 上海普洛麦格生物产品有限公司。实验室所用试剂均为分析纯。
5 L发酵罐 上海宝兴生物设备工程有限公司;752N型紫外可见分光光度计 上海仪电分析仪器有限公司;恒温培养振荡器ZWY-2102 上海智城分析仪器有限公司;SX-500全自动高压蒸汽灭菌锅 日本TOMY公司;超净工作台SW-CJ-2FD 苏州安泰空气技术有限公司。
1.2 实验方法
1.2.1 培养基 斜面培养基(g/L):酸水解酪蛋白6 g/L,酵母浸粉10 g/L,MgSO4·7H2O 20 g/L,NaCl 200 g/L,琼脂20 g/L,pH7.0;种子培养基(g/L):酸水解酪蛋白6 g/L,酵母浸粉10 g/L,MgSO4·7H2O 20 g/L,NaCl 200 g/L,pH7.0;初始发酵培养基(g/L):酸水解酪蛋白9 g/L,酵母浸粉15.156 g/L,MgSO4·7H2O 26.718 g/L,KCl 3.186 g/L,柠檬酸三钠5 g/L,(NH4)2Fe(SO4)2·6H2O 0.07 g/L,MnSO40.19 g/L,NaCl 200 g/L,pH7.0;补料培养基:4 g/L玉米浆200 mL。
1.2.2 菌体裂解液的配制 按照参考文献[20]配制裂解液,取90 mL去离子水,4 mol 的NaOH 5 mL,4 mol的NH4OH 5 mL,加入0.1 mg脱氧核糖核酸酶,混合均匀,置于4 ℃保存,备用。
1.2.3 发酵液中菌体生物量的检测 将每次取的发酵液8000 r/min离心10 min获得上清,作为对照组,用紫外可见分光光度计检测发酵液的生物量,菌体的生物量用OD600表示。
1.2.5 5 L发酵罐培养条件
1.2.5.1 初始发酵条件 5 L发酵罐按3 L的装液量将发酵培养基加入发酵罐中,在121 ℃的条件下灭菌20 min,待培养基冷却到发酵设置温度,且通气量及转速稳定后,按照10%的接种量将活化好的种子液接入发酵罐中,未优化前培养温度37 ℃,搅拌转速200 r/min,通氧量1.2 vvm,pH为7.0,发酵过程中不用酸液和碱液进行调节。
1.2.5.2 发酵条件优化 分别优化发酵温度、pH、搅拌转速、通气量,依次探究了 发酵培养温度32、37、42 ℃,pH7.01~7.40、7.41~7.80、7.81~8.20及初始pH7.0(发酵过程不进行pH控制),搅拌转速200、250、300 r/min,通气量1.2、1.3、1.4 vvm,及补料流速对H.salinarium菌株发酵过程的影响,每24 h取一次样,检测发酵液中菌体的生物量和BR的含量,用来确定最优的发酵条件。
1.2.6 数据统计分析方法 本实验数据均为3次重复实验结果的平均值。采用SPSS 20.0 统计软件进行数据分析,利用origin 8.0 软件进行作图。
2 结果与讨论
2.1 发酵罐的初始培养和BR的含量
盐沼盐杆菌的初始培养使用的是未加入玉米浆的发酵培养基,在1.2.5的发酵条件下,盐沼盐杆菌的生物量和BR含量如图1所示。
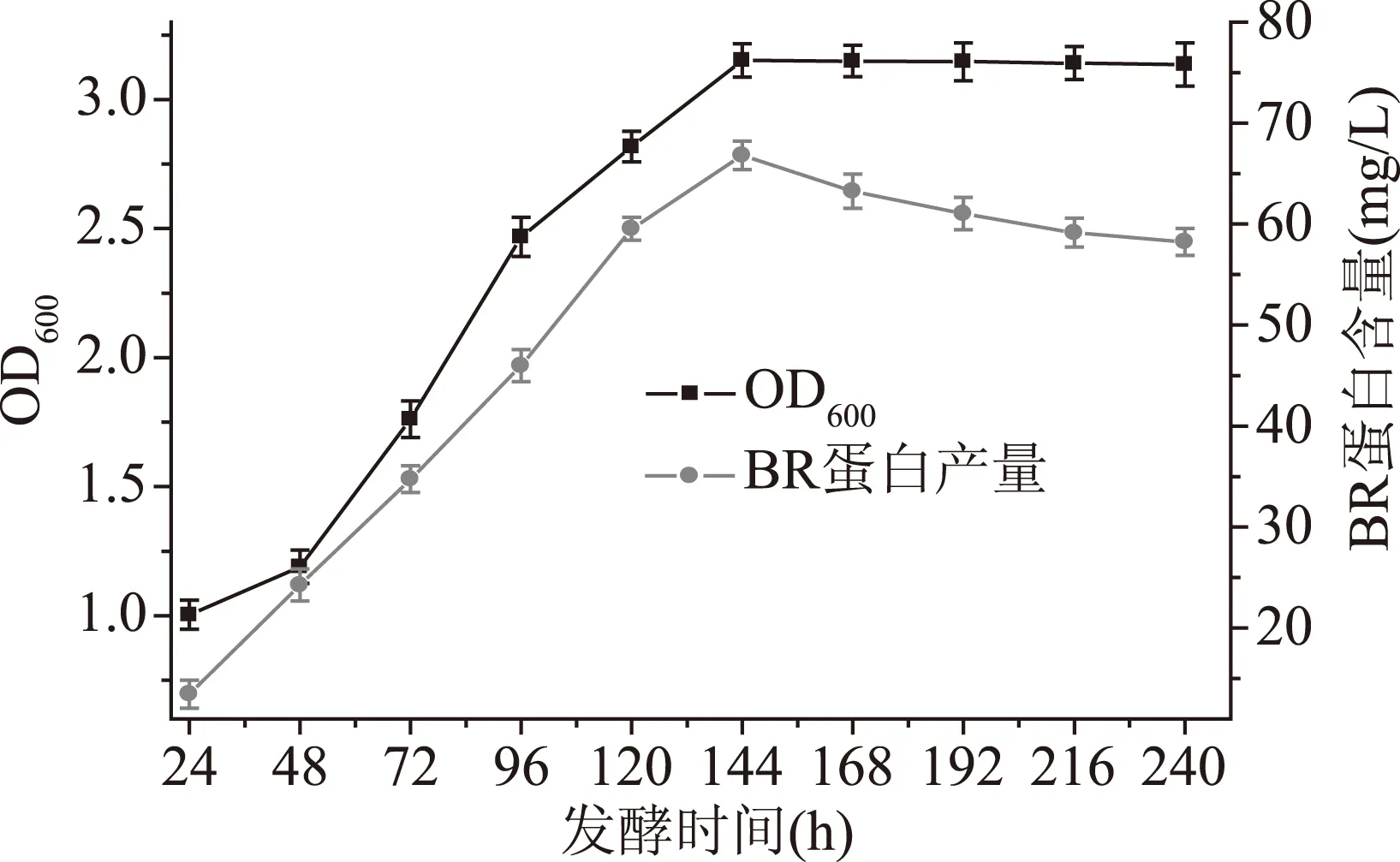
图1 初始条件对盐沼盐杆菌发酵过程的影响Fig.1 Effect of initial fermentation conditions on the fermentation process of H. salinarium
从图1得出盐沼盐杆菌的生物量在24~144 h期间都是增大的,在发酵前48 h,菌体的生物量增加缓慢,48 h后菌体的生物量增加较大,在发酵第144 h时,菌体生物量达到最大,之后菌体的生物量趋于稳定,菌体的生物量最大是3.151。BR含量在24~144 h持续增加,在发酵144 h时,BR的含量达到最大,随后伴随发酵的继续进行BR的含量开始逐渐下降。蛋白的含量最大为66.79 mg/L。因此确定最佳的发酵时间是144 h。Seyedkarimi[23]等人使用摇瓶培养盐沼盐杆菌,培养时间为12 d,菌体的生物量在第7 d达到最大值,之后菌体生长进入平稳期,菌体的生物量最大为2.95。BR的含量在第7 d达到最大值为46 mg/L。通过与实验所得的结果进行对比得出:使用发酵罐培养盐沼盐杆菌可以使它的生物量和BR含量增多。
2.2 温度对盐沼盐杆菌发酵过程的影响
温度对菌体生长发育、繁殖及代谢产物合成有重要的影响。本文研究了不同温度对盐沼盐杆菌的生物量及合成BR含量的影响。实验中分别控制发酵罐温度为32、37、42 ℃。不同温度对盐沼盐杆菌的生物量和BR含量的影响如图2所示。
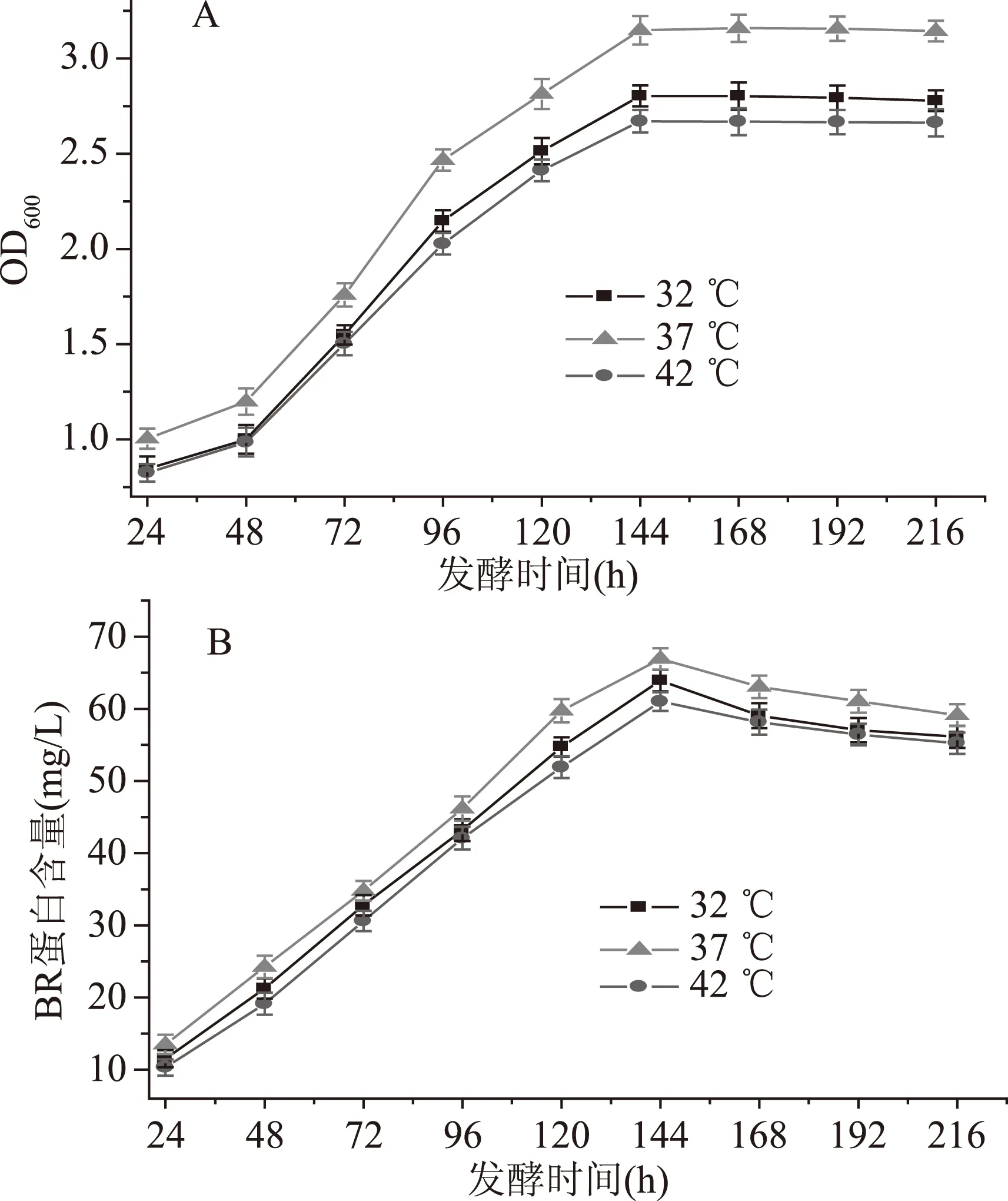
图2 温度对盐沼盐杆菌发酵过程的影响Fig.2 Effect of temperature on the fermentation process of H. salinarium
从图2A得知,温度对盐沼盐杆菌的生长有较大的影响。当32、37、42 ℃时菌体的生物量在24~144 h都是增加的,在144 h达到最大值,分别为2.802、3.158、2.67,之后菌体生物量几乎不变化。当温度从32 ℃升高到37 ℃,随着温度的升高,菌体生长增快,但是当温度为42 ℃时菌体生长缓慢,这可能是由于菌体内部没有合成RNA[22],说明温度较高时不利于菌体的生长,通过图2B可得,当32、37、42 ℃时BR含量都是持续增加的,在144 h时达到最大值,BR含量分别为63.92、66.92、61.02 mg/L,之后BR含量开始下降。发酵温度为37 ℃时利于菌体的生长和BR的合成,最终选定温度为37 ℃,这个结果与其他研究者的一致[24]。
2.3 pH对盐沼盐杆菌发酵过程的影响
pH是决定实验结果的关键因素之一,它对菌体的生长和产物的合成起主要作用。为了确定pH对菌体生物量和BR含量的影响,实验分别探究了初始pH为7.0(在发酵过程中对pH不进行调控)及发酵过程中将pH控制在7.01~7.40、7.41~7.80、7.81~8.20范围内,所得的结果如图3所示。
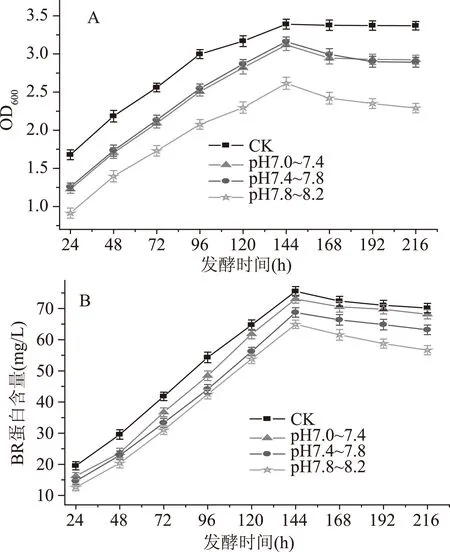
图3 pH对盐沼盐杆菌发酵过程的影响Fig.3 Effect of pH on the fermentation process of H. salinarium
从图3A得出,pH的变化对菌体的生物量有一定的影响,图中CK表示初始的pH为7.0(在发酵过程不进行pH控制),pH为7.01~7.40、7.41~7.80的菌体生物量均大于pH在7.81~8.20的菌体生物量;发酵时间为24~144 h时,在设置的pH范围内菌体的生物量一直增加,当培养基初始pH为7.0(在发酵过程不进行pH控制)时,菌体的生物量在发酵的第144 h达到最大,为3.39,之后菌体的生物量几乎不变化。从图3B可以得到pH对视紫红质含量的影响,pH为7.01~7.40、7.41~7.80的BR含量均大于pH在7.81~8.20的BR含量;在发酵的第144 h时BR含量都达到最大,之后BR的含量开始下降;当培养基初始的pH为7.0(在发酵过程不进行pH控制)时BR的含量最多,为75.54 mg/L。因此,发酵时设置初始pH为7.0(在发酵过程不进行pH控制)。
2.4 搅拌转速对盐沼盐杆菌发酵过程的影响
发酵过程中氧的浓度是影响发酵的又一个重要因素,高的搅拌转速利于氧气迅速溶解发酵液中。为了确定合适的搅拌转速,实验分别考察了搅拌转速为200、250、300 r/min时,盐沼盐杆菌的生长及BR含量如图4所示。
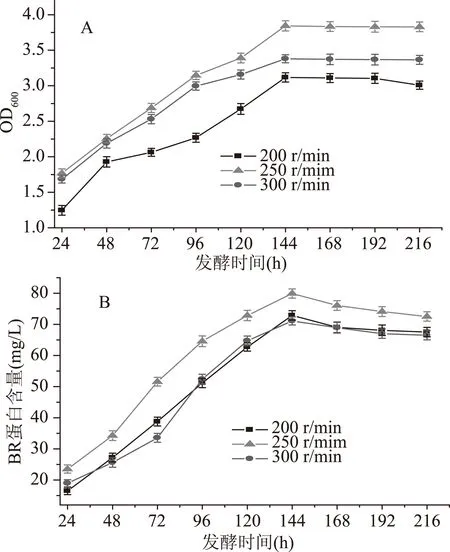
图4 搅拌转速对盐沼盐杆菌发酵过程的影响Fig.4 Effect of agitation speed on the fermentation process of H. salinarium
从图4A得知,搅拌转速为200、250、300 r/min菌体的生物量在发酵时间为144 h时都达到最大,之后趋于稳定,菌体的生物量分别为3.118、3.843、3.38。当转速为200 r/min菌体的生物量变化较慢,随着转速增加菌体的生物量变大,当转速达到300 r/min时,菌体的生物量没有继续增加,这说明转速提高,体系的剪切力随之变大,对菌体的生长不利。从图4B得出BR的含量在144 h达到最大,之后BR的含量开始减少。BR的含量分别为72.92、79.92和71.11 mg/L。转速为300 r/min时BR含量的最大值比其他条件的最大值都小,原因可能是溶解氧对BR合成有较大的影响,氧含量不高的情况下有利于BR的合成,高浓度的氧抑制BR的形成[25-26]。因此,转速的变化直接影响氧在发酵液中的传质效率,进而影响菌体的生长和产物的合成,最终选择250 r/min为最适搅拌转速。
2.5 通气量对盐沼盐杆菌发酵过程的影响
通气量是决定供氧的一个重要的因素,通气量增加可以使发酵罐内截面气速增加,发酵液的气含率增加,进而增加气-液的比表面积,这样有利于氧的传递。为了确定合适的通气量,实验考察的通气量分别为1.2、1.3、1.4 vvm,盐沼盐杆菌的生长及BR含量,如图5所示。
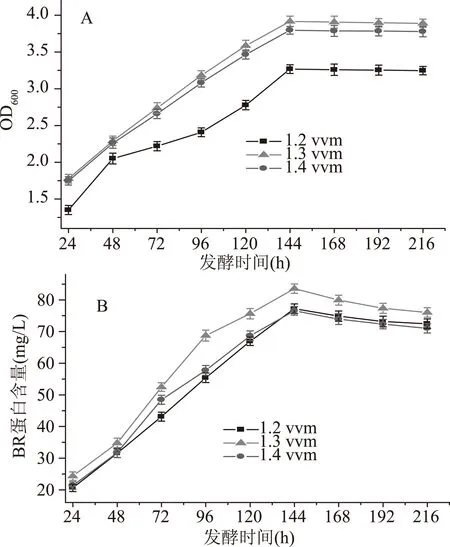
图5 通气量对盐沼盐杆菌发酵过程的影响Fig.5 Effect of ventilation volume on the fermentation process of H. salinarium
从图5A得出菌体的生物量在发酵时间为144 h达到最大值,分别是3.268、3.916和3.796,在通气量为1.2 vvm时菌体生长较慢,随着通气量的增加菌体的生物量也增大,说明通气量过小,使发酵液中的氧含量不高,菌体的生长受到抑制,在通气量为1.3 vvm时,菌体生长旺盛,但是当通气量为1.4 vvm时,菌体的生物量没有继续增大,说明通气量过大使氧的传质效率变小,从而影响菌体的生长。从图5B得出BR的含量在发酵的第144 h达到最大,之后BR的含量开始降低。BR的含量分别为77.24、83.56和76.56 mg/L。通气量为1.4 vvm时BR的含量都小于其他通气量条件下的BR含量,原因可能是氧含量对BR的合成起主要的作用,低氧含量的情况下更有利于BR的形成[25-26]。因此,氧的传递和氧的含量直接影响菌体的生长和BR的合成,溶解氧在发酵过程中是一个特别重要的限制因子。最终选择的通气量为1.3 vvm。
2.6 不同流速的玉米浆对盐沼盐杆菌发酵过程的影响
玉米浆作为一种较好的微生物生长或代谢产物合成的促进剂已经广泛用于发酵生产中。为了获得最佳的补料流速,实验考察了在菌体生长的对数期即菌体生长的第四天进行补料,补料流速分别为0.1、0.2和0.3 mL/min时,盐沼盐杆菌的生长及BR含量,如图6所示。以不补玉米浆作为对照。
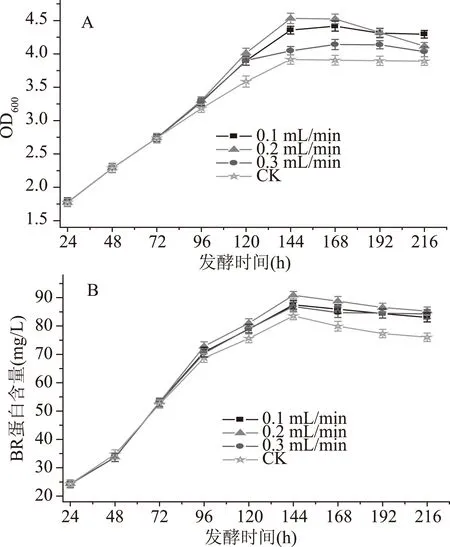
图6 不同流速的玉米浆对盐沼盐杆菌发酵过程的影响Fig.6 Effect of corn pulp with different flow rates on the fermentation process of H. salinarium
由图6A可知,补加玉米浆后菌体的生物量均增大,玉米浆流速为0.2 mL/min和没有补加玉米浆的菌体的生物量在发酵的第144 h均达到最大,分别为4.531、3.916,设置玉米浆的流速为0.1 mL/min和0.3 mL/min时菌体的生物量在发酵96~120 h内增加的幅度一致,在发酵的第168 h达到最大值,分别为4.416、4.141。BR的含量如图6B,在发酵的第144 h达到最大值,分别为83.56、87.46、90.86、86.86 mg/L。说明玉米浆的流速为0.2 mL/min时有利于菌体的生长和BR的合成,因此在发酵过程中补加合适流速的物质对菌体的生长和产物的合成有显著的影响,最终选择补加的流速为0.2 mL/min。
3 结论
目前,BR是一类“绿色”的生物材料,它可以用于许多领域,研究意义重大。BR的获取主要是借助于摇瓶的生产,因此加强对BR含量的研究具有重要的现实意义。
本文在5 L发酵罐中,研究了温度、pH、转速、通氧量及补加不同流速的玉米浆对盐沼盐杆菌的生长和BR含量的影响。在发酵的过程中菌体生物量是先增大后趋于稳定,BR含量的变化趋势是先增加达到最大值后开始逐渐下降。在发酵过程中温度过高不利于菌体的生长,氧含量过高抑制BR的合成。在发酵过程中补加玉米浆可以使菌体的生物量增加,BR的含量也随之增多。最终确定最佳的条件是温度37 ℃,转速为250 r/min,初始pH为7.0(在发酵过程不进行pH控制),通气量为1.3 vvm,补加玉米浆的流速为0.2 mL/min,优化后菌体的生物量达到4.531,BR含量达到90.86 mg/L,和未优化的条件相比分别提高43.8%、36%,本次实验为盐沼盐杆菌的工业化生产提供了依据。
[1]魏晓星,侯雪. 嗜盐菌的基本特性分析[J]. 科技资讯,2013(20):252-253.
[2]Suezawa Y,Tamura A. Spoilage of Food by Halotolerant Lactic Acid Bacteria and its Prevention[J]. Journal of the brewing society of Japan,2008,103(2):94-99.
[3]高瑞昌,赵梦琴,石彤,等. 嗜盐古生菌Halobacteriaceaesp.产胞外蛋白酶特性及其酶学性质[J]. 食品与发酵工业,2016,42(11):65-70.
[4]Chuprom J,Bovornreungroj P,Ahmad M,et al. Approach toward enhancement of halophilic protease production byHalobacterium,sp. strain LBU50301 using statistical design response surface methodology[J]. Biotechnology Reports,2016,10(C):17-28.
[5]Tapingkae W,Tanasupawat S,Parkin K L,et al. Degradation of histamine by extremely halophilic archaea isolated from high salt-fermented fishery products[J]. Enzyme & Microbial Technology,2010,46(2):92-99.
[6]Sang Y L,Chang H N,Um Y S,et al. Bacteriorhodopsin production by cell recycle culture ofHalobacteriumhalobium[J]. Biotechnology Letters,1998,20(8):763-765.
[7]Koch M K,Oesterhelt D. MpcT is the transducer for membrane potential changes inHalobacteriumsalinarum[J]. Molecular Microbiology,2005,55(6):1681-1694.
[8]Puthenveetil R,Vinogradova O. Optimization of the design and preparation of nanoscale phospholipid bilayers for its application to solution NMR[J]. Proteins-structure Function & Bioinformatics,2013,81(7):1222-31.
[9]Knoblauch C,Griep M,Friedrich C. Recent Advances in the Field of Bionanotechnology:An Insight into Optoelectric Bacteriorhodopsin,Quantum Dots,and Noble Metal Nanoclusters[J]. Sensors,2014,14(10):19731-19766.
[10]Grout M J. Application of bacteriorhodopsin for optical limiting eye protection filters[J]. Optical Materials,2000,14(2):155-160.
[11]Patil A V,Premaraban T,Berthoumieu O,et al. Engineered Bacteriorhodopsin:A Molecular Scale Potential Switch[J]. Chemistry-A European Journal,2012,18(18):5632-5636.
[12]Dummer A M,Bonsall J C,Cihla J B,et al. Bacterioopsin-Mediated Regulation of Bacterioruberin Biosynthesis inHalobacteriumsalinarum[J]. Journal of Bacteriology,2011,193(20):5658-67.
[13]Mohammadpour R,Janfaza S,Zeinoddini M. Potential of light-harvesting of bacteriorhodopsin co-sensitized with green fluorescence protein:A new insight into bioenergy application[J]. Biomass & Bioenergy,2016,87:35-38.
[14]Mahyad B,Janfaza S,Hosseini E S. Bio-nano hybrid materials based on bacteriorhodopsin:Potential applications and future strategies.[J]. Advances in Colloid & Interface Science,2015,225:194-202.
[15]陈蔚青,李一飞,申屠超. 响应面法优化一株中度嗜盐菌的培养条件[J]. 食品工业科技,2013,34(1):140-144.
[16]祝亚娇,宋嘉宾,陈杨阳,等. 地衣芽胞杆菌工程菌高产纳豆激酶的发酵罐工艺优化及中试放大[J]. 食品与发酵工业,2016,42(1):37-41.
[17]Chuprom J,Bovornreungroj P,Ahmad M,et al. Approach toward enhancement of halophilic protease production byHalobacterium.sp. strain LBU50301 using statistical design response surface methodology[J]. Biotechnology Reports,2016,10:17-28.
[18]Irfan M,Asghar U,Nadeem M,et al. Optimization of process parameters for xylanase production by Bacillus. sp. in submerged fermentation[J]. Journal of Radiation Research & Applied Sciences,2016,9(2):139-147.
[19]Henderson R,Baldwin J M,Ceska T A,et al. Model for the structure of bacteriorhodopsin based on high-resolution electron cryo-microscopy[J]. Journal of Molecular Biology,1990,213(4):467-467.
[20]Ghasemi M F,Shodjai-Arani A,Moazami N. Optimization of bacteriorhodopsin production byHalobacteriumsalinariumPTCC 1685[J]. Process Biochemistry,2008,43:1077-1082.
[21]Shiu P J,Ju Y H,Chen H M,et al. Facile isolation of purple membrane fromHalobacteriumsalinarum,via aqueous-two-phase system[J]. Protein Expression & Purification,2013,89(2):219-224.
[22]Ratkowsky D A,Olley J,Mcmeekin T A,et al. Relationship between temperature and growth rate of bacterial cultures[J]. Journal of Bacteriology,1982,149(1):1-5.
[23]Seyedkarimi M S,Aramvash A,Ramezani R. High production of bacteriorhodopsin from wild typeHalobacteriumsalinarum[J]. Extremophiles,2015,19(5):1021-1028.
[24]Lu H,Yuan W,Cheng J,et al. Modeling the Growth of ArchaeonHalobacteriumhalobium,Affected by Temperature and Light[J]. Applied Biochemistry & Biotechnology,2017,181:1080-1095.
[25]Shand R F,Betlach M C. Expression of the bop gene cluster ofHalobacteriumhalobiumis induced by low oxygen tension and by light[J]. Journal of Bacteriology,1991,173(15):4692-4699.
[26]Nazeerullah R,Thajuddin N,Syed M R. Studies on bacteriorhodopsin synthesis in UV induced MutantHalobacteriumsalinariumwith different time of UV exposure[J]. Microbiology,2016,5(1):571-573.
Fermentation conditions optimization of producing bacteriorhodopsin byHalobacteriumsalinariumin a 5 L fermentor
DONG Fei-fei,ZHANG Yong-jie,MU Hang-fan,ZHANG Hong*
(College of Life Science,Henan University,Kaifeng 475004,China)
The technological conditions for bacteriorhodopsin and biomass by theHalobacteriumsalinariumin a 5 L fermenter were optimized,in order to provide the basis for further application of the strain. The effects of temperature,pH,agitation speed,ventilation volume and corn pulp with different flow rates on theHalobacteriumsalinariumwere investigated by single factor experiments. The optimum fermentation conditions were temperature at 37 ℃,agitation speed at 250 r/min,ventilation volume at 1.3 vvm,flow rate of corn pulp at 0.2 mL/min. pH was not regulated by acid and alkali in the fermentation process. Under these conditions,the maximum biomass was 4.531,the maximum BR yield was 90.86 mg/L,which was about respectively 43.8%、36% greater than those obtained with initial fermentation conditions.
bacteriorhodopsin;culture condition;Halobacteriumsalinarium
2017-01-19
董菲菲(1989-),女,在读研究生,研究方向:生物物质分离工程研究,E-mail:dff890106@126.com。
*通讯作者:张洪(1964-),男,博士,副教授,主要从事生物物质分离及生物材料的研究,E-mail:zhanghong4601@163.com。
河南省科技攻关项目(142102210392)。
TS201.3
A
1002-0306(2017)15-0164-05
10.13386/j.issn1002-0306.2017.15.031
——乌尤尼盐沼

