妊娠期PM2.5,暴露影响子代鼠主要脏器发育
郑昕蕊,赵会,田换兵,张红霞,张雪莉,吴洪娟,于丽*
(潍坊医学院1临床医学院,2生物科学与技术学院,潍坊261053)
妊娠期PM2.5,暴露影响子代鼠主要脏器发育
郑昕蕊1,赵会1,田换兵2,张红霞1,张雪莉1,吴洪娟1,于丽1*
(潍坊医学院1临床医学院,2生物科学与技术学院,潍坊261053)
目的 探讨妊娠期大气细颗粒物PM2.5(颗粒直径≤2.5μm)暴露对子代鼠主要脏器发育的影响。方法 孕鼠随机分为空白组、对照组、PM2.5低剂量组、PM2.5中剂量组、PM2.5高剂量组。利用气管滴注方法,建立小鼠妊娠期PM2.5暴露模型。通过HE染色和PAS反应,观察妊娠期暴露于PM2.5后新生子代鼠主要脏器的病理形态学改变,通过电子显微镜观察细胞超微结构变化。结果 与空白组和对照组相比,PM2.5模型组新生子代鼠心、肝、脾、肺和肾组织结构均受损,可见炎症等病理改变。子代鼠主要脏器超微结构出现不同程度的细胞核周隙局部增宽、自噬体增多、线粒体嵴模糊和断裂等变化。结论 妊娠期暴露于PM2.5可导致新生子代鼠心、肝、脾、肺、肾等主要脏器出现组织形态异常。这可能是PM2.5致生后远期慢性疾病发生的解剖学基础和发育源性病因。
妊娠期PM2.5暴露;子鼠;主要脏器;炎症
大气细颗粒物PM2.5(fine particulate matter with diameter of ≤2.5μm)是指空气动力学当量直径小于等于2.5μm的颗粒物,可造成机体多个系统不同程度的损伤[1]。PM2.5组成成分复杂,可吸附大量重金属元素和有毒有机污染物,肺部产生的炎性因子及超细颗粒物可通过支气管和肺泡进入血液循环并经胎盘直接影响孕妇和新生儿[2]。流行病学调查研究表明,长期暴露于空气污染的环境中,孕妇的流产率明显增高,且更易造成胎儿各种畸形的发生,妊娠期PM2.5暴露可影响婴儿的生长发育。Faiz等[3]发现在孕妇分娩前短期暴露于高浓度PM2.5可增加死产的风险。本课题组前期采用动物实验研究发现随孕期PM2.5吸入剂量的增加,孕鼠体重增长明显变缓,妊娠天数减少,主要脏器出现病理改变[4]。虽然目前对PM2.5的研究较多,但关于其对子代鼠的主要脏器发育情况的影响研究较少。本研究通过建立妊娠期PM2.5暴露模型,观察妊娠期PM2.5暴露后新生子代鼠脏器的发育情况,进一步探讨妊娠期PM2.5暴露对子代鼠主要脏器发育的影响,从而评价妊娠期空气污染物暴露对胎儿的全身性毒性作用,为更好地预防PM2.5引起的不良后果提供依据。
材料与方法
1 实验动物
选用6~8周龄普通级昆明小鼠,雌鼠体重28~33g,雄鼠体重32~36g(山东青岛市动物实验中心提供)。饲养条件:适应喂养1周,室内温度25℃,自由饮水、进食。
2 PM2.5标本的采样和处理
采用大气颗粒物采样器,收集2014年12月至2015年2月采暖季某地城区大气PM2.5。样品制备方法参考课题组前期的研究[4]。
3 动物分组和模型制备
受试动物按照2:1雌雄比合笼,次日查出阴栓者记为妊娠第0d(E0)。将孕鼠随机分为空白组、对照组、低剂量组、中剂量组和高剂量组,每组6只。空白组不做任何处理;对照组气管内滴注30µl PBS;低、中、高剂量组按照文献[4]分别注入浓度为0.2592µg/µl、1.56695µg/µl和3.456µg/µl的30µl PM2.5混悬液,从E0至分娩,每3d采用快速小鼠气管滴注改良法滴注1次,共7次(即妊娠第1、4、7、10、13、16、19d滴注)。
4 新生子代鼠主要脏器病理学观察
分娩后当天,取新生子代鼠心、肝、脾、肺、肾组织,4%多聚甲醛固定,常规石蜡包埋,连续切片,肝、脾组织切片厚4μm,肺、心、肾组织厚5μm,常规HE染色,镜下观察、拍照。
PAS染色:肝、肾石蜡切片,常规脱蜡至水后,蒸馏水浸洗2次。过碘酸室温浸染20min,自来水冲洗5min,Shiff试剂浸染2min,自来水冲洗5min,苏木精染核1min,分化返蓝,逐级常规乙醇脱水,二甲苯透明,中性树胶封固。镜下观察,拍照。
5 新生子代鼠主要脏器超微结构观察
将新生子代鼠心、肝、脾、肺、肾组织切成1mm3左右的立方体,并置于2.5%戊二醛中固定,制备超薄切片,醋酸铀及枸橼酸铅双重染色,透射电镜下进行观察、拍照。
结 果
1 妊娠期PM2.5暴露引起新生子代鼠主要脏器组织形态学异常
心脏HE染色检测发现,对照组(图1A)心肌组织排列紧密有序,结构清晰;PM2.5低剂量组(图1B)可见心肌组织排列稍疏松;PM2.5中剂量组(图1C,1D)心肌组织排列疏松增加,心肌组织间隙增宽,炎性细胞分布增多;PM2.5高剂量组(图1E,1F)心脏损害严重,可见心肌结构紊乱,心肌细胞灶性坏死,部分核固缩、消失,间质水肿充血,可见炎细胞浸润,心肌细胞呈波浪形改变。
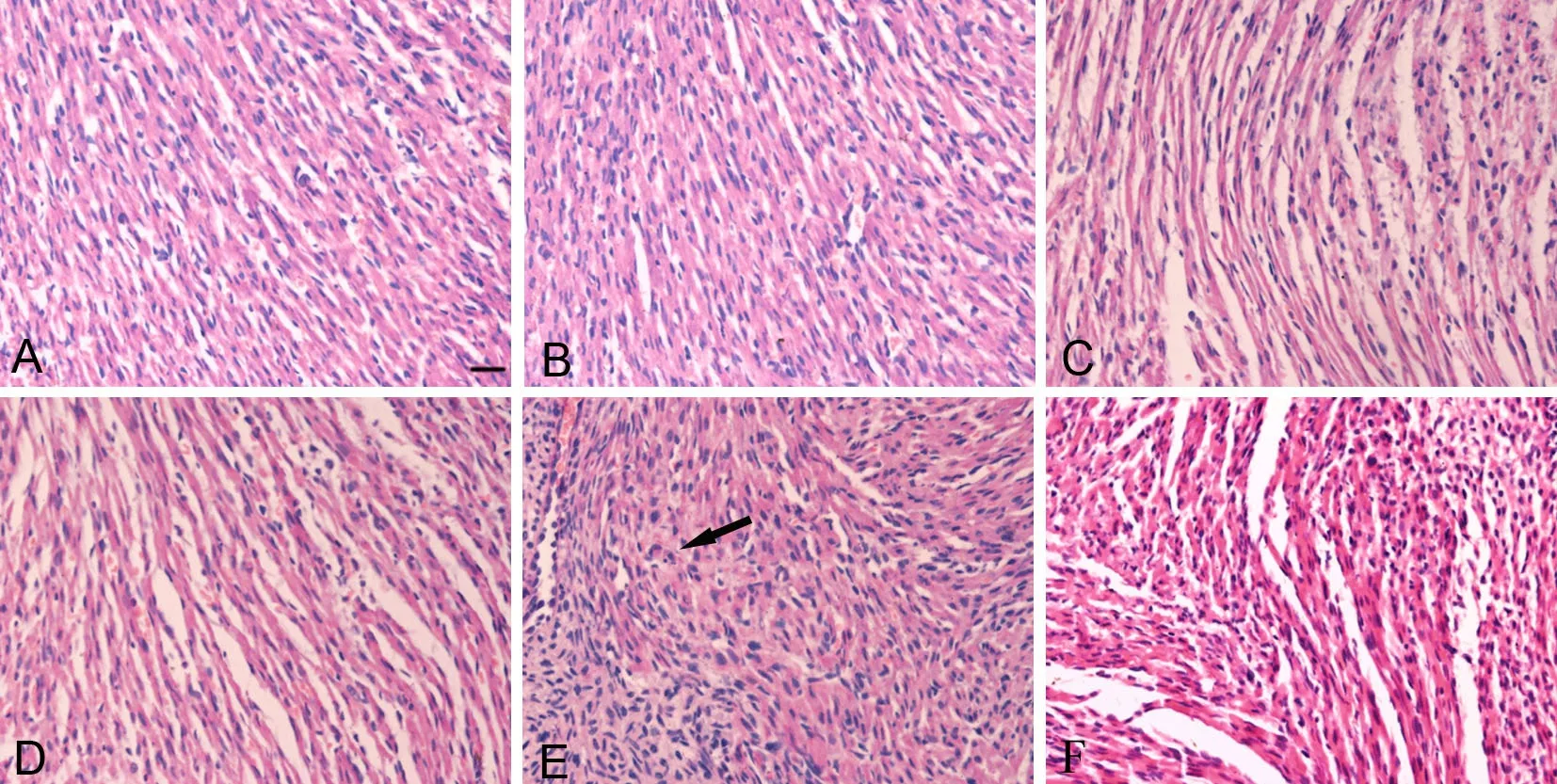
图1 妊娠期PM2.5暴露对新生子代鼠心脏组织形态学的影响。A,对照组;B,低剂量组;C和D,中剂量组;E和F,高剂量组;箭头示心肌细胞坏死;比例尺,20μmFig.1 Effect of PM2.5 exposure during pregnancy on the histological morphology of newborn mouse heart. A, control group; B, low dose group; C and D, medium dose group; E and F, high dose group; Arrow indicates myocardial necrosis; scale bar: 20μm
肝脏PAS染色可见,对照组肝组织糖原被染成红色颗粒呈团块状分布在细胞胞浆内;糖原分布广,含量丰富(图2A)。随着染毒剂量增加,肝组织糖原减少或消失(图2B-D)。高剂量组肝组织结构紊乱,肝细胞水肿,出现明显脂肪变性,肝细胞浑浊,可见炎细胞浸润,部分肝细胞核固缩,可见巨噬细胞(图2E-F)。
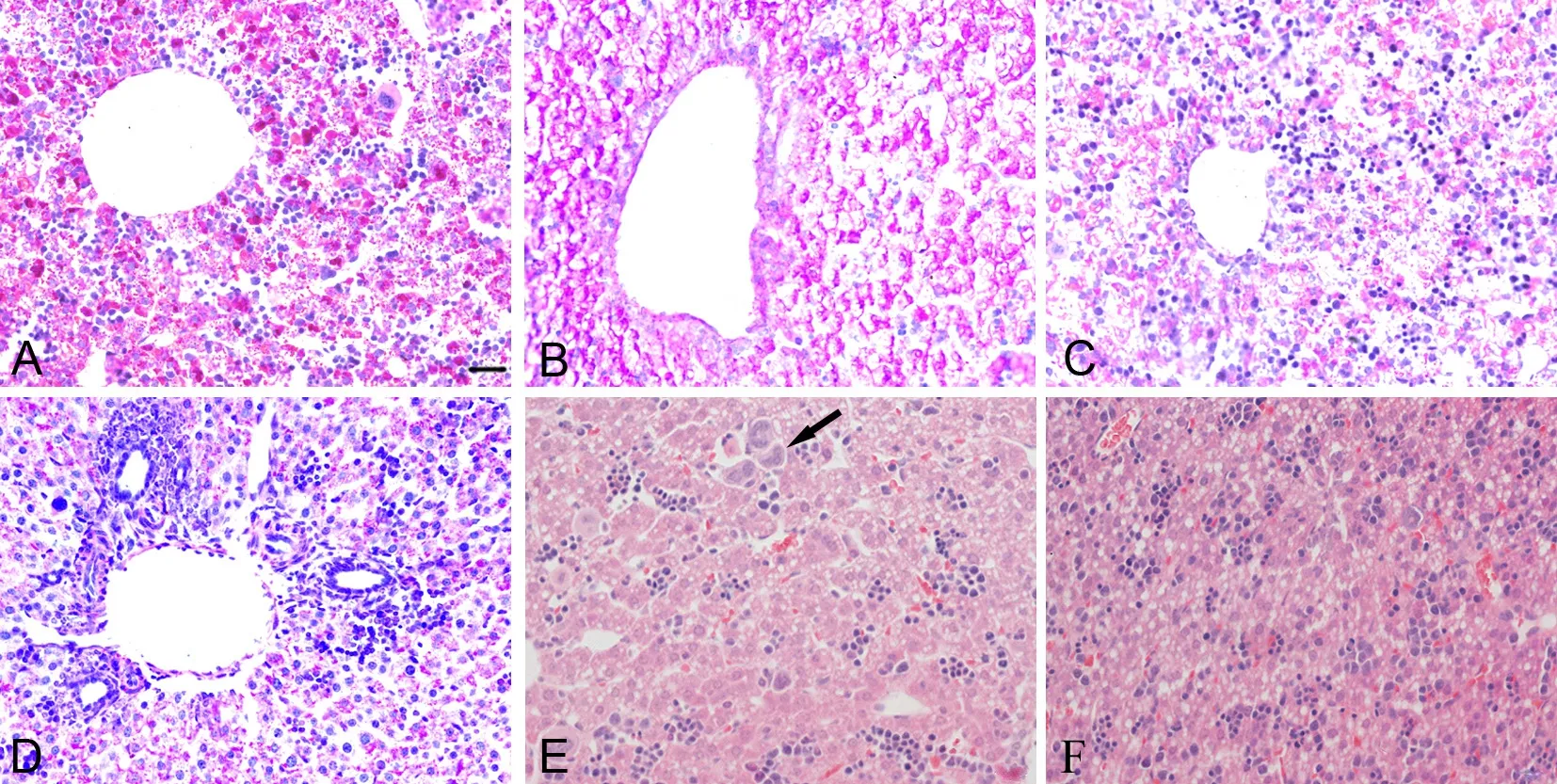
图2 妊娠期PM2.5暴露对新生子代鼠肝组织形态学的影响。A,对照组;B,低剂量组;C,中剂量组;D-F,高剂量组;A-D,PAS染色;E和F,HE染色;箭头示巨噬细胞;比例尺,20μmFig.2 Effect of PM2.5 exposure during pregnancy on the histological morphology of newborn mouse liver. A, control group; B, low dose group; C, medium dose group; D to F, high dose group; A to D, PAS staining; E and F, HE staining; arrow points to the macrophages; scale bar, 20μm
脾脏HE染色检测发现,对照组子鼠脾白髓边缘区界线清楚,均匀致密蓝染,组织排列有序(图3A);与对照组相比,PM2.5剂量组脾有明显的组织结构异常,红髓白髓界线不清,脾窦变窄,团块状结构消失,且有炎性细胞浸润,有轻微淤血(图3B-F),异常程度随PM2.5剂量增加逐渐加重。
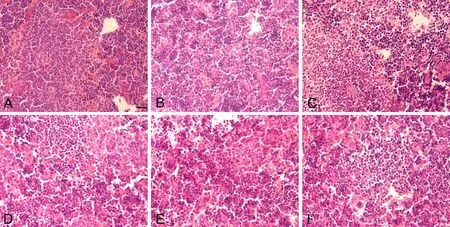
图3 妊娠期 PM2.5暴露对新生子代鼠脾组织形态学的影响。A,对照组;B,低剂量组;C和D,中剂量组;E和F,高剂量组;比例尺,20μmFig.3 Effect of PM2.5 exposure during pregnancy on the histological morphology of newborn mouse spleen. A, control group; B, low dose group; C and D, medium dose group; E and F, high dose group; scale bar, 20μm
肺脏HE染色检测显示,对照组(图4A)、PM2.5低剂量组和中剂量组(图4B-C)肺组织未见明显异常;PM2.5高剂量组肺泡腔较小,肺泡间隔明显增宽、断裂、充血,部分肺泡间隔断裂,肺泡腔融合,小血管充血明显(图4D-F)。
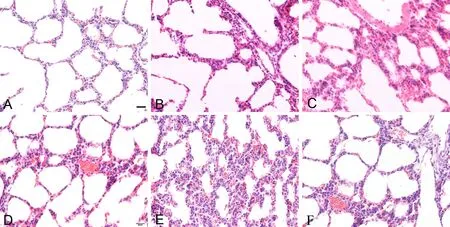
图4 妊娠期 PM2.5暴露对新生子代鼠肺组织形态学的影响。A,对照组;B,低剂量组;C,中剂量组;D-F,高剂量组;比例尺,20μmFig. 4 Effect of PM2.5 exposure during pregnancy on histological morphology of newborn mouse lung. A, control group; B, low dose group; C, medium dose group; D to F, high dose group; scale bar, 20μm
肾脏HE染色检测发现,对照组(图5A)未见明显异常,PM2.5低、中、高剂量组(图5B-D)均有不同程度肾小球固缩,肾小管上皮细胞水肿,其中PM2.5高剂量组(图5D)肾小球固缩最明显。PAS染色可见,PM2.5高剂量组系膜细胞和基质轻度增生,肾小球基底膜粗细不均(图5E-F)。
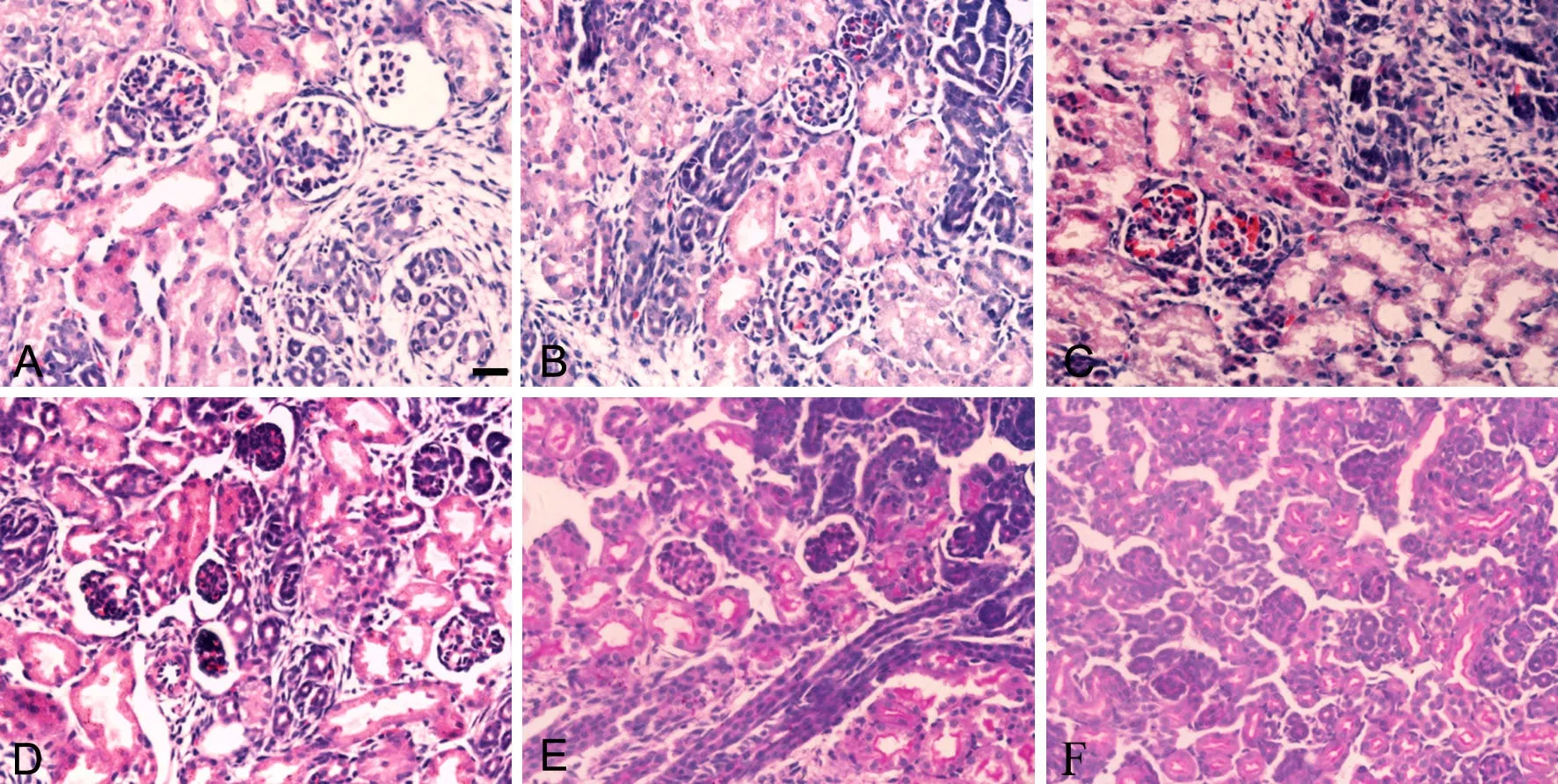
图5 妊娠期PM2.5暴露对新生子代鼠肾组织形态学的影响。A,对照组;B,低剂量组;C,中剂量组;D-F,高剂量组;A-D,HE染色;E和F,PAS染色;比例尺,20μmFig.5 Effect of PM2.5 exposure during pregnancy on histological morphology of newborn mouse kidney. A, control group; B, low dose group; C, medium dose group; D to F, high dose group; A to D, HE staining, E and F, PAS staining. arrow points to macrophages; scale bar, 20μm
2 妊娠期PM2.5暴露引起新生子代鼠主要脏器超微结构异常
心脏标本电镜检查结果显示:对照组(图6Aa)新生小鼠心肌细胞线粒体丰富,包膜完整,嵴排列整齐、连续、密集,基质电子密度正常,肌节规则,结构清晰,细胞核正常;PM2.5高剂量组(图6Ab,图6Ac)心肌细胞线粒体嵴出现断裂、局部模糊、部分线粒体基质出现空泡状,心肌细胞胞浆内可见大量脂褐素。
肝脏标本电镜检查结果显示:从对照组(图6Ba)肝细胞核核膜清晰,核仁明显;核周线粒体、粗面内质网等细胞器非常丰富,线粒体为卵圆形或球形,线粒体嵴清晰,基质密度适中;粗面内质网比较发达,毛细胆管及桥粒清晰可见。PM2.5高剂量组(图6Bb,图6Bc)可见粗面内质网扩张,线粒体嵴模糊,呈空泡样改变和髓鞘样改变,胞质内分散大小不等的脂滴,并形成自噬体。
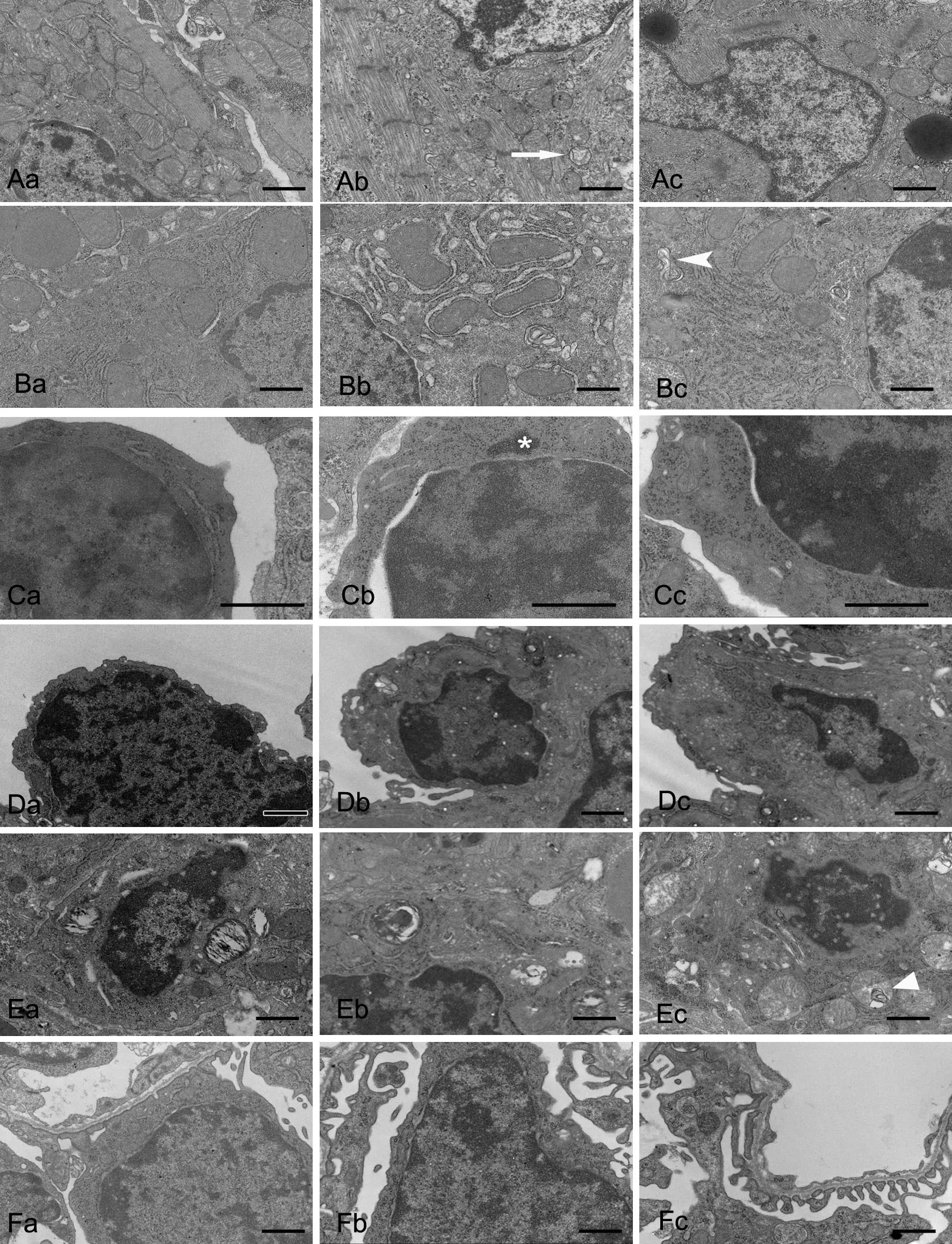
图6 妊娠期PM2.5暴露对新生子代鼠主要脏器超微结构的影响。a,对照组;b和c,高剂量组;A,心肌细胞,长箭头示线粒体空泡样变;B,肝细胞,短箭头示自噬体;C,淋巴细胞,星号示染色质外移;D,Ⅰ型肺泡细胞;E,ⅠⅠ型肺泡细胞,三角形示线粒体髓鞘样变;F,足细胞;比例尺,1.0μmFig. 6 Effect of PM2.5 exposure on ultrastructures of the important organs of the newborn mice. a, control group; b and c, high dose groups; A, cardiomyocyte, the long arrow points to the vacuolation of the mitochondrion; B, hepatocyte, the short arrow points to the autophagosome; C, lymphocyte, the asterisk indicates the chromatin that drops out into the cytoplasm; D, type Ⅰ alveolar cell; E, type ⅠⅠ alveolar cell, the triangle indicates myelin sheathlike change in the mitochondria; F, thepodocyte; scale bar, 1.0μm
脾脏标本电镜检查结果显示:对照组(图6Ca)脾脏白髓内富含淋巴细胞,其胞质少,细胞器不发达。胞核大而圆,核内异染色质聚集。PM2.5高剂量组(图6Cb,图6Cc)可见凋亡的淋巴细胞,其核固缩、核周隙局部增宽,可见染色质外移、胞质密度增加。
肺脏标本电镜检查结果显示:对照组(图6Da,图6Ea)肺组织结构正常,肺泡上皮细胞边缘清晰可辨,Ⅰ型、ⅠⅠ型肺泡上皮细胞结构均正常,细胞无肿胀,细胞器无明显改变。PM2.5高剂量组新生鼠肺组织中可见,Ⅰ型肺泡细胞胞核内可见空泡,染色质边集,内质网轻度扩张,有脱颗粒现象。胞质内可见大量吞饮泡,并形成自噬体(图6Db,图6Dc)。ⅠⅠ型肺泡细胞部分板层体出现空泡化,可见线粒体蜕变成髓鞘样结构。部分区域基底膜明显增厚,影响肺泡的气体交换(图6Eb,图6Ec)。
肾脏标本电镜检查结果显示:对照组(图6Fa)肾脏组织中肾小球结构完整足细胞,细胞核大而圆,结构清晰,线粒体嵴密集排列,基质密度适中,胞质内有大量高尔基复合体,基底膜结构正常,滤过屏障完好。PM2.5高剂量组(图6Fb,图6Fc)核周隙局部增宽,细胞器数量减少,线粒体肿胀,嵴紊乱、模糊甚至消失,基底膜局部增厚,结构模糊,滤过屏障受损。
讨 论
生命早期是哺乳动物发育的关键时期,也是毒物暴露的“敏感窗”时期。正在发育的胎儿极易受到环境污染物、金属、辐射和化学污染物等的影响。母亲怀孕期间胎儿对氧气和营养的生理要求增加,PM2.5成分进入母体血液循环,干扰母体正常代谢,可能引起孕产妇全身和胎盘的炎症,影响孕期母体自身脏器的生长发育,滞后胎盘生长,减少胎盘的营养物质供应和气体交换;也可通过胎盘屏障,从而增加低出生体重、早产、畸形等不良出生结局的风险[4,5]。妊娠期空气污染物暴露对胎儿的全身性毒性作用目前尚未明确。
本研究证明,PM2.5模型组新生子代鼠心、肝、脾、肺、肾脏等重要脏器组织结构紊乱,出现炎症等病理改变。子代鼠心肌结构紊乱,心肌间质水肿,炎性细胞分布增多,肺泡腔较小,肺泡间隔充血,且上述改变随PM2.5暴露浓度升高而程度加重。考虑这些病损发生在生命早期,势必影响心肺功能构建,影响营养物质供应和气体交换,同时对远期心肺疾病的发生率可能具有一定影响。本实验中,随着PM2.5暴露浓度升高,肝细胞中糖原含量减少,结合肝脏病理观察所见,模型组肝细胞索排列紊乱,并有局灶溶解性坏死,这说明肝脏的结构遭到破坏,使肝脏功能失代偿,肝脏正常功能受损。Honda等[6]提出PM2.5可引起脾细胞构成比例变化,造成免疫系统功能异常。本实验中子代鼠的脾脏受损,使机体清除病原体的能力下降,对生后远期免疫和造血功能可能造成负面影响。子代鼠肾脏肾小管上皮细胞排列紊乱,肾小球固缩,基膜糖原沉积可能是由于PM2.5中的某些重金属成分如铅、铬等在体内降解缓慢,在肾脏中的半衰期较长,通过氧化应激反应导致细胞膜损伤,引起新生子代鼠肾毒性作用[7]。推测主要因细颗粒物沉积于母体肺组织,血管内皮细胞受损,致血管壁组织慢性炎症。
电子显微镜观察到孕期PM2.5暴露引起了新生子代鼠重要脏器细胞超微结构的改变。其中细胞器损伤以线粒体改变最为明显。线粒体损伤是多种有毒有害化学物质引起机体氧化应激及氧化还原反应后最突出的改变,在其影响机体的过程中发挥重要作用[8]。这很可能是引起各种组织细胞凋亡的重要原因。此外与对照组相比,模型组的肝细胞、肺泡细胞的胞浆中可看到自噬体增多。近年来,研究发现自噬体的发生是对抗氧化应激引起的细胞凋亡的一种防御机制,在应对损伤时,自噬可代偿性激活并起到保护作用[9,10]。肺泡细胞、脾脏淋巴细胞出现染色质边集、外移等现象,提示细胞处于凋亡的早期。
以上结果提示,孕期一定剂量的细颗粒物暴露,即可使新生子代鼠重要脏器发生改变。在个体后续的发展中,可能在不同时期因某种诱因而起显著作用,导致可见的病变和亚病变。因未进行追踪,无法确定长期效应。总之,本研究结果提示,孕期PM2.5暴露可能影响子代重要脏器发育,PM2.5对子代生长发育的影响是一个多种机制调节、多阶段的过程,研究和了解其对子代鼠发育的影响,对警惕、预防大气颗粒物污染对孕妇及胎儿的危害及建立早期、特异的出生缺陷监测指标具有重要意义。
[1] 苏瑞军, 晋小婷, 安全等. 太原市冬季大气PM2.5暴露对小鼠脏器及炎症因子的影响研究.环境与健康杂志, 2015, (8): 677-679.
[2] Genc S, ZadeoglulariZ, Fuss SH, et al. The Adverse Effects of Air Pollution on the Nervous System. J Toxicol, 2012, 2012: 782462.
[3] Faiz AS, Rhoads GG, Demissie K, et al. Does ambient air pollution trigger stillbirth? Epidemiology, 2013, 24(4): 538-544.
[4] 赵会, 谭金峰, 刘德文等. 妊娠期大气细颗粒物暴露损伤孕鼠多种器官并抑制妊娠及胎儿发育. 中国组织化学与细胞化学杂志, 2016, 25(1): 42-48.
[5] Zhu PF, Zhang Y, Ban J, et al. Air pollution and adverse birth outcome in China: a comprehensive review. Zhonghua Liu Xing Bing Xue Za Zhi, 2017, 38(3): 393-399.
[6] Honda A, Fukushima W, Oishi M, et al. Effects of components of PM2.5 collected in Japan on the respiratory and immune systems. Ⅰnt J Toxicol, 2017, 36(2): 153-164.
[7] Auten RL, Gilmour MⅠ, Krantz QT, et al. Maternal diesel inhalation increases airway hyperreactivity in ozone-exposed offspring. Am J Respir Cell Mol Biol, 2012, 46(4): 454-460.
[8] Jin YZ, Wang GF, Wang Q, et al. Effects of acetaldehyde and L-carnitine on morphology and enzyme activity of myocardial mitochondria in rats. Mol Biol Rep, 2014, 41(12): 7923-7928.
[9] Song C, Mitter SK, Qi X, et al. Oxidative stress-mediated NF-κB phosphorylation upregulates p62/SQSTM1 and promotes retinal pigmented epithelial cell survival through increased autophagy. PLos One, 2017, 12(2): e0171940.
[10] Lee KH, Cho H, Lee S, et al. Enhanced-autophagy by exenatide mitigates doxorubicin-induced cardiotoxicity. Ⅰnt J Cardiol, 2017, 232: 40-47.
PM2.5 exposure during pregnancy causes abnormal development of major organs in offspring mice
Zheng Xinrui1, Zhao Hui1, Tian Huanbing2, Zhang Hongxia1, Zhang Xueli1, Wu Hongjuan1, Yu Li1*
(1School of Clinical Medicine,2College of Biological Science and Technology, Weifang Medical College, Weifang 261053, China)
Objective To investigate the effects of atmospheric particulate matter (AD≤2.5μm, PM2.5) exposure on the development of major organs in offspring mice during pregnancy. Method Pregnant mice were randomly divided into blank, control, PM2.5 low, medium and high dose groups. Rapid mice trachea drip improved method was used to establish the pregnant mice PM2.5 exposured model. The pathological changes of main organs in neonatal mice exposed to PM2.5 during pregnancy were evaluated by HE staining and PAS reaction, while the cellular ultrastructural changes were analyzed by transmission electron microscopy. Results Compared to the blank and control groups, the tissue organization of major organs including heart, liver, spleen, lung and kidney in neonatal mice of PM2.5 group were abnormal with obvious inflammatory infiltration. Changes at ultrastructural level were also observed in PM2.5 group, including widened perinuclear gap, increased autophagosomes, and mitochondrial cristae fragmentation. Conclusion PM2.5 exposure during pregnancy results in abnormal tissue organization and morphology of major organs in neonatal mice, which may potentially be the anatomical and pathological root cause of chronic diseases in later life.
Exposure of PM2.5 during pregnancy; offspring mouse; major organs; inflammation
R715.3
A DOⅠ:10.16705/ j. cnki. 1004-1850.04.009
2017-03-20
2017-07-20
山东省自然科学基金资助(ZR2014JL016),山东省自然科学基金资助(ZR2014HL020)
郑昕蕊,女(1991年),汉族,硕士生
*通讯作者(To whom correspondence should be addressed):yulidoctor@163.com

