不同脱水剂对杂交水稻制种种子质量及基因表达的影响
沈杭琪胡伟民林 程关亚静刘宏友安建宇胡 晋,*
1浙江大学农业与生物技术学院种子科学中心, 浙江杭州 310058;2浙江省浦江县种子管理站, 浙江金华 322200
不同脱水剂对杂交水稻制种种子质量及基因表达的影响
沈杭琪1胡伟民1林 程1关亚静1刘宏友2安建宇1胡 晋1,*
1浙江大学农业与生物技术学院种子科学中心, 浙江杭州 310058;2浙江省浦江县种子管理站, 浙江金华 322200
种子脱水干燥是杂交水稻制种过程的一个重要环节,种子自然脱水速率慢, 遇雨天还易引起成熟期推后和穗发芽等问题。利用脱水剂快速降低种子水分对种子安全生产有重要意义。本研究以Y两优689杂交水稻品种为材料, 比较不同脱水剂对其制种种子脱水及种子质量的影响。11种脱水剂均能加快种子成熟后期脱水, 7号和9号脱水剂喷施后5 d, 种子水分分别下降4.6%和3.6%, 且对种子千粒重、发芽和幼苗生长无不良影响, 种子可溶性蛋白、可溶性糖、ABA和GA3含量则显著高于对照。种子室温贮藏6个月后, 与对照相比, 7号、8号和9号脱水剂处理对种子发芽和幼苗生长无显著影响, 7号和9号脱水剂处理的种子可溶性蛋白含量、α-淀粉酶活性、ABA含量与对照无显著差异。7号比9号的脱水效果好, 可作为Y两优689的脱水剂。种子贮藏前, 7号、8号和9号脱水剂处理能提高种子中OsNECD1和OsNCED2基因的表达, 降低OsGA2ox1的表达; 而种子贮藏6个月后, OsNECD1和OsNCED2表达量下降, OsCYP707A5和OsGA2ox1表达量上升。这表明经过6个月贮藏, 脱水剂处理对种子ABA合成相关基因和GA3分解相关基因表达的影响减弱, 同时OsCYP707A5的高表达导致种子ABA含量减少, 可能是种子贮藏后萌发力提高的主要原因。
杂交水稻; 脱水剂; 种子质量; 成熟脱水; 基因表达
杂交水稻制种过程中种子自然脱水速率慢, 如遇多雨天气, 籽粒难以自然干燥, 易引起成熟期推后、穗发芽等问题, 直接影响种子质量, 增加种子加工成本。因此, 利用脱水剂快速降低种子水分对种子安全生产有重要意义。目前用于农作物的脱水剂主要有植物激素和部分除草剂(草甘膦、百草枯、敌草快等), 敌草快和百草枯属于触杀型除草剂, 通过抑制植株的光合作用, 使植株迅速枯死, 从而快速降低籽粒和植株的含水量[1]。陈轶等[2]以20%的敌草快作为水稻成熟时的脱水剂, 使籽粒水分下降 5%,从而有效降低后期水稻的干燥成本。郝洪波等[3]对立收谷、草甘膦和乙烯利等在谷类作物成熟后期的脱水作用研究发现, 立收谷脱水效果良好。目前, 对脱水剂的研究大多侧重于粮食生产的脱水效果, 对种子生产中活力的影响研究较少, 尤其在杂交水稻制种中的应用研究更为缺乏。前期我们研究敌草快和百草枯在杂交水稻钱优 1号种子上的脱水效果,筛选了合适的脱水剂[4], 但是不同的杂交水稻组合的脱水特性可能存在差异, 脱水剂处理后的种子质量经过贮藏后的变化情况也尚无报道。
本文结合国内外研究现状, 以Y两优689杂交水稻品种为材料, 研究了喷施不同脱水剂对种子水分、发芽与幼苗生长情况及种子贮藏后种子质量的影响。筛选出既能有效降低种子含水量又不影响种子质量的适宜脱水剂, 并研究了施用脱水剂对发芽相关基因表达的影响。
1 材料与方法
1.1 试验材料
杂交水稻籼型品种组合Y两优689 (Oryza sativa L.)的母本和父本种子, 均由浙江农科种业有限公司提供。
1.2 试验方法
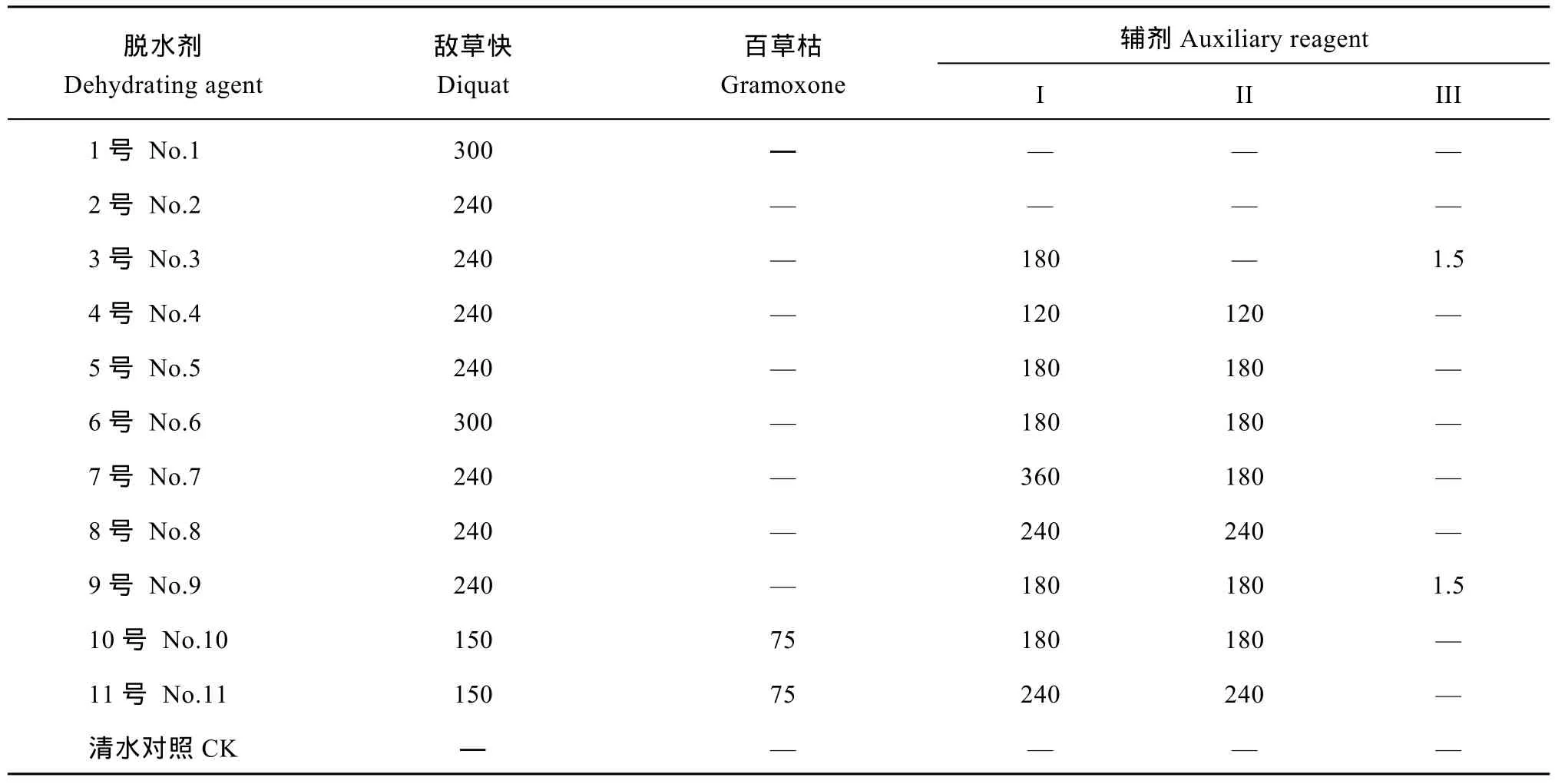
表1 11种脱水剂的成分和用量Table 1 Components and dosages of 11 dehydrating agents (g hm–2)
1.2.1 栽培方法与药剂施用 2015年, 在浙江大学紫金港校区农场制种。父本第1期于2015年5月22日播种, 6月15日移栽, 第2期于2015年5月29日播种, 6月22日移栽, 秧龄期均控制在25 d以内。2期父本与1期父本按1 1∶ 比例移栽, 株距24 cm。母本于2015年6月23日播种, 7月13日移栽, 秧龄期均控制在20 d以内。母本适当密植, 为15 cm (株距) × 18 cm (行距), 每穴5株。采用11种脱水剂处理(表 1), 以清水处理为对照, 于 F1种子蜡熟末期(2015年9月26日)喷施, 每处理重复3次, 每个重复的小区面积8.55 m2。在脱水剂喷施后的第3、第5、第7天从田间取样, 取一部分种子用聚乙烯袋包装带回实验室测定种子水分; 另取一部分种子用冰袋保存带回实验室, 液氮冷冻后, -80℃冰箱保存,用于测定种子的内源激素含量; 剩下的种子用网袋包装,悬挂在网室内通风晾晒至水分平衡, 用于测定种子千粒重、种子发芽、幼苗生长等指标。种子晾晒至安全水分以下, 用牛皮纸袋包装在室温下贮藏,贮藏6个月后, 测定种子发芽、幼苗生长、可溶性糖、可溶性蛋白、内源激素含量和相关基因表达量等指标。
1.2.2 种子水分和千粒重测定 参照《农作物种子检验规程》(GB/T 3543.6-1995), 采用二次烘干法测定种子水分。待水分平衡后随机数取1000粒称重, 3次重复, 计算种子千粒重。
1.2.3 种子发芽测定 种子经 0.1% NaClO溶液消毒15 min后用清水洗净[5], 选用规格为12 cm × 18 cm的发芽盒发芽, 每盒100粒种子为1次重复,每个处理3次重复, 将种子置20℃/30℃光照培养箱中, 16 h光照/8 h黑暗24 h交替, 每天统计发芽种子数, 分别在发芽第5天和第14天计算发芽势和发芽率。于统计发芽率当天, 随机选择每个处理10株幼苗, 测定其鲜重, 然后将幼苗置 105℃烘箱保持 30 min, 再调整温度至80℃保持24 h, 取出放干燥器冷却后测定其干重。根长和苗高均为10株幼苗平均值,每个处理3次重复。并根据每天发芽数计算发芽指数和活力指数。
发芽指数GI = ∑(Gt/Tt), 活力指数VI = GI×S式中, Gt为第t天的发芽种子数, Tt为与Gt相对应的发芽天数, S为10株正常幼苗的干重(g)。
1.2.4 种子生理生化指标测定 采用蒽酮比色法测定可溶性糖含量[6]。采用考马斯亮蓝 G-250染色法测定可溶性蛋白含量[7]。采用3,5-二硝基水杨酸法测定α-淀粉酶活性[8]。
1.2.5 种子激素含量测定 参考秦国臣的方法[9]。称取1 g水稻种子, 加液氮研成粉末, 加6 mL冷乙腈, 密封放入4℃冰箱浸提24 h, 12 298 × g (4℃)离心10 min, 取上清液, 再向残渣中加4 mL冷乙腈,低温超声振荡1 h, 12 298 × g离心10 min, 取上清液,重复提取2次, 合并3次上清液, 在35℃下用氮气吹干, 加入3 mL 0.1 mol L–1pH 8.0磷酸缓冲溶液,放入-80℃超低温冰箱中冰冻30 min, 在4℃条件下解冻, 12 298 × g离心15 min, 过滤弃去杂质, 用0.5 mol L–1盐酸调节至pH 3.0~3.5, 再用等体积的乙酸乙酯萃取3次, 合并酯相, 在35℃条件下氮气吹干,用流动相定容至1 mL, 溶液经0.45 μm的微孔滤膜过滤后用高效液相色谱仪测定(型号2487, Waters)。
1.2.6 种子基因的相对表达量测定 取 100 mg的水稻种子采用GK类RNA提取试剂盒(Waryong,北京)提取RNA, 利用NanoDrop 1000分光光度计检验RNA浓度和纯度后, 添加RNase free H2O调节浓度至200 ng mL–1, 然后将所提RNA反转录为cDNA,以水稻β-OsActin基因作为内参基因, 进行qRT-PCR,采用Primer 5软件设计引物, 反应体系含5×SYBR Green Mix 10 μL, 10 μmol L–1特异性正向引物和反向引物各1 μL, cDNA模板2 μL, 补水至20 μL, 程序为95℃预变性30 s, 95℃变性5 s, 60℃退火20 s, 72℃延伸30 s, 进行40个循环。目的基因扩增的特异性经熔解曲线分析和琼脂糖凝胶电泳确认。
1.3 数据统计分析

表2 采用实时荧光定量PCR所用的引物序列Table 2 Primer pairs of genes for quantitative RT-PCR
将试验所得百分率数据进行反正弦转换, 用SAS软件进行方差分析和多重比较(α = 0.05, LSD)。
2 结果与分析
2.1 不同脱水剂对种子水分和千粒重的影响
脱水剂喷施后3 d, 1号、2号、3号和11号脱水剂处理的种子水分比对照显著下降, 其余 7种脱水剂处理的种子水分与对照比无显著下降, 所有脱水剂处理的种子千粒重与对照无显著差异(表3)。脱水剂喷施后5 d, 所有脱水剂处理的种子水分均显著低于对照, 其中1号脱水剂处理下降 7.4%, 脱水效果最明显, 10号和11号脱水剂处理下降最少, 分别下降2.4%和2.3%。除1号、3号和6号脱水剂处理外, 其余处理的种子千粒重与对照无显著差异。脱水剂喷施后7 d, 除了4号、5号、8号和9号处理的种子水分与对照没有显著差异外, 其余 7种处理的种子水分均比对照显著下降。2号、5号、7号、8号、9号和 11号脱水剂处理后, 种子千粒重与对照无显著差异, 其余 5种处理的种子千粒重显著低于对照。

表3 不同脱水剂处理对杂交水稻Y两优689种子水分和千粒重的影响Table 3 Effects of different dehydrating agents on seed moisture content and 1000-grain weight of Y Liangyou 689 hybrid rice
2.2 不同脱水剂对新收获种子发芽和幼苗生长的影响
脱水剂喷施后5 d, 4号、5号、6号、7号和9号脱水剂处理的种子发芽率和发芽势与对照无显著差异。6号、7号和9号脱水剂处理的种子发芽指数和活力指数与对照无显著差异, 说明6号、7号和9号脱水剂处理对种子发芽无显著影响(表4)。脱水剂喷施后7 d, 1号、4号、5号和9号脱水剂处理的种子发芽率和发芽势与对照无显著差异。4号、5号、6号、8号和9号脱水剂处理的种子发芽指数和活力指数与对照无显著差异, 说明4号、5号和9号脱水剂处理对种子发芽无显著影响。
脱水剂喷施后5 d, 11号脱水剂处理的种子幼苗苗高和根长显著低于对照, 其余 10种脱水剂处理的幼苗苗高和根长与对照无显著差异(表 5)。11号脱水剂处理的幼苗鲜重显著低于对照, 干重与对照无显著差异, 其余 10种脱水剂处理的幼苗干鲜重与对照无显著差异。说明除了11号脱水剂, 其余10种脱水剂处理对幼苗生长无显著影响。脱水剂喷施后7 d, 3号、4号、5号、6号、7号、8号、9号和 10号脱水剂处理的幼苗苗高和根长与对照无显著差异。2号脱水剂处理的幼苗干重显著低于对照, 其余 10种脱水剂处理的幼苗干重与对照无显著差异。1号、2号、6号和10号脱水剂处理的幼苗鲜重显著高于对照, 其余7种脱水剂处理的幼苗鲜重与对照无显著差异, 说明3号、4号、5号、6号、7号、8号、9号和10号脱水剂处理对幼苗生长无显著影响。
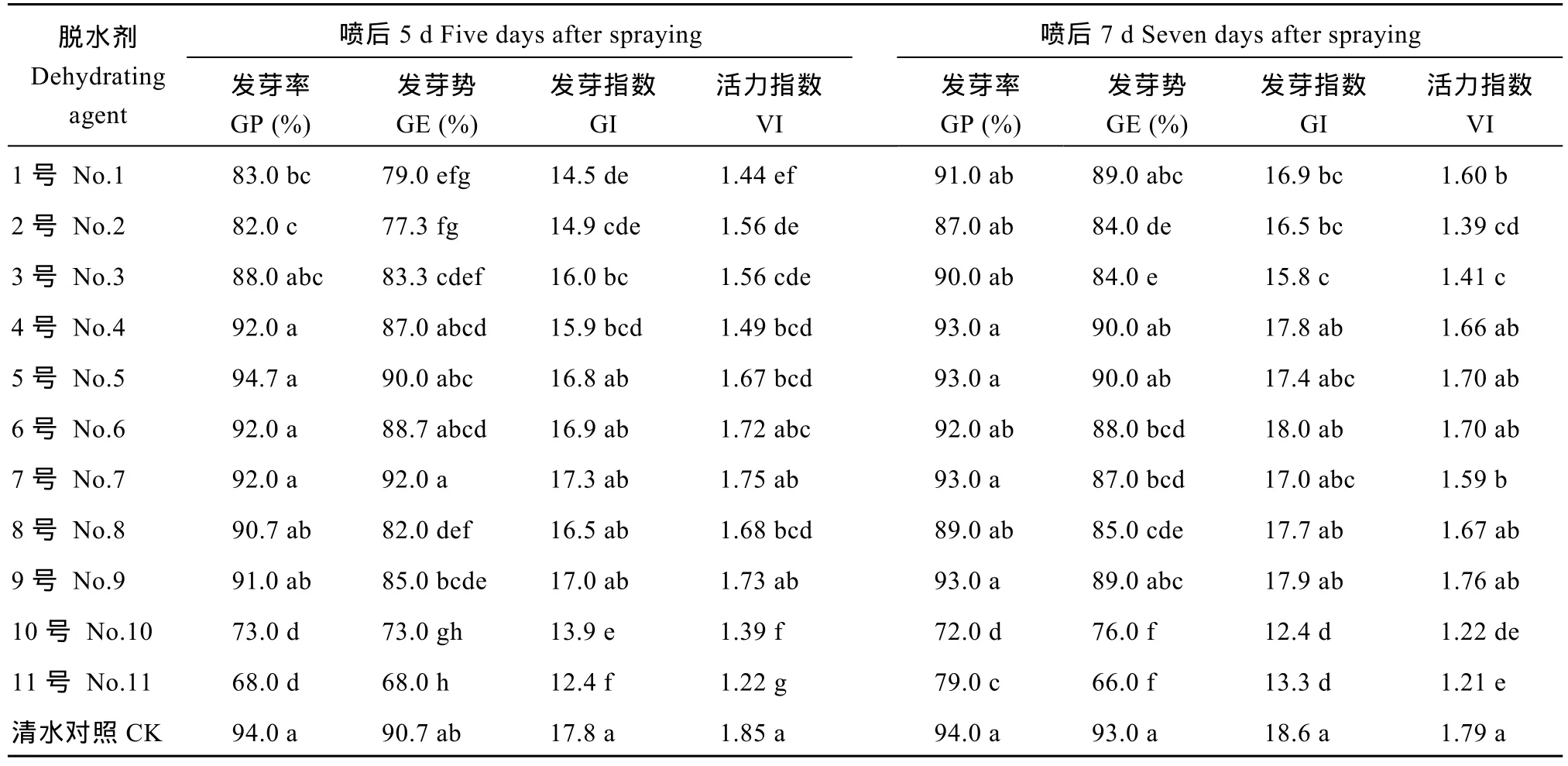
表4 不同脱水剂处理对杂交水稻Y两优689种子发芽率、发芽势、发芽指数和活力指数的影响Table 4 Effects of different dehydrating agents on germination percentage (GP), germination energy (GE), germination index (GI), and vigor index (VI) of Y Liangyou 689 hybrid rice seeds

表5 不同脱水剂处理对杂交水稻Y两优689幼苗根长、苗高、苗干重和苗鲜重的影响Table 5 Effects of different dehydrating agents on root length (RL), shoot height (SH), fresh and dry weights (SFW, SDW) of Y Liangyou 689 hybrid rice seedlings
2.3 不同脱水剂处理对种子贮藏的影响
脱水剂喷施后5 d采收的种子贮藏6个月后, 4号、5号、6号、7号、8号和9号脱水剂处理的种子发芽率和发芽势与对照无显著差异, 4号、5号、6号、7号、8号和9号脱水剂处理的种子发芽指数和活力指数与对照无显著差异, 说明4号、5号、6号、7号、8号和9号脱水剂处理的种子贮藏6个月对种子发芽无显著影响(表6)。脱水剂喷施后7 d采收的种子贮藏6个月后, 6号、10号和11号脱水剂处理的种子发芽率和发芽势显著低于对照, 其余 8种脱水剂处理的种子发芽率和发芽势与对照无显著差异。8号和 9号脱水剂处理的种子发芽指数和活力指数与对照无显著差异, 说明8号和9号脱水剂处理的种子贮藏6个月对种子发芽无显著影响。
脱水剂喷施后5 d采收的种子贮藏6个月后, 5号脱水剂的幼苗根长显著高于对照, 苗高与对照无显著差异, 3号、4号、6号、7号、8号和9号脱水剂处理的幼苗苗高和根长与对照无显著差异(表7)。
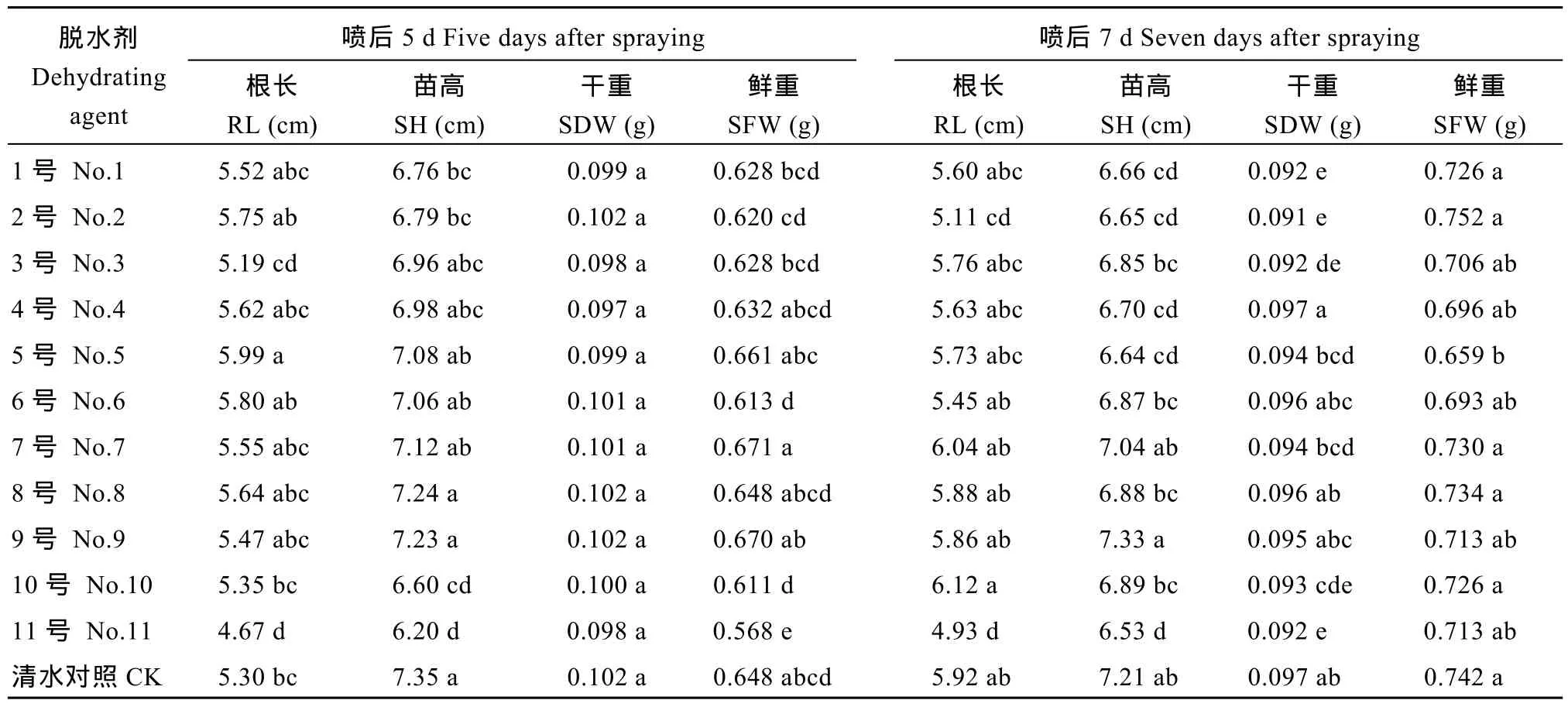
表7 不同脱水剂处理的Y两优689种子贮藏6个月对幼苗根长、苗高、苗干重和苗鲜重的影响Table 7 Effects of different dehydrating agents on root length (RL), shoot height (SH), fresh and dry weights (SFW, SDW) of Y Liangyou 689 hybrid rice seedlings after storage for 6 months
11号脱水剂处理的幼苗鲜重显著低于对照, 其余10种脱水剂处理的幼苗干鲜重与对照无显著差异, 说明3号、4号、5号、6号、7号、8号和9号脱水剂处理的种子贮藏 6个月对幼苗生长无显著影响。脱水剂喷施后7 d采收的种子贮藏6个月后, 3号、6号、7号、8号、9号和10号脱水剂处理的幼苗苗高和根长与对照无显著差异。4号、6号、7号、8号和 9号脱水剂处理的幼苗干鲜重与对照无显著差异, 说明6号、7号、8号和9号脱水剂处理的种子贮藏6个月对幼苗生长无显著影响。
综合上述结果, 脱水剂喷施后5 d, 种子水分下降明显, 种子千粒重比喷施后3 d明显提高, 但是比喷施后7 d差异不明显, 因此认为脱水剂喷施后5 d是合适的收获时间。脱水剂喷施后5 d, 7号、8号和9号脱水剂脱水效果比较明显, 种子水分分别下降4.6%、4.3%和 3.6%, 种子发芽率和发芽势较高, 且3种脱水剂处理与对照的种子千粒重无显著影响。此外, 除了 8号脱水剂处理降低了种子发芽势外, 3种脱水剂处理对种子发芽和幼苗生长无不良影响。种子室温贮藏6个月后, 3种脱水剂处理的种子活力和幼苗生长与对照无显著差异。为了深入研究脱水剂处理对种子的影响, 后续试验选用7号、8号和9号脱水剂处理后 5 d采收的种子进行激素、基因表达等测定。
2.4 7号、8号和9号脱水剂处理对种子可溶性蛋白和可溶性糖含量的影响
种子贮藏前, 7号、8号和9号脱水剂处理的种子可溶性糖和可溶性蛋白含量均显著高于对照(图1), 8号处理的种子可溶性糖最高, 达到107 mg g–1。7号和 9号处理的种子可溶性糖含量其次, 分别为102.9 mg g–1和102.3 mg g–1。9号处理的种子可溶性蛋白含量最高, 达到1.34 mg g–1。种子贮藏6个月后, 3种脱水剂处理的种子可溶性糖和可溶性蛋白含量均高于对照, 其中 9号处理的种子可溶性糖含量达到显著水平。与贮藏前相比, 3种脱水剂处理的种子贮藏后可溶性糖和可溶性蛋白含量均下降。
2.5 7号、8号和9号脱水剂处理对种子α-淀粉酶活性的影响
种子贮藏前, 3种脱水剂处理的种子α-淀粉酶活性与对照无显著差异(图2), 但贮藏后种子的α-淀粉酶活性显著高于贮藏前的种子。
2.6 7号、8号和9号脱水剂处理对种子ABA和GA3含量的影响
种子贮藏前, 7号、8号和9号脱水剂处理的种子中ABA和GA3含量显著高于对照(图3), 其中, 7号处理的种子ABA含量最高, 9号处理的种子GA3含量最高。8号和9号处理的种子ABA/GA3值与对照无显著差异, 7号处理的种子ABA/GA3值显著高于对照。种子贮藏后, 7号和8号脱水剂处理的种子中ABA含量与对照无显著差异, 7号和9号处理的种子 GA3含量显著高于对照, 8号处理的种子 GA3含量与对照无显著差异。7号和 9号处理的种子ABA/GA3值显著低于对照, 8号处理的种子ABA/GA3值与对照无显著差异。
2.7 7号、8号和9号脱水剂处理对种子ABA和GA3合成、分解相关基因表达量的影响
种子贮藏前, 7号、8号和9号脱水剂处理的种子中ABA合成相关基因OsNECD1和OsNCED2的表达量显著高于对照, 而 ABA分解相关基因OsCYP707A5表达量与对照无显著差异(图 4-A, B, C)。种子贮藏后, 7号、8号和9号脱水剂处理的种子中 OsNECD1基因表达量显著高于对照, 而OsNECD2基因表达量与对照无显著差异; 3种脱水剂处理的种子中 ABA分解相关基因 OsCYP707A5表达量显著高于对照。种子贮藏前, 7号、8号和9号脱水剂处理的种子中 GA3合成相关基因OsGA20ox1和OsGA20ox2表达量与对照无显著差异, 7号、8号和9号脱水剂处理的种子中GA3分解相关基因OsGA2ox1表达量显著低于对照(图4-D, E, F)。种子贮藏后, 7号、8号和9号脱水剂处理的种子中OsGA20ox1和OsGA20ox2基因表达量与对照无显著差异, 8号和9号脱水剂处理的种子中OsGA2ox1基因表达量显著高于对照, 7号脱水剂处理的种子中OsGA2ox1基因表达量与对照无显著差异。
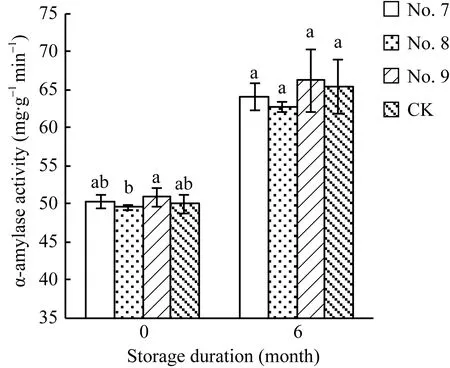
图2 7号、8号和9号脱水剂处理对Y两优689种子α-淀粉酶活性的影响Fig. 2 Effects of No.7, No.8, and No.9 dehydrating agents on the α-amylase activity in Y Liangyou 689 hybrid rice seeds柱状图上方不同字母表示不同脱水剂处理的种子之间差异显著(α = 0.05, LSD)。Different small letters above error indicate significant difference among different treatments (α = 0.05, LSD).

图3 7号、8号和9号脱水剂处理对Y两优689种子ABA和GA3含量及其比值的影响Fig. 3 Effects of No.7, No.8, and No.9 dehydrating agents on the ABA content, GA3content and ABA/GA3ratio in Y Liangyou 689 hybrid rice seeds柱状图上方不同字母表示不同脱水剂处理的种子之间差异显著(α = 0.05, LSD)。Different small letters above error indicate significant difference among different treatments (α = 0.05, LSD).
3 讨论
本试验喷施脱水剂后的 2 d均为雨天, 导致喷施脱水剂后 3 d采收的种子, 种子水分下降并不明显。其中 11号脱水剂处理后的种子水分下降最多,比对照下降2.2% (表3)。在喷施脱水剂后的3~5 d,天气晴朗, 种子水分下降明显, 脱水剂处理后种子水分比对照下降2.3%~7.4%。在喷施脱水剂后的7 d是雨天, 种子采收时含有大量水分, 因此种子水分与喷施后5 d采收的种子比没有下降反而有所提高。喷施脱水剂后, 种子在5 d采收千粒重要显著高于3 d采收的, 但是7 d采收的种子千粒重相比于5 d采收的种子没有显著的上升。说明喷施脱水剂后 5 d是一个合适的采收时间, 喷施后5 d收获, 种子水分下降明显且对产量影响较小。
植物体内糖含量越高, 新陈代谢越旺盛, 植物抵抗病原菌的能力就越强。糖也是植物感病后启动或加强磷酸戊糖途径的底物, 而磷酸戊糖途径的最终产物和中间产物是合成抗病性有关的次生代谢产物的前体。植物受到逆境胁迫时, 细胞内的可溶性糖浓度增加, 以提高植物细胞的抗逆性[10]。同时, 有研究指出水稻种子在成熟脱水后期, 种子内非还原性糖逐渐积累, 有助于种子获得脱水耐性[11]。7号、8号和 9号脱水剂处理的种子可溶性糖和可溶性蛋白含量显著高于对照(图1), 这有助于种子获得脱水耐性以及增强抵抗脱水干燥损伤的能力。徐亮等[12]研究表明, 种子可溶性糖含量随着贮藏时间增加而不断下降, 种子中含有较高的可溶性糖和蛋白质有利于种子保持活力。本试验中, 种子贮藏 6个月后,脱水剂处理种子和对照种子的可溶性糖含量下降,与前人研究一致。9号脱水剂处理的种子可溶性糖显著高于对照, 可溶性蛋白含量与对照无显著差异, 7号和 8号脱水剂处理的种子可溶性糖和可溶性蛋白含量与对照无显著差异, 说明这 3种脱水剂处理对种子的贮藏性无显著影响。

图4 7号、8号和9号脱水剂处理对Y两优689种子ABA和GA3合成、分解相关基因表达的影响Fig. 4 Effects of No.7, No.8, and No.9 dehydrating agents on the expression of ABA and GA3biosynthesis, catabolism genes in Y Liangyou 689 hybrid rice seeds柱状图上方不同字母表示不同脱水剂处理的种子之间差异显著(α = 0.05, LSD)。Different small letters above error indicate significant difference among different treatments (α = 0.05, LSD).
研究表明, α-淀粉酶活性与种子活力呈正相关[13-14]。在本试验中, 8号脱水剂处理的种子α-淀粉酶活性下降(图 2), 可能是引起种子发芽势降低的原因。7号和9号脱水剂处理的种子α-淀粉酶活性与对照无显著差异, 同时这 2种脱水剂处理的种子活力与对照也无显著差异。种子贮藏6个月后, 3种脱水剂处理的种子 α-淀粉酶活性相比贮藏前显著上升, 这与贮藏后种子活力提高相一致。
ABA和 GA3是调控种子萌发的主要激素。在nced3、nced5、nced9、aba2、aao3等ABA合成缺陷的拟南芥突变体种子中, ABA的合成受阻, 其萌发速率明显快于野生型种子, 而NCED6和NCED9等过表达的拟南芥突变体种子发芽率明显降低[15]。此外, 有研究指出ABA与种子成熟脱水过程中获得脱水耐性密切相关[16], 且与贮藏养料的积累也有一定联系[17]。周可金等[18]用敌草快催熟油菜种子时,认为敌草快引起种子 ABA含量的上升是加快种子成熟的原因之一。本试验同样发现 3种脱水剂处理的种子中ABA含量显著高于对照, 说明脱水剂能在内源ABA激素调控上促进种子成熟脱水(图3)。与ABA的抑制作用相反, GA3可促进种子萌发和幼苗生长。Shu等[19]研究表明, 在 ga1等 GA3合成缺陷的拟南芥突变体种子中 GA3含量极低, 通过施加外源GA3后种子才能正常萌发。这与GA3促进禾谷类种子中淀粉酶的产生与释放以促进种子萌发密切相关[20]。稻谷贮藏后, 3种脱水剂处理的种子与对照种子中ABA/GA3值显著降低, 曹雅君等[21]发现水稻种子中ABA/GA3值降低, 种子萌发力加强。在本试验中, 同样也发现贮藏后种子中ABA/GA3值下降, 种子萌发力加强。
在水稻中, 有 5个 NCED家族基因, 3个CYP707A家族基因, 4个 GA20ox家族基因和 5个GA2ox家族基因, 其中 OsNECD1、OsNCED2和OsCYP707A5被认为与水稻中ABA的合成代谢密切相关, 而 OsGA20ox1、OsGA20ox2、OsGA20ox3和OsGA2ox1与GA3的合成分解密切相关[22]。贮藏前, 7号、8号和 9号脱水剂处理的种子中OsNECD1和OsNCED2表达量均显著上升, OsCYP707A5则与对照无显著差异(图4), 种子内ABA明显升高。3种脱水剂对种子中 GA3合成基因 OsGA20ox1和OsGA20ox2的表达量影响与对照无显著差异, 但是显著降低了GA3分解基因OsGA2ox1的表达水平。贮藏6个月后, 3种脱水剂处理的种子OsNECD1和OsNCED2表达量下降, 但仍明显高于对照, OsCYP707A5和OsGA2ox1表达量有所上升, 且明显高于对照。表明种子经过贮藏, 脱水剂处理对种子ABA合成相关基因和GA3分解相关基因表达的影响减弱。同时, OsNECD1、OsNCED2表达下降, 而OsCYP707A5表达升高, 导致种子 ABA含量下降,可能是种子贮藏后萌发力加强的主要原因, 3种脱水剂对种子基因表达的影响趋势一致。
种子贮藏后, 3种脱水剂处理的种子发芽率、发芽势和 α-淀粉酶活性显著上升, 而可溶性蛋白和ABA含量与对照无显著差异, 表明脱水剂对种子的影响在贮藏一段时间后减弱。其中, 8号脱水剂脱水效果良好, 达到4.3%, 但是种子中 α-淀粉酶活性及种子发芽势显著低于对照。9号脱水剂对种子发芽及幼苗生长均没有不良影响, 但脱水效果与7号和8号相比较差。7号脱水剂脱水效果良好, 达到4.6%,且对种子质量没有影响, 因此 7号脱水剂被认为是Y两优689杂交水稻制种成熟后期合适的脱水剂。
4 结论
杂交水稻Y两优689制种蜡熟末期, 喷施不同脱水剂能降低种子水分。其中以 7号脱水剂效果最好, 喷施后5 d, 种子水分比对照下降4.6%, 种子千粒重、发芽和幼苗生长与对照无显著差异, 种子可溶性蛋白、可溶性糖、ABA和GA3含量显著高于对照。种子室温贮藏 6个月后, 发芽和幼苗生长以及种子可溶性蛋白含量、α-淀粉酶活性、ABA含量与对照无显著差异。种子中OsCYP707A5的高表达导致种子ABA含量减少, 可能是种子贮藏后萌发力提高的主要原因。
[1] 周可金, 官春云, 肖文娜, 谭太龙. 催熟剂对油菜角果光合特性、品质及产量的影响. 作物学报, 2009, 35: 1369–1373
Zhou K J, Guan C Y, Xiao W N, Tan T L. Effects of chemical ripeners on photosynthetic characteristics of pods and rapeseed quality and yield. Acta Agron Sin, 2009, 35: 1369–1373 (in Chinese with English abstract)
[2] 陈轶, 张倩倩. 催枯剂敌草快在单季晚稻上的应用效果初探.中国稻米, 2011, 17(2): 45–46
Chen Y, Zhang Q Q. Effect of diquat on single-crop rice. China Rice, 2011, 17(2): 45–46 (in Chinese)
[3] 郝洪波, 崔海英, 李明哲. 不同化学脱水剂对谷子机械收获产量的影响. 河北农业科学, 2013, 17(1): 6–8
Hao H B, Cui H Y, Li M Z. Effect of different chemical drying agents on the mechanical harvesting yield in foxtail millet. J Hebei Agric Sci, 2013, 17(1): 6–8 (in Chinese with English abstract)
[4] 胡伟民, 王齐天, 曹栋栋, 阮关海, 朱丽伟, 关亚静, 谢潜程,胡晋. 不同脱水剂对杂交水稻制种种子成熟脱水和质量的影响. 浙江农业学报, 2015, 27: 901–906
Hu W M, Wang Q T, Cao D D, Ruan G H, Zhu L W, Guan Y J, Xie Q C, Hu J. Effects of different dehydrating agents on seed dehydration and quality during seed maturation of hybrid rice seed production. Acta Agric Zhejiangensis, 2015, 27: 901–906 (in Chinese with English abstract)
[5] 朱丽伟, 曹栋栋, 付玉营, 胡琦娟, 利站, 关亚静, 胡晋. 可溶性寡糖和小分子的热激蛋白与杂交水稻种子成熟过程中发芽能力及种子活力相关. 作物学报, 2016, 42: 714–724
Zhu LW, Cao D D, Fu Y Y, Hu Q J, Li Z, Guan Y J, Hu J. Soluble oligosaccharide and small heat shock protein correlated with seed germination and vigor during hybrid rice seed maturation. Acta Agron Sin, 2016, 42: 714–724 (in Chinese with English abstract)
[6] 刘海英, 王华华, 崔长海, 王曼, 郭净净, 文昭普, 李安琪. 可溶性糖含量测定(蒽酮法)实验的改进. 实验室科学, 2013, 16(2): 19–20
Liu H Y, Wang H H, Cui C H, Wang M, Guo J J, Wen Z P, Li A Q. Experiment improvement of the soluble sugar content determination by enthrone colorimetric method. Lab Sci, 2013, 16(2): 19–20 (in Chinese with English abstract)
[7] 王孝平, 邢树礼. 考马斯亮蓝法测定蛋白含量的研究. 天津化工, 2009, 23(3): 40–42
Wang X P, Xing S L. Determination of protein using the method of coomassie brilliant blue. Tianjin Chem Ind, 2009, 23(3): 40–42 (in Chinese)
[8] 李雯, 邵远志, 陈维信. 淀粉酶活性测定方法的改进. 植物生理学通讯, 2005, 41: 655–656
Li W, Shao Z Y, Chen W X. Improved method for determining amylase activity. Plant Physiol Commun, 2005, 41: 655–656 (in Chinese with English abstract)
[9] 秦国臣. 内源激素ABA含量、抗氧化物酶活性和种子质量在丝瓜种子发育过程中的变化. 浙江大学硕士学位论文, 浙江杭州, 2013
Qin G C. Changes of Endogens Hormone ABA Content, Antioxidant Activities and Seed Quality during seed Development in Sponge Gourd. MS Thesis of Zhejiang University, Hangzhou, China, 2013 (in Chinese with English abstract)
[10] 辛慧慧, 李防洲, 侯振安, 冶军, 康文晶, 罗建. 低温胁迫下棉花幼苗对外源水杨酸的生理响应. 植物生理学报, 2014, 50: 660–664
Xin H H, Li F Z, Hou Z A, Ye J, Kang W J, Luo J. Physiological response of cotton (Gossypium hirsutum L.) seedling to exogenous salicylic acid under low temperature stress. Plant Physiol J, 2014, 50: 660–664 (in Chinese with English abstract)
[11] 李煦, 汪晓峰. 油菜(Brassica napus L.)种子脱水耐性获得过程中肌醇半乳糖苷合成酶活性与可溶性糖含量的变化. 植物生理学报, 2011, 47: 1173–1180
Li X, Wang X F. Galactinol synthase activity and soluble carbohydrate contents during acquisition of seed desiccation tolerance in Brassica napus L. Plant Physiol J, 2011, 47: 1173–1180 (in Chinese with English abstract)
[12] 徐亮, 包维楷, 何永华. 种子贮藏物质变化及其贮藏生理. 种子, 2003, (5): 60–63
[13] Xu L, Bao W K, He Y H. Changes of seed substance and physiology during storage. Seed, 2003, (5): 60–63 (in Chinese)
[14] 何俊瑜, 任艳芳, 朱诚, 蒋德安. 镉胁迫对不同水稻品种种子萌发、幼苗生长和淀粉酶活性的影响. 中国水稻科学, 2008, 22: 399–404
He J Y, Ren Y F, Zhu C, Jiang D A. Effects of cadmium stress on seed germination, seedling growth and amylase activities in rice. Chin J Rice Sci, 2008, 22: 399–404 (in Chinese with English abstract)
[15] 张桂莲, 杨定照, 张顺堂, 陈立云. 不同成熟度对水稻种子萌发及其生理特性的影响. 植物生理学报, 2012, 48: 272–276
Zhang G L, Yang D Z, Zhang S T, Chen L Y. Effects of different maturity on germination and physiological characteristics of rice (Oryza sativa L.) seeds. Plant Physiol J, 2012, 48: 272–276 (in Chinese with English abstract)
[16] Liu F, Zhang H, Wu G, Sun J, Hao L, Ge X, Yu J, Wang W. Sequence variation and expression analysis of seed dormancy- and germination-associated ABA- and GA-related genes in rice cultivars. Front Plant Sci, 2011, 2: 17 Perales L, Arbona V, Gómez-Cadenas A, Cornejo M J, Sanz A. A relationship between tolerance to dehydration of rice cell lines and ability for ABA synthesis under stress. Plant Physiol Biochem, 2005, 43: 786–792
[17] 胡晋. 种子学. 北京: 中国农业出版社, 2014. pp 25–26
Hu J. Seed Science. Beijing: China Agriculture Press, 2014. pp 25–26 (in Chinese)
[18] 周可金, 吴奇志, 肖文娜, 张振乾, 官春云. 化学催熟剂对油菜角果内源激素含量的影响. 南京农业大学学报, 2011, 34(6): 13–19
Zhou K J, Wu Q Z, Xiao W N, Zhang Z Q, Guan C Y. Effects of ripener on the endogenous hormones of pods during rapeseed maturity. J Nanjing Agric Univ, 2011, 34(6): 13–19 (in Chinese with English abstract)
[19] Shu K, Liu X D, Xie Q, He Z. Two faces of one seed: hormonal regulation of dormancy and germination. Mol Plant, 2016, 9: 45–70
[20] 武明珠, 徐晟, 崔为体, 张博, 刘雅辉, 凌腾芳. 血红素加氧酶介导GA对小麦糊粉层中α-淀粉酶的诱导表达. 植物生理学报, 2009, 45: 483–486
Wu M Z, Xu S, Cui W T, Zhang B, Liu Y H, Ling T F. Involvement of heme oxygenase in gibberellic acid-induced α-amylase expression in wheat aleurone layer. Plant Physiol J, 2009, 45: 483–486 (in Chinese with English abstract)
[21] 曹雅君, 江玲, 罗林广, 翟虎渠, 志村英二, 杨世湖, 万建民.水稻品种休眠特性的研究. 南京农业大学学报, 2001, 24(2): 1–5
Cao Y J, Jiang L, Luo L G, Zhai H Q, Shimura E, Yang S H, Wan J M. A study on seed dormancy in rice (Oryza sativa L.). J Nanjing Agric Univ, 2001, 24(2): 1–5 (in Chinese with English abstract)
[22] Du W, Cheng J, Cheng Y, Wang L, He Y, Wang Z, Zhang H. Physiological characteristics and related gene expression of after-ripening on seed dormancy release in rice. Plant Biol, 2015, 17: 1156–1164
Effects of Different Dehydrating Agents on Seed Quality and Gene Expression in Hybrid Rice Seed Production
SHEN Hang-Qi1, HU Wei-Min1, LIN Cheng1, GUAN Ya-Jing1, LIU Hong-You2, AN Jian-Yu1, and HU Jin1,*
1Seed Science Center, College of Agriculture and Biotechnology, Zhejiang University, Hangzhou 310058, China;2Seed Management Station of Pujiang County, Jinhua 322200, China
Seed dehydration is very important in hybrid rice seed production. For seed production safety, dehydrating agents are used in this process because natural dehydration is slow and easily affected by rainy weather, which often results in seed late mature of and pre-harvest sprouting. In this study, the effects of different dehydrating agents on seed dehydration and quality were compared using hybrid rice variety “Y Liangyou 689”. The eleven dehydrating agents tested all accelerated seed dehydration. Particularly, agents No.7 and No.9 resulted in seed moisture content at five days after spray decreased by 4.6% and 3.6%, respectively, and had no negative effects on 1000-grain weight, seed germination and seedling growth. Moreover, both agents significantly increased the contents of soluble protein, soluble sugar, ABA and GA3in seeds. After storage at room temperature for six months, agents No.7, No.8, and No.9 had no negative effects on seed germination and seedling growth as compared to the control. There were no significant differences in soluble protein content, α-amylase activity and ABA content among agents No.7, No.9 and the control. Agent No.7 was better in lowering seed moisture content than No.9, suggesting its potential use in Y Liangyou 689 seed production. Interestingly, agents No.7, No.8, and No.9 induced OsNECD1 and OsNCED2 expressions and reduced OsGA2ox1 expression in seeds before storage. After six-month storage, the expressions of OsNECD1 and OsNCED2 decreased and the expression of OsCYP707A5 and OsGA2ox1 increased in seeds treated with agents No.7, No.8, and No.9. This result indicate that the effects of dehydrating agents on ABA biosynthesis genes and GA3catabolism genes in seeds weakened during stor-age and the high expression level of OsCYP707A5 resulted in the decline of ABA content, which might be a main reason for better seed germination.
Hybrid rice; Dehydration agent; Seed quality; Mature dehydration; Gene expression
(
): 2016-12-09; Accepted(接受日期): 2017-05-10; Published online(网络出版日期): 2017-05-25.
10.3724/SP.J.1006.2017.01308
本研究由国家公益性行业(农业)科研专项(201203052), 浙江省科技厅项目(2013C02005, 2013C32023), 浙江省自然科学基金项目(LZ14C130002, LY15C130002)和江苏省现代作物生产协同创新中心项目资助。
This study was supported by the China Special Fund for Agro-scientific Research in the Public Interest (201203052), the Science and Technology Department of Zhejiang Province (2013C02005, 2013C32023), the Natural Science Fundation of Zhejiang Province (LZ14C130002, LY15C130002), and the Jiangsu Collaborative Innovation Center for Modern Crop Production.
*通讯作者(Corresponding author): 胡晋, E-mail: jhu@zju.edu.cn
联系方式: E-mail: 736935396@qq.com
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20170525.1021.002.html

