外周化学感受性反射在慢性心力衰竭中的作用及其机制探讨*
唐玉红 周华 周黎明 丁延锋 HD Schultz
(1.四川大学华西基础医学与法医学院生理教研室,四川 成都 610041;2.四川大学华西基础医学与法医学院药理教研室,四川 成都 610041;3.美国内布拉斯加州立大学医学中心细胞与整合生理系,内布拉斯加州 奥马哈 68198-5850)
论 著
外周化学感受性反射在慢性心力衰竭中的作用及其机制探讨*
唐玉红1△周华1周黎明2丁延锋3HD Schultz3
(1.四川大学华西基础医学与法医学院生理教研室,四川 成都 610041;2.四川大学华西基础医学与法医学院药理教研室,四川 成都 610041;3.美国内布拉斯加州立大学医学中心细胞与整合生理系,内布拉斯加州 奥马哈 68198-5850)
目的:探讨外周化学感受性反射在缺血性心脏病所致慢性心力衰竭中的作用及其机制。方法:采用结扎SD大鼠左冠状动脉前降支制备慢性心力衰竭(Chronic heart failure,CHF)模型;测定清醒大鼠的每分肺通气量(Minute ventilation,VE)作为衡量外周化学感受性反射的指标;放射免疫技术测定颈动脉体(Carotid body,CB)血管紧张素II(Angiotensin II,Ang II)水平;并采用Western blot方法检测 CB组织Ang II 1型受体(Angiotensin II receptor subtype 1 receptor,AT1R)和血管紧张素转化酶(Angiotensin converting enzyme,ACE)的蛋白表达。结果:8周后模型组大鼠形态学和血流动力学指标均达到CHF动物模型标准,CHF模型制备成功。清醒CHF大鼠在常氧和不同程度缺氧状态下,VE均高于假手术组(P<0.05)。放射免疫实验结果显示,CHF组CB组织AngII水平明显高于假手术组(P<0.05);Western blot结果显示,与假手术组相比,CHF组CB组织AT1R和ACE的蛋白表达显著增强(P<0.05)。结论:冠脉结扎的CHF大鼠对缺氧刺激引起的外周化学感受性反射增强,可能促进了交感神经活动的过度激活。升高的Ang II可能通过AT1R参与了CB化学感受性反射增强。
慢性心力衰竭;外周化学感受性反射;颈动脉体;血管紧张素II;血管紧张素II1型受体;缺氧
心力衰竭,简称心衰(Chronic heart failure,CHF)是各种心血管疾病发展的终末阶段,也是导致心血管疾病死亡的主要原因。随着人口老龄化的加速、冠心病和高血压发病率的上升,冠状动脉疾病所致缺血性心脏病成为引起心衰最常见的病因[1-3]。探讨缺血性心脏病心衰的深层次病理生理机制,进而发掘治疗新策略,有着极其重大的理论和实际意义。
大量研究证实交感神经活动(Sympathetic nerve activity,SNA)增强是慢性心衰的特征。持续增强的SNA增加了心脏的前、后负荷,最终导致心肌毒性和细胞凋亡,是加速病情恶化并使患者存活期缩短的重要因素[4-9]。研究发现,在CHF中造成交感功能紊乱涉及多种因素,其机制非常复杂。
近年来,在临床病人和CHF动物模型都观察到化学感受性反射(Chemoreceptive reflex)参与了CHF中的交感功能紊乱[10-11]。前期研究表明,起搏方式诱导的心衰家兔,在清醒状态下对外周化学感受性反射(Peripheral chemoreceptive reflex)的敏感性增强,并对交感神经的过度兴奋起到重要作用;升高的Ang II对CB的作用介导了这一效应[12-14]。 然而,关于外周化学感受性反射在CHF中的作用,对临床病人的研究结果不尽相同,至今尚无定论[15]。
因此,本实验以冠脉结扎诱导的CHF大鼠为研究对象,以每分肺通气量为衡量外周化学感受性反射的指标, 并结合Western blot方法和放射免疫测定技术,观察在缺血性心肌病性心衰过程中,外周化学感受性反射是否增强及AngII在其中的作用。
1 材料与方法
1.1 材料
1.1.1 动物
SD雄性大鼠共52只,220-280 g ,由Sasco Breeding Laboratories (Omaha,NE,USA)提供,实验方案得到内布拉斯加大学医学中心动物护理和使用委员会批准,饲养和护理符合美国国立卫生研究院《实验动物护理和使用指南》。
1.1.2 仪器
PowerLab16S生物信号采集和处理系统(AD Instruments Inc, Australia);出口管与分压传感器 MP-45(Validyne Engineering,Northridge,CA,USA);SigmaScan Pro软件(Aspire Software International,USA);DSI Dataquest PA C40血压遥测装置(Data Science International,USA);Wizard 1470自动伽玛计数仪(PerkinElmer,CT,USA)等。
1.1.3 试剂
羊抗大鼠AT1 抗体(SC-31181,Santa Cruz,USA);羊抗大鼠ACE抗体(SC-12187,Santa Cruz,USA);小鼠抗大鼠TH抗体(Sigma-Aldrich Chemical Co.,St Louis,MO,USA);驴抗羊抗体(Invitrogen Alexa Fluro 488,Molecular Probes,USA);驴抗小鼠抗体(Invitrogen Alexa Fluro 568,Molecular Probes,USA);BCA蛋白定量检测试剂盒(Protein assay kit (Pierce,USA);01-RK-A22 AngII125I 放射免疫试剂盒(ALPCO Diagnostics,USA)等。
1.2 方法
1.2.1 大鼠冠脉结扎心衰模型的制备
雄性SD大鼠,3%异氟醚麻醉,于左冠状动脉起始点下2 mm(前降支)处,用穿有6-0号丝线的不锈钢弯针穿过,结扎,造成心肌缺血。假手术组(Sham)以完全相同的方式操作,但不结扎冠状动脉。术后8周超声心动图评估所有大鼠的心脏功能。与Sham组大鼠正常心脏功能相比,冠脉结扎大鼠的射血分数(Ejection fraction,EF)和左室短轴缩短率(Left ventricular fractional shortening,FS)降低>30%时,计入心衰模型组。并且在实验结束后和处死动物前,进一步测量左室舒张期末压(Left ventricular end diastolic pressure,LVEDP)等指标;处死动物,测量心梗面积和全左心室壁面积;当LVEDP>15 mmHg及心梗面积占左室壁面积之比>30%的冠脉结扎大鼠,最终被确定获得CHF。
1.2.2 大鼠在清醒状态下外周化学感受性反射活动的记录
将大鼠置于一自制的有机玻璃盒里,通入气体的导管经从盒两侧小孔出入,不同浓度的混合气体流过有机玻璃盒,使血液气体浓度改变。出口管与分压传感器MP-45相连,后者通过放大器连于PowerLab 16S生物信号采集和处理系统。记录大鼠清醒状态下潮气量(Tidal volume,VT)和呼吸频率(Respiratory rate,RR)以计算VE。依次给予大鼠21%O2(常氧)、15%O2(轻度缺氧)和10%O2(重度缺氧),观察上述指标的改变,同时经放置于股动脉的血压遥测装置监测动脉血压和心率。
1.2.3 CB组织Ang II浓度的测定
将假手术组与CHF组大鼠CB组织匀浆、萃取和重建,每管样品用Wizard 1470自动伽玛计数仪计数1 min,根据标准曲线得到AngII浓度。采用放射免疫技术测定CB组织Ang II的浓度。
1.2.4 CB组织AT1R和ACE的表达
迅速取下每只大鼠两侧的CB,立即放入干冰,并储存于-80°C备用。提取CB组织中的蛋白质,采用常规Western blot方法,检测AT1R和ACE在CB组织的表达。
1.3 统计分析
各组数据用均值±标准差表示,用SigmaStat统计软件对数据进行配对t检验,以P<0.05为有显著性差异。分别以AT1R和ACE蛋白条带的灰度值与内参GAPDH条带的灰度值的比值作为评价AT1R和ACE蛋白质表达水平的指标。
2 结果
2.1 大鼠冠脉结扎心衰模型的制备
26只假手术组大鼠动物均存活,冠脉结扎组存活率约为68%。假手术组大鼠心脏形态正常,没有可见的心肌损伤,见图1A;模型组大鼠心脏增大,左室可见明显的梗死区域,梗死区心肌为白色瘢痕组织代替,左室腔扩大,左室壁增厚,见图1B,模型组心梗面积占左室壁面积之比为43.1%±3.9。与假手术组相比,模型组大鼠的心脏重量与体重之比增加,左室舒张期末压(Left ventricular end diastolic pressure,LVEDP)明显升高,而射血分数(Ejection fraction,EF)和左室短轴缩短率(Left ventricular fractional shortening,FS)显著降低,见表1。

A B图1 假手术组(A)和CHF大鼠(B)左心室腔照片 (黄色箭头指示梗死区)
注:与假手术组相比,*P<0.05。
LVESD(Left ventricular end-systolic diameter)—左室收缩末期直径;LVEDD(Left ventricular end-diastolic diameter)—左室舒张末期直径。
2.2 CHF大鼠在清醒状态下外周化学感受性反射活动增强
实验发现,在常氧(21%O2)、中度(15%O2)和重度(10%O2)缺氧的状态下,CHF组的每分肺通气量(VE)均高于假手术组(P<0.05),见表2 。

表2 在不同O2浓度下假手术组和CHF组大鼠的每分肺通气量(X±SD)
注:与假手术组相比,*P<0.05。
2.3 CHF组CB组织Ang II浓度增高
放射免疫实验结果显示,CHF组AngII水平明显高于假手术组(P<0.05),见表3。
2.4 CHF大鼠CB组织AT1R和ACE的蛋白表达增强
Western blot结果显示,与假手术组相比,CHF组CB组织AT1R和ACE的蛋白表达增强(P<0.05),见图2和表3。
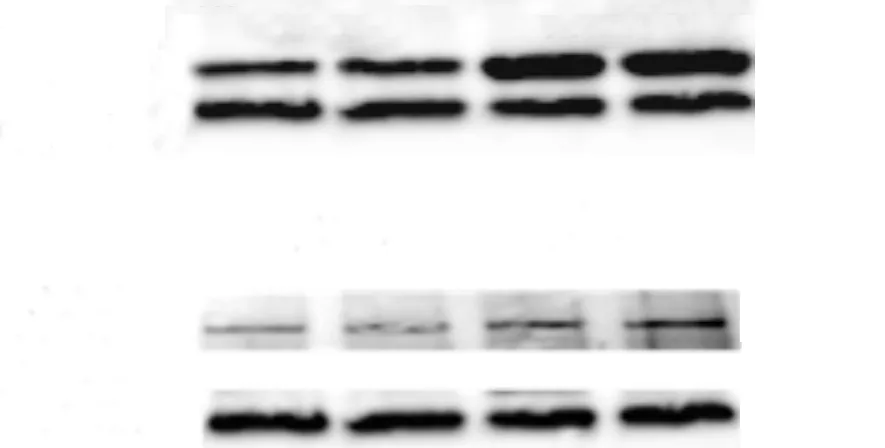
图2 假手术组和慢性心衰组大鼠CB组织 AT1R(A)及ACE(B)的表达

组 别例 数AngII浓度(pg·mg-1)AT1R/GAPDHACE/GAPDH假手术组 20362±363113±025028±002慢性心衰组195144±043∗213±023∗037±002∗
注:与假手术组相比,*P<0.05。
3 讨论
本实验采用结扎大鼠左冠状动脉前降支8周制备CHF模型,结果显示,模型组大鼠心室肥厚,左心室有大于30%的梗死区域和左心室功能明显减弱,达到心衰动物模型的组织学和功能学指标,表明CHF模型制备成功。
与快速起搏心衰模型相比,大鼠冠脉结扎的心衰模型能更好地模拟临床缺血性心肌病性CHF的病理生理过程,并具有成本低廉,可操作性强等优点,更适用于缺血性心肌病性心衰的研究[16]。
本实验以VE为衡量外周化学感受性反射的指标,观察到冠脉结扎的心衰大鼠对缺氧刺激引起的外周化学反射增强,与前期在家兔心衰模型的研究报道一致[12],进一步证实了CHF过程中外周化学感受性反射的增强,该现象可能参与了交感神经活动的过度激活。而在冠脉结扎诱导的心衰大鼠模型上的这一发现,则为临床缺血性心肌病性心衰中SNA增强机制的研究提供了新的路径。常氧下CHF组VE也高于假手术组,可能的机制是在CHF发生发展过程中,由于心脏功能减弱造成的动脉供血供氧不足,引起代偿性化学反射增强。
AngII是肾素-血管紧张素系统的成分之一,由血浆或组织中的ACE水解血管紧张素I而生成;其生理作用几乎都是激动AT1受体产生的。AngII主要在失血、运动、肾血流量降低时发挥心血管调控作用[17]。由于Ang II具有改变中枢神经系统交感功能的作用,被认为是调节交感传出最主要的因素。有研究表明在冠脉结扎诱导的心衰大鼠中枢Ang II在交感传出的增强起到重要作用[13]。在CHF病人和CHF动物模型都观察到血浆和组织的Ang II 水平增高[14]。前期采用起搏诱导的家兔心衰模型研究也提示CB的Ang II和AT1R增强了外周化学感受器对低氧的敏感性[12]。在本实验中,CHF大鼠CB组织Ang II的浓度增加及AT1R、ACE的蛋白表达增强,提示CB组织AngII合成增加,并通过AT1受体发挥作用。
综上所述,本研究证实了CHF过程中外周化学感受性反射活动增强并可能参与交感神经活动的过度激活,升高的Ang II可能通过AT1受体参与了CB化学感受性反射增强。该研究为进一步探讨缺血性心脏病心衰的病理生理机制及发掘新的药物靶点提供了新的实验依据。
1 ACC/AHA 2005 Guideline Update for the Diagnosis and Management of Chronic Heart Failure in the Adult[J]. Circulation, 2005, 112(12): e154-e235.
2 2007中国慢性心力衰竭诊断治疗指南[J]. 中华心血管病杂志, 2007, 35(12): 1076-1095.
3 姜红,葛均波. 心力衰竭流行病学特点[J]. 中国医学前沿杂志(电子版), 2010, 2(1): 1-5.
4 Packer M. Neurohormonal interactions and adaptations in congestive heart failure[J]. Circulation, 1988, 77(4): 721-730.
5 Cerqueira-Gomes M, Polónia J, Brandão F, et al. Neuro-hormonal mechanisms in heart insufficiency--from physiopathology to treatment[J]. Rev Port Cardiol, 1989, 8(2): 129-148.
6 戴闺柱. β1受体阻滞剂治疗心力衰竭:选择性β1受体阻滞剂或全受体阻滞剂[J].中华心血管病杂志, 2001, 29(11): 696-697.
7 Esler M, Kaye D, Lambert G, et al. Adrenergic nervous system in heart failure[J]. Am J Cardiol, 1997, 80(11A): 7L-14L.
8 Singh K, Xiao L, Remondino A, et al. Adrenergic regulation of cardiac myocyte apoptosis[J]. J Cell Physiol, 2001, 189(3): 257-265.
9 Zucker IH, Schultz HD, Li YF, et al. The origin of sympathetic outflow in heart failure: the roles of angiotensin II and nitric oxide[J]. Prog Biophys Mol Biol, 2004, 84(2-3): 217-232.
10Marshall JM. Peripheral chemoreceptors and cardiovascular regulation[J]. Physiol Rev, 1994, 74(3): 543-594.
11Schultz HD, Sun SY. Chemoreflex function in heart failure[J]. Heart Fail Rev, 2000, 5(1): 45-56.
12Sun SY, Wang W, Zucker IH, et al. Enhanced peripheral chemoreflex function in conscious rabbits with pacing-induced heart failure[J]. J Appl Physiol, 1999, 86(4): 1264-1272.
13Liu JL, Zucker IH. Regulation of sympathetic nerve activity in heart failure: a role for nitric oxide and angiotensin II[J]. Circ Res, 1999, 84(4): 417-423.
14Sun SY, Wang W, Zucker IH, et al. Alteration of peripheral chemoreflex and arterial baroreflex in heart failure: Role of central angiotensin II[J]. The FASEB J, 1999, 13(A): 444-444.
15Francis GS. The relationship of the sympathetic nervous system and the renin angiotensin system in congestive heart failure[J]. Am Heart J, 1989, 118(3): 642-648.
16Schultz HD, Marcus NJ, Del Rio R. Role of the carotid body chemoreflex in the pathophysiology of heart failure: A perspective from animal studies[J]. Adv Exp Med Biol, 2015, 860(12): 167-185.
17朱大年,王庭槐. 生理学(第8版)[M]. 北京: 人民卫生出版社, 2013, 138-139.
Enhanced peripheralchemoreceptive reflex activity and the involved mechanism in conscious rats with chronic heart failure*
Tang Yu-hong1Δ, Zhou Hua1, Zhou Li-ming2, Ding Yan-feng3, HD Schultz3
(1.Department of Physiology, West China School of Basic Medical Sciences and Forensic Medicine, Sichuan University, Sichuan Chengdu 610041; 2.Department of Pharmacology, West China School of Basic Medical Sciences and Forensic Medicine, Sichuan University, Sichuan Chengdu 610041; 3.Department of Cellular and Integrative Physiology, University of Nebraska Medical Center, Nebraska Omaha 68198-5850)
Objective:To investigate the mechanisms of the peripheral chemoreceptive reflex in chronic heart failure caused by ischemic cardiomyopathy. Methods: CHF was produced by ligating the left anterior descending coronary artery in SD male rats. VE were measured in conscious rats as an indicator of peripheral chemoreceptive reflex. The Ang II levels of CB tissues were measured by radioimmunoassay, and the expression of AT1R and ACE protein in CB tissues were detected by Western blot. Results: CHF model was successfully produced for the morphological and hemodynamic indexes of rats reached the standard of CHF animal model 8 weeks after ligation. The VE in conscious CHF rats under normoxia and hypoxia were higher than that in the sham group (P<0.05). The level of AngII of CB tissues in CHF group was significantly higher than that in the sham group (P<0.05) by radioimmunoassay; Western blot results showed that compared with the sham group, the expressions of AT1R and ACE in CB tissues increased in CHF group (P<0.05). Conclusion: An enhancement of the peripheral chemoreceptive reflex occurs in the conscious rats with ligation-induced CHF and it may contribute to the sympathetic over-activation in the CHF state. Elevated Ang II in CB may be involved in the enhancement of CB chemoreceptive reflex via AT1R.
Chronic heart failure; Peripheral chemoreceptive reflex; Angiotensin II; Angiotensin II 1-type receptor; Carotid body; hypoxia
NIH基金(编号:PO-1 HL 62222)
唐玉红,女,讲师,主要从事神经生理学研究,Email:yvonneyht@163.com。
2017-7-17)

