微波-超声波协同影响菜籽蛋白糖基化改性
张燕鹏,张曼君,齐玉堂,张维农*,祝贤彬
(武汉轻工大学食品科学与工程学院,湖北 武汉 430023)
微波-超声波协同影响菜籽蛋白糖基化改性
张燕鹏,张曼君,齐玉堂,张维农*,祝贤彬
(武汉轻工大学食品科学与工程学院,湖北 武汉 430023)
采用微波-超声波协同作用强化菜籽蛋白的糖基化改性,并对所得糖基化产物进行了功能性质和分子结构的对比分析。结果表明,当改性条件为微波功率500 W、超声波功率300 W、协同作用时间7 min时,菜籽蛋白的接枝度可达67.1%,显著高于湿热法和微波法制备的糖基化产物,有效提高了蛋白质糖基化反应的效率;协同作用可显著改善所得糖基化产物的溶解性、乳化活性、起泡能力、泡沫稳定性,分别提高至55.7%、13.9 m2/g、50.0%和80.0%;糖基化产物的表面疏水性和圆二色谱结果分析表明,微波和超声波处理使得菜籽蛋白的分子展开,表面疏水性和分子柔性增加,从而促进了糖基化反应的进行,改善了蛋白质糖基化产物的功能特性。
微波-超声波协同作用;糖基化;菜籽蛋白;功能特性;分子结构
蛋白质的糖基化改性是基于蛋白质分子中的自由氨基与糖分子还原末端羰基之间的美拉德(Maillard)反应,无需化学试剂仅靠加热即可自发进行。蛋白质经糖基化改性后,不仅其溶解性、乳化性、起泡性、抗菌性和抗氧化性等功能特性可显著改善,并且可有效降低部分蛋白质的致敏性,因此被认为是一种绿色安全的蛋白质分子修饰改性方法[1-2]。目前蛋白质的糖基化反应分为干热法和湿热法,其中湿热法的糖基化反应时间较短,易于控制反应程度,但在湿热法反应过程中蛋白质易发生变性聚集而将反应基团包裹在分子内部,并且若采用多糖分子作为反应底物,其大分子结构会产生空间阻碍作用,从而影响糖基化反应的进行,降低糖接枝程度[3-5]。因此如何高效节能地促进蛋白质与多糖之间的接枝反应是通过Maillard反应改善蛋白质功能特性的关键。
微波-超声波协同作用可有效克服超声波与微波单独作用的不足,使得热作用、机械力学作用、空化作用和自由基作用等多种物理化学作用之间产生协同增强的效应,从而改变反应体系的微环境,加速反应过程的进行[6-7]。目前已有关于采用微波和超声波来强化蛋白质糖基化改性的研究[8-9],但有关微波-超声波复合物理场协同强化蛋白质糖基化改性的研究鲜见报道,因此本研究基于微波-超声波协同作用的原理,以菜籽蛋白为原料,在前期工作的基础上进一步研究探讨微波-超声波复合物理场对菜籽蛋白糖基化改性的影响,为更好改善菜籽蛋白的功能性质,扩展菜籽蛋白质的利用范围提供技术参考。
1 材料与方法
1.1 材料与试剂
菜籽蛋白(蛋白质量分数85.1%)为实验室自制;β-巯基乙醇、葡聚糖(分子质量40 kD)、邻苯二甲醛(o-phthalaldehyde,OPA) 美国Sigma公司;赖氨酸、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、硼砂、磷酸氢二钠、磷酸二氢钠 国药集团化学试剂有限公司。
1.2 仪器与设备
UWave-1000型微波-紫外-超声波三位一体合成萃取反应仪 上海新仪微波化学科技有限公司;SorvallRC6Plus型高速冷冻离心机 美国Thermo Scientific公司;T6新世纪紫外-可见分光光度计 北京普析通用仪器有限责任公司;FiveEasy实验pH计 瑞士Mettler Toledo公司;T25型高速分散器 德国IKA公司;F-4600型荧光光谱仪 日本日立公司;J-810型圆二色谱仪 日本Jasco公司;透析袋(截留分子质量10 kD)国药集团化学试剂有限公司。
1.3 方法
1.3.1 菜籽蛋白-糖接枝物的制备
根据前期实验结果,称取菜籽蛋白样品加入0.01 mol/L pH 9.0磷酸盐缓冲液中配制成8 mg/mL的蛋白质悬浮液,按1∶1(m/V)的比例加入葡聚糖充分搅拌2 h后置于微波-紫外-超声波三位一体合成萃取仪内,装好回流装置后,通过调节微波和超波的功率及反应时间来强化糖基化反应。反应结束迅速冷却至室温,离心取上清液经透析和冷冻干燥后制成干粉备用。
1.3.2 接枝度与褐变程度的测定
取4 mL现配的OPA试剂于试管中与200 μL样品液相混匀后35 ℃反应2 min,反应完毕后立即在340 nm波长处测其吸光度,同时以去离子水做空白。采用相同的方法使用赖氨酸制作标准曲线,并根据A340nm计算样品中自由氨基的含量,按公式(1)计算蛋白质的接枝度(degree of graft,DG)[10]。

式中:C0为未反应时蛋白质自由氨基含量/(μmol/mg);Ct为反应t时刻蛋白质自由氨基含量/(μmol/mg)。
取2 mL反应后的样品液与2 mL 0.1% SDS溶液相混合,以SDS溶液为空白,在420 nm波长处测定其吸光度,并以吸光度表示糖基化反应后的褐变程度[11]。
1.3.3 溶解性的测定
参照Jung等[12]的方法,将蛋白质溶解于去离子水中配制质量分数为1%的蛋白质溶液,在室温条件下搅拌1 h后8 000×g离心20 min,收集上清液,采用凯氏定氮法测定上清液中的蛋白质量,按公式(2)计算蛋白质的溶解性。

1.3.4 乳化性的测定
参照Gong Kuijie等[13]的方法并做一定修改后测定菜籽蛋白的乳化性。取45 mL 0.2%蛋白质溶液(溶于0.01 mol/L pH 7.0磷酸盐缓冲液中)加入15 mL大豆油,在10 000 r/min、25 ℃条件下搅拌1 min后分别在0 min和10 min时从底部抽取50 μL的样品,加入5.0 mL的0.1%的SDS溶液中,以SDS溶液为空白测定A500nm。分别按公式(3)、(4)计算乳化活性指数(emulsifying activity index,EAI)和乳化稳定性指数(emulsifying stability index,ESI)。
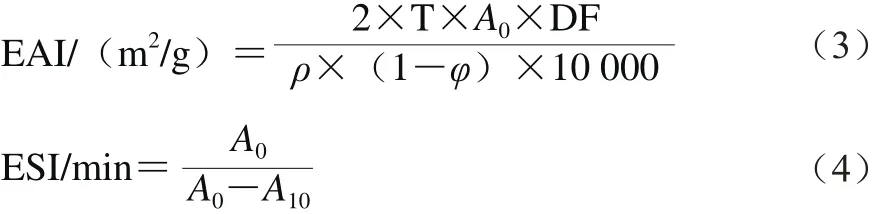
式中:T为2.303;DF为稀释倍数(100);ρ为蛋白质量浓度/(g/mL);φ为乳液中油相所占比例;A0和A10分别为0 min和10 min时的吸光度。
1.3.5 起泡性的测定
采用Phongthai等[14]的方法并做一定的修改,取100 mL 1%蛋白质溶液加入250 mL量筒中,在高速搅拌器作用下以10 000 r/min搅拌1 min后立即测定其泡沫体积V0,将量筒静置120 min后,再次测量泡沫的体积V120,按公式(5)、(6)计算蛋白质的起泡能力(foam capacity,FC)和泡沫稳定性(foam stability,FS)。


1.3.6 表面疏水性的测定
以8-苯氨基萘-1-磺酸铵盐(1-anilino-8-naphthalenesulfonate,ANS)为荧光探针来测量蛋白质的表面疏水性,用0.01 mol/L pH 7.0磷酸盐缓冲液中配制质量浓度为0.14~0.02 mg/mL之间的蛋白质溶液,取30 μL 8.0 mmol/L ANS溶液(采用0.01 mol/L pH 7.0磷酸盐缓冲液配制)与6 mL不同质量浓度的蛋白质溶液混合后在激发光和散射光分别为390 nm和470 nm波长处测定荧光强度。以荧光强度为纵坐标、菜籽蛋白质量浓度为横坐标作图,曲线初始阶段的斜率即为蛋白质的表面疏水性指数[15]。
1.3.7 圆二色谱分析
将蛋白质糖基化产物溶解于pH 7.2 0.01 mol/L磷酸盐缓冲液中,并调节蛋白质量浓度为0.3 mg/mL左右。以磷酸盐缓冲液为参比,采用0.1 cm的比色皿,在190~250 nm范围内进行扫描,扫描速率设为30 nm/min,灵敏度设为100 mdeg,响应时间为2 s,重复扫描3 次得到圆二色光谱图[16],并采用CD Pro软件对蛋白质二级结构含量进行分析。
1.4 数据处理
所有实验均重复3 次后求平均值,并采用Origin 9.0和SPSS 22分析软件对实验数据进行处理分析。
2 结果与分析
2.1 微波对蛋白质糖基化反应的影响
根据前期实验结果可知,当湿热法的条件为:菜籽蛋白质量浓度8 mg/mL、蛋白质与葡聚糖比例1∶1(m/m)、反应温度和时间分别为60 ℃和6 h时,菜籽蛋白的接枝度最高可达45.9%。在此基础上,将糖基化反应体系的温度控制在60 ℃以内,研究单独微波处理对蛋白质糖基化反应的影响。
2.1.1 微波功率对蛋白质糖基化反应的影响
如图1所示,随着微波功率的增强,菜籽蛋白的接枝度呈现先增大后减小的趋势,这可能是因为在100~500 W的范围内时,微波处理可一定程度改善蛋白质的溶解性[17],增加反应体系中自由氨基的含量,从而增加自由氨基与多糖羰基碰撞的几率,促进糖基化反应的进行,但随着微波功率的继续增大,在高强度的微波作用下,反应体系的温度不好控制,容易使得局部产生高温,造成部分蛋白质发生聚集而降低表面自由氨基的含量,使得接枝度下降,同时随着微波功率的增加,反应体系的褐变程度加大,故选取微波功率为500 W比较合理。

图1 微波功率对菜籽蛋白糖基化反应的影响Fig. 1 Effect of microwave power on glycosylation of rapeseed protein
2.1.2 微波时间对糖基化反应的影响
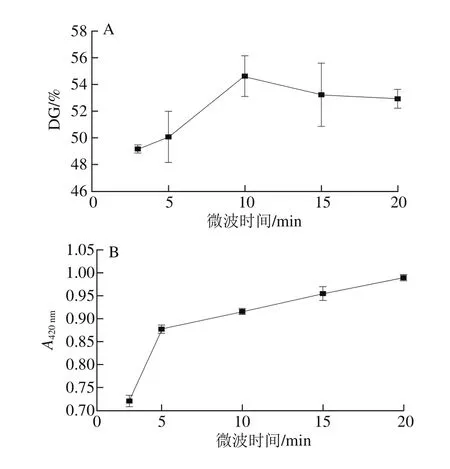
图2 微波时间对菜籽蛋白糖基化反应的影响Fig. 2 Effect of microwave treatment time on glycosylation reaction of rapeseed protein
由图2可知,当微波处理时间为10 min时,菜籽蛋白的接枝度最高可达54.6%,随着微波处理时间的延长,接枝度的变化不显著(P>0.05),这可能是因为在过长时间的微波处理下,一方面菜籽蛋白的溶解性增加,另外蛋白质分子发生解离和去折叠展开[18],从而使得可利用的自由氨基增加,而同时由于多糖的含量减少,更多的自由氨基无法发生接枝反应,自由氨基的基数变大,因此使得菜籽蛋白的接枝度的变化不显著,甚至有下降的趋势。另外从反应体系的褐变程度来看,随着反应时间的延长褐变程度加大,故选取微波时间为10 min。
2.2 微波-超声波协同作用对蛋白质糖基化反应的影响在上述微波强化米糠蛋白糖基化反应的基础上,采用微波功率500 W,进一步研究微波-超声波协同作用对菜籽蛋白糖基化反应的影响。
2.2.1 协同作用下超声波功率对糖基化反应的影响

图3 超声波功率对菜籽蛋白糖基化的影响Fig. 3 Effect of ultrasonic power on glycosylation reaction of rapeseed protein
由图3可知,当作用时间同为10min时,与单独微波处理相比,微波-超声波协同作用可有效增加菜籽蛋白的接枝度,这是由于在微波-超声波协同作用下,微波快速加热效应和超声波的机械搅拌与加速扩散作用可有效增强体系的加热效果的均匀性,同时微波的电磁场与超声波的空穴作用会在反应体系中形成超临界高温与高压的微环境及界面浓缩现象,可显著增大分子的运动频率与速率,增加蛋白质分子与多糖分子接触面积和碰撞,促进分子间的相互作用,从而有利于糖基化反应的进行[7-8,19]。但随着超声功率的增加,接枝度有一定程度的降低,这可能是由于微波-超声波协同作用使得蛋白质部分肽链发生断裂,或使得蛋白质展开的肽链发生重新聚集,从而导致接枝度降低,另外过高的超声波功率会使得反应体系向Maillard反应的高级阶段进行,从而使褐变程度增加。
2.2.2 协同作用时间对糖基化反应的影响
由图4可知,菜籽蛋白的接枝度在协同作用7 min时达到最大值67.1%,当协同作用时间继续延长时,接枝度反而降低。这说明在一定强度的微波-超声波协同作用下,菜籽蛋白的分子结构发生变化,有利于增加蛋白质分子与多糖分子之间的碰撞机率,促进糖基化反应的进行,但过高强度的微波-超声波协同处理可能会导致蛋白质的氢键和肽键断裂,N-末端残基数目增多,产生新的自由氨基,导致其基数的增大,从而使得接枝度下降[20-21],同时随着协同作用时间的延长,体系中Maillard反应的高级产物增多,褐变程度增加,因此选择微波-超声波协同作用时间为7 min。

图4 协同作用时间对菜籽蛋白糖基化反应的影响Fig. 4 Effect of synergic treatment time on glycosylation reaction of rapeseed protein
2.3 糖基化反应对蛋白质功能性质与结构的影响
2.3.1 蛋白质功能性质的分析

表1 蛋白质样品功能性质分析Table 1 Functional properties of native and glycosylated protein
基于上述实验和前期的研究工作,以接枝度最大的菜籽蛋白糖基化产物为研究对象,分析不同糖基化改性方法对菜籽蛋白功能性质的影响。由表1可知,与菜籽蛋白质相比,蛋白质经糖基化改性后,其溶解性均显著增加(P<0.05),其中超声波-微波协同强化制备的菜籽蛋白糖基化产物的溶解性显著提高至55.7%左右,这说明由于微波-超声波协同作用可有效增加菜籽蛋白的接枝度,使其分子上的亲水性羟基增多,从而有利于菜籽蛋白溶解性的增加。
蛋白质的糖基化改性不仅可影响其溶解性,而且可进一步影响到蛋白质的其他功能特性。如表1所示,糖基改性后菜籽蛋白的乳化活性显著改善,尤其是在微波-超声波协同作用下,菜籽蛋白糖基化产物的EAI提高了
2.6 倍,这与糖基化菜籽蛋白的溶解性显著提高有关,可使较多蛋白质分子吸附到油/水界面,降低界面张力。但与菜籽蛋白和湿热法所得糖基化产物相比,物理场处理得到的菜籽蛋白糖基化产物的ESI显著降低,这是由于糖链的引入虽然可以在一定程度上使得蛋白质表面的电荷增加,加强空间位阻效应,有利于乳状液的稳定性,但界面上蛋白质膜的机械程度还与分子间的相互作用有关,静电排斥力过强,疏水作用太强,均会影响蛋白质在界面黏稠膜的形成,从而使得蛋白质的ESI降低[22]。这就说明适当的接枝反应是蛋白质糖基化改性中的重要一方面。另外就起泡性质而言,糖基化改性后,菜籽蛋白的FC均显著增加,但湿热法制备的菜籽蛋白糖基化产物的FS与原样菜籽蛋白相比差异性不显著,而经微波和微波-超声波协同作用所得菜籽蛋白糖基化产物的FS显著增强,这说明物理场作用使得蛋白质分子上接入更多的糖链后,一方面由于增加了其溶解性,使得更多的蛋白质吸附于界面而降低界面张力,同时也改变了蛋白质表面亲水性-疏水性平衡,从而有利于改善菜籽蛋白的起泡能力;另一方面物理场的作用也改变了蛋白质分子的分子结构,使得蛋白质分子更易于在界面展开排列并相互作用形成较紧密的膜从而有利于改善菜籽蛋白的泡沫稳定性[23-24]。
2.3.2 表面疏水性分析

图5 糖基化改性对菜籽蛋白表面疏水性的影响Fig. 5 Effect of glycosylation on surface hydrophobicity of rapeseed protein
如图5所示,与菜籽蛋白相比,糖基化改性后蛋白质的表面疏水性均显著增加(P<0.05),说明糖基化改性使得菜籽蛋白分子展开,疏水基团外露,而外加物理场破坏了蛋白质分子结构中部分化学键间的相互作用,使得菜籽蛋白发生解聚和展开,不仅有利于糖接枝反应的进行,同时也使得表面疏水基团增加。但与单独微波处理相比,微波-超声波协同作用使得蛋白糖基化产物的表面疏水性降低,这可能是因为在复合物理场下,超声波的空化作用会产生瞬间的高温,高压效应及强烈的机械效应,这使得部分蛋白质分子发生聚集,从而降低了蛋白质分子的表面疏水性[25]。表面疏水性的增加可能会导致蛋白质分子由于疏水相互作用而在界面聚集、凝结和最终沉淀,因而不利于蛋白质膜的完整性[22],这在一定程度上影响了蛋白质糖基化产物的乳化稳定性。当然也有研究表明,蛋白质经糖基化改性后由于糖链上的羟基可以增加蛋白质的亲水性,改变亲水性和疏水的平衡,并且部分屏蔽表面疏水基团,从而使得表面疏水性降低[26]。这种糖基化改性反应对蛋白质表面疏水性的影响差异性可能与所选用的蛋白质种类和蛋白质接枝程度的不同有关。
2.3.3 远紫外圆二色谱分析
蛋白质的圆二色谱分为2 段:远紫外区(190~250 nm)和近紫外区(250~320 nm),远紫外区是肽键的吸收范围,反映蛋白质主链的构象,具有不同二级结构的蛋白质所产生的圆二色谱谱带的位置和吸收的强度不同,可根据远紫外圆二色谱来推测蛋白质的二级结构[27]。

图6 菜籽蛋白样品的圆二色谱图Fig. 6 Circular dichroism spectra of native and glycosylated rapeseed protein

表2 菜籽蛋白样品二级结构比例Table 2 Secondary structure contents of native and glycosylated rapeseed protein %
图6为菜籽蛋白与其糖基化产物样品的远紫外圆二色谱图,通过CDPro软件分析可得α-螺旋、β-折叠、β-转角及无规卷曲4 种结构的比例如表2所示,经糖基化改性后菜籽蛋白的β-折叠结构相对含量明显降低,α-螺旋相对含量则增加,同时β-转角和无规卷曲的相对含量则各有不同程度的增加,这说明糖基化改性使得菜籽蛋白质分子中部分β-折叠有序结构转变为无序结构,有利于蛋白质分子的展开,增加其表面疏水性和柔性,有利于其功能特性的改善[1,28-29]。另外与湿热法糖基化改性相比,物理场强化糖基化改性使得菜籽蛋白中无序结构含量增加较多,这也表明微波与微波-超声波协同作用可有效的部分破坏蛋白质分子间的相互作用力,使得蛋白质分子发生去折叠,有利于菜籽蛋白糖基化改性的进 行。
3 结 论
采用微波-超声波协同作用对菜籽蛋白进行糖基化改性,利用物理场之间的协同增强效应可有效改变反应体系的微环境,促进分子之间相互作用与碰撞,从而提高蛋白质糖基化改性的效率。当微波功率500 W、超声波功率300 W、协同作用时间7 min时,蛋白质的DG可达67.1%,显著高于湿热法和微波法制备的糖基化产物,同时所需时间也大幅降低,有效提高了糖基化反应的效率。对所制备菜籽蛋白糖基化产物的功能性质进行对比研究发现,在微波-超声波协同作用下,糖基化产物的溶解性、乳化活性、起泡性和泡沫稳定性等功能特性显著提高,而乳化稳定性则显著降低。糖基化产物的表面疏水性和圆二色谱图的结果分析表明,与菜籽蛋白和湿热法制备的糖基化产物相比,微波和微波-超波协同作用所得糖基化产物的表面疏水性显著增加,二级结构发生变化,其中β-转角和无规卷曲等无序结构含量增加,这说明在蛋白质的糖基化反应过程中,物理场作用使得菜籽蛋白的分子结构发生了改变,蛋白质分子的柔性增加,不仅促进了糖基化反应的进行,而且影响了糖基化产物的结构与功能性质。
[1] LIU J H, RU Q M, DING Y T. Glycation a promising method for food protein modifi cation: physicochemical properties and structure, a review[J]. Food Research International, 2012, 49(1): 170-183. DOI:10.1016/j.foodres.2012.07.034.
[2] 张楠, 布冠好, 朱婷伟, 等. 糖基化反应对大豆蛋白-乳糖复合物抗原性及结构的影响[J]. 现代食品科技, 2015, 31(8): 117-121. DOI:10.13982/j.mfst.1673-9078.2015.8.020.
[3] PERUSKO M, AL-HANISH A, VELICKOVIC T C, et al. Macromolecular crowding conditions enhance glycation and oxidation of whey proteins in ultrasound-induced Maillard reaction[J]. Food Chemistry, 2015, 177: 248-257. DOI:10.1016/j.foodchem.2015.01.042.
[4] ZHU D, DAMODARAN S, LUCEY J A. Formation of whey protein isolate (WPI)-dextran conjugates in aqueous solutions[J]. Journal of Agricultural and Food Chemistry, 2008, 56(16): 7113-7118. DOI:10.1021/jf800909w.
[5] MATSUDOMI N, INOUE Y, NAKASHIMA H, et al. Emulsion stabilization by Maillard-type covalent complex of plasma protein with galactomannan[J]. Journal of Food Science, 1995, 60(2): 265-268. DOI:10.1111/j.1365-2621.1995.tb05652.x.
[6] GUDE V G. Synergism of microwaves and ultrasound for advanced biorefi neries[J]. Resource-Effi cient Technologies, 2015, 1(2): 116-125. DOI:10.1016/j.reffi t.2015.10.001.
[7] MARTINEZ-GUERRA E, GUDE V G. Transesterification of used vegetable oil catalyzed by barium oxide under simultaneous microwave and ultrasound irradiations[J]. Energy Conversion and Management, 2014, 88: 633-640. DOI:10.1016/j.enconman.2014.08.060.
[8] ZHANG H, YANG J, ZHAO Y. High intensity ultrasound assisted heating to improve solubility, antioxidant and antibacterial properties of chitosan-fructose Maillard reaction products[J]. LWT-Food Science and Technology, 2015, 60(1): 253-262. DOI:10.1016/ j.lwt.2014.07.050.
[9] 管军军, 白新鹏, 方希修, 等. 微波合成大豆蛋白-糖接枝物理化性质的研究[J]. 食品科学, 2007, 28(6): 30-35. DOI:10.3321/ j.issn:1002-6630.2007.06.002.
[10] XU D, YUAN F, WANG X, et al. The effect of whey protein isolatedextran conjugates on the freeze-thaw stability of oil-in-water emulsions[J]. Journal of Dispersion Science and Technology, 2010, 32(1): 77-83. DOI:10.1080/01932690903546785.
[11] LI Y, LU F, LUO C, et al. Functional properties of the Maillard reaction products of rice protein with sugar[J]. Food Chemistry, 2009, 117(1): 69-74. DOI:10.1016/j.foodchem.2009.03.078.
[12] JUNG S, MAHFUZ A A. Low temperature dry extrusion and highpressure processing prior to enzyme-assisted aqueous extraction of full fat soybean flakes[J]. Food Chemistry, 2009, 114(3): 947-954. DOI:10.1016/j.foodchem.2008.10.044.
[13] GONG Kuijie, SHI Aimin, LIU Hongzhi, et al. Emulsifying properties and structure changes of spray and freeze-dried peanut protein isolate[J]. Journal of Food Engineering, 2016, 170: 33-40. DOI:10.1016/j.jfoodeng.2015.09.011.
[14] PHONGTHAI S, LIM S T, RAWDKUEN S. Optimization of microwave-assisted extraction of rice bran protein and its hydrolysates properties[J]. Journal of Cereal Science, 2016, 70: 146-154. DOI:10.1016/j.jcs.2016.06.001.
[15] ZHANG J B, WU N N, YANG X Q, et al. Improvement of emulsifying properties of Maillard reaction products from β-conglycinin and dextran using controlled enzymatic hydrolysis[J]. Food Hydrocolloids, 2012, 28(2): 301-312. DOI:10.1016/j.foodhyd.2012.01.006.
[16] ZHANG X, QI J R, LI K K, et al. Characterization of soy β-conglycinin-dextran conjugate prepared by Maillard reaction in crowded liquid system[J]. Food Research International, 2012, 49(2): 648-654. DOI:10.1016/j.foodres.2012.09.001.
[17] 潘牧, 孙汉巨, 姜绍通, 等. 醇法菜籽浓缩蛋白的微波改性试验[J].农业机械学报, 2009, 40(6): 116-119.
[18] LAMACCHIA C, LANDRISCINA L, D’AGNELLO P. Changes in wheat kernel proteins induced by microwave treatment[J]. Food Chemistry, 2016, 197: 634-640. DOI:10.1016/j.foodchem.2015.11.016.
[19] MARTINEZ-GUERRA E, GUDE V G. Synergistic effect of simultaneous microwave and ultrasound irradiations on transesterifi cation of waste vegetable oil[J]. Fuel, 2014, 137: 100-108. DOI:10.1016/j.fuel.2014.07.087.
[20] MU L, ZHAO M, YANG B, et al. Effect of ultrasonic treatment on the graft reaction between soy protein isolate and gum acacia and on the physicochemical properties of conjugates[J]. Journal of Agricultural and Food Chemistry, 2010, 58(7): 4494-4499. DOI:10.1021/jf904109d.
[21] SAHA M, ESKICIOGLU C, MARIN J. Microwave, ultrasonic and chemo-mechanical pretreatments for enhancing methane potential of pulp mill wastewater treatment sludge[J]. Bioresource Technology, 2011, 102(17): 7815-7826. DOI:10.1016/j.biortech.2011.06.053.
[22] DAMODARAN S, PARKIN K L, FENNEMA O R, 等. 食品化学[M]. 4版. 江波, 杨瑞金, 钟芳, 等, 译. 北京: 中国轻工业出版社, 2013: 241-244.
[23] BAIER A K, KNORR D. Influence of high isostatic pressure on structural and functional characteristics of potato protein[J]. Food Research International, 2015, 77: 753-761. DOI:10.1016/ j.foodres.2015.05.053.
[24] DAS PURKAYASTHA M, GOGOI J, KALITA D, et al. Physicochemical and functional properties of rapeseed protein isolate: infi uence of antinutrient removal with acidifi ed organic solvents from rapeseed meal[J]. Journal of Agricultural & Food Chemistry, 2014, 62(31): 7903-7914. DOI:10.1021/jf5023803.
[25] HIGUERA-BARRAZA O A, DEL TORO-SANCHEZ C L, RUIZCRUZ S, et al. Effects of high-energy ultrasound on the functional properties of proteins[J]. Ultrasonics Sonochemistry, 2016, 31: 558-562. DOI:10.1016/j.ultsonch.2016.02.007.
[26] GALAZKA V B, SMITH D, LEDWARD D A, et al. Complexes of bovine serum albumin with sulphated polysaccharides: effects of pH, ionic strength and high pressure treatment[J]. Food Chemistry, 1999, 64(3): 303-310. DOI:10.1016/S0308-8146(98)00104-6.
[27] 张新, 张红城, 董捷, 等. 蜂王浆主蛋白1低聚体的分离纯化及其圆二色谱分析[J]. 食品科学, 2014, 35(17): 63-67. DOI:10.7506/ spkx1002-6630-201417013.
[28] JIAN W J, HE J, SUN Y M, et al. Comparative studies on physicochemical properties of bovine serum albumin-glucose and bovine serum albumin-mannose conjugates formed via Maillard reaction[J]. LWT-Food Science and Technology, 2016, 69: 358-364. DOI:10.1016/j.lwt.2015.11.061.
[29] NIU L Y, JIANG S T, PAN L J, et al. Characteristics and functional properties of wheat germ protein glycated with saccharides through Maillard reaction[J]. International Journal of Food Science and Technology, 2011, 46(10): 2197-2203. DOI:10.1111/j.1365-2621.2011.02737.x.
Synergistic Effect of Simultaneous Microwave and Ultrasonic Treatment on Glycosylation of Rapeseed Protein
ZHANG Yanpeng, ZHANG Manjun, QI Yutang, ZHANG Weinong*, ZHU Xianbin
(College of Food Science and Engineering, Wuhan Polytechnic University, Wuhan 430023, China)
The microwave-ultrasonic synergism (MUS) was applied in the glycosylation of rapeseed protein (RP) and the functional properties and molecular structure of RP-dextran conjugates were investigated. The results indicated that the grafting degree of RP was up to 67.1% under the following reaction conditions: microwave power 500 W, ultrasonic power 300 W, and treatment time 7 min, which was even higher than that obtained by wet heating and microwave methods. Therefore, the combined treatment could significantly increase the efficiency of glycosylation reaction. Compared with rapeseed protein and the RP-dextran conjugates prepared by other methods, the solubility, emulsifying activity, foaming capacity, and foam stability of the RP-dextran conjugates prepared by MUS were signifi cantly improved to 55.7%, 13.9 m2/ g, 50.0% and 80.0%, respectively. The results of surface hydrophobicity and circular dichroism (CD) spectroscopy indicated that combined microwave and ultrasonic treatment led to protein unfolding and increased the molecular fi exibility of RP, thereby promoting the glycosylation reaction of RP and improving the functional properties of RP-dextran conjugates.
microwave-ultrasonic synergism; glycosylation; rapeseed protein; functional property; molecular structure
10.7506/spkx1002-6630-201717019
TS201.2
A
1002-6630(2017)17-0114-06
张燕鹏, 张曼君, 齐玉堂, 等. 微波-超声波协同影响菜籽蛋白糖基化改性[J]. 食品科学, 2017, 38(17): 114-119.
DOI:10.7506/spkx1002-6630-201717019. http://www.spkx.net.cn
ZHANG Yanpeng, ZHANG Manjun, QI Yutang, et al. Synergistic effect of simultaneous microwave and ultrasonic treatment on glycosylation of rapeseed protein[J]. Food Science, 2017, 38(17): 114-119. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201717019. http://www.spkx.net.cn
2016-08-01
湖北省自然科学基金面上项目-青年基金项目(2014CFB884)
张燕鹏(1980—),男,讲师,博士,研究方向为粮食油脂与植物蛋白工程。E-mail:ayzyp@126.com *通信作者:张维农(1969—),男,教授,博士,研究方向为油料资源综合开发。E-mail:zhangweinong@163.com

