BCA-TCA法快速测定烟草蛋白质的研究
翟羽晨,王万能*,项钢燎,张潇骏,刘 钦,唐晓莲,戴 亚,马扩彦,谭兰兰
(1.重庆理工大学 药学与生物工程学院,重庆 400054; 2.重庆中烟工业有限责任公司,重庆 400060; 3.四川中烟工业有限责任公司,四川 成都 610000)
BCA-TCA法快速测定烟草蛋白质的研究
翟羽晨1,王万能1*,项钢燎1,张潇骏1,刘 钦1,唐晓莲1,戴 亚2,马扩彦2,谭兰兰3
(1.重庆理工大学 药学与生物工程学院,重庆 400054; 2.重庆中烟工业有限责任公司,重庆 400060; 3.四川中烟工业有限责任公司,四川 成都 610000)
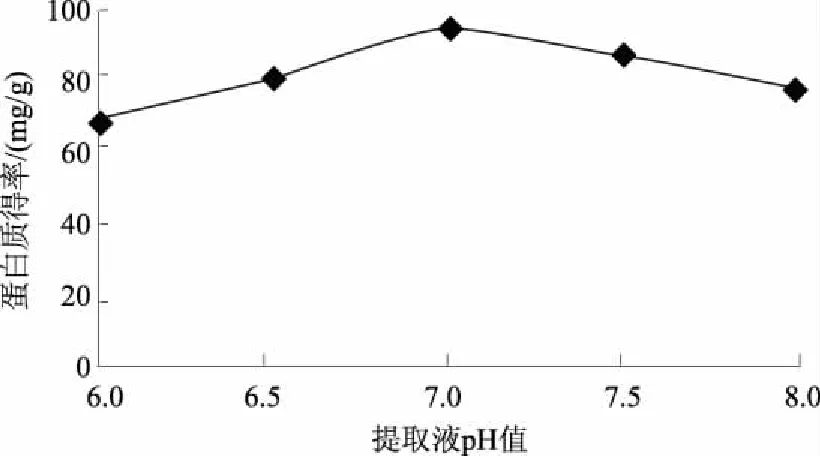
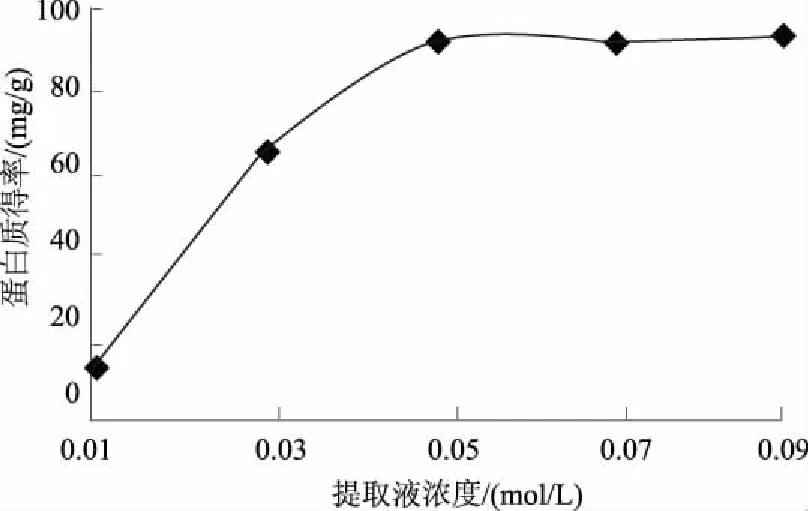
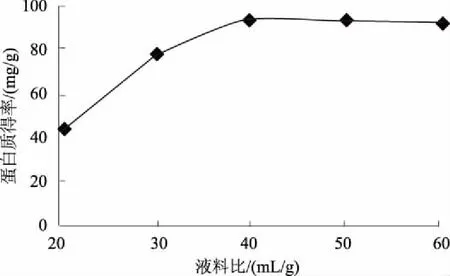
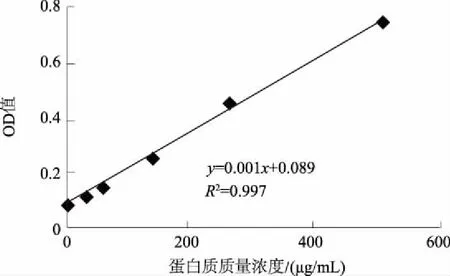
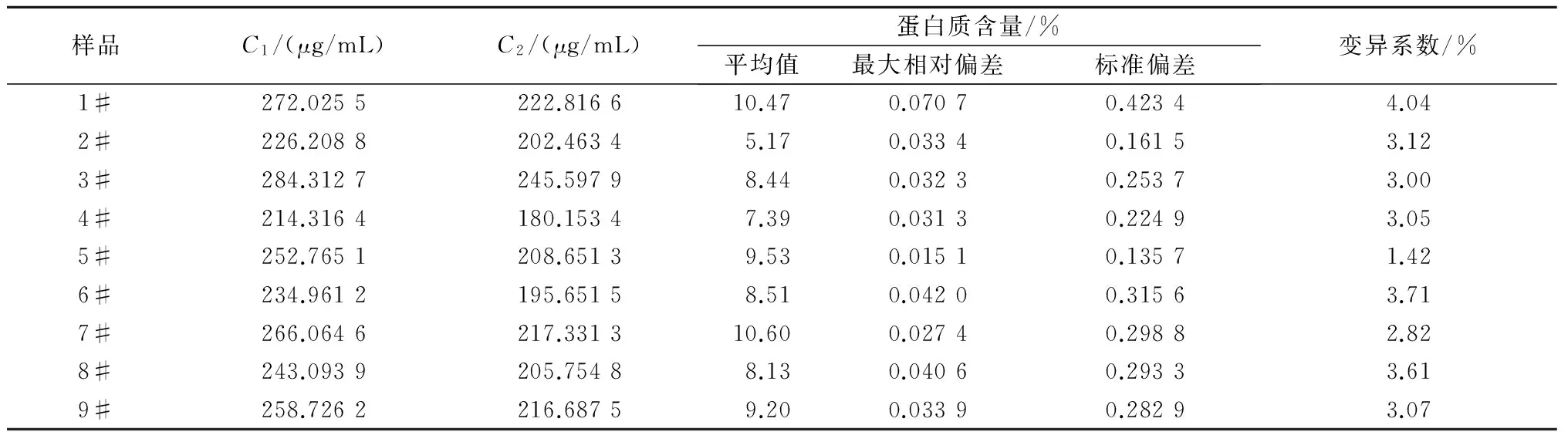
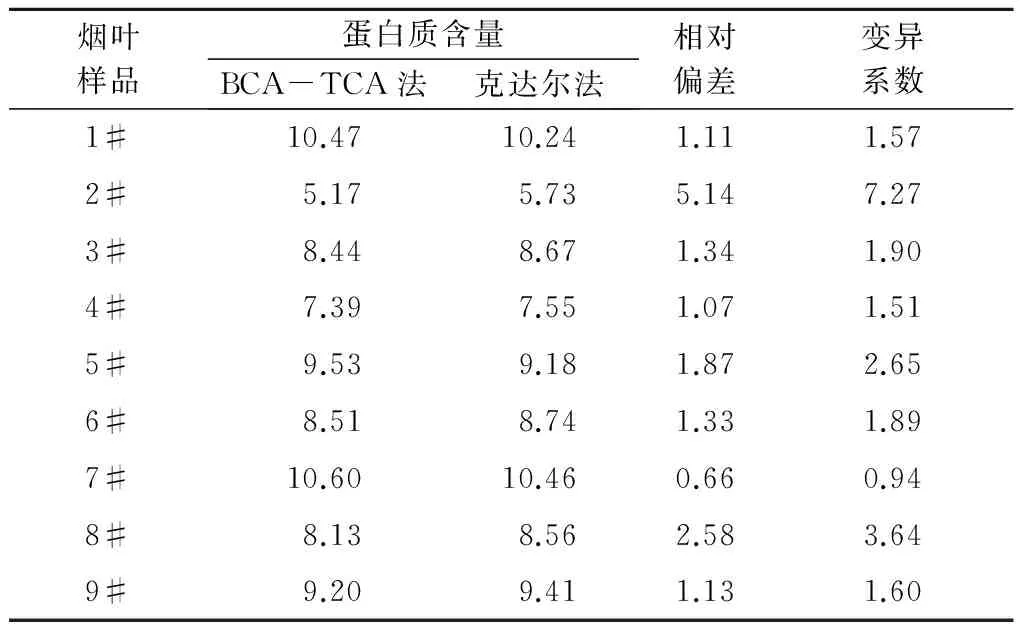
为快速准确地测定烟草中的蛋白质含量,建立并优化了BCA-TCA法,即提取烟叶蛋白质的最佳体系条件为pH值7.0的0.05 mol/L PBS缓冲液、液料比40 mL/g,使用TCA沉淀蛋白质,利用差减法去除烟叶中还原性物质对BCA方法准确性的影响,从而准确测定样品的蛋白质含量。结果表明:该方法测得的烟叶样品蛋白质含量变异系数小于5%,重复性较好;样品的加标回收率为96.39%,加标回收变异系数为0.75%<2%,准确度高;BCA-TCA法和克达尔法测定值的t检验结果为t=1.554 5 烟草; 蛋白质; BCA-TCA法; 测定 烟草是我国重要的经济作物之一,在国民经济中占有举足轻重的地位。蛋白质是烟叶的重要化合物,过多的蛋白质会增加烟叶燃烧时的苦味和烧焦羽毛味[1],因此,快速准确地测定烟草中的蛋白质含量对及时评价烟叶品质具有重要意义。蛋白质含量测定方法有凯氏定氮法、克达尔法、Lowry法、二喹啉甲酸(BCA)法等[2-4]。国际上常采用克达尔法或改良的凯氏定氮法测定烟叶蛋白质含量,虽然测定较准确,但由于操作繁琐、检测周期长,限制了其应用和推广[5-6];连续流动分析法已在国内烟草行业普遍使用[7],但其耗时达10 h以上[8],而且这些方法测得的为总氮量,受样品中非蛋白质氮的影响,无法真正准确地测得烟叶的蛋白质含量。BCA法的原理是在碱性环境下蛋白质与Cu2+作用生成的Cu+,然后与BCA结合形成稳定复合物,该复合物在562 nm处有最大吸光值,通过测定复合物的浓度而计算得到蛋白质的含量[9],该方法具有快速、操作简便、成本低、灵敏度及准确度高等优点[10-13],但BCA法测定蛋白质会受到还原性物质的干扰影响[14]。而三氯乙酸(TCA)可以使蛋白质沉淀,可用于分离蛋白质[15-16]。鉴于此,根据烟草蛋白质的特点,使用TCA沉淀蛋白质,利用差减法消除烟叶中还原性物质对BCA方法测定结果准确性的影响,旨在为更加精确地测定烟叶中的蛋白质含量提供技术依据。 1.1材料、试剂与仪器 烟叶经过烘干处理后剪碎,粉碎成粉末装于封口袋中。所用烟叶样品的具体情况见表1。 表1 烟叶样品产地和品名 主要试剂: BCA蛋白质定量试剂盒(SIGMA-ALDRICH)、磷酸氢二钠(AR)、磷酸二氢钠(AR)、牛血清蛋白质(AR)、TCA(15%三氯乙酸水溶液)、PBS(磷酸缓冲液,pH值6~8)。 主要仪器:ELX808酶标仪(美国Bio-Tek公司)、TGL-16M高速台式冷冻离心机(湘仪离心机仪器有限公司)、ALC-110.4型精密电子天平(德国赛多利斯集团公司,精度0.000 1 g)、KD-98-1型电热恒温水浴锅(南北仪器生产厂)、85-1数显恒温磁力搅拌器(金坛市精密仪器制造有限公司)、SHZ-D9型循环水式真空泵(上海坦泽仪器设备有限公司)、DW-86L386超低温保存箱(青岛海尔特种电器有限公司)、FE20梅特勒-托利多实验室pH计(梅特勒-托利多上海有限公司)、MP2002型电子天平(上海舜宇恒平科学仪器有限公司)、QL-901快速混匀器(其林贝尔仪器制造公司)。 1.2方法 1.2.1 试剂的配制 BCA工作液:将BCA试剂盒中A液(BCA碱性溶液)和B液(硫酸铜溶液)按体积比50∶1混合得BCA工作液,现用现配。蛋白质标准储备液:BCA试剂盒中提供的2 mg/mL标准蛋白质母液。 1.2.2 蛋白质标准曲线的制作 用PBS将2 mg/mL标准蛋白质母液配制成0、25、50、125、250、500 μg/mL系列标准工作溶液。酶标板每孔加入25 μL标准蛋白质工作溶液和200 μL BCA工作液,充分混匀,37 ℃水浴30 min,取出后快速冷却至室温,在波长为562 nm处用酶标仪测定标准溶液的吸光度值,制得标准蛋白质工作曲线。 1.2.3 烟叶蛋白质的提取 准确称取0.5 g烟叶样品粉末于玻璃匀浆器中,加入10 mL PBS研磨。将匀浆液在4 ℃条件下以4 000 r/min离心5 min。上清液用中速滤纸过滤,离心分离得到的残渣采用上述方法研磨、离心、过滤,重复上述操作2次。收集总过滤液用PBS定容至250 mL,得到样品液。 缓冲液浓度、pH值、液料比这3个因素对蛋白质得率均具有直接影响。分别对pH值、缓冲液浓度、液料比进行单因素试验优化,确定烟叶中蛋白质的最佳提取条件,并进行重复性和加标回收试验以验证其准确性。 1.2.4 提取样品液中蛋白质含量的检测 取1.2.3所得样品液2 mL于10 mL离心管,加入3倍体积的PBS,混匀,标为1号待测液;另取上述所得的烟叶样品液2 mL于10 mL 离心管,加3倍体积的15% TCA,混匀,于37 ℃水浴中孵育10 min,再于20~25 ℃条件下以10 000 r/min离心10 min[17],取上清液标为2号待测液。分别取25 μL上述2个待测液于96微孔板中,并在每孔中加入200 μL BCA工作液,充分混匀,37 ℃恒温水浴30 min,快速冷却至室温,用酶标仪测定吸光度值,每个待测液平行测定3次,取平均值。 根据标准蛋白质的回归曲线方程和待测液样品的吸光度值计算蛋白质含量,公式如下: 式中,X为烟叶样品蛋白质的百分含量(%);V为样品液定容后的总体积(mL);C1为1号待测液中与BCA反应的总物质的质量浓度(μg/mL);C2为2号待测液中与BCA反应的非蛋白质的质量浓度(μg/mL);m为所称烟叶样品质量(g);G为水分校正系数(物质干质量占总量的百分比);n为稀释倍数。 2.1烟叶样品中蛋白质提取条件的优化 2.1.1 提取液最优pH值的确定 分别配制pH值为6.0、6.5、7.0、7.5、8.0的0.09mol/LPBS缓冲液,以液料比为40mL/g进行蛋白质提取,按1.2方法进行提取和测定,比较蛋白质得率。由图1可见,当提取液pH值从6.0上升至8.0时,烟叶蛋白质得率呈先升高后下降的趋势,并且在提取液pH值为7.0时,烟叶蛋白质得率最高,为91.4mg/g。故选择pH值7.0为PBS提取液的最优pH值。 图1 提取液pH值对蛋白质提取的影响 2.1.2 提取液最优浓度的确定 分别配制0.01、0.03、0.05、0.07、0.09 mol/L的 pH值为7.0的PBS缓冲液,以液料比为40 mL/g按1.2方法进行蛋白质提取和测定,比较蛋白质提取效率。由图2可见,当缓冲液浓度提高到0.05 mol/L后,蛋白质得率为92.1 mg/g,之后,继续增加缓冲液浓度,蛋白质得率基本保持不变,故选择提取缓冲液浓度为0.05 mol/L。 2.1.3 最优液料比的确定 配制0.05 mol/L pH值为7.0的PBS缓冲液,以液料比20、30、40、50、60 mL/g 按1.2方法进行蛋白质提取和测定,比较蛋白质得率。由图3可以看出,提取烟叶蛋白质的研磨液料比为40 mL/g时,蛋白质得率达到最大值,为93.1 mg/g,随着液料比继续增加,蛋白质得率基本没有太大的变化。故选择液料比40 mL/g为提取蛋白质的最优液料比。 图2 提取液浓度对蛋白质提取的影响 图3 磨浆液料比对蛋白质提取的影响 2.2方法学考察 2.2.1 标准曲线的制作 通过试验测定分析,在波长为562 nm处将测得的吸光度值与对应的蛋白质质量浓度进行线性回归,回归方程为:y=0.001x+0.089[y为吸光度,x为蛋白质质量浓度(μg/mL)],R2=0.997>0.995,该曲线可作为测定烟叶蛋白质的标准曲线(图4)。该方程表明,蛋白质质量浓度在0~0.5 mg/mL,与吸光度值呈良好的线性关系。 图4 牛血清蛋白质标准曲线 2.2.2 重复性验证 采用本法测定了9个烟叶样品的蛋白质含量,重复3次,结果如表2,所有待测烟叶样品的蛋白质含量变异系数均小于5%,说明本法具有较好的重复性。 2.2.3 加标回收试验 取2 mL烟叶样品蛋白提取液于10 mL离心管中,再加入相当于样品中蛋白质含量86.96%、108.70%、130.43%的标准蛋白质溶液,按1.2中检测方法进行检测,并计算加标回收率(至少重复试验3次),加标回收数据见表3。由表3可见,样品的加标回收率平均值在95.38%~97.25%,变异系数为0.75%<2%,说明本方法具有良好的准确度。 表2 烟叶样品中蛋白质含量测定结果 表3 标准蛋白质加标回收测定结果 2.3BCA-TCA法与克达尔法的比较 为了验证BCA-TCA法测定结果的准确性,参照YC/T 166—2003,按现行的克达尔法同时测定9个待测烟叶样品中的蛋白质含量,结果见表4。由表4可以看出,2种方法所测得的蛋白质含量的相对偏差皆小于6%。对2种方法所测得的结果进行t检验,t=1.554 5 表4 BCA-TCA法与克达尔法的比较结果 % 经优化,烟叶蛋白质提取的最佳体系为pH值7.0的0.05 mol/L PBS缓冲液、液料比40 mL/g。与克达尔法相比,采用BCA-TCA法所测得的蛋白质含量数据相差不大,相对偏差皆小于6%。对 2种方法所测得的结果进行t检验,结果为t=1.554 5 本研究确定的BCA-TCA测定法,因其去除了还原糖和非蛋白质氮对BCA法测蛋白质含量的影响,能更加准确测定烟叶的蛋白质含量,所测数值更加真实、准确,将本方法进行推广将大大提高实际生产中烟叶蛋白质含量测定的准确度和效率。 [1] 金闻博,戴亚.烟草化学[M].北京:清华大学出版社,1994. [2] 王爱军,王风山,王友联,等.低浓度蛋白质含量测定方法的研究[J].中国生化药物杂志,2003,24(2):78-80. [3] Chutipongtanate S,Watcharatanyatip K,Homvises T,etal.Systematic comparisons of various spectrophotometric and colorimetric methods to measure concentrations of protein,peptide and amino acid:Detectable limits,linear dynamic ranges,interferences,practicality and unit costs[J].Talanta,2012,98:123-129. [4] 王淡兮,孙秀兰.蛋白质定量检测方法的探讨[J].粮食与食品工业,2009,16(4):49-51,62. [5] 汪家政,范明.蛋白质技术手册[M].北京:科学出版社,2000:38. [6] 宋思远,李巧玲,刘英华,等.乳及乳制品中蛋白质检测技术的研究进展[J].江苏农业科学,2012,40(5):279-282. [7] 瞿先中,程涛,蒋士盛,等.连续流动分析法测定烟草中的蛋白质[J].烟草科技,2006(1):41-42,53. [8] 李玲,杨艳萍,周红,等.克达尔法结合连续流动分析测定烟草中蛋白质[C]//云南省烟草学会.云南省烟草学会2006年学术年会论文集.昆明:[出版者不详],2006:25-28. [9] Smith P K,Krohn R I,Hermanson G T,etal.Measurement of protein using bicinchoninic acid[J].Analytical Biochemistry,1985,150(1):76-85. [10] Moore J C,Devries J W,Lipp M A,etal.Total protein methods and their potential utility to reduce the risk of food protein adulteration[J].Comprehensive Reviews in Food Science and Food Safety,2010,9(4):330-357. [11] Williams K M,Arthur S J,Burrell G,etal.An evaluation of protein assays for quantitative determination of drugs[J].Journal of Biochemical and Biophysical Methods,2003,57(1):45-55. [12] Poms R E,Capelletti C,Anklam E.Effect of roasting history and buffer composition on peanut protein extraction efficiency[J].Molecular Nutrition & Food Research,2004,48(6):459-464. [13] 冯志明,熊灿娟,武斌,等.BCA比色法测定工业循环冷却水中的微量铜[J].广东化工,2014,41(22):144-145. [14] 周志军,李策生,李陶敬,等.检测人凝血因子Ⅷ蛋白质含量的BCA法的优化及验证[J].中国生物制品学杂志,2013,26(10):1488-1492. [15] 韩富亮,袁春龙,郭安鹊,等.二喹啉甲酸法(BCA)分析蛋白质多肽的原理、影响因素和优点[J].食品与发酵工业,2014,40(11):203-207. [16] Cheung C K,Mak Y T,Swaminathan R.Automated trichloroacetic acid precipitation method for urine total protein[J].Annals of Clinical Biochemistry,1987,24(2):140-144. [17] 陈少迁,吴少雄,柳陈坚,等.TCA沉淀液态奶蛋白质的最佳实验条件研究[J].乳业科学与技术,2009(6):278-281. Rapid Determination of Tobacco Protein by BCA-TCA Method ZHAI Yuchen1,WANG Wanneng1*,XIANG Gangliao1,ZHANG Xiaojun1,LIU Qin1,TANG Xiaolian1,DAI Ya2,MA Kuoyan2,TAN Lanlan3 (1.College of Pharmaceutical and Bioengineering,Chongqing University of Technology,Chongqing 400054,China;2.China Tobacco Chongqing Industrial Co.,Ltd.,Chongqing 400060,China;3.China Tobacco Sichuan Industrial Co.,Ltd.,Chengdu 610000,China) For the rapid and accurate determination of the protein content in tobacco,an accurate and efficient BCA-TCA method was established and optimized.The optimum conditions for extracting tobacco protein were 0.05 mol/L PBS buffer at pH 7.0,and liquid-solid ratio was 40 mL/g.Differential subtraction was used to accurately determine the sample protein content,through removing the impact of interfering substances by using TCA to precipitate proteins.The results showed that the coefficient of variation of protein content was less than 5% and the reproducibility was good.The standard recovery rate of the samples were 96.39%,the coefficient of variation was 0.75%<2% and the accuracy was high.Thettest results of the BCA-TCA method and the Kedar method weret=1.554 5 tobacco; protein; BCA-TCA; determination 2017-05-31 川渝中烟工业有限责任公司科技项目(2014Q116) 翟羽晨(1994-),男,山西临汾人,本科,主要从事分析检测方面的研究。E-mail:648411151@qq.com *通讯作者:王万能(1971-),男,四川开江人,教授,博士,主要从事生物工程方面的研究。E-mail:wannengw@cqut.edu.cn TS41+1 : A : 1004-3268(2017)09-0156-051 材料和方法

2 结果与分析

3 结论与讨论

