阻塞性睡眠呼吸暂停低通气综合征患者血清脂联素水平与其认知功能的相关性
李 倩,刘运秋,兰 璇,刘晓宇
(开滦总医院呼吸科,河北 唐山 063000)
·论著·
阻塞性睡眠呼吸暂停低通气综合征患者血清脂联素水平与其认知功能的相关性
李 倩,刘运秋*,兰 璇,刘晓宇
(开滦总医院呼吸科,河北 唐山 063000)
目的探讨阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea-hypopnea syndrome,OSAHS)患者血清脂联素(adiponectin,APN)水平与其认知功能的相关性。方法选取我院就诊的OSAHS患者94例作为OSAHS组,同时从健康体检中心选取非OSAHS健康人群93例作为正常对照组。收集其人口学资料及临床检验指标,采用酶联免疫吸附测定(enzymes linked immunosorbent assay,ELISA)法检测血清APN水平。采用36导多导睡眠图监测仪进行睡眠呼吸监测。用重复性成套神经心理状态测验量表(Repeatable Battery for the Assessment of Neuropsychological Status,RBANS)和简易精神状态量表(Mini-Mental State Examinatlon,MMSE)进行认知功能评定。结果①与正常组相比,OSAHS组血清APN水平降低,RBANS认知功能量表评分包括即刻记忆、视觉广度、注意力、延迟记忆及总分均下降;②OSAHS患者血清APN与体质量指数、胰岛素抵抗指数、呼吸暂停低通气指数、氧分压<90%占监测时间的百分比呈负相关,与平均氧饱和度呈正相关;③在OSAHS患者中,与非认知功能障碍组相比,认知功能障碍组血清APN水平降低;④经Logistic回归分析发现,APN是OSAHS患者认知功能的保护性因素(OR=0.212,P=0.008);⑤APN与OSAHS患者RBANS认知功能量表评分包括即刻记忆、注意力、延迟记忆及总分呈正相关。结论OSAHS患者血清APN水平及认知功能评分均降低,且APN水平与认知功能评分呈正相关,是其认知功能的保护性因素,提示血清APN水平下降可能参与了OSAHS患者认知功能受损的发生及发展过程。
睡眠呼吸暂停,阻塞性;脂联素;认知
阻塞性睡眠呼吸暂停低通气综合征(obstructivesleepapnea-hypopneasyndrome,OSAHS)是一种常见的睡眠相关呼吸障碍性疾病,表现为睡眠中反复出现低通气或呼吸暂停等情况,引起低氧血症、高碳酸血症,导致睡眠结构紊乱,甚至造成心脑血管乃至多器官损害,严重影响患者的生活质量。近年来研究发现,OSAHS可以导致患者脑结构和功能出现缺陷,表现为认知能力明显降低,目前其发病机制还不是很明确,可能与低氧血症、氧化应激等机制有关[1]。脂联素(adiponectin,APN)是脂肪细胞分泌的一种蛋白质,它除了能够增加胰岛素的敏感性并参与糖脂代谢过程以外,还与认知功能具有一定的联系[2]。目前研究表明OSAHS患者常常合并血清APN水平下降[3]。本研究探讨OSAHS患者血清APN水平与其认知功能的相关性,旨在为其认知功能障碍的预防和治疗提供重要线索。
1 资料与方法
1.1 一般资料 选取2016年2月—2017年1月于我院呼吸科就诊的OSAHS患者94例作为OSAHS组,其中男性56例,女性38例,年龄20~79岁,平均(52.24±13.57)岁。将OSAHS组根据简易精神状态量表(Mini-MentalStateExaminatlon,MMSE)评定结果分为认知功能障碍(cognitiveimpairment,CI)组39例和非认知功能障碍(non-cognitiveimpairment,NCI)组55例。同时从医院健康体检中心选取非OSAHS健康人群93例作为正常对照组,其中男性49例,女性44例,年龄20~79岁,平均(52.63±14.12)岁。2组性别、年龄、受教育年限差异均无统计学意义(P>0.05),具有可比性。
1.2 入选标准和排除标准OSAHS的诊断符合2011年《阻塞性睡眠呼吸暂停低通气综合征诊治指南》标准。排除标准:①存在慢性阻塞性肺病、间质性肺病等慢性缺氧性疾病;②患有糖尿病、甲状腺等内分泌相关疾病;③合并严重心(心功能>2级)、肝(肝酶≥2倍的正常上限值)、肾功能不全(eGFR≤60mL·min-1·1.73m-2)及感染、肿瘤等疾病;④严重高血压(3级及以上)、脑卒中、神经精神异常及其他中枢神经系统疾病;⑤正在服用镇静安眠等影响睡眠和精神状态的药物,以及酗酒者;⑥有失语、构音障碍、耳聋及严重视力障碍者;⑦年龄≥80岁。
1.3 研究方法
1.3.1 临床资料收集 记录患者的人口学资料,包括年龄、性别、教育情况、体质量指数(bodymassindex,BMI)、收缩压(systolicbloodpressure,SBP)、舒张压(diastolicbloodpressure,DBP)。收集其临床检验结果,包括空腹血糖(fastingplasmaglucose,FPG)、空腹胰岛素(fastinsulin,FINS)、总胆固醇(totalcholesterol,TC)、三酰甘油(triglyceride,TG)、高密度脂蛋白胆固醇(highdensitylipoproteincholesterol,HDL-C)、低密度脂蛋白胆固醇(lowdensitylipoproteincholesterol,LDL-C),并计算胰岛素抵抗指数(homeostasismodelassessmentforinsulinresistance,HOMA-IR)。
1.3.2 血清APN检测 患者于晨起6~7时抽取空腹静脉血3mL,室温放置30min后3 000r/s离心15min,收集上清液放入-80 ℃冰箱中待用。采用酶联免疫吸附测定(enzyme-linkedimmunosorbentassay,ELISA)法检测血清APN水平。试剂盒购于联科生物技术有限公司(MultiSciencesBiotechCo.,Ltd),批内、批间变异系数小于10%。
1.3.3 夜间多导睡眠图监测 受试者置身于安静、舒适的多导睡眠图监测室内,应用美国Polysmith公司生产的36导多导睡眠图监测仪对其进行睡眠呼吸监测;受试者在监测前48h内禁止服用镇静安眠药物,禁止喝咖啡、茶及酒等兴奋性饮品;监测当天向患者告知监测的目的意义及方法,以消除可能出现的紧张、焦虑等心理状况;于当晚22时开始监测,监测时间>7h,记录受试者呼吸暂停低通气指数(apneahypoventilationindex,AHI)、夜间最低血氧饱和度(lowestoxygensaturation,SaO2min)、平均氧饱和度(meanoxygensaturation,SaO2mean)、SaO2<90%占监测时间的百分比(%night-timespentwithoxygensaturation<90%,TSat90)。
1.3.4 认知功能评定 ①认知功能评定重复性成套神经心理状态测验量表(RepeatableBatteryfortheAssessmentofNeuropsyehologicalStatus,RBANS)[4]具有良好的信度和效度[5],是评价认知功能的敏感工具。其包括5个分测验,每个分测验下设2个子测验:即时记忆(包括词汇学习和故事复述)、视觉广度(包括图形临摹和线条定位)、言语功能(包括图画命名和语义流畅)、注意力(包括数字广度和编码任务)和延迟记忆(包括词汇、故事、图形回忆和词汇再识)。将以上5个分测验得分相加,经查表以后获得一个校正年龄影响的总分。②采用MMSE对患者进行认知功能评定,以进一步区分是否存在认知功能障碍。该量表包括以下5个方面:定向力、记忆力、注意力及计算力、回忆能力、语言能力。共30项题目,每项回答正确得1分,回答错误或答不知道评0分,量表总分范围为0~30分。评判标准:文盲≤17分,小学学历≤20分,中学及以上学历≤24分(大于以上分值为正常)。
1.4 统计学方法 应用SPSS22.0统计软件分析数据。计量资料比较采用独立样本的t检验;计数资料比较采用χ2检验;单因素相关性采用Pearson或Spearman相关分析;多因素相关性采用多元逐步回归分析或偏相关分析;危险因素筛查采用非条件Logistic回归分析。P<0.05为差异有统计学意义。
2 结 果
2.1OSAHS组与正常组一般资料比较 与正常组相比,OSAHS组BMI、HOMA-IR、AHI、TSat90水平升高,而APN、SaO2min、SaO2mean水平降低,差异均有统计学意义(P<0.05);2组年龄、教育年限、性别、SBP、DBP、TC、TG、LDL-C、HDL-C水平差异均无统计学意义(P>0.05)。见表1。


组别例数年龄(岁)教育(年)性别(例数)男性女性BMISBP(mmHg)DBP(mmHg)TC(mmol/L)TG(mmol/L)OSAHS9452.24±13.5710.58±3.17563826.31±3.18120.75±17.9380.16±9.734.83±1.121.98±0.74正常组9352.63±14.1210.93±2.52494422.25±2.93120.34±15.7579.52±10.104.79±1.011.65±0.58t/χ20.3520.6030.9001.4310.5120.6740.4211.039P0.6180.5160.3430.0150.6330.5090.5370.257组别例数HDL-C(mmol/L)LDL-C(mmol/L)HOMA-IRAPN(mg/L)AHI(次/h)SaO2min(%)SaO2mean(%)TSat90(%)OSAHS940.98±0.362.95±0.783.15±0.932.32±0.6419.65±4.7170.53±5.4287.26±6.3314.12±3.27正常组931.11±0.192.84±0.751.93±0.463.26±0.583.42±0.9389.31±4.9797.42±7.931.64±0.51t0.9180.7935.1842.9517.5394.5284.7369.382P0.3220.3670.0000.0040.0000.0000.0000.000
2.2 OSAHS组与正常组RBANS评分比较 与正常组相比,OSAHS组即刻记忆、视觉广度、注意力、延迟记忆及总分下降,差异均有统计学意义(P<0.05);2组言语功能评分,差异无统计学意义(P>0.05)。见表2。
2.3 APN与一般资料相关性 对OSAHS组进行单因素相关分析发现,APN与BMI、HOMA-IR、AHI、TSat90呈负相关,与SaO2min、SaO2mean呈正相关。以APN为因变量,年龄、教育、性别、BMI、SBP、DBP、TC、TG、LDL-C、HDL-C、HOMA-IR、AHI、SaO2min、SaO2mean、TSat90为自变量进行多元逐步回归分析发现,APN仍与BMI、HOMA-IR、AHI、TSat90呈负相关,与SaO2mean呈正相关。见表3,4。

表2 OSAHS组与正常组RBANS评分比较Table 2 Comparison of RBANS scores in OSAHS group and control group 分)
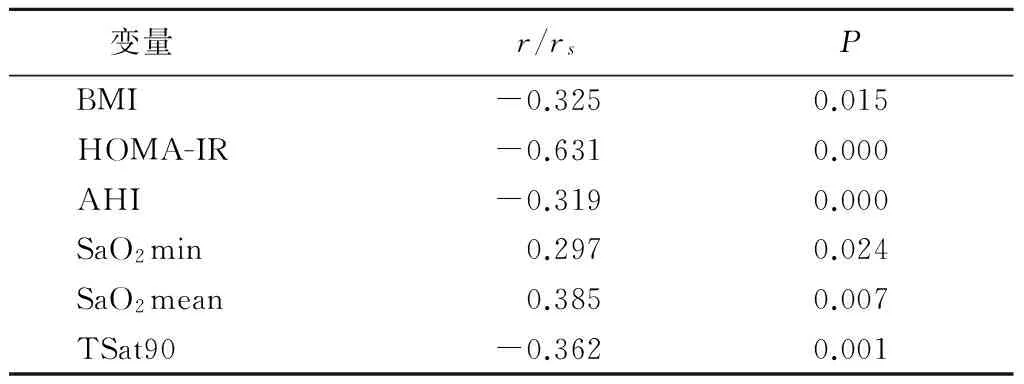
表3 APN与一般资料的相关性Table 3 Correlation of APN with general informations in patients with OSAHS

表4 APN与一般资料的多元逐步回归分析Table 4 Multiple stepwise regression analysis for APN and general informations in patients with OSAHS
2.4 OSAHS患者CI组与NCI组一般资料比较 与NCI组相比,CI组年龄较大、受教育水平较低,HOMA-IR、AHI、TSat90水平较高,APN、SaO2mean水平较低,差异均有统计学意义(P<0.05);2组BMI、SBP、DBP、TC、TG、LDL-C、HDL-C、SaO2min水平差异均无统计学意义(P>0.05)。见表5。
2.5 OSAHS患者认知功能障碍危险因素筛查 经Logistic回归分析校正年龄、性别、教育、BMI、SBP、DBP、TC、TG、HDL-C、LDL-C、HOMA-IR、APN、AHI、SaO2min、SaO2mean、TSat90的影响后发现,年龄、HOMIA-IR、APN、AHI、SaO2mean、TSat90是OSAHS患者认知功能障碍的危险因素,其中年龄、HOMIA-IR、AHI、TSat90是破坏性因素,而APN、SaO2mean是保护性因素,见表6,7。
2.6 APN与OSAHS患者RBANS评分的相关性 对OSAHS患者进行单因素相关分析发现,APN与即刻记忆、注意力、延迟记忆及总分呈正相关;偏相关分析在校正年龄、性别、教育、BMI、SBP、DBP、TC、TG、HDL-C、LDL-C、HOMA-IR、AHI、SaO2min、SaO2mean、TSat90的影响后发现,APN仍与即刻记忆、注意力、延迟记忆及总分呈正相关。见表8。


组别例数年龄(岁)教育(年)性别(例数)男性女性BMISBP(mmHg)DBP(mmHg)TC(mmol/L)TG(mmol/L)CI组 3957.34±11.399.02±3.43261326.55±2.83120.77±16.9280.53±8.934.84±1.372.01±0.54NCI组5550.53±13.5211.23±3.01302525.93±3.02120.68±16.4280.01±9.144.82±1.651.89±0.79t/χ22.4732.2951.3920.7940.4820.5160.3511.874P0.0140.0230.2380.4310.6440.5970.7170.062组别例数HDL-C(mmol/LLDL-C(mmol/L)HOMA-IRAPN(mg/L)AHI(次/h)SaO2min(%)SaO2mean(%)TSat90(%)CI组 390.97±0.283.02±0.694.13±1.361.69±0.5123.48±4.9170.02±5.3184.56±7.8318.25±3.04NCI组550.10±0.162.98±0.872.52±0.992.87±0.8215.52±5.3371.54±4.6290.11±8.1710.47±2.98t1.0630.6292.6283.1794.6180.5982.4375.115P0.3850.5520.0100.0020.0000.4590.0180.000

表6 变量赋值表Table 6 Variable assignment table

表7 OSAHS患者认知功能障碍危险因素Logistic回归分析Table 7 Logistic regression analysis of risk factors for cognitive deficits in patients with OSAHS

表8 APN与OSAHS患者RBANS评分相关性Table 8 Correlation of serum APN with RBANS scale scores in patients with OSAHS
3 讨 论
OSAHS作为一种慢性缺氧性疾病,可以导致多种并发症的发生,如血脂紊乱、2型糖尿病、高血压、冠心病、心力衰竭、脑卒中、肺动脉高压以及神经认知功能缺陷等[6]。其中,与认知功能的相关性越来越被人们所关注。国外一项为期5年的随访研究显示,与对照组相比,OASHS患者发生痴呆的风险增加1.7倍;在50~59岁中年男性患者中,发生痴呆的风险增加6倍;在70岁以上老年女性患者中,其风险增加3.2倍[7]。OSAHS导致的认知功能障碍表现为记忆力、注意力、执行力、处理问题能力、计划能力、定向能力、精神活动可塑性降低[8]。本研究结果也显示,OSAHS患者认知功能评分包括即刻记忆、视觉广度、注意力、延迟记忆及总分均降低。与上述结果基本一致。伴随OSAHS出现的认知功能障碍,严重影响患者的日常工作及生活质量,因此探索其可能的发病机制、寻找有效的预防和治疗方法十分重要。
APN是脂肪细胞分泌的一种细胞因子,主要由白色脂肪组织合成,它主要参与调节糖脂代谢和胰岛素敏感性,具有抗炎、抗动脉粥样硬化及心血管保护等作用[9]。研究表明OSAHS可以导致患者血清脂联素水平下降[3,10]。本研究结果也显示,OSAHS患者血清APN水平明显降低,并且与AHI、TSat90、SaO2mean等缺氧低通气指标相关。OSAHS患者血清APN水平下降可能与以下原因有关:①OSAHS引起的夜间低氧血症及觉醒次数增多可以导致机体的交感神经系统活跃,血清儿茶酚胺的水平升高,而异丙肾上腺素可以抑制APN基因的表达;②OSAHS可以导致机体氧化应激水平升高,TNF-α、IL-6的表达明显增加[11-12],而IL-6、TNF-α可以抑制APN的合成和分泌;③OSAHS常可以导致肥胖,而伴随肥胖出现的脂肪细胞炎症反应增加可以抑制APN基因的表达[13]。
目前许多研究已经发现APN与糖尿病、阿尔茨海默病、帕金森病等导致的认知功能下降相关,但与OSAHS认知功能障碍之间关系的深入研究甚少。本研究结果显示,OSASH患者血清APN水平及认知功能明显下降,并且两者之间呈正相关;危险因素分析也发现APN是OSAHS患者认知功能的保护性因子。因此,笔者认为血清APN下降可能参与OASHA患者认知功能障碍的发生及发展过程,通过查阅文献发现其机制可能主要为以下2个方面。①脑内胰岛素信号通路对于认知功能的维持具有重要的作用,研究表明胰岛素抵抗与认知功能障碍密切相关[14]。OSHAS患者常合并胰岛素抵抗[15],本研究也得出了相同的结果,因此这可能是其出现认知功能障碍的原因之一。目前APN在外周组织中改善胰岛素敏感性的作用已经明确,而在中枢神经系统中,有基础研究发现,APN可以通过改善脑内AMPK和PI3K/Akt胰岛素信号传导途径,抑制小鼠海马β淀粉样蛋白、tau蛋白的表达和沉积,起到保护神经元和提高认知的作用[16]。②氧化应激导致的各种炎症因子增加参与了脑损伤及认知功能障碍的形成[17]。研究表明OSAHS患者机体氧化应激水平升高,多种炎症因子表达水平增加,与其神经认知功能下降相关[18]。而APN作为一种细胞因子,具有抗炎、抗氧化应激的作用[19]。有研究发现APN可以抑制红藻氨酸诱导的氧化应激对小鼠海马神经元的损伤[20]。通过以上研究结果,笔者推测APN与OSAHS认知功能之间可能是通过胰岛素抵抗与氧化应激联系起来的。
综上所述,OSAHS患者伴有血清APN水平及认知功能下降,并且APN水平下降与其认知功能受损相关。由于本研究属于回顾性分析,样本量较小,加之参与OSAHS认知功能损伤的因素较多,因此对于血清APN下降与认知功能受损是否存在因果关系还需要大样本前瞻性临床试验来进一步证实。
[1] Devita M,Montemurro S,Ramponi S,et al. Obstructive sleep apnea and its controversial effects on cognition[J]. J Clin Exp Neuropsychol,2016:1-12.
[2] Wennberg AM,Gustafson D,Hagen CE,et al. Serum Adiponectin Levels,Neuroimaging,and Cognition in the Mayo Clinic Study of Aging[J]. J Alzheimers Dis,2016,53(2):573-581.
[3] 梁丽,马佳韵.脂联素、胰岛素抵抗与阻塞性睡眠呼吸暂停低通气综合征[J].国际呼吸杂志,2011,31(17):1348-1350.
[4] Randolph C,Tierney MC,Mohr E,et al. The Repeatable Battery for the Assessment of Neuropsychological Status (RBANS):preliminary clinical validity[J]. J Clin Exp Neuropsychol,1998,20(3):310-319.
[5] 张保华,谭云龙,张五芳,等.重复性成套神经心理状态测验的信度、效度分析[J].中国心理卫生杂志,2008,22(12):865-869.
[6] Werli KS,Otuyama LJ,Bertolucci PH,et al. Neurocognitive function in patients with residual excessive sleepiness from obstructive sleep apnea:a prospective,controlled study[J]. Sleep Med,2016,26:6-11.
[7] Osorio RS,Gumb T,Pirraglia E,et al. Sleep-disordered breathing advances cognitive decline in the elderly[J]. Neurology,2015,84(19):1964-1971.
[8] Décary A,Rouleau I,Montplaisir J. Cognitive deficits associated with sleep apnea syndrome:a proposed neuropsychological test battery[J]. Sleep,2000,23(3):369-381.
[9] Freitas Lima LC,Braga VA,do Socorro de França Silva M,et al. Adipokines,diabetes and atherosclerosis:an inflammatory association[J]. Front Physiol,2015,6(51):1-15.
[10] Hobzová M,Salzman R,Stejskal D,et al. Serum adiponectin level in obstructive sleep apnea:Relation of adiponectin to obesity and long-term continuous positive airway pressure therapy[J]. Adv Med Sci,2015,61(1):130-134.
[11] Jiang H,Cao H,Wang P,et al. Tumour necrosis factor-α/interleukin-10 ratio in patients with obstructive sleep apnoea hypopnoea syndrome[J]. J Laryngol Otol,2014,129(1):73-78.
[12] Kurt OK,Tosun M,Talay F. Serum cardiotrophin-1 and IL-6 levels in patients with obstructive sleep apnea syndrome[J]. Inflammation,2013,36(6):1344-1347.
[13] Nigro E,Scudiero O,Monaco ML,et al. New insight into adiponectin role in obesity and obesity-related diseases[J]. Biomed Res Int,2014,2014:658913.
[14] Bloemer J,Bhattacharya S,Amin R,et al. Impaired insulin signaling and mechanisms of memory loss[J]. Prog Mol Biol Transl Sci,2014,121:413-449.
[15] Iftikhar IH. Incretins and Insulin Resistance in Obstructive Sleep Apnea. Chicken or the Egg?[J]. Ann Am Thorac Soc,2016,13(8):1221-1222.
[16] Ng RC,Cheng OY,Jian M,et al. Chronic adiponectin deficiency leads to Alzheimer's disease-like cognitive impairments and pathologies through AMPK inactivation and cerebral insulin resistance in aged mice[J]. Mol Neurodegener,2016,11(1):71.
[18] He Y,Chen R,Wang J,et al. Neurocognitive impairment is correlated with oxidative stress in patients with moderate-to-severe obstructive sleep apnea hypopnea syndrome[J]. Respir Med,2016,120:25-30.
[19] Esfahani M,Movahedian A,Baranchi M,et al. Adiponectin:an adipokine with protective features against metabolic syndrome[J]. Iran J Basic Med Sci ,2015,18(5):430-442.
[20] Qiu G,Wan R,Hu J,et al. Adiponectin protects rat hippocampal neurons against excitotoxicity[J]. AGE,2011,33(2):155-165.
(本文编辑:刘斯静)
Association of serum adiponectin levels with cognitive function in patients with obstructive sleep apnea-hypopnea syndrome
Li Qian, Liu Yun-qiu*, Lan Xuan, Liu Xiao-yu
(DepartmentofRespiratoryMedicine,KailuanGeneralHospital,HebeiProvince,Tangshan063000,China)
ObjectiveToinvestigatetheassociationofserumadiponectin(APN)levelswithcognitivefunctioninpatientswithobstructivesleepapnea-hypopneasyndrome(OSAHS).MethodsAtotalof94patientswithOSAHScaredatourhospitaland93healthycontrolswithoutOSAHSfromthemedicalexaminationcenterwererecruited.Dataondemographiccharacteristicsandclinicalparameterswerecollected.APNwasmeasuredbyenzymeslinkedimmunosorbentassay(ELISA).CognitiveperformancewasassessedbytheRepeatableBatteryfortheAssessmentofNeuropsychologicalStatus(RBANS)andMini-MentalStateExaminatlon(MMSE).Results①Comparedwithcontrols,SerumAPNlevelsandRBANSscoresincludingimmediatememory,visuospatial/constructional,attention,delayedmemoryandtotalscoreswerealllowerinpatientswithOSAHS. ②APNwasnegativelycorrelatedwithbodymassindex,Homeostasismodelassessmentforinsulinresistance,apneahypoventilationindexand%night-timespentwithoxygensaturation<90%,butpostivelycorrelatedwithmeanoxygensaturation. ③InpatientswithOSAHS,cognitiveimpairmentgrouphadlowerlevelsofAPNthannon-cognitiveimpairmentgroup. ④LogisticregressionanalysisshowedthatAPNwasaprotectivefactorofcognitivefunctioninpatientswithOSAHS(OR=0.212,P=0.008); ⑤APNwaspostivelycorrelatedwithRBANSscoresincludingimmediatememory,attention,delayedmemoryandtotalscoresinpatientswithOSAHS.ConclusionPatientswithOSAHShavelowerserumAPNlevelsandworsecognitiveperformance,andserumAPNwaspostivelycorrelatedwiththeircognitiveperformance,suggestingthatserumAPNmaybeinvolvedincognitivedeficitsofpatientswithOSAHS.
sleepapnea,obstructive;adiponectin;cognition
2017-03-09;
2017-03-22
李倩(1982-),女,山东淄博人,开滦总医院主治医
R563.8
A
1007-3205(2017)09-1001-06
10.3969/j.issn.1007-3205.2017.09.003
师,医学硕士,从事呼吸系统疾病诊治研究。
*通讯作者

