miR-205通过靶向调控caspase-3表达调节神经胶质瘤的生物学行为
王 潇
(四川友谊医院肿瘤科,四川 成都 610000)
·论著·
miR-205通过靶向调控caspase-3表达调节神经胶质瘤的生物学行为
王 潇
(四川友谊医院肿瘤科,四川 成都 610000)
目的探讨微小RNA-205、天冬氨酸特异性半胱氨酸蛋白酶3(cyserinly aspartate-specific protease,caspase-3)表达水平对神经胶质瘤生物学行为的影响及其可能的作用机制。方法采用实时荧光定量PCR检测30例神经胶质瘤组织及正常脑组织中miR-205表达水平;采用脂质体转染技术分别将miR-205 模拟物(miR-205 mimics)、对照(control mimics)、miR-205抑制物(miR-205-inhibitor)导入至U251细胞中,以Transwell实验观察细胞侵袭能力;采用生物信息学及荧光蛋白报告基因实验验证miR-205对caspase-3的靶向调控作用;采用RNA干扰技术研究U251细胞中caspase-3蛋白表达水平及细胞克隆数量变化。结果神经胶质瘤组织miR-205表达值低于正常脑组织(P<0.05),30神经胶质瘤组织中28例miR-205下调2倍以上。将miR-205模拟物或miR-205抑制剂转染入U251细胞中发现,在miR-205的表达水平上,miR-205模拟物显著高于对照,miR-205抑制物低于对照,差异有统计学意义(P<0.05)。miR-205模拟物转染U251细胞后caspase-3蛋白表达高于对照转染后细胞(P<0.05)。miR-205模拟物+pcDNA3-Wt共转染组荧光值显著高于对照及miR-205模拟物+pcDNA3-Mut(P<0.05)。转染miR-205模拟物组,其细胞克隆形成明显少于对照组及空白组,而转染miR-205 inhibitor后,其细胞克隆形成则多于空白组(P<0.05)。结论多数神经胶质瘤存在miR-205表达下调现象,而miR-205可能通过靶向调控caspase-3影响胶质瘤细胞的侵袭、增殖、克隆形成能力,这将为进一步认识及治疗神经胶质瘤提供有力依据。
神经胶质瘤;微RNAs;半胱氨酸天冬氨酸蛋白酶3
神经胶质瘤是颅内最常见的一种脑肿瘤,在我国发病率占颅内肿瘤的40%~50%[1]。由于神经胶质瘤浸润性生长的特点,手术无法完全切除,而放化疗又易对神经系统产生毒性,该病一直处于高复发率、高病死率及低治愈率的局面[2]。因此,从分子机制角度对疾病进行干预或许可为目前的治疗困境提供新的思路。微小RNA(microRNA,miRNA)在肿瘤发生及发展中占有重要调控作用,如miR-205在肺癌[3]、乳腺癌[4]、肾癌[5]等恶性肿瘤中呈现低表达,且对癌症的增殖、侵袭、凋亡具有调控作用。但目前miR-205在神经胶质瘤中的研究涉及较少。因此,本研究将从组织及细胞水平对miR-205在神经胶质瘤中的作用及相关机制进行初步探讨,以期为神经胶质瘤治疗提供新的药物靶点。报告如下。
1 资料与方法
1.1 细胞及主要试剂U251神经胶质瘤细胞系购自中国科学院上海细胞库;30例神经胶质瘤[男性18例,女性12例,年龄13~72岁,平均(44.6±14.6)岁;肿瘤部位:额叶12例,颞叶10例,顶叶8例;根据神经系统肿瘤分类:Ⅰ~Ⅱ级11例,Ⅲ~Ⅳ19例]及其配对组织miRNAs的cDNA文库、pcDNA3/绿色荧光蛋白(enhancedgreenfluorescentprotein,EGFP)来自本实验室;DMEM基础培养基及胎牛血清购自Gibco;miRNAPCR试剂盒、U6及miR-205特异性引物、miR-205模拟物、miR-205-抑制物、对照QIAGEN、Trizol、逆转录试剂盒、Lipofectamine2000均购自Invitrogen;实时荧光定量PCR试剂盒购自大连Takara公司;PCR引物及DNA片段由大连Takara公司合成;Transwell板购自BD;caspase-3siRNA及control、鼠抗人caspase-3一抗及β-actin一抗购自Abcam公司;羊抗鼠二抗购自北京中杉金桥。
1.2 方法
1.2.1 细胞培养 购买的U251是神经胶质瘤细胞,属于传代细胞系,可稳定传代并用于实验研究。将含有U251细胞的冻存管从液氮中拿出,并迅速放入37℃水浴锅中摇晃至完全溶解,随后按1∶9体积比加入无血清培养基DMEM,以500r/min离心8min,去上清,加入1mL完全培养基(DEME+10%血清)重悬,将细胞悬液转移入T25细胞培养瓶中,补加5mL完全培养基,摇匀,放入37 ℃ 5%CO2培养箱中培养,待细胞融合至80%~90%时传代。细胞传代2~3次后,用于后续实验。
1.2.2 细胞转染 取上述培养的U251细胞,按5×103cell/孔接种至6孔板中,待细胞长满至60%~70%时,将完全培养基替换成无血清DMEM培养基,并根据Lipofectamine2000试剂使用说明书,将miR-2015及对照品、caspase-3siRNA及对照品转染入U251细胞中,转染5~8h时,将无血清培养基替换成完全培养基,继续培养2d。收集细胞,提取RNA、蛋白进行相关分子实验以及Transwell细胞迁移实验和软琼脂实验。
1.2.3RT-PCR取Trizol抽提的总RNA1μL,按FermentasRevertAid逆转录说明书将RNA逆转录为cDNA。以RT-PCR验证miR-205的表达情况,其步骤按照SYBRPrimeSCrpitmiRNART-PCR说明书添加试剂。Caspase-3引物序列:上游5′-GGCATGGAGAACACTGAAAAC-3′;下游5′-GCGAATCTGTTTCTTTGCATG-3′。其反应条件为:95 ℃ 5min,95 ℃ 10s,62 ℃ 20s,35个循环。U6为内参引物序列:上游5′-CTCGCTTCGG-CAGCACA-3′;下游5′-AACGCTTCACGAATTT-GCGT-3′。
1.2.4 载体构建 依据生物信息学预测结果,将合成的含有BamHⅠ和EcoRⅠ酶切位点以及miR-205结合位点的caspase-3正反链DNA片段和缺失结合miR-205位点的正反链DNA片段,重组至荧光报道载体pcDNA3/EGFP中,从而获得野生型报告载体(pcDNA3-Wt)及突变型报告载体(pcDNA3-Mut)。野生型正反链序列为:上游5′-CTAGCTAGCACGGGCCGCATTTAAAGTAAAG-3′;下游5′-CCGCTCGAGGAAGCACGCACCGAGA-CG-3′。PCR扩增程序为:95 ℃ 5min,95 ℃ 30s,67 ℃ 30s,35 个循环。突变型引物序列:上游5′-CTAGCTAGCACGGGCCGCATTTAAAGTAA-3′;下游5′-CTAGTCTAGATATATGGTCCAT-GATATT-3′。PCR扩增程序为:95 ℃ 5min,95 ℃ 30s,66 ℃ 30s,35个循环。
1.2.5 靶基因检测 将合成的miR-205模拟物、对照模拟物分别与构建的荧光报告载体或空载体(pcDNA3/EGFP)共转染U251细胞,转染48h,用RAPI裂解细胞对蛋白进行定量分析。在507nm下测定样品中EGFP的荧光值。
1.2.6Westernblot实验 设置miR-205单转染组、miR-205+野生型报告载体(pcDNA3-Wt)组及miR-205+突变型报告载体(pcDNA3-Mut)组。将其转染U251细胞后24h,收集细胞,用RAPI低温裂解细胞30min,吸取裂解液,以4 ℃ 12 000r/min离心20min,取上清,测定总蛋白浓度,并以每孔30μg进行SDS-PAGE电泳,湿转至PVDF膜上,以5%脱脂奶粉封闭,分别加入caspase-3一抗(1∶2 000稀释)及β-catin一抗(1∶2 500稀释),4 ℃孵育过夜,PBST洗涤3次后加入HRP标记二抗,室温孵育1h,PBST洗涤3次,ECL底物显色。
1.2.7Transwell细胞迁移实验 将Transwell小室从-20 ℃冰箱中取出室温平衡30min后,取出小室放入24孔板中,上下室分别加入500μL完全培养基,放入细胞培养箱中水化2h,随后弃去上下室培养基。往小室中加入密度为1×107/mL细胞悬液500μL后,将小室放置到含有完全培养基的24孔板中。放入细胞培养箱培养24h,吸弃上下室液体,用干净棉签擦净Transwell膜上室内细胞后,PBS洗涤3次,并用预冷的甲醇固定Transwell下室细胞,以1%结晶紫染色8~10min后,以流水清洗多余结晶紫,吸水纸吸干后放于显微镜下观察。
1.2.8 软琼脂克隆实验 设置miR-205模拟物组、miR-205inhibitor组、对照组及空白细胞组。4组均按照“1.2.2”项细胞转染步骤转染U251细胞,培养24h后,分别与0.6%低熔点琼脂糖按等比例混合,并以1×105cell/mL浓度接种至培养皿中,每组3个板,37 ℃ 5%CO2培养。记录培养2周后各组克隆形成数量。
1.3 统计学方法 应用SPSS22.0统计软件分析数据。计量资料比较分别采用t检验、单因素方差分析和SNK-q检验;计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1miR-205在神经胶质瘤中的表达水平 以正常脑组织中miR-205表达值1.00±0.03为参照,30例神经胶质瘤组织miR-205表达值为0.27±0.04,差异有统计学意义(t=9.545,P=0.000)。30例神经胶质瘤组织中28例miR-205下调2倍以上。
2.2miR-205在U251细胞中的表达 将miR-205模拟物或miR-205抑制剂转染入U251细胞中发现,在miR-205的表达水平上,miR-205模拟物组显著高于对照组和miR-205抑制物组,且miR-205抑制物组低于对照,差异有统计学意义(P<0.05),见表1。
Transwell结果显示,随着miR-205表达量上调,U251迁移能力及数量均显著下降,而当转染miR-205inhibitor时,细胞迁移能力及数量则有所增加(图1)。


组别 miR-205表达水平miR-205模拟物组6.43±0.32对照组 1.15±0.42*miR-205抑制物组0.78±0.33*# F 5.234 P 0.005
*P<0.05与miR-205模拟物组比较 #P<0.05与对照组比较(SNK-q检验)
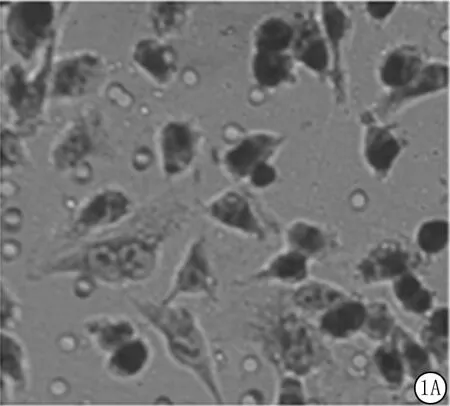

图1 细胞迁移结果A.对照组;B.miR-205模拟物;C.miR-205抑制物Figure1 Resultsofcellmigration
2.3 miR-205靶向调控caspase-3的表达 生物信息学预测结果分析显示,caspase-3 mRNA 3′-UTR的134-145区域与miR-205存在互补(图2)。Western blot验证,miR-205模拟物转染U251细胞后caspase-3蛋白表达(0.95±0.08)高于对照转染后细胞(0.36±0.07),差异有统计学意义(SNK-q=8.135,P<0.05)(图3)。荧光报告实验显示,miR-205模拟物+pcDNA3-Wt共转染组荧光值(0.94±0.04)显著高于对照(0.32±0.04)及miR-205模拟物+pcDNA3-Mut(0.55±0.03),差异有统计学意义(SNK-q=8.183、6.284,P<0.01)。证明miR-205能够特异性结合Caspase-3的3′-UTR区域,从而使荧光蛋白表达水平显著增加,而Caspase mRNA的3′-UTR结合区域突变后,则无此现象,提示caspase-3是miR-205的靶基因。

图2生物信息学预测结果
Figure2Resultsofbioinformaticsprediction

图3 Western blot结果
Figure3ResultsofWesternblot
2.4 软琼脂实验 转染miR-205 模拟物组,其细胞克隆形成明显少于对照组和空白组;而转染 miR-205 抑制物后,其细胞克隆形成则多于对照组和空白组,差异有统计学意义(P<0.05)。见图4,表2。

图4各组U251细胞克隆形成结果
A.空白;B.对照模拟物;C.miR-205模拟物;D.miR-205抑制剂
Figure4U251cellcolonyformationineachgroup


组别 克隆数空白组 134.3±16.8miR-205模拟物组18.4±4.3*#对照组 128.5±15.9miR-205抑制物组178.4±18.5*#F 7.285P 0.002
*P<0.05与空白组比较 #P<0.05与对照组比较(SNK-q检验)
2.5 caspase-3表达对U251生物学功能的影响 为进一步观察caspase-3是否参与神经胶质瘤细胞克隆的形成,采用siRNA技术成功降低caspase-3表达水平后,通过Western blot检测转染miR-205模拟物、miR-205模拟物+pcDNA3-Wt、miR-205模拟物+pcDNA3-Wt+siRNA、miR-205模拟物+pcDNA3-Mut的U251细胞,并以单转染miR-205模拟物的caspase-3表达量为标准(1.00±0.12)。caspase-3蛋白表达上调可导致细胞克隆数量明显减少。见表3。


组别caspase-3灰度值克隆数miR-205模拟物1.00±0.1215.32±6.27miR-205模拟物+pcDNA3-Wt3.24±0.34*3.67±1.25*miR-205模拟物+pcDNA3-Wt+siRNA0.48±0.13*#25.82±5.91*#miR-205模拟物+pcDNA3-Mut2.25±0.29*#△10.28±2.26*#△F804.377129.424P0.0000.000
*P<0.05与miR-205模拟物比较 #P<0.05与miR-205模拟物+pcDNA3-Wt比较 △P<0.05与miR-205模拟物+pcDNA3-Wt+siRNA比较(SNK-q检验)
3 讨 论
3.1 神经胶质瘤、microRNA研究现状 目前,我国神经胶质瘤成人发病率约为6/10万,但5年病死率高达80%,其中以高度恶性的多形胶质母细胞瘤病死率最高,其患者中位数生存期<1年[6]。然而,肿瘤的发生及发展常涉及多种机制,且关于神经胶质瘤的病因及发病机制存在多种学说,如细胞凋亡抑制、细胞过度增殖等。因此,通过调节某种特点蛋白或mRNA的表达来观察细胞增殖、凋亡等将有助于进一步了解神经胶质瘤的发病机制。
miRNA在肿瘤中的作用机制是目前研究的热点之一。其主要是一类高度保守,经转录后可发挥调控的非编码小RNA,其通过与下游靶基因mRNA3′-UTR序列配对,抑制或降解靶基因mRNA,并最终导致蛋白翻译失败。近年来,关于miRNA在神经胶质瘤中报道显著增加。如Quintavalle等[7]发现敲除miR-21后,可抑制胶质瘤细胞生长,促进其细胞凋亡及减弱侵袭力。孙利波等[8]则发现miR-10b高表达可促使胶质瘤细胞体外增殖能力增强,并使处于S期的细胞增多。Gao等[9]发现miR-34a作用与以上2种miRNA截然相反,转染miR-34a的U251细胞其细胞增殖减弱,而凋亡细胞明显增多。由此可见,不同的miRNA对于神经胶质瘤的作用存在差异[10]。本研究结果显示,miR-205表达上调可抑制神经胶质瘤细胞迁移及细胞克隆的形成。
3.2 miR-205在神经胶质瘤中的表达意义 本研究结果显示,miR-205在神经胶质瘤中的表达水平显著低于正常脑组织,而通过转染技术提高miR-205在U251细胞中的表达后发现,U251细胞侵袭能力明显下降,给予miR-205 inhibitor后,其侵袭能力恢复甚至高于空白组。提示miR-205在神经胶质瘤中起到抑癌作用。目前已经证实,miR-205可调控血管内皮生长因子A(vascular endothelial growth factor A,VEGF-A)、E2F1、Bcl-2等表达。其中VEGF-A是促肿瘤微血管生产的重要蛋白,高表达VEGF-A可激活酪氨酸激酶,促发信号传导,并诱导内皮细胞增殖及迁移,从而引起新生血管生成[11];而E2F1则可调控细胞周期,使胶质瘤细胞由G1向S期进展加快[12];Bcl-2则是细胞凋亡途径中的重要调控蛋白。
3.3 caspase-3在神经胶质瘤中的表达意义 caspase家族是一类细胞凋亡的重要执行蛋白,而caspase-3更是该家族中的核心蛋白,且一直被认为是细胞凋亡中最后的共同通道[13]。其对于肿瘤凋亡的作用也已有大量文献报道,如在胃癌、肝癌、前列腺癌等中均出现表达下调现象[14]。本研究通过软琼脂克隆实验证实,当caspase-3表达上升时,其细胞克隆数量明显下降,而采用siRNA干扰技术阻断caspase-3的表达,其细胞克隆数量明显增多。结合caspase-3在细胞凋亡中的关键作用,可能由于大部分细胞出现凋亡,从而使细胞侵袭、增殖及成瘤作用受到影响[15]。
3.4 miR-205通过靶向调控caspase-3表达调节神经胶质瘤的生物学行为 通过生物信息学预测及构建荧光蛋白报告系统证实,当miR-205与野生型caspase-3同转染后,荧光蛋白表达水平显著高于miR-205与突变型caspase-3,且干扰caspase-3的表达后细胞克隆形成数量及侵袭性趋势与下调miR-205结果相似。由此推测caspase-3是miR-205的靶向蛋白之一,并且高表达caspase-3有助于抑制神经胶质瘤细胞的侵袭及增殖。
综上所述,miR-205或可作为神经胶质瘤治疗或诊断的新指标。上调miR-205表达有利于降低神经胶质瘤细胞的侵袭及细胞增殖能力,caspase-3作为miR-205的靶向基因,下调caspase-3的表达水平也可获得上调miR-205表达的相同效果。
[1] 农大件,李国成,周围.神经胶质瘤的治疗研究进展[J].中国医药指南,2013,11(26):58-59.
[2] 王志刚,钟根深,马鹏举,等.三氧化二砷联合顺铂抑制C6胶质瘤细胞增殖的实验研究[J].中国医药生物技术,2014,9(3):167-173.
[3] Cai J,Fang L,Huang Y,et al. miR-205 targets PTEN and PHLPP2 to augment AKT signaling and drive malignant phenotypes in non-small cell lung cancer[J]. Cancer Res,2013,73(17):5402-5415.
[4] Lee JY,Park MK,Park JH,et al. Loss of the polycomb protein Mel-18 enhances the epithelial-mesenchymal transition by ZEB1 and ZEB2 expression through the downregulation of miR-205 in breast cancer[J]. Oncogene,2014,33(10):1325-1335.
[5] 聂奇伟,胡卫列,欧阳可育,等.过表达miR-205对顺铂诱导的肾上腺皮质癌细胞株SW-13凋亡的影响及其机制[J].肿瘤防治研究,2014,41(7):719-723.
[6] 赖华生,陈志浩,陈祎招.神经胶质瘤与新型抑癌基因的研究进展[J].广东医学,2015,36(7):1122-1124.
[7] Quintavalle C,Donnarumma E,Iaboni M,et al. Effect of miR-21 and miR-30b/c on TRAIL-induced apoptosis in glioma cells[J]. Oncogene,2013,32(34):4001-4008.
[8] 孙利波,刘莉,梁华新,等.微小RNA-10b对胶质瘤细胞增殖能力的影响[J].中华实验外科杂志,2014,31(7):1514-1516.
[9] Gao H,Zhao H,Xiang W. Expression level of human miR-34a correlates with glioma grade and prognosis[J]. J Neurooncol,2013,113(2):221-228.
[10] 吴彩云,张春妮.MicroRNA与神经胶质瘤关系的研究进展[J].医学研究生学报,2014,27(7):746-750.
[11] Szczyrba J,Nolte E,Hart M,et al. Identification of ZNF217,hnRNP-K,VEGF-A and IPO7 as targets for microRNAs that are downregulated in prostate carcinoma[J]. Int J Cancer,2013,132(4):775-784.
[12] Haim Y,Blüher M,Slutsky N,et al. Elevated autophagy gene expression in adipose tissue of obese humans:a potential non-cell-cycle-dependent function of E2F1[J]. Autophagy,2015,11(11):2074-2088.
[13] 刘志英,肖刚,刘铁菊.青年乳腺癌中XIAP,Smac,Caspase-3的表达及其与HER2的相关性研究[J].河北医科大学学报,2012,33(10):1214-1216.
[14] Maellaro E,Leoncini S,Moretti D,et al. Erythrocyte caspase-3 activation and oxidative imbalance in erythrocytes and in plasma of type 2 diabetic patients[J]. Acta Diabetol,2013,50(4):489-495.
[15] 陈斯泽,张威,钟德泉,等.Caspase-3及Gpc1的表达对神经胶质瘤细胞增殖的影响及其机制研究[J].中华神经医学杂志,2015,14(6):553-557.
(本文编辑:赵丽洁)
Effect of miR-205 on the biological behavior of glioma via targeting caspase-3
WANG Xiao
(DepartmentofOncology,theFriendshipHospitalofSichuanProvince,Chengdu610000,China)
ObjectiveToinvestigatetheeffectofmicroRNA-205andaspartate-specificcaspase-3expressiononthebiologicalbehaviorofgliomaanditspossiblemechanism.MethodsTheexpressionofmiR-205in30casesofgliomatissueandnormalbraintissuewasdetectedbyreal-timefluorescencequantitativePCR.ThemiR-205mimics,controlmimics,miR-205inhibitor(miR-205-inhibitor)wasintroducedintoU251cellsandtheinvasiveabilityofthecellswasobservedbyTranswellassay.TheeffectofmiR-205oncaspase-3wastestedbybioinformaticsandfluorescentproteinreporterassay.Theexpressionlevelofcaspase-3proteinandthenumberofcellclonesinU251cellswerestudiedbyRNAinterferencetechnique.ResultsTheexpressionofmiR-205ingliomatissuewaslowerthanthatinnormalbraintissue(P<0.05),and28casesofgliomatissuewere28timeslowerthanthatofmiR-205.ThemiR-205mimeticormiR-205inhibitorwastransfectedintoU251cellsandfoundthatmiR-205mimicsweresignificantlyhigherthanthoseofcontrolatmiR-205expressionlevels,andthatofmiR-205waslowerthanthatofcontrol.Thedifferencewasstatisticallysignificant(P<0.05).Theexpressionofcaspase-3proteininU251cellstransfectedwithmiR-205mimicswashigherthanthatincontroltransfectedcells(P<0.05).ThefluorescencevalueofmiR-205mimics+pcDNA3-Wtco-transfectiongroupwassignificantlyhigherthanthatofcontrolandmiR-205mimics+pcDNA3-Mut(P<0.05).ThemiR-205mimeticgroupwastransfectedintomiR-205mimeticgroup,anditscellcloneformationwassignificantlylessthanthatofthecontrolgroupandtheblankgroup.AftertransfectionofmiR-205inhibitor,thecellcloneformationwasmorethanthatintheblankgroup(P<0.05).ConclusionMostofthegliomashavemiR-205expressiondownregulation,andmiR-205mayinfluencetheinvasion,proliferationandclonalabilityofgliomacellsbytargetingcaspase-3,whichwillprovideapowerfulbasisforfurtherunderstandingandtreatmentofglioma.
glioma;microRNAs;caspase-3
2016-03-15;
2016-05-02
王潇(1978-),男,江苏南京人,四川友谊医院主
R730.264
A
1007-3205(2017)09-1024-06
10.3969/j.issn.1007-3205.2017.09.008
治医师,医学学士,从事肿瘤的化疗与分子靶向治疗研究。

