离子液体中酶法酯化选择性富集单甘酯的研究
吕松泰, 邹孝强, 钱海峰, 金青哲, 王兴国
(江南大学食品学院,食品科学与技术国家重点实验室,江苏省食品安全与质量协同创新中心,江苏 无锡 214122)
油脂化工
离子液体中酶法酯化选择性富集单甘酯的研究
吕松泰, 邹孝强, 钱海峰, 金青哲, 王兴国
(江南大学食品学院,食品科学与技术国家重点实验室,江苏省食品安全与质量协同创新中心,江苏 无锡 214122)

离子液体;单甘酯;选择性富集;脂肪酶;溶剂性质;极性
酶催化合成单甘酯(MAG)分为甘三酯(TAG)的水解[1-2]、醇解[3]、甘油解[4]和脂肪酸与甘油的酯化法[5]。目前报道较多的是采用食用油的甘油解来制备MAG。甘油解虽然有较高的得率,但是难以得到高纯度的单一脂肪酸甘油酯,这种产品只有通过脂肪酸与甘油酯化得到。另外,不论是酯化还是甘油解反应都是多步反应,反应最终在生成MAG的同时,还有甘二酯(DAG)以及TAG作为副产物产生,选择性富集MAG是很困难的。已有文献[6-7]报道,在有机溶剂中,通过溶剂工程增加溶剂的极性,可以调节反应平衡,使得反应向富集MAG方向进行。然而,有机溶剂作为反应介质虽然具有提高反应速率、缓和反应条件以及提高酶稳定性等优势, 但存在副反应多、反应选择性低以及易产生毒气、易对人体造成伤害和污染环境等缺点。
近年来,离子液体在提高酶的热稳定性、反应选择性和底物溶解性等方面展现出优越的介质特性,特别是在酶促酯类合成领域,大量学者将离子液体作为酶反应的介质[8-9]。另外,离子液体作为一种“可设计性”的溶剂,通过阴阳离子的自由组合改变其极性、疏水性、氢键性质以及黏度等,从而调节反应平衡,选择性地富集甘油酯[10-12]。Guo等[13]在离子液体中选择性地合成了MAG。在一种双性季铵盐离子液体CPMA.MS中用Novozym 435催化甘油解商品化油脂生产MAG。研究结果为:TAG转化率100%,MAG含量90%。这种离子液体的两亲性结构为甘油以及TAG提供了一个兼容体系,并且使反应平衡显著向MAG的生成方向移动。这些可以调节的溶剂性质除了对反应中酶的活性、稳定性和选择性有很大的影响外,对产物中甘油酯的选择性也有一定的影响。虽然离子液体中酶法合成甘油酯已有研究,但是单甘酯选择性与离子液体性质的相关性却鲜见报道。
本文在不同离子液体中,以油酸与甘油的酶法酯化反应作为模型反应,探究离子液体性质与MAG选择性的相关性,从而筛选出能选择性富集MAG的离子液体,并进行了条件优化,为发现一些具有特别结构和性质的离子液体用以甘油酯的选择性合成提供理论依据。
1 材料与方法
1.1 实验材料
离子液体[BMIM]BF4、[HMIM]BF4、[OMIM]BF4、[BMIM]N(CN)2、[HMIM]N(CN)2、[BMIM]PF6、[HMIM]PF6、[OMIM]PF6、[C10MIM]PF6、[BMIM]Tf2N、[HMIM]Tf2N、[OMIM]Tf2N、[BMMIM]Tf2N、[HMMIM]Tf2N、[OMMIM]Tf2N、[MeO(CH2)2MIM]PF6、[HO(CH2)2MIM]Tf2N、[MeO(CH2)2MIM]Tf2N、[Oct3MeN]Tf2N,购于上海成捷化学有限公司;Novozym 435,购于诺维信(中国)生物技术有限公司;色谱分析标准品1,3-甘油二酯(99%)、1,2-甘油二酯(97%)、1-单油酸甘油酯(99%)、2-单油酸甘油酯(95%)、三油酸甘油酯(95%)、油酸(90%),购于Sigma公司;甘油、乙醚、无水乙醇,均为分析纯,正己烷、异丙醇均为色谱纯。
夹层反应器,超高级恒温水浴锅,多点磁力搅拌器,分析天平,离心机,NDJ数显旋转黏度计,Waters1525高效液相色谱仪,蒸发光散射检测器(ELSD)。
1.2 实验方法
1.2.1 酶促油酸与甘油的酯化反应
将油酸和甘油以一定的摩尔比混合,加入离子液体作为反应介质,搅拌后,加入占底物总质量4%的固定化脂肪酶Novozym 435,450 r/min磁力搅拌,在一定的温度下反应一定时间后,离心去除离子液体(含甘油)和脂肪酶,得到含有MAG的产物。采用正相高效液相色谱蒸发光散射检测器(NP-HPLC-ELSD)测定反应后体系中MAG的含量并用外标法定量,酸碱滴定法测定其中脂肪酸含量变化。
100%
1.2.2 NP-HPLC-ELSD法分析甘油酯含量
取20 μL产物,溶入B相溶剂中,NP-HPLC-ELSD测定反应体系中甘油酯的含量。色谱条件:Luna硅胶柱(4.6 mm×250 mm×5 μm,美国Phenomenex公司),柱温30℃;ELSD条件为漂移管温度55℃,增益1,气体流速1.8 mL/min;样品质量浓度0.5 mg/mL,进样量5 μL;二元梯度洗脱系统为A相正己烷-异丙醇(体积比98∶2),B相正己烷-异丙醇-冰乙酸(体积比1∶1∶0.01),流速1.0 mL/min,梯度洗脱程序见表1。

表1 NP-HPLC-ELSD法测定甘油酯含量二元梯度洗脱程序
甘油酯含量的测定:分别建立MAG、DAG、TAG的标准曲线,利用外标法测定MAG、DAG、TAG在反应体系中的质量分数。
MAG选择性表示为:
反应后体系中MAG含量表示为:
1.2.3 离子液体的黏度测定
离子液体黏度由NDJ数显旋转黏度计在25℃下测得。
2 结果与讨论
2.1 离子液体中溶剂性质对MAG选择性的影响
本实验选择了19种含有不同阴阳离子的离子液体作为反应溶剂。将5 mmol油酸和5 mmol甘油
混合,加入占底物总质量30%的离子液体作为反应介质,搅拌后,加入占底物总质量4%的固定化脂肪酶Novozyme 435,450 r/min磁力搅拌,在60℃下反应8 h。表2为反应结果以及离子液体的一些溶剂性质。由于离子液体阴阳离子的结构不同,导致其具有不同的溶剂性质,从而也会改变酶促反应产物的选择性和脂肪酸转化率[7],通过分析不同溶剂性质对MAG选择性的影响,从而筛选出有利于MAG合成的离子液体。

表2 不同离子液体对MAG选择性、脂肪酸转化率的影响以及离子液体的性质
注:离子液体的性质数据引自a文献[14];b文献[15] ; c文献[16]; d文献[17]; e文献[18];h文献[19];j文献[20]; k文献[21]; l文献[22]; m文献[23]; n 文献[24]; o文献[25]。
2.1.1 极性对MAG选择性和脂肪酸转化率的影响(见图1)
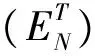
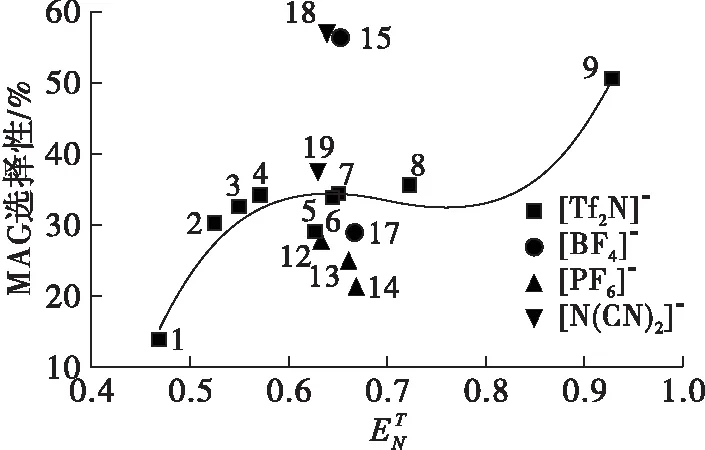
图1极性对MAG选择性和脂肪酸转化率的影响

2.1.2 氢键性质对MAG选择性和脂肪酸转化率的影响(见图2)


图2氢键碱性对MAG选择性和脂肪酸转化率的影响
从图2可以看出,β值与MAG选择性呈明显的正相关趋势。特别的,[BMIM]N(CN)2具有最高的β值(0.71),虽然其α值(0.54)并不高,但是却具有很高的MAG选择性(57.3%)。这可能是由于[BMIM]N(CN)2具有一种电负性很强的阴离子[N(CN)2]-,这种阴离子是一种很强的氢键受体,易与MAG形成氢键从而使MAG选择性增加。然而,[BMIM]N(CN)2的脂肪酸转化率却很低。Zhao等[25]的研究表明,β值与酶的稳定性呈负相关,通常具有高β值的离子液体大多是亲水的,使得酶与溶剂之间产生一种强的相互作用,这种作用能够破坏酶的蛋白质结构,从而使酶的活性降低,导致脂肪酸转化率降低。
2.1.3 疏水性logP对MAG选择性和脂肪酸转化率的影响(见图3)
离子液体的疏水性用logP(辛醇-水分配系数)表征,即离子液体在辛醇和水相的浓度比的对数值。

图3logP对MAG选择性和脂肪酸转化率的影响
从图3可以看出,脂肪酸转化率与logP呈明显的正相关关系。[PF6]-、[Tf2N]-类离子液体的脂肪酸转化率明显高于[BF4]-和[N(CN)2]-类离子液体,这与酶在离子液体中的活性与疏水性的关系是一致的,一般酶在含 [PF6]-、[Tf2N]-疏水性阴离子的离子液体中具有较高活性,而在含[BF4]-和[N(CN)2]-亲水性阴离子的液体中活性很低[26]。另外MAG的选择性与logP并没有明显的相关性,相比较而言,疏水性大的离子液体MAG选择性相对较低。
2.1.4 黏度对MAG选择性和脂肪酸转化率的影响(见图4)
离子液体的黏度普遍比有机溶剂的高,离子液体的黏度主要取决于氢键和范德华力的强弱,表现为黏度大小与烷基链的长短和阴离子的种类有关。从图4可以看出,整体而言黏度与MAG选择性以及脂肪酸转化率并没有明显的相关性。但是,不同种类的离子液体中黏度却呈现出不同的趋势。对于[Tf2N]-而言,随着阳离子烷基链长的增加,黏度增加、脂肪酸转化率增加、MAG选择性有所降低,主要
是由于烷基链长的增加导致离子液体极性降低所致。然而[PF6]-类离子液体却呈现出相反的趋势,随着阳离子酰基链长的增加,脂肪酸转化率降低,MAG选择性有所提高。由表2可以看出,不同阴离子离子液体黏度呈现很大的差异,[PF6]-和[BF4]-类离子液体的黏度远远高于相同类型的[Tf2N]-和[N(CN)2]-类的离子液体。高黏度的溶剂导致了较高的传质阻力,使得反应的转化率有所降低,同时更多的底物生成了MAG,使得酯化反应很难再转化为DAG和TAG,从而表现为MAG选择性高。

图4黏度对MAG选择性和脂肪酸转化率的影响
综上所述,离子液体的极性以及氢键性质是影响MAG选择性的主要性质。经过分析可以得到,具有羟基功能基团的离子液体[HO(CH2)2MIM]Tf2N以及含有[N(CN)2]-的具有强氢键碱性阴离子的离子液体[BMIM]N(CN)2都具有很高的MAG选择性。由于[N(CN)2]-容易破坏酶的活性,从而导致转化率降低,另外其与MAG的高相容性导致反应结束后产物的分离难度加大,因此选择[HO(CH2)2MIM]Tf2N作为溶剂,对MAG合成条件进行优化。
2.2 离子液体中MAG的选择性合成
2.2.1 反应时间对MAG合成的影响
在反应温度50℃、底物(甘油与油酸,下同)摩尔比3∶1、酶添加量4%和离子液体添加量30%的条件下,设计实验考察反应时间对MAG合成的影响,结果如图5所示。

图5 反应时间对MAG合成的影响
从图5可以看出,随着反应时间的延长,MAG含量先迅速增加并在8 h达到最高,之后有所下降。FFA含量一直降低,DAG含量随着反应时间延长一直增高。TAG含量一直很低。酯化反应是一个多步反应,先生成MAG,MAG再结合脂肪酸生成DAG、TAG,随着脂肪酸转化率的增大,MAG转化成了DAG和TAG。延长反应时间将不利于MAG生成。综合考虑,最佳的反应时间为8 h。
2.2.2 脂肪酶添加量对MAG合成的影响
在反应时间8 h、反应温度50℃、底物摩尔比3∶1和离子液体添加量30%的条件下,设计实验考察脂肪酶添加量对MAG合成影响,结果如图6所示。
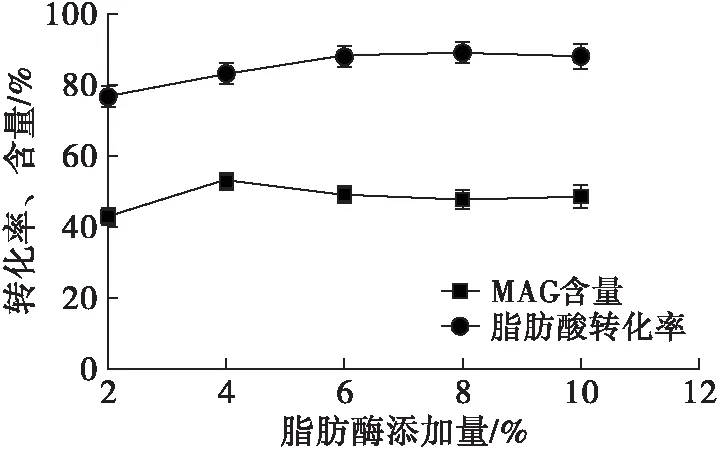
图6 脂肪酶添加量对MAG合成的影响
从图6可以看出,脂肪酶添加量在2%~10%的范围内,脂肪酸转化率一直增加,最终趋于平衡。MAG含量先增加而降低,并在脂肪酶添加量为4%时,MAG含量达到最大值53.2%;当继续增加脂肪酶添加量到10%时,MAG含量有所降低。综合考虑,最佳的脂肪酶添加量为4%。
2.2.3 反应温度对MAG合成的影响
在反应时间8 h、脂肪酶添加量4%、底物摩尔比3∶1和离子液体添加量30%的条件下,设计实验考察反应温度对MAG合成影响,结果如图7所示。

图7 反应温度对MAG合成的影响
从图7可以看出,反应温度在30~70℃的范围内,脂肪酸转化率和MAG含量都随着反应温度的升高先增加后降低,并在反应温度为50℃时,脂肪酸转化率及MAG含量都达到最大值。反应温度升高,酶的活性有所提高,但当反应温度超过50℃时,温度过高导致酶的活性有所降低,从而使脂肪酸转化率降低,MAG含量也有所降低。综合考虑,最佳的反应温度为50℃。
2.2.4 离子液体添加量对MAG合成的影响
在反应时间8 h、脂肪酶添加量4%、底物摩尔比3∶1和反应温度50℃的条件下,设计实验考察离子液体添加量对MAG合成的影响,结果如图8所示。

图8 离子液体添加量对MAG合成的影响
从图8可以看出,在离子液体添加量20%~60%的范围内,脂肪酸转化率随着离子液体添加量的增大先降低后升高,这可能是由于随着离子液体的加入增加了反应体系的体积,同时影响了酶的活性从而降低了反应速率,随着离子液体添加量的增多增加了底物相容性降低了传质阻力,提高了反应速率,使得脂肪酸转化率升高。MAG含量呈先增加后减少的趋势,由于随着离子液体添加量的增加MAG的选择性增加,但脂肪酸转化率的提高使一部分MAG转化成了DAG和TAG致。考虑到离子液体成本以及MAG含量,最佳的离子液体添加量为30%。
2.2.5 底物摩尔比对MAG合成的影响
在反应时间8 h、脂肪酶添加量4%、离子液体添加量30%和反应温度50℃的条件下,设计实验考察底物摩尔比对MAG合成的影响,结果如图9所示。

图9 底物摩尔比对MAG合成的影响
从图9可以看出,在底物摩尔比为1∶1~5∶1的范围内,脂肪酸转化率和MAG含量都随着底物摩尔比的增大先升高后降低,并在底物摩尔比为 4∶1时,脂肪酸转化率达到最大值93.6%,MAG含量达到最大值61.1%,其中MAG选择性为64.5%。这是由于酯化反应是可逆反应, 增大底物甘油的量, 有利于酯化反应向生成MAG的方向进行, 使得脂肪酸转化率、MAG含量增大。但是由于离子液体自身具有一定黏度,甘油量过多时,体系黏度进一步增大,将不利于反应,从而使脂肪酸转化率降低。综合考虑,最佳的底物摩尔比为4∶1。
3 结 论

选择[HO(CH2)2MIM]Tf2N作为反应溶剂,对MAG合成反应条件进行优化。得到合成MAG的最佳工艺条件为底物(甘油与油酸)摩尔比4∶1、反应时间8 h、脂肪酶添加量4%、离子液体添加量30%、反应温度50℃。在最佳工艺条件下,MAG含量为61.1%,脂肪酸转化率为93.6%,其中MAG选择性为64.5%。
[1] KRALOVA I, SJÖBLOM J. Surfactants used in food industry: a review[J]. J Disp Sci Technol, 2009, 30:1363-1383.
[2] 陈琼, 杨雪, 赵金利, 等.酶法制备甘油二酯与甘油三酯的结晶特性研究[J].中国油脂,2015,40(11):48-53.
[3] MILLQVIST A, ADLERCREUTZ P, MATTIASSON B. Lipase-catalyzed alcoholysis of triglycerides for the preparation of 2-monoglycerides[J]. Enzyme Microb Technol, 1994,16:1042-1047.
[4] KRISTENSEN J B, XU X, MU H. Process optimization using response surface design and pilot plant production of dietary diacylglycerols by lipase-catalyzed glycerolysis[J]. J Agric Food Chem, 2005,53:7059-7066.
[5] BERGER M, LAUMEN K, SCHNEIDER M P. Enzymatic esterification of glycerol I. Lipase-catalyzed synthesis of regioisomerically pure 1, 3-sn-diacylglycerols[J]. J Am Oil Chem Soc, 1992,69:955-960.
[6] JANSEEN A E, VAN DER PADT A, VAN SONSBEEK H M, et al. The effect of organic solvents on the equilibrium position of enzymatic acylglycerol synthesis[J]. Biotechnol Bioeng, 1993, 41:95-103.
[7] BELLOT J C, CHOISNARD L, CASTILLO E, et al. Combining solvent engineering and thermodynamic modeling to enhance selectivity during monoglyceride synthesis by lipase-catalyzed esterification[J]. Enzyme Microb Technol, 2001,28:362-369.
[8] KRAGL U, ECKSTEIN M, KAFTZIK N. Enzyme catalysis in ionic liquids[J]. Curr Opin Biotechnol, 2002,13: 565-571.
[9] MONIRUZZAMAN M, NAKASHIMA K, KAMIYA N, et al. Recent advances of enzymatic reactions in ionic liquids[J]. Biochem Eng J, 2010,48:295-314.
[10] ZHAO H, BAKER G A, SONG Z, et al. Designing enzyme-compatible ionic liquids that can dissolve carbohydrates[J]. Green Chem, 2008,10:696-705.
[11] SUN S, CHEN X. Kinetics of enzymatic synthesis of monoferuloyl glycerol and diferuloyl glycerol by transesterification in [BMIM]PF6[J].Biochem Eng J, 2015,97: 25-31.
[12] ZHAO H. Methods for stabilizing and activating enzymes in ionic liquids—a review[J]. J Chem Technol Biotechnol, 2010,85:891-907.
[13] GUO Z, XU X B. New opportunity for enzymatic modification of fats and oils with industrial potentials[J]. Org Biomol Chem, 2005,3:2615-2619.
[14] COLEMAN S, BYRNE R, MINKOVSKA S, et al. Thermal reversion of spirooxazine in ionic liquids containing the [NTf2]-anion[J].Phys Chem Chem Phys, 2009,11:5608-5614.
[15] MULDOON M J, GORDON C M, DUNKIN I R. Investigations of solvent-solute interactions in room temperature ionic liquids using solvatochromic dyes[J]. J Chem Soc, 2001,2:433-435.
[16] ZHANG S G, QI X J, MA X Y, et al. Hydroxyl ionic liquids: the differentiating effect of hydroxyl on polarity due to ionic hydrogen bonds between hydroxyl and anions[J]. J Phys Chem B, 2010,114:3912-3920.
[17] MELLEIN B R, AKI S N, LADEWSKI R L, et al. Solvatochromic studies of ionic liquid/organic mixtures[J]. J Phys Chem B, 2007,111:131-138.
[18] CHIAPPE C, PIERACCINI D. Determination of ionic liquids solvent properties using an unusual probe: the electron donor-acceptor complex between 4, 4′-bis (dimethylamino)-benzophenone and tetracyanoethene[J]. J Phys Chem A, 2006,110:4937-4941.
[19] KHUPSE N D, KUMAR A. Contrasting thermosolvatochromic trends in pyridinium-, pyrrolidinium-, and phosphonium-based ionic liquids[J]. J Phys Chem B, 2009,114:376-381.
[20] RANI M A, BRANT A, CROWHURST L,et al. Understanding the polarity of ionic liquids[J].Phys Chem Chem Phys, 2011,13:16831-16840.
[21] TOKUDA H, TSUZUKI S, SUSAN M A B H, et al. How ionic are room-temperature ionic liquids? An indicator of the physicochemical properties[J]. J Phys Chem B, 2006,110:19593-19600.
[22] YOSHIDA Y, BABA O, SAITO G. Ionic liquids based on dicyanamide anion: influence of structural variations in cationic structures on ionic conductivity[J]. J Phys Chem B,2007, 111:4742-4749.
[23] CHIAPPE C, POMELLI C S, RAJAMANI S. Influence of structural variations in cationic and anionic moieties on the polarity of ionic liquids[J]. J Phys Chem B,2011, 115:9653-9661.
[24] ROPEL L, BELVZE L S, AKI S N, et al. Octanol-water partition coefficients of imidazolium-based ionic liquids[J].Green Chem, 2005(7):83-90.
[25] ZHAO H, BAKER G A, SONG Z, et al. Effect of ionic liquid properties on lipase stabilization under microwave irradiation[J]. J Mol Catal B: Enzym, 2009,57:149-157.
[26] DE DIEGO T, LOZANO P, GMOUH S, et al. Understanding structure-stability relationships ofCandidaantarticalipase B in ionic liquids[J]. Biomacromolecules, 2005(6):1457-1464.
Selectiveenrichmentofmonoglyceridesinionicliquidsbylipase-catalyzedesterification
LÜ Songtai, ZOU Xiaoqiang, QIAN Haifeng, JIN Qingzhe, WANG Xingguo
(Synergetic Innovation Center of Food Safety and Nutrition, State Key Laboratory of Food Science and Technology, School of Food Science and Technology, Jiangnan University, Wuxi 214122, Jiangsu,China)

ionic liquid; monoglycerides; selective enrichment; lipase; solvent property; polarity
2016-10-10;
:2017-04-05
国家自然科学基金(31601433);江苏省自然科学基金青年基金项目(BK20140149)
吕松泰(1992),男,硕士研究生,研究方向为油脂化学及结构脂的合成(E-mail)lvsongtai@hotmail.com。
邹孝强,副教授(E-mail)xiaoqiangzou@163.com。
TQ645;TQ426
:A
1003-7969(2017)08-0037-07

