在线化学清洗对厌氧MBR产甲烷性能影响研究
虞雪晴,王志伟,梅晓洁,苗 妍,吴志超 (同济大学环境科学与工程学院,污染控制与资源化研究国家重点实验室,上海 200092)
在线化学清洗对厌氧MBR产甲烷性能影响研究
虞雪晴,王志伟*,梅晓洁,苗 妍,吴志超 (同济大学环境科学与工程学院,污染控制与资源化研究国家重点实验室,上海 200092)
研究了厌氧膜-生物反应器(AnMBR)污泥在不同浓度的NaOH (10~400mg/L)和NaClO (5~40mg/L)短期暴露下产甲烷活性(SMA)、产甲烷潜能(BMP)、脱氢酶活(DHA)和辅酶F420活性的变化情况.结果表明,采用NaOH作为清洗剂时,SMA随着NaOH浓度的增加而下降;当NaOH浓度在200mg/L内,厌氧微生物产甲烷活性受抑制但未致死,当NaOH浓度超过200mg/L时,产甲烷微生物活性降低甚至致死.从相关酶活性来看,DHA对NaOH具有耐受性,而辅酶F420在一定NaOH浓度范围内(10~100mg/L)受激发而活性增强,超过100mg/L其活性下降.当采用NaClO作清洗剂时,随着NaClO浓度的增加(0~40mg/L),SMA由50mLCH4/(gVSS·d)下降至15mLCH4/(gVSS·d);BMP在这一浓度范围内无明显变化;DHA和辅酶F420活性均随NaClO浓度的升高而降低,NaClO浓度为40mg/L时,DHA降低30%,辅酶F420活性降低70%.
氢氧化钠;次氯酸钠;产甲烷活性;膜清洗;厌氧膜-生物反应器
厌氧膜-生物反应器(AnMBRs)是厌氧生物技术与膜分离技术相结合的废水处理工艺[1-2].这一技术在保留厌氧技术诸多优点的基础上,引入膜组件,不仅实现了水力停留时间和污泥龄彻底分离,也避免了传统厌氧工艺生物固体流失的问题,因此对难降解和有毒有害化合物也具有较好的处理效果[3-4].近年来,随着污水资源化能源化概念的提出,这一技术因能产生生物沼气(甲烷),而引起了国内外学者的广泛关注,并逐渐应用于处理低浓度废水和城市生活污水[3].
然而,膜污染是 AnMBR工艺应用的瓶颈之一,它主要由溶解性有机物(DOM)在膜表面、膜孔内的吸附和以及污泥等颗粒物的沉积而引起[5-6].膜清洗是清除膜污染和恢复膜通量的有效手段[5],根据膜污染去除机理,膜清洗可分为 4类:化学清洗、物理清洗、物理化学清洗和生物/生物化学清洗[7-8].化学清洗是利用化学试剂来去除不可逆膜污染的清洗方法,常用的化学试剂有酸(盐酸、硫酸、柠檬酸、草酸等)、碱(氢氧化钠等)和氧化剂(次氯酸盐和过氧化氢)[8].NaOH和NaClO作为有效的化学清洗药剂,被广泛应用于 MBR的在线清洗和离线清洗中.但是,NaClO对于细菌的生长具有一定的毒副作用,高剂量的NaClO会导致细胞裂解.研究发现随着有效氯投加量的增加,MBR出水对发光菌的抑制效果明显增加[9].相关文献表明在 NaClO为 5mg/g-SS浓度下,30min内硝化速率降低了69%,更高浓度的 NaClO 会导致有机物质裂解[10-11,13-14].在NaClO浓度为21mg/g-SS,反应3h后,胞内物质从污泥微生物体内释放出来[12-13,15].NaOH 也可影响微生物的生理活性,在对氢自养型反硝化菌反硝化性能研究发现,pH高于7.2时,9h和12h后总氮去除率均会随 pH上升而下降[16].然而截至目前,还没有系统的关于NaOH和NaClO对厌氧污泥的影响研究,而有关上述清洗药剂对脱氢酶和辅酶F420影响的研究基本为空白.
本实验探究厌氧污泥在NaOH和NaClO的短期暴露下的生物应激反应,研究在不同浓度梯度的NaOH和NaClO下厌氧微生物的活性,测定了包括产甲烷活性(SMA)、产甲烷潜能 (BMP)及关键酶活,即脱氢酶活(DHA)和辅酶 F420在内的系列指标,研究微生物活性与清洗药剂的关系,为选用厌氧膜-生物反应器膜清洗的清洗药剂种类及浓度提供科学参考.
1 材料与方法
1.1 污泥和清洗药剂
取稳定运行的中试厌氧膜-生物反应器内污泥,污泥VSS/SS约为65%,用0.5%NaCl溶液离心清洗污泥,重复3次,洗去污泥混合液中的本底有机物.
用 NaOH固体配制 NaOH储备液(浓度为11.2g/L),取不同体积加至污泥样品中,配置一系列的NaOH浓度,分别为0、10、20、40、60、80、100、200、300和400mg/L (pH范围为7.36~10.10);用次氯酸钠标准液配制NaClO储备液(浓度为 640mg/L),取不同体积加至污泥样品中,配置成一系列NaClO浓度,分别为0、5、10、20、30和 40mg/L (由于污泥的缓冲作用,各样品的pH均在7.3左右).
1.2 产甲烷批次测试方法
将配置好的污泥依次加入134mL的血清瓶中.每种药剂每个浓度设置3组平行.
取洗净的厌氧污泥,加入预先配好的营养盐(营养盐配方: NaHCO3: 5000mg/L、NH4Cl: 280mg/L、 CaCl2·2H2O: 10mg/L、 K2HPO4: 250mg/L、MgSO4·7H2O: 100mg/L、酵母膏: 100mg/L、H3BO3: 0.05mg/L、FeCl2·4H2O: 2mg/L、ZnCl2: 0.05mg/L、MnCl2·4H2O: 0.05mg/L、CuCl2·2H2O: 0.03mg/L 、 (NH4)SeO3·5H2O: 0.05mg/L、AlCl3·6H2O: 2mg/L、NiCl2·6H2O: 0.05mg/L、Na2SeO3·5H2O: 0.1mg/L、EDTA: 1mg/L、刃天青: 0.2mg/L、36% HCl: 0.001mL/L),配制好的污泥 MLVSS 为 4.92g/L.称取CH3COONa粉末 0.0801g,分别加入预先准备好的血清瓶中,再分别加入25mL配制好的污泥.用高纯氮气吹脱 5min后用橡胶塞密封,放置于35℃摇床(100r/min)中培养12h后,每隔12~24小时测定血清瓶顶空的气体组分(CH4和 CO2),连续监测到产气不再增加为止.测定CH4和CO2的仪器为气相色谱仪(GC 6890N-TCD, Agilent).根据测得的气体体积作出单位质量VSS产生的甲烷量与对应的时间关系曲线,取前5点作图,求得的斜率即为SMA.
为获得 BMP,采用修正的 Gompertz三因素模型拟合实验得到的甲烷生成曲线[17].

式中:M(t)为累积产生的甲烷量,mL/VSS;t为反应时间d;P为最大产甲烷量,mL/VSS,即BMP;Rmax为最大产甲烷速率,mL/(gVSS·d),即SMA;λ为延滞时间 d;e为自然常数.参数 P、Rmax、λ用SigmPlot 12.0的最小二乘法拟合.
1.3 脱氢酶DHA测试方法
污泥样品离心(8000r/min,5min)后重悬在15.4mmol/L的 NaCl 溶液中,取 0.5mL 悬液与1mL 的INT溶液(2g/L)混合,在DHA作用下INT会转化为非水溶性的三苯基甲臜(TF)晶体.在 35℃下培养30min后,加入0.5mL甲醛(37%)停止反应,离心(8000rpm, 5min)使 TF晶体沉淀,去除上清液后加入 5mL乙酸乙酯以萃取 TF,暗处振荡30min 后再次离心(8000rpm, 5min),取上清液在490nm波长下比色.
为便于对比,将与NaOH和NaClO接触前的DHA 活性含量作为对照,设为 100%,其他所有样品DHA活性含量与之相比,最后求得以%为单位的DHA活性.
1.4 辅酶F420测试方法
取10mL厌氧污泥,离心清洗两次,剩下的泥饼加0.5%生理盐水定容至 20mL,污泥在95 °C水浴加热 20min,冷却,加入 2.5倍污泥体积的乙醇,搅拌混合,在6000rpm下离心分离10min,取离心后上清液,往上清液中加入 4mol/L NaOH,使pH调整到13.5,然后在1000r/min下离心10min,弃沉淀,将上清液分为2份,一份加入6mol/L的HCl调节 pH<3作为参比样,另一份加入与酸等量的去离子水作为试样,在分光光度计上测定420nm处的吸光度.由下式计算污泥中的辅酶F420浓度.
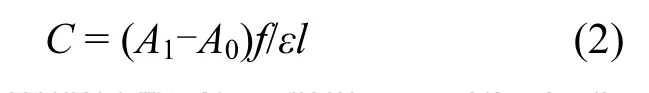
式中:C为污泥中的辅酶 F420浓度,mmol/L;A1为试样在 420nm 下的吸光度值;A0为参比样在420nm下的吸光度值;f为稀释倍数;l为比色皿厚度,cm;ε为辅酶F420的消光系数,L/(cm·mmol);在pH = 13.5时,ε = 54.3L/(cm·mmol).
在求出污泥混合液的F420浓度C后,可根据污泥液的VSS浓度求出污泥内的F420浓度,计算公式为:

式中:Cx为单位质量污泥中辅酶 F420的含量, mmol/g;X为单位体积污泥中的挥发性污泥质量,g/L.
2 结果与讨论
2.1 NaOH清洗对微生物产甲烷的影响
不同浓度的 NaOH对厌氧微生物产甲烷性能的影响如图1所示.由图1(a) 可知,污泥与不同浓度NaOH接触后SMA与NaOH浓度呈线性负相关.空白组的厌氧微生物产甲烷活性最大(34.0mLCH4/(gVSS·d)),当NaOH上升到400mg/L时,SMA几乎降为 0.有研究发现,甲烷生成的最佳 pH 在中性附近[18-20].这是因为厌氧产甲烷体系内的CH4主要由CH3COOH和H2反应生成,而CH3COOH可与NaOH反应而降低浓度,从而降低CH4的生成量.由图1(b)知,当NaOH浓度低于 200mg/L 时,污泥产甲烷潜能在 79~106mLCH4/(gVSS·d)范围内波动,当 NaOH浓度在200mg/L以上时,微生物产甲烷潜能开始下降,在 NaOH浓度为 400mg/L时,BMP降至最低(17.6mLCH4/(gVSS·d)).在 NaOH由 0上升至200mg/L期间,虽然厌氧微生物的产甲烷体积下降,但产甲烷的潜能并未下降,这反映在此期间产甲烷微生物的产甲烷活动受到抑制,但NaOH并未达到致死浓度,当 NaOH大于 200mg/L时, NaOH对微生物开始发挥致死作用,产气潜能大大下降,最后在NaOH为400mg/L时,几乎丧失产气能力,产甲烷潜能约为空白组的20%,可以认为产甲烷微生物在该浓度下已丧失活性.当 NaOH浓度由10mg/L上升至400mg/L时, pH由7.39上升至10.10.有研究表明,pH会影响细胞内电解质的平衡,直接影响微生物的活性甚至灭活,此外, pH还会影响溶液中基质或抑制物浓度,而间接影响微生物活性[21-22].
图 2(a)表明,当 NaOH浓度小于 100mg/L时,DHA活性在一定范围内(98%~148%)上下波动,且活性基本均大于 100%,表明小于 100mg/L浓度的NaOH对DHA活性具有促进作用,有研究同样发现pH在7.5~8.2时,DHA浓度有一定的上升[23].DHA变化与SMA的趋势不一致,这是因为DHA参与的是乙酸生成反应,与甲烷生成相相比,酸生成相的最佳 pH 有相对更大的范围[18].当NaOH浓度大于100mg/L时,DHA活性呈现下降趋势;当NaOH浓度为400mg/L,DHA活性为98%.说明NaOH在100~400mg/L范围内波动时,并不会对DHA造成明显不利影响.
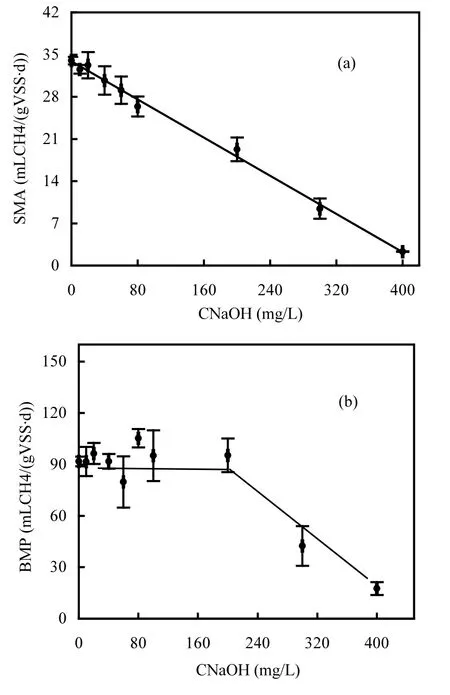
图1 不同NaOH浓度下的 (a) SMA和 (b) BMPFig.1 (a) SMAs and (b) BMPs under various NaOH dosages
图2(b)反映了单位污泥F420浓度随NaOH浓度的变化,随着NaOH浓度上升,F420浓度先上升后下降.空白组的 F420浓度为 1.75×10-3mmol/g,在 NaOH为 100mg/L时,F420浓度达到峰值,为2.68×10-3mmol/g;当NaOH浓度在100~400mg/L时,F420浓度逐渐下降.F420浓度变化趋势与SMA和 BMP不一致,因为虽然辅酶 F420是产甲烷菌特有的辅酶, F420在所有的产甲烷细菌中都被检测到,但由于 F420乙酸型产甲烷菌含量远远低于氢营养型产甲烷菌,因此 F420仅为研究氢营养型产甲烷菌的典型指标,但不能指示所有的产甲烷活动[24-26].当 NaOH浓度在 0~100mg/L时, F420浓度上升,说明低浓度的NaOH对其具有促进作用,当NaOH浓度高于100mg/L时,F420浓度下降,最后随着NaOH浓度升高,F420接近于初始浓度,反映了浓度高于100mg/L的NaOH对氢营养型产甲烷菌促进作用减弱,在浓度为 400mg/L时,NaOH最终失去对氢营养型产甲烷菌的促进作用而导致F420浓度接近空白组水平.

图2 不同NaOH浓度下的(a)DHA和(b)辅酶F420Fig.2 (a) DHA and (b) coenzyme F420under various NaOH dosages
2.2 NaClO清洗对微生物产甲烷的影响
图3(a) 表明污泥与不同浓度的NaClO接触后SMA的变化,其变化趋势与不同浓度NaOH下的SMA变化相似(图1(a)).SMA与NaClO浓度呈线性负相关,空白组的 SMA 最大(47.147mLCH4/(gVSS·d)),当 NaClO 浓度为40mg/L时,SMA 下降到最低(14.726mLCH4/ (gVSS·d)),约为空白的 30%.而随着 NaClO浓度升高,BMP仅在140~231mLCH4/(gVSS·d)范围内波动而未有明显下降(图3(b)). 可见,NaClO的浓度由0上升至40mg/L时,虽然产甲烷微生物的产甲烷活性受到抑制,但微生物仍具较高的产甲烷潜能,表明 0~40mg/L浓度范围内的NaClO对产甲烷微生物具有抑制作用而不具致死作用.
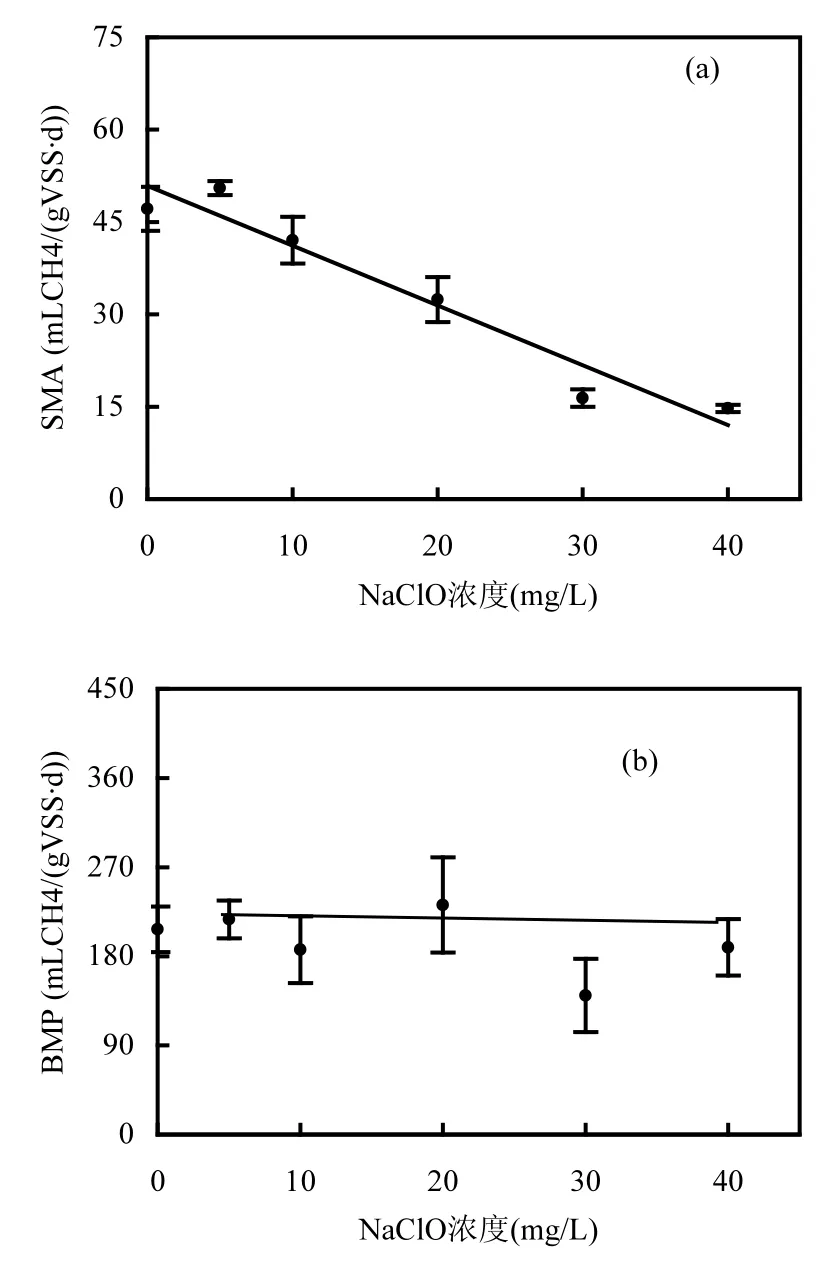
图3 不同NaClO浓度下的 (a) SMA和 (b) BMPFig.3 (a) SMA and (b) BMP under various NaClO dosages
图 4(a)反映了厌氧污泥与不同浓度 NaClO接触后 DHA活性的变化,两者呈线性负相关关系.随着NaClO浓度由0上升至40mg/L,DHA活性由 100%下降至 70%.有文献显示,当在传统活性污泥法工艺中使用氯或者臭氧等氧化剂杀灭丝状菌的过程中,微生物 DHA活性会受到抑制
[27-28].本实验结果进一步表明,在 MBR的化学清洗过程中厌氧污泥的DHA活性也会受NaClO的抑制.NaClO 对DHA活性的抑制作用可能是由于 NaClO在短时间内就可破坏细胞膜,因此NaClO大量流入细胞内部,其氧化性对DHA的蛋白质结构或者基团造成了破坏[29],因此 DHA活性下降.
图4(b)为不同浓度NaClO下的辅酶F420浓度,两者的关系与图4(a)相似,但是F420的变化比DHA剧烈.空白组的F420浓度约为3×10-3mmol/g,随着清洗药剂浓度上升,F420浓度下降,在40mg/L的NaClO刺激下,F420浓度最低,仅为空白的不到30%.主要原因可能是NaClO可渗入细胞壁进入细胞内部,与细胞内蛋白质接触,辅酶F420结构中含有还原性较强的基团如羟基、羰基等[30-32],易被次氯酸根氧化从而失去其原有结构,相比于DHA,辅酶F420则更易受到影响.

图4 不同NaClO浓度下的(a)DHA和(b)辅酶F420Fig.4 (a) DHA and (b) coenzyme F420under various NaClO dosages
对比NaOH和NaClO的浓度与对应SMA关系,斜率分别为-0.08和-0.97,即 NaClO单位浓度变化较NaOH引起SMA的变化更大,因此可认为NaClO的浓度变化对微生物产甲烷活性的影响更剧烈.对比NaOH和NaClO与对应的DHA则发现,当NaOH由空白增大至400mg/L时,DHA活性减小了约50%,而当NaClO由空白增到至40mg/L时,DHA活性减小了30%,即增大单位浓度的清洗药剂,NaClO引起DHA活性的变化更大.
3 结论
3.1 厌氧污泥短期暴露在NaOH对厌氧微生物产甲烷具有抑制作用,浓度低于200mg/L时,产甲烷活性受抑制但产甲烷潜能无影响,说明此浓度下产甲烷菌受抑制但未致死,而浓度高于200mg/L时,产甲烷潜能下降,微生物活性受抑制或部分致死,当污泥暴露在400mg/L NaOH中,产甲烷微生物几乎丧失活性.
3.2 酶活性分析表明, DHA对NaOH具有耐受性,NaOH浓度低于100mg/L对脱氢酶活性影响不大,浓度高于 100mg/L会轻微抑制 DHA活性;NaOH低于100mg/L可提高辅酶F420活性,高于100mg/L则对辅酶F420产生抑制作用.
3.3 厌氧污泥短期暴露在NaClO中对厌氧微生物产甲烷有抑制作用,随着 NaClO浓度的增加(0~40mg/L),SMA由 50mLCH4/(gVSS·d)下降至15mLCH4/(gVSS·d);BMP在这一浓度范围内无明显变化(150~225mLCH4/(gVSS·d));酶活性分析显示, DHA和辅酶F420活性均随NaClO浓度的升高而降低,NaClO浓度为40mg/L时,DHA降低30%,辅酶F420活性降低70%.
[1]梅晓洁,王志伟,马金星,等.膜-生物反应器污泥缺氧反硝化过程中SMP的形成 [J]. 中国环境科学, 2012,32(10):1784-1791.
[2]林红军,陆晓峰,梁国明,等.厌氧膜生物反应器的研究和应用进展 [J]. 净水技术, 2007,26(6):1-6.
[3]Lew B, Tarre S, Beliavski M, et al. Anaerobic membrane bioreactor (AnMBR) for domestic wastewater treatment [J]. Desalination, 2009,243(1–3):251-257.
[4]Chang I S, Lee C H. Membrane filtration characteristics in membrane-coupled activated sludge system—the effect of physiological states of activated sludge on membrane fouling [J]. Desalination, 1998,120(3):221-233.
[5]Baek S H, Pagilla K R, Kim H J. Lab-scale study of an anaerobic membrane bioreactor (AnMBR) for dilute municipal wastewater treatment [J]. Biotechnology and Bioprocess Engineering, 2010,15(4):704-708.
[6]Choo K H, Lee C H. Membrane fouling mechanisms in the membrane-coupled anaerobic bioreactor [J]. Water Research, 1996,30(8):1771-1780.
[7]Padmasiri S I, Zhang J, Fitch M, et al. Methanogenic population dynamics and performance of an anaerobic membrane bioreactor (AnMBR) treating swine manure under high shear conditions [J]. Water Research, 2007,41(1):134-144.
[8]Wang Z, Ma J, Tang C Y, et al. Membrane cleaning in membrane bioreactors: A review [J]. Journal of Membrane Science, 2014,468(20):276-307.
[9]杜婧茹,李魁晓,周 军,等.膜生物反应器处理城市污水的后续次氯酸钠消毒研究 [J]. 环境科学, 2011,32(8):2292-2297.
[10]Batstone D J, Keller J, Angelidaki I, et al. The IWA Anaerobic Digestion Model No 1 (ADM1) [J]. Water Science & Technology, 2002,45(10):65-73.
[11]Wang Z W, Wu Z C, Mai S H, et al. Research and applications of membrane bioreactors in China: Progress and prospect [J]. Separation and Purification Technology, 2008,62(2):249-263.
[12]Lee E J, Kwon J S, Park H S, et al. Influence of sodium hypochlorite used for chemical enhanced backwashing on biophysical treatment in MBR [J]. Desalination, 2013,316:104-109.
[13]Lim B R, Ahn K H, Song K G, et al. Microbial community in biofilm on membrane surface of submerged MBR: effect of in-line cleaning chemical agent [J]. Water Science & Technology, 2005,51(6/7):201-7.
[14]Wang Z, Ma J, Tang C Y, et al. Membrane cleaning in membrane bioreactors: A review [J]. Journal of Membrane Science, 2014,468(20):276-307.
[15]Han X, Wang Z, Wang X, et al. Microbial responses to membrane cleaning using sodium hypochlorite in membrane bioreactors: Cell integrity, key enzymes and intracellular reactive oxygen species [J]. Water Research, 2015,88:293-300.
[16]张彦浩,谢 康,钟佛华,等.pH对氢自养型反硝化菌反硝化性能的影响 [J]. 环境污染与防治, 2010,32(4):40-43.
[17]Zwietering M H, Jongenburger I, Rombouts F M, et al. Modeling of Bacterial Growth Curve [J]. 1990,56(6):1875-1881.
[18]赵明星,严 群,邹 华,等.pH调控对厨余物厌氧发酵产沼气影响研究 [C]//工业生物技术研发及生产生物质能和生物基化学品技术交流与发展研讨会, 2007.
[19]远藤银朗,野池达野,松本顺一郎.厌氧消化中酸生成相及温度和pH的影响 [C]//土木学会论文集, 1983,330:49-57.
[20]野池达也.甲烷发酵 [M]. 化学工业出版社, 2014.
[21]杨 洋,左剑恶,沈 平,等.温度、pH值和有机物对厌氧氨氧化污泥活性的影响 [J]. 环境科学, 2006,27(4):691-695.
[22]余智勇.厌氧膜生物反应器的污泥消化和膜污染特性 [D]. 北京:清华大学, 2015.
[23]Navacchia M L, Capobianco M L, D’Angelantonio M, et al. Monoelectronic reduction of dihydroartemsisinin (DHA): pH dependence and product analysis [J]. Tetrahedron Letters, 2013, 54(38):5257-5260.
[24]Dolfing J, Bloeman W G B M. Acitivity measurements as a tool to characterize the microbial composition of methanogenic environments [J]. Journal of Microbiological Methods, 1985,4(1): 1-12.
[25]Dolfing J, Mulder J W. Comparison of methane production rate and coenzyme f(420) content of methanogenic consortia in anaerobic granular sludge [J]. Applied & Environmental Microbiology, 1985,49(5):1142-1145.
[26]Zábranská J, Schneiderová K, Dohányos M. Relation of coenzyme F420 to the activity of methanogenic microorganisms [J]. Biotechnology Letters, 1985,7(8):547-552.
[27]Caravelli A, Giannuzzi L, Zaritzky N. Effect of chlorine on filamentous microorganisms present in activated sludge as evaluated by respirometry and INT-dehydrogenase activity [J]. Water Research, 2004,38(9):2394-2404.
[28]Caravelli A, Giannuzzi L, Zaritzky N. Effect of ozone on filamentous bulking in a laboratory scale activated sludge reactor using respirometry and INT-Dehydrogenase activity [J]. Journal of Environmental Engineering, 2006,132(9):1001- 1010.
[29]Kanao T, Kawamura M, Fukui T H, et al. Characterization of isocitrate dehydrogenase from the green sulfur bacterium Chlorobium limicola - A carbon dioxide-fixing enzyme in the reductive tricarboxylic acid cycle [J]. European Journal of Biochemistry, 2002,269(7):1926–1931.
[30]Eirich L D, Vogels G D, Wolfe R S. Proposed structure for coenzyme F420 from Methanobacterium [J]. Biochemistry, 1978,17(22):4583-4593.
[31]Listed N. Coenzyme F420: another example of the diversity in structure and function of natural flavins [J]. Nutrition Reviews, 1980,38(2):88-90.
[32]Aufhammer S W, Warkentin E, Ermler U, et al. Crystal structure of methylenetetrahydromethanopterin reductase (Mer) in complex with coenzyme F420: Architecture of the F420/FMN binding site of enzymes within the nonprolyl cis-peptide containing bacterial luciferase family [J]. Protein Science A Publication of the Protein Society, 2005,14(7):1840-1849.
Effects of in-situ chemical cleaning on methanogenic activities in anaerobic membrane bioreactors.
YU Xue-qing, WANG Zhi-wei*, MEI Xiao-jie, MIAO Yan, WU Zhi-chao (State Key Laboratory of Pollution Control and Resource Reuse, College of Environmental Science and Engineering, Tongji University, Shanghai 200092, China). China Environmental Science, 2017,37(9):3339~3345
NaOH and NaClO are the common chemicals used for in-situ cleaning in anaerobic membrane bioreactors (AnMBRs); however, the cleaning reagents can affect the viability of anaerobic microbes along with the elimination of membrane foulants. In this study, the methanogenic activities and related enzymes of anaerobic sludge were tested under the short-term exposure to NaOH (10~400mg/L) and NaClO (5~40mg/L), including specific methanogenic activity (SMA), biochemical methane potential (BMP), dehydrogenase activity (DHA) and coenzyme F420activity. The results showed that SMA decreased with the increase of NaOH concentration. The NaOH concentrations of 0~200mg/L caused inhibition effects while the concentrations above 200mg/L might induce cell death. In terms of key enzymes, dehydrogenase could tolerate relatively high NaOH concentrations while coenzyme F420was more sensitive to NaOH. The activities of coenzyme F420were slightly improved at the NaOH concentration of 10~100mg/L and declined when NaOH concentration was above 100mg/L. Under the exposure of NaClO, SMA decreased from 50mLCH4/(gVSS·d) to 15mL CH4/(gVSS·d) when NaOCl concentration increased from 0 to 40mg/L while BMP exhibited no obvious change. The activity of DHA and coenzyme F420decreased with the increase of NaClO, and DHA decreased by 30% and activity of coenzyme F420decreased by 70% at the NaClO concentration of 40mg/L.
NaOH;NaClO;methanogenic activity;membrane cleaning;anaerobic membrane bioreactor (AnMBR)
X703
A
1000-6923(2017)09-3339-07
2017-03-09
国家自然科学基金资助项目(51678423)
* 责任作者, 教授, zwwang@tongji.edu.cn
虞雪晴(1994-)女,江苏苏州人,同济大学环境科学与工程学院硕士研究生,主要从事污水处理与资源化研究.
——李红,安明哲,苟梓希.CN 114180719A

