利用蛋白质组学技术研究不同储藏条件稻谷陈化机制
孙术国,王若晖,林亲录,蒋春燕,丁玉琴,曹建中
利用蛋白质组学技术研究不同储藏条件稻谷陈化机制
孙术国,王若晖,林亲录※,蒋春燕,丁玉琴,曹建中
(中南林业科技大学食品科学与工程学院/稻谷及副产物深加工国家工程实验室,长沙410004)
为了研究储藏过程中不同温度和气调条件对稻谷品质劣化的影响,利用蛋白质组学技术探讨稻谷储藏陈化的分子机理,研究温度37 ℃、25 ℃和25 ℃+CO2气调下稻谷储藏90 d品质和蛋白质组的变化。结果表明,较37、25 ℃贮藏,25 ℃+CO2气调下稻谷储藏脂肪酸值升高最少,发芽率下降最少(<0.05)。稻谷储藏产生125个差异蛋白点,其中37个蛋白得到鉴定,根据蛋白质的功能可分为5类,包括代谢(45.9%),细胞结构(29.7%),抗胁迫(2.7%),功能性蛋白(5.4%)和其他蛋白(16.3%)。并鉴定出4个目标蛋白,分别为蛋白酶体亚基-1(B26、D09和F16),葡糖-1-磷酸腺苷酰基转移酶(C01和E07),ADP-葡萄糖焦磷酸化酶大亚基(B04和F04)和乙酰辅酶A(A06和C05)。采用蛋白质组学技术分析稻谷储藏过程中蛋白质组变化,结果表明高温储藏促进稻谷差异蛋白表达,CO2气调储藏可降低差异蛋白表达。对差异表达蛋白功能分析表明,稻谷陈化可能与糖代谢紊乱、蛋白质分解能力降低,抗氧化酶活性降低,脂肪水解和氧化增强有关。研究结果为稻谷的合理、安全储藏提供参考。
蛋白;储藏;品质控制;蛋白质组学;陈化;稻谷
0 引 言
稻谷是世界半数以上人口的主要粮食,其生产具有很强的季节性特点,在稻谷生产当季只有少部分稻谷被加工成糙米或精米销售,绝大部分稻谷需要储藏保鲜。稻谷在储藏过程中品质会下降,这种自然和自发的变化叫做陈化[1]。陈化会导致稻谷物理、化学和生物特性变化,影响其生物活性和发芽率,以及影响其作为食品的蒸煮、加工、食用和营养品质,最终影响其商业价值[2]。因此,选择合适储藏方式,提高稻谷储藏性意义重大。
影响稻谷储藏性能的因素较多,包括稻谷的品种、稻谷加工方式以及稻谷储藏的环境条件(温度、湿度、环境气体等)等[3-5]。目前,中国在稻谷储藏保鲜研究方面也取得了一定进展,如采用低温储藏[6]、CO2气调储藏等技术[7],这些稻谷储藏保鲜技术一定程度上实现了稻谷的安全储藏,减少了储藏过程中稻谷品质劣化和营养损失。同时,有学者研究分析稻谷储藏过程中淀粉、脂肪酸、可溶性蛋白和氨基酸的变化,以及这些变化对稻谷的蒸煮品质、质构品质、凝胶特性、风味品质、感官属性以及生物酶活性的影响,旨在获得稻谷陈化机制[8]。这些研究发现稻谷在储藏过程中蛋白质含量变化不大,但几种主要蛋白会发生不同程度的降解、变性或是结构的变化[9-10]。这种蛋白质水平的变化,与稻米陈化后米饭蒸煮品质劣化(米饭硬度增大和黏性降低)有着密切的联系,但导致这种蛋白质变化的分子机制至今仍不清楚。
随着基因组学、蛋白质组学等高通量技术的高速发展,使得人们从系统生物学角度研究特定环境、特定时空条件下细胞或组织中各组分的变化成为可能,进而揭示食物原料或经加工后其深层品质变化机制[11-13]。近年来,蛋白质组学技术开始广泛应用于以茭白、豆类、蛋类、肉类和鱼类等为研究对象的食品领域[14-17]。也有学者将蛋白质组学技术应用于研究不同品种的稻谷种子储藏特性,分析了自然储藏条件对稻谷发芽率的影响[18]。这些研究为研究稻谷陈化机理以及与陈化相关的功能性蛋白提供了一种系统性的分析手段,从动态角度描述蛋白水平表达的差异,并且鉴定出与其生理变化相关的蛋白,分析不同储藏条件对稻谷陈化的影响,为稻谷陈化机理的研究提供了一种技术方法。本文从蛋白质分子水平研究了不同储藏温度及气调储藏条件下稻谷蛋白的表达情况,并将鉴定出来的蛋白与已知的理化变化进行相关性分析,为分析稻谷陈化机理提供一种新的思路和方法。
1 材料与方法
1.1 试验材料与仪器
试验稻谷来源于国家杂交水稻工程技术研究中心提供的晚籼稻黄华粘(2014年当年生产的稻谷)。稻谷从收割到试验控制在1个月内,试验进行前,将试验稻谷在50 ℃干燥至含水率13.5%±0.5%(卡尔费休法测定含水率)。
AKF-3卡尔费休氏水分测定仪(上海禾工科学仪器有限公司);UV-2600紫外可见分光光度计(日本岛津公司);GE Ettan IPGphor 3等电聚焦仪(美国通用电气公司);Ultraflex III TOF/TOF质谱仪(德国布鲁克公司);MS105DU电子分析天平(日本岛津公司);T70智能电位滴定仪(瑞士梅特勒公司);PRX-150A智能人工气候箱(宁波赛福试验仪器有限公司);DHG-9123A电热鼓风干燥箱(上海一恒科学仪器有限公司);H5050R冷冻离心机(湖南湘仪实验室仪器开发有限公司)。
1.2 稻谷储藏试验
准备54个密封罐,每个放置150 g稻谷,将这些密封罐分为3组,每组18个。其中第一组置于37 ℃的恒温箱中储藏,第二组置于25 ℃的恒温箱中储藏,第三组密封罐中充入浓度99%的CO2,置于25 ℃的恒温箱中储藏,每隔15 d从每组取3罐测定稻谷发芽率和脂肪酸值,另外取同样样品采用液氮冷冻,再利用蛋白质组学技术分析稻谷蛋白质表达差异。
1.3 稻谷发芽率和脂肪酸值的测定
稻谷发芽率按照GB/T 3543.3-1995方法测定,脂肪酸值按GB/T 29405-2012方法测定。
1.4 蛋白质组双向电泳
1.4.1 稻谷样品的研磨
研磨前先在研钵中倒入液氮预冷,然后将10 g稻谷样品置于研钵中,迅速加入液氮研磨,直至组织变成粉末,立刻在研钵中加入20 mg聚乙烯吡咯烷酮(polyvinyl- polypyrrolidone,PVPP),用药勺将粉末转移至50 mL离心管中。
1.4.2 蛋白质提取
在50 mL离心管中加入10mL提取液(0.7 mol/L蔗糖,0.1 mol/L氯化钾,50 mmol/L乙二胺四乙酸二钠,0.5 mol/L三羟甲基氨基甲烷盐酸缓存液,pH值7.5),再加入10 mLTris饱和酚,充分振荡后于冰上保温,每隔5 min振荡一次,总共6次。然后在4 ℃,5 000 r/min,离心30 min,吸出上层酚相,转移到15 mL离心管中[19]。
1.4.3 蛋白质纯化
1)在离心管中加入与酚相等体积的提取液,充分振荡后于冰上保温,每隔5 min振荡一次,总共6次,4 ℃,5 000 r/min,离心30 min,吸出上层酚相,转移至新的15 mL离心管中。重复一次操作。
2)加入最后得到的酚的5倍体积的醋酸铵甲醇溶液对蛋白进行沉淀,充分振荡后置于冰上保温每隔5 min振荡一次,总共6次,−20 ℃沉淀过夜。
3)对沉淀过夜的蛋白质4 ℃,5 000 r/min,离心30 min,倾倒上清液,加入5 mL甲醇对蛋白进行洗涤,除去蛋白中的色素及盐,用移液器(1 mL)反复吹打均匀后,4 ℃,5 000 r/min,离心30 min。重复一次操作。
4)加入5 mL丙酮对蛋白进行洗涤,用移液器(1 mL)反复吹打均匀之后,在4 ℃,5 000 r/min,离心30 min。重复一次操作。洗涤两次之后最后一次加入4 mL丙酮,吹打均匀之后将蛋白质平均分到4支1.5 mL 微型离心管EP(eppendorf)中,在4 ℃,12 000 r/min,离心20 min。倒去上清液后,室温下干燥,即可得到处理后的蛋白质团块,−80 ℃保存备用。
1.4.4 蛋白质定量
取5、10、15、20、25、30、35g的牛血清白蛋白BSA(bovine serum albumin,质量浓度为5g/L)标准品制作标准曲线,样品一般取2~3L,双复管测定。每支管加入1mLBradford溶液,涡旋振荡20 s,使其充分混匀后即可测定吸光值(OD595)。加入液体时要均匀,避免产生气泡。定量分两次进行,第一次为初步定量,计算得到各样品的浓度后,将所有样品浓度尽量调至比较接近,再进行第二次定量,为了保证定量的准确性,每次定量都需制作标准曲线(=6.7305+0.0134,2=0.998)。
1.4.5 双向电泳
蛋白质的提取、双向电泳、凝胶转移及银染等步骤按照丁承强等[20]的方法进行。
1.4.6 凝胶的扫描和保存
扫描模式设定为256灰阶透视扫描,分辨率为300 像素。扫描完的凝胶用保鲜膜包好后置于4 ℃保存。
1.4.7 图像分析
分析软件为Image Master 2Dplatinum5.0(GE)。
1.5 数据处理与统计分析
上述所有试验重复3次,取平均值,试验采用SPSS软件对数据进行统计分析。
2 结果与分析
2.1 储藏温度及CO2气调储藏条件对稻谷脂肪酸值和发芽率影响
由图1a可以看出,随着稻谷储藏时间的延长,其脂肪酸值也随之升高,尤其在37 ℃下升高最明显,与25 ℃和25 ℃+CO2气调两组相比,差异显著(<0.01)。这主要是由于高温条件下稻谷游离脂肪酸增多,且进一步氧化后,产生难闻的戊醛、己醛等挥发性羰基化合物,蛋白质也容易引起水解,游离氨基酸上升,导致稻谷脂肪酸值升高[21]。在同样25 ℃下储藏的稻谷,CO2气调储藏脂肪酸值增长趋势小于非气调组(<0.05)。随着稻谷储藏时间的延长,稻谷发芽率逐渐降低,这与Gao等观察的结果一致[18]。储藏温度对稻谷发芽率影响非常大,在同样的储藏时间下,储藏温度越高,稻谷发芽率越低;但在同样的温度条件下,气调储藏的稻谷发芽率高于非气调组(<0.05)(图1b),而种子发芽率直接反映种子的活力水平,这些结果充分说明气调储藏可以较好地保持种子活力,进而起到对稻谷储藏保鲜效果[7]。上述结果充分表明CO2气调储藏有利于稻谷品质的保持,可能原因在于CO2气调使储藏的稻谷处于低氧或者无氧的环境,降低了稻谷中不饱和脂肪酸氧化,减少了游离脂肪酸和一些自由基产生,对稻谷种子起到一定的保护作用[22]。
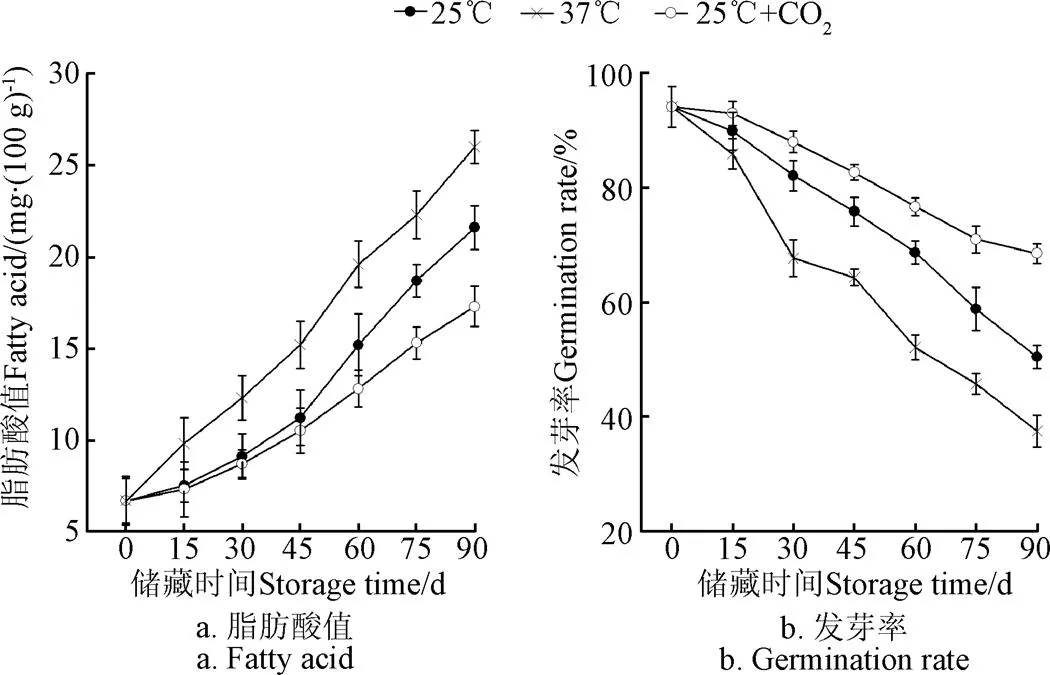
图1 不同储藏条件下稻谷脂肪酸值和发芽率的变化规律
2.2 稻谷蛋白的双向电泳分析及与稻谷陈化关系
利用双向电泳研究了稻谷在不同储藏条件下的蛋白表达情况,结果如图2所示,结果表明,与储藏初始相比,在37 ℃储藏条件下(图2b、c)共发现46个差异蛋白,其中16个表达上调,30个表达下调;在25 ℃储藏条件下的稻米(图2d、e)中共发现39个差异蛋白,其中12个表达上调,27个表达下调;在25 ℃+CO2气调储藏条件下(图2f、g),发现差异蛋白30个,其中16个表达上调,14个表达下调。这些结果亦表明,稻谷陈化过程中蛋白质组的变化对温度敏感,高温可能导致更多差异蛋白质的表达,在同样温度储藏条件下,CO2气调储藏可以降低温度所造成的蛋白质的差异表达,间接说明CO2气调储藏可以降低稻谷在储藏过程中蛋白质分子水平上生理生化变化,延缓稻谷的陈化。

图2 不同储藏条件下的稻谷蛋白质双向电泳图
2.3 稻米差异蛋白的质谱鉴定
利用质谱仪对所有125个差异蛋白点进行质谱分析,利用BioTools(Bruker Dalton)软件搜索美国国立生物技术信息中心(national center for biotechnology information,NCBI)数据库,对稻谷贮藏过程中发生显著变化的蛋白质进行鉴定。共鉴定出37个差异蛋白,不同功能蛋白的编号和名称见表1。根据蛋白质的功能可分为5类,包括代谢(45.9%),细胞结构(29.7%),抗胁迫(2.7%),功能性蛋白(5.4%)和其他蛋白(16.3%),具体分析如下。
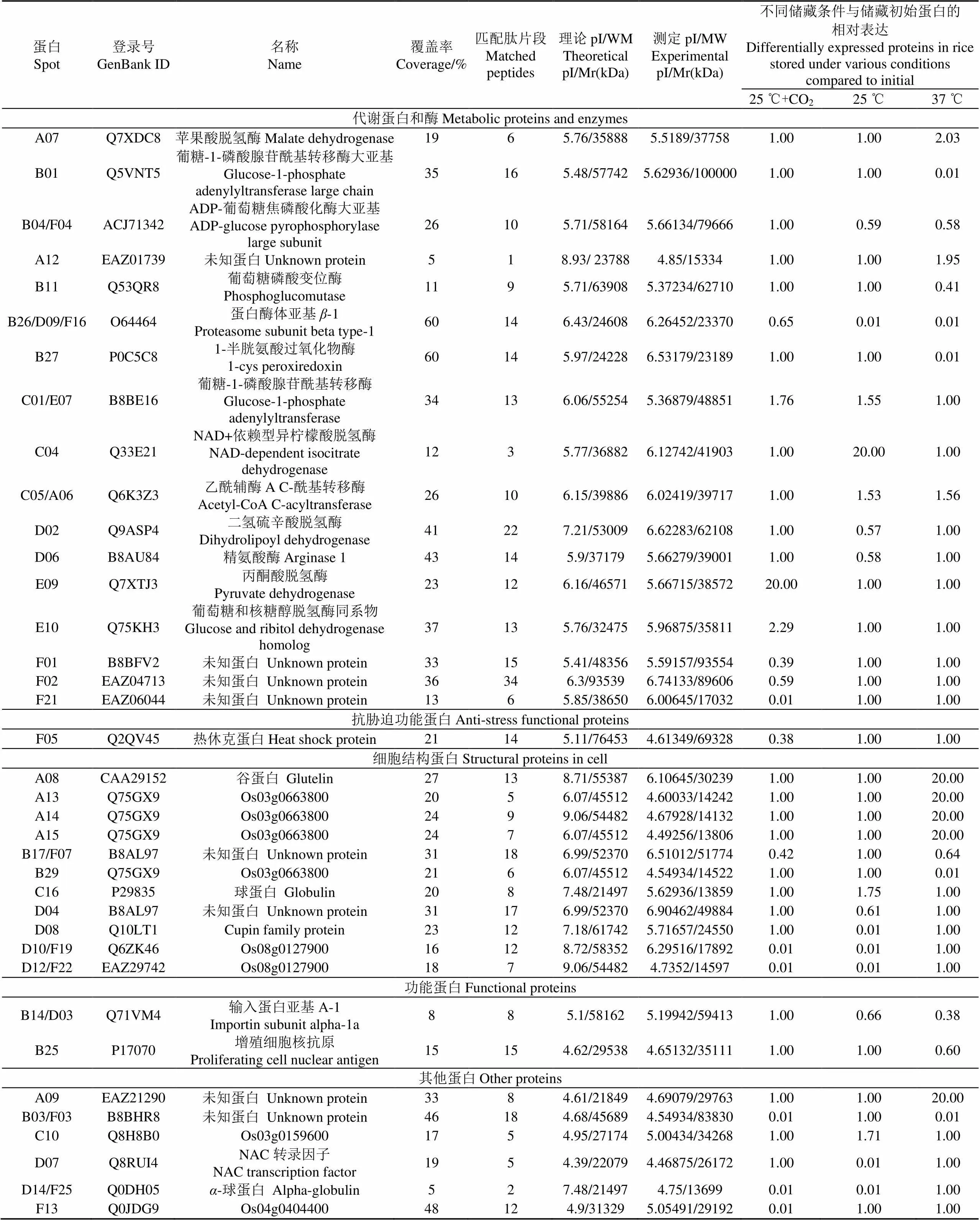
表1 不同储藏条件下稻谷差异蛋白的Ultraflex III TOF/TOF质谱鉴定
结合表1和图2b、c显示,37 ℃储藏下鉴定出的18个差异蛋白,其中8个表达上调,10个表达下调。在表达上调的蛋白中,4个(A08、A13、A14、A15)与细胞结构相关蛋白表现出极高的匹配度。在10个表达下调的蛋白中,B03、B17被鉴定为未知蛋白;5个蛋白(B01、B04、B11、B26、B27)与代谢相关,经鉴定分别为葡糖-1-磷酸腺苷酰基转移酶大亚基、ADP-葡萄糖焦磷酸化酶大亚基、葡萄糖磷酸变位酶、蛋白酶体亚基-1、1-半胱氨酸过氧化物酶。2个蛋白(B14、B25)为功能蛋白,分别鉴定为输入蛋白亚基-1和增殖细胞核抗原。
结合表1和图2d、e显示,25 ℃储藏下鉴定出的16个差异蛋白,其中5个上调,11个下调。在表达上调的蛋白中,3个代谢蛋白(C01、C04、C05),经鉴定分别为葡糖-1-磷酸腺苷酰基转移酶、异柠檬酸脱氢酶和乙酰辅酶A。在表达下调的蛋白中,大多数蛋白(D04、D08、D10、D12)为与细胞结构相关匹配性较高的蛋白,2个蛋白(D02和D06)与代谢相关,经鉴定分别为二氢硫辛酸脱氢酶和精氨酸酶。D07和D14经鉴定为转录因子与-球蛋白。
结合表1和图2f、g结果,25 ℃气调储藏下共鉴定出14个差异蛋白,其中表达上调3个,表达下调11个。表达上调的蛋白E09和E10均与代谢相关,经鉴定分别为丙酮酸脱氢酶和葡萄糖和核糖醇脱氢酶同系物。表达下调的蛋白(F01、F02、F21)经质谱和生物信息学分析,表明这3种蛋白可能与代谢相关;2种蛋白F05和F13经鉴定分别为抗胁迫功能的热休克蛋白和功能未知的Os04g0404400蛋白。
2.4 不同储藏条件下稻谷蛋白组的变化及其与稻谷陈化关系
2.4.1 不同储藏温度条件下稻谷的蛋白变化与稻谷陈化关系
通过将稻谷分别置于37和25 ℃温度条件储藏90 d,结果如图2所示,结果表明,与新鲜稻谷作对照,37 ℃高温条件导致稻谷产生46个差异蛋白,其中16个表达上调,30个表达下调,这些差异表达蛋白经质谱和生物学信息学分析,发现表达上调的多为结构相关蛋白。而25 ℃条件下储藏的稻谷差异蛋白点有所降低,只有39个,其中共鉴定出16种差异蛋白,上调的5个蛋白中,多为代谢相关蛋白。由此可见,在稻谷储藏过程中,不同温度对稻谷蛋白表达差异明显,温度越高,差异表达蛋白越多,稻谷品质劣化越明显(图1),适当低温条件下有利于稻谷储藏保鲜。
针对稻谷储藏过程产生差异蛋白,利用质谱和生物学信息学,系统研究这种蛋白质差异表达对稻谷陈化影响。结果表明:
1)在25 ℃储藏条件下,稻谷表达上调蛋白C01(E07)为葡糖-1-磷酸腺苷酰基转移酶,是淀粉合成过程中一种重要的酶,而该酶在高温条件下表达下调(表1),说明在较高温度的条件下,该酶的表达受到抑制,从而导致稻谷淀粉合成受阻,进而影响了稻谷食用品质。表达上调蛋白C04经鉴定异柠檬酸脱氢酶,其参与三羧酸循环,负责催化异柠檬酸氧化脱羧成-酮戊二酸,是循环途径中的限速酶,上述两种酶类都与核苷酸代谢有关,他们表达上调说明核苷酸降解,导致稻谷代谢失调,最终加速了陈化。表达上调蛋白C05(A06)经鉴定为乙酰辅酶A,乙酰辅酶A是质体中脂肪酸合成的前体物,脂肪酸合成的第一步是由乙酰辅酶A羧化酶参与完成,催化合成的丙二酰辅酶是脂肪酸合成和脂酰链延伸系统等重要代谢反应的底物[23],因此,乙酰辅酶A表达上调,说明在陈化过程中脂肪酸增加。表1显示乙酰辅酶A在高温及25℃条件下都有表达上调,但是相对来说,高温上调表达更为明显,其表达上调说明会导致稻谷脂肪酸值增加,进而导致稻谷品质下降,因此推测高温条件稻谷品质劣化越明显。而根据施利利等[24]研究20种陈化糙米脂肪酸值平均值增加了2倍,变化最大的津稻168,脂肪酸值增加了3.67倍。据此也可以推测,高温条件促进脂肪酸增加,因此会加剧稻谷品质的劣化。表达下调蛋白D02经鉴定为二氢硫辛酸脱氢酶,作为丙酮酸脱氢酶系的一种,其参与三羧酸循环的第二阶段,使得丙酮酸氧化脱羧形成乙酰CoA[25],由于丙酮酸脱氢酶体系的复杂,该酶的表达下调可以推测丙酮酸脱羧反应受到影响,导致CoA的表达上调。
2)在37 ℃储藏条件下,B11鉴定为葡萄糖磷酸变位酶,是淀粉合成需要的葡萄糖磷酸变位酶。B01为葡糖-1-磷酸腺苷酰基转移酶(AGPP)大亚基,它是淀粉合成的一个限速酶,催化1-磷酸葡萄糖(G-1-P)与三磷酸腺苷(ATP)反应形成腺苷二磷酸葡萄糖(ADPG)并释放焦磷酸(PPi)。而ADPG作为活化葡萄糖基供体将糖基部分加到-1,4葡聚糖引物的还原端,被淀粉合成酶用来催化形成淀粉颗粒,因此直链淀粉和支链淀粉都与其相关[26]。抑制AGPP的活性将导致淀粉合成的部分或全部终止[27]。淀粉作为大米中比例最高的成分,其淀粉变化和稻谷陈化后质构特性变化具有一定关联,如淀粉在储藏过程中直链淀粉含量略增加,平均分子量下降,不溶性直链淀粉的比例显著增加,最终导致米饭蒸煮过程中水分难以渗透,淀粉溶解度和糊化度下降,米饭黏性较小,口感较硬[28-30]。图2c中与储藏初始比较表达下调蛋白点B27为具有抗氧化作用的1-半胱氨酸过氧化物酶,其作用为预防稻谷重要蛋白和淀粉氧化,该酶表达下降,说明了稻谷储藏过程中抗氧化作用下降,更易陈化。B26(D09,F16)经鉴定为蛋白酶体,蛋白酶体是一个广泛分布于生物体内的多亚基大分子复合物,具有多种催化功能,可选择性降解细胞内的蛋白质,是细胞新陈代谢的一个重要组成部分,能维护细胞内蛋白质稳态[31],其表达下调说明蛋白质代谢的不稳定也是导致稻谷陈化的一个重要原因。
2.4.2 气调与非气调储藏条件下稻谷蛋白的变化与稻谷陈化关系
通过将稻谷置于25 ℃气调和非气调条件下储藏90 d,结果如图2所示,结果表明,气调储藏下稻谷差异蛋白为30个,与非气调储藏条件比较差异明显,结合图1,表明稻谷气调储藏陈化速度变慢。
针对稻谷气调和非气调储藏过程产生差异蛋白,利用质谱和生物学信息学,系统研究这种蛋白质差异表达对稻谷陈化影响。结果表明:在25 ℃气调储藏条件下,表达上调蛋白E09(表1),经鉴定为丙酮酸脱氢酶,该酶是丙酮酸脱氢酶系中的核心结构,主要作用于三羧酸循环第二阶段,催化生成乙酰CoA,该酶的表达上调说明稻谷在CO2气调储藏期间一定程度能保持生理活性正常,相关代谢酶活性保持较好。由表1对比,研究发现B26、D09与F16为不同储藏条件下的相同蛋白点,经鉴定为蛋白酶体,结合前文分析,在稻谷的储藏中,无论是高温、室温或是室温下气调储藏,蛋白质本身将会发生一系列的降解,分解成精氨酸、苯丙氨酸、酪氨酸、亮氨酸和谷氨酸等小分子物质,但稻谷在非气调储藏条件下,蛋白酶体表达量下降非常大,而CO2气调储藏能较好维持蛋白酶体表达,有利于稻谷品质维持(图1和表1)。因此,可以推测稻谷蛋白质代谢对其品质影响较大,蛋白质代谢减弱,特别是蛋白质分解代谢降低可能是导致稻谷陈化一个重要的原因。蛋白F04(B04)经鉴定为ADP-葡萄糖焦磷酸化酶大亚基,其在37和25 ℃非气调储藏条件下均表达下调(表1),而气调储藏其表达上调维持不变,这很好说明气调能较好维持淀粉合成代谢,从而控制稻谷劣化,延缓其陈化。
总之,稻谷在储藏过程中会产生差异蛋白,这些蛋白当中一部分目标蛋白与稻谷陈化密切相关,经鉴定分别为蛋白酶体亚基-1(B26、D09和F16),葡糖-1-磷酸腺苷酰基转移酶(C01和E07),ADP-葡萄糖焦磷酸化酶大亚基(B04和F04)和乙酰辅酶A(A06和C05),这些目标蛋白有潜力成为稻谷品质劣化程度的生物标示物(Biomarker)。
3 结 论
1)稻谷储藏过程中脂肪酸值增加,发芽率降低。而37 ℃储藏条件导致脂肪酸值增加更快,25 ℃+CO2气调储藏能降低脂肪酸增加。稻谷高温储藏致使稻谷发芽率下降更快,而CO2气调储藏能延缓稻谷发芽率下降。上述结果说明稻谷在储藏过程中品质易陈化,高温会导致陈化更加严重,而CO2气调储藏能减缓稻谷陈化。
2)高温能影响稻谷差异蛋白表达,产生更多差异蛋白。在同样储藏温度条件下,与非气调储藏比较,CO2气调储藏能一定程度降低稻谷差异蛋白的表达,减轻高温所导致的稻谷蛋白差异表达,对差异蛋白生物信息学进行分析,鉴定出4个目标蛋白,分别为蛋白酶体亚基-1(B26、D09和F16),葡糖-1-磷酸腺苷酰基转移酶(C01和E07),ADP-葡萄糖焦磷酸化酶(B04和F04)和乙酰辅酶A(A06和C05),将其与稻谷储藏过程品质变化规律相偶联,从蛋白质分子代谢视角发现高温储藏加速稻谷陈化,CO2气调储藏能延缓稻谷陈化。
[1] Houston D F. Rice: Chemistry and Technology[M]. American Minnesota: American Association of Cereal Chemists, 1972: 443-454.
[2] Tran T U, Suzuki K, Okadome H, et al. Detection of changes in taste of japonica and indica brown and milled rice (Oryza sativa L.) during storage using physicochemical analyses and a taste sensing system[J]. Journal of Agricultural and Food Chemistry, 2005, 53(4): 1108-1118.
[3] 徐凤英,黄木水,陈震,等. 稻谷烘干过程中的水分扩散特性与品质特性[J]. 农业工程学报,2016,32(15):261-267.
Xu Fengying, Huang Mushui, Chen Zhen, et al. Moisture diffusion characteristics and quality characteristics of rice during drying[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2016, 32(15): 261-267. (in Chinese with English abstract)
[4] Chen L B. Physiological character of hybrid rice seed and its storage tolerance[J]. Seed, 1994, 4(1): 19-21.
[5] Tran TU, Suzuki K, Okadome H, et al. Detection of changes in taste of japonica and indica brown and milled rice (Oryza sativa L.) during storage using physicochemical analyses and a taste sensing system[J]. Journal of Agricultural & Food Chemistry, 2005, 53(4): 1108-1118.
[6] 庞文渌. 高水分稻谷低温储藏技术的研究[J]. 粮食加工,2007,32(1):78-80.
Pang Wenlu. The research of storage high water rice by low temperature[J]. Grain Processing, 2007, 32(1): 78-80. (in Chinese with English abstract)
[7] 涂杰,兰盛斌,高影,等. CO2气调储藏和常规储藏籼稻谷品质比较[J]. 粮食储藏,2003,32(6):31-33.
Tu Jie, Lan Shengbin, Gao Ying. et al. Comparision of the quality of Long-grain rice between CA storage and conventional storage[J]. Grain Storage, 2003, 32(6): 31-33. (in Chinese with English abstract)
[8] Zhou Z, Robards K, Helliwell S, et al. Ageing of stored rice: changes in chemical and physical attributes[J]. Journal of Cereal Science, 2002, 35(1): 65-78.
[9] Chrastil J, Zarins Z M. Influence of storage on peptide subunit composition of rice oryzenin[J]. Journal of Agricultural and Food Chemistry, 1992, 40(6): 927-930.
[10] Hamaker B R, Griffin V K. Effect of disulfide bond-containing protein on rice starch gelatinization and pasting[J]. Cereal Chemistry, 1993, 70(4): 927-930.
[11] Pedreschi R, Hertog M, Lilley K S, et al. Proteomics for the food industry: opportunities and challenges[J]. Critical Reviews in Food Science and Nutrition, 2010, 50(7): 680-692.
[12] Carbonaro M. Proteomics: Present and future in food quality evaluation[J]. Trends in Food Science & Technology, 2004, 15(3): 209-216.
[13] Han J Z, Wang Y B. Proteomics: present and future in food science and technology[J]. Trends in Food Science & Technology, 2008, 19(1): 26-30.
[14] 罗海波,姜丽,包永华,等. 茭白冷藏期间蛋白质表达谱的变化[J]. 农业工程学报,2014,30(1):285-292.
Luo Haibo, Jiang Li, Bao Yonghua, et al. Changes of protein profile in Zizania latifolia during cooling storage[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2014, 30(1): 285-292. (in Chinese with English abstract)
[15] Komatsu S, Ahsan N. Soybean proteomics and its application to functional analysis[J].Journal of Proteomics, 2009, 72(3): 325-336.
[16] Picard B, Lefèvre F, Lebret B. Meat and fish flesh quality improvement with proteomic applications[J]. Animal Frontiers, 2012, 2(4): 18-25.
[17] Qiu N, Ma M, Cai Z, et al. Proteomic analysis of egg white proteins during the early phase of embryonic development[J]. Proteomics. 2012,75(6): 1895-1905.
[18] Gao J, Fu H, Zhou X, et al. Comparative proteomic analysis of seed embryo proteins associated with seed storability in rice (Oryza sativa L) during natural aging[J]. Plant Physiol Biochem, 2016, 103(1): 31-44.
[19] 任为聪,程建军,张智宇,等. 不同改性方法对蛋白质溶解性的影响研究进展[J]. 中国粮油学报,2011,8:123-128.
Ren Weicong, Cheng Jianjun, Zhang Zhiyu, et al. Study on different modification methods on solubility properties of protein[J]. Journal of the Chinese Cereals and Oils Association, 2011, 8: 123-128. (in Chinese with English abstract)
[20] 丁承强,马丹,王绍华,等. 水稻蛋白质组双向电泳优化流程及方法[J]. 植物学报,2011,46(1):67-73.
Ding Chengqiang, Ma Dan, Wang Shaohua, et al. Optimization process and method of 2-D electrophoresis for rice proteomics[J]. Chinese Bulletin of Botany, 2011, 46(1): 67-73. (in Chinese with English abstract)
[21] Park C E, Kim Y S, Park K J, et al. Changes in physicochemical characteristics of rice during storage at different temperatures[J]. Journal of Stored Products Research, 2012, 48(1): 25-29.
[22] 张美玲. 稻谷储藏品质变化规律与其挥发性物质挥发规律相关性研究[D]. 南京:南京财经大学,2012.
Zhang Meiling. Research on the Law of Rice Quality Change and the Relativity with Rice Volatile Matters[D]. Nanjing: Nanjing University of Finance and Economics, 2012. (in Chinese with English abstract)
[23] 龚莹,彭少丹,汪骞,等. 乙酰辅酶A羧化酶的结构•功能及基因的研究进展[J]. 安徽农业科学,2010,38(35):19893-19896.
Gong Ying, Peng Shaodan, Wang Qian, et al. Research progress on the structure Function of acetyl-CoA carboxylase and its genes[J]. Journal of Anhui Agricultural Sciences, 2010, 38(35): 19893-19896. (in Chinese with English abstract)
[24] 施利利,张欣,丁得亮,等. 陈化稻米的主要品质指标的变化研究[J]. 食品科技,2014,39(10):166-169.
Shi Lili, Zhang Xin, Ding Deliang, et al. Comparison of physicochemical properties between new rice and stored rice varieties[J]. Food Science and Technology, 2014, 39(10): 166-169. (in Chinese with English abstract)
[25] 王琦环. 丙酮酸脱氢酶复合酶系研究进展[J]. 包头钢铁学院学报,2004,23(1):93-96.
Wang Qihuan. Development of pyrurate dehydrogenase complex[J]. Journal of Baotou University of Iron and Steel Technology, 2004, 23(1): 93-96. (in Chinese with English abstract)
[26] Okita T W. Is there an alternative pathway for starch synthesis?[J]. Plant Physiology, 1992, 100: 560-564.
[27] Sweetlove L J, Muller-rober B, Will Mitzer L.et al. The contribution of AGPP to the control of starch synthesis in potato tubers[J]. Planta, 1999, 20(9): 330-337.
[28] 徐民,程旺大,蔡新华,等. 储藏对稻米淀粉结构及含量的影响[J]. 中国农学通报,2005,21(6):113-115.
Xu Min, Cheng Wangda, Cai Xinhua, et al. Effect of storage on starch structure and content in rice grain[J]. Chinese Agricultural Science Bulletin, 2005, 21(6): 113-115. (in Chinese with English abstract)
[29] 吴莉莉,李琦,熊宁,等. 不同储藏条件对稻谷直链淀粉含量变化的影响[J]. 粮食与饲料工业,2015,12:27-30.
Wu Lili, Li Qi, Xiong Ning, et al. Change of amylase content in paddy under different storage condition[J]. Cereal & Feed Industry, 2015, 12: 27-30. (in Chinese with English abstract)
[30] 权萌萌,鞠兴荣,石嘉怿. 稻谷蛋白质氧化及其对稻谷陈化品质的影响[J]. 粮食与饲料工业,2015,8:9-13.
Quan Mengmeng, Ju Xingrong, Shi Jiayi. Effect of protein oxidation on aging quality of rice[J]. Cereal & Feed Industry, 2015, 8: 9-13. (in Chinese with English abstract)
[31] 孙鹏,刘淼,冯利兴,等. 蛋白酶体结构和活性调节机制的研究进展[J]. 生物化学与生物物理进展,2015,42(12):1084-1093.
Sun Peng, Liu Miao, Feng Lixing, et al. Progress in study of clarifying the structure and the mechanisms that regulate the activity of the proteasome[J]. Progress in Biochemistry and Biophysics, 2015, 42(12): 1084-1093. (in Chinese with English abstract)
Molecular mechanism of rice aging during different storage conditions based on protein levels
Sun Shuguo, Wang Ruohui, Lin Qinlu※, Jiang Chunyan, Ding Yuqin, Cao Jianzhong
(/410004,)
In this study, proteomics technology was used to study the molecular mechanism of rice grain stored under different conditions. The changes in the proteomic profiles of rice during storage at 37oC, 25oC, 25°C and CO2controlled atmosphere were analyzed; the effects of temperature and CO2controlled atmosphere storage on the quality of rice grain were also investigated. The results showed that a total of 125 differentially expressed proteins in the process of rice storage were detected and 37 protein spots were identified by mass spectrometry. According to the function of protein, the 37 identified proteins can be divided into five groups: metabolic (45.9%), cell structure (29.7%), stress (2.7%), functional protein (5.4%), and unclassified proteins (16.3%). We identified four groups of the target proteins, respectively expressed by the down-regulate proteasome subunit beta 1 (B26, D09 and F16), the up-regulate glucose-1-adenosine phosphate acyltransferase (C01 and E07), the down-regulate ADP-glucose pyrophosphorylase large subunit (B04 and F04), and the up-regulate acetyl coenzyme A (A06 and C05). The functional properties of these differentially expressed proteins and their essential role in plant metabolism were evaluated according to the bioinformatics method, combined with the analysis of changes in physicochemical properties of rice during storage under different conditions. The results indicated that high temperature storage led to a higher level of differential protein expression in rice. The appearance of numerous differential protein expressions might disturb glucose metabolism, which reduced the synthesis of the starch granule. In rice, high temperature storage resulted in a reduction of antioxidant activity of key enzymes and proteins and an increase of free fatty acid, the antioxidant activity played an important role in the prevention of protein, starch, and lipid oxidation and the reduction in the aging degree of rice. High temperature storage of rice might disturb protein metabolism and brought about a decrease in catabolism for protein degradation. The greater changes of protein expression, antioxidant activity, glucose metabolism, free fatty acid, and protein metabolism in rice at higher temperature might contribute to a fast deterioration of rice quality and a rapid aging of rice. Thus, functional analysis of these differentially expressed proteins showed that the high temperature promoted the differential protein expressions in rice at the molecular level, which could lead to the aging of the rice, and the mechanism of rice aging might involve glucose metabolism, protein decomposition, fat hydrolysis and oxidation. In our experiment, the surprising finding was that low-oxygen high-carbon dioxide controlled atmosphere storage of rice could effectively reduce the level of differential protein expression under high temperature conditions. Protein metabolism in rice stored during controlled atmosphere storage with carbon dioxide could be to a certain extent maintained at normal levels, disorders of glucose metabolism in rice was effectively suppressed by the low-oxygen high-carbon dioxide controlled atmosphere storage of rice. At the same time, the metabolism on the levels of starch synthesis tended to be normal and natural aging-related biochemical changes in rice were reduced, which thus delayed the process of quality deterioration in rice at high temperature. Our study provides new research ideas and methods for rice storage.
proteins; storage; quality control; proteomics; aging; rice
10.11975/j.issn.1002-6819.2017.18.036
TS205; Q816; S645.2
A
1002-6819(2017)-18-0277-08
10.11975/j.issn.1002-6819.2017.18.036 http://www.tcsae.org
2017-06-19
2017-09-03
湖南省重点研发计划项目(2016NK2146);国家自然科学基金面上项目(31571874);长沙市科技计划重点项目(k1508009-21)。
孙术国,湖南新邵人,副教授,博士,主要研究方向为食品贮藏保鲜。Email:sshuguo@163.com
林亲录,湖南洞口人,教授,博士,博士生导师,主要研究方向为粮食加工和贮藏保鲜。Email:linql0403@126.com
——专访中国食品工业协会食品物流专业委员会副会长张签名

