FOXC2在非小细胞肺癌细胞株及组织中的表达及意义
刘曙光,章思思,邹振宁,马红梅,周有俭
(1.中山大学附属第八医院病理科,广东 深圳 518033;2.南方医科大学病理学系,广东 广州 510515;3.广东医科大学病理教研室,广东 湛江 524023)
FOXC2在非小细胞肺癌细胞株及组织中的表达及意义
刘曙光1,章思思2,邹振宁3,马红梅1,周有俭1
(1.中山大学附属第八医院病理科,广东 深圳 518033;2.南方医科大学病理学系,广东 广州 510515;3.广东医科大学病理教研室,广东 湛江 524023)
目的研究叉头框C2(Forkhead box c2,FOXC2)在人非小细胞肺癌(non small cell lung cancer,NSCLC)细胞株和组织中的表达水平,并探讨FOXC2与临床病理因素的相关性。方法应用RT-PCR方法检测FOXC2在人肺癌细胞株A549和H460中mRNA水平的表达情况,并与永生化人支气管上皮细胞株16HBE进行比较;应用免疫组化(IHC)方法检测FOXC2蛋白在66例NSCLC组织和8例癌旁肺组织中的表达情况,并分析FOXC2表达与NSCLC患者临床病理因素的关系。结果肺癌细胞株A549和H460中FOXC2的mRNA表达水平高于永生化人肺上皮细胞株,差异有统计学意义(P<0.05); FOXC2蛋白在NSCLC组织中表达高于癌旁组织,与肺癌组织淋巴结转移密切相关(P<0.05),而与患者年龄、性别、吸烟、组织学类型、分化程度和TNM分期无明显相关(P>0.05)。结论FOXC2可能在促进NSCLC的发生和发展过程中发挥了重要的作用,有望作为评估临床肺癌患者预后的指标。
非小细胞肺癌;FOXC2;细胞株;免疫组织化学
肺癌是最常见的恶性肿瘤,其发生率和死亡率均占首位,其中非小细胞肺癌(non small cell lung cancer,NSCLC)约占所有肺癌的80%。NSCLC发生与发展是一个多步骤、多因素的过程,涉及众多癌基因和抑癌基因。叉头框C2(Forkhead box c2,FOXC2)与多种恶性肿瘤相关,但与肺癌关系的研究仍处于起步阶段。本实验初步探讨了FOXC2在NSCLC癌发生发展中可能的作用。
1 材料与方法
1.1主要材料
人非小细胞肺癌细胞株A549、H460和永生化人支气管上皮细胞株16HBE均来自南方医科大学病理系重点实验室。1640培养基、胎牛血清FBS 及胰蛋白酶(HyClone公司);逆转录试剂盒(Thermo公司);荧光实时定量PCR检测试剂盒(全式金公司)。肺癌组织学标本来自2008 年6 月至2014 年8 月中山大学附属第八医院病理科和广东医科大学病理学教研室共66例患者,术前均未接受放疗或化疗。病例包括男性48例,女性18例;年龄<60岁35例,≥60岁31例;有吸烟史40例,无吸烟史26例;鳞癌21例、腺癌45例;高中分化34例,低分化32例;淋巴结转27例,无淋巴结转移39例;TNM分期I期15例,II+Ⅲ51例。选取同期8例癌旁肺组织作对照。
1.2细胞培养
细胞选用PRIM 1640 培养液进行培养,培养条件:置于37 ℃、CO2体积分数为5%的培养箱中培养。根据细胞生长情况每2~3 d换液培养1次,当细胞覆盖瓶底壁大部分表面时,进行细胞传代或收集细胞。
1.3 qRT-PCR检测不同细胞株中FOXC2表达
采用RNA 抽提试剂盒抽提16HBE、A549和H460细胞中总RNA,逆转录合成cDNA保存于-80 ℃冰箱中备用。FOXC2定量PCR上游引物: CCTCCTGGTATCTCAACCACA;下游引物:GAGGGTCGAGTTCTCAATCCC。PCR扩增反应体系为20 μL,其中包括PCR primers 2 μL,2×SYBR Mix 10 μL,RTproduct 2.0 μL,Rox 0.1 μL,蒸馏水5.9 μL。以U6为内参,所测定的FOXC2的相对表达量采用2-ΔΔCt表示。
1.4免疫组化方法
所有组织均经10%甲醛固定,常规石蜡包埋后行4 μm 连续切片,每例均行HE染色和免疫组织化学染色。采用免疫组织化学SP 法检测组织中FOXC2表达。FOXC2单克隆抗体购于Abcam公司,抗体稀释比例1∶100。以PBS替代一抗做阴性对照,按试剂盒说明书步骤进行。
1.5染色结果判断
FOXC2为胞浆或细胞核着色。随机选择5个高倍镜视野(400 倍)细胞计数,按染色强度和染色细胞所占百分比对每例染片进行综合评分,染色强度判分标准:细胞未着色为0 分、浅黄色为1分、棕黄色为2分、棕褐色为3分。阳性细胞所占百分比判分标准:阳性细胞<5%为0分;5%~25%为1分、26%~50%为2分、51%~75%为3分;>75% 为4分。以染色强度与阳性细胞百分比评分之和作为染色结果的判定,阴性或低表达:0~3分;高表达:≧4分[1]。
1.6统计学分析
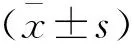
2 结果
2.1 FOXC2在肺细胞株中的表达情况
Real-time PCR 检测两种肺癌细胞株及永生化人支气管上皮细胞株16HBE FOXC2的表达, 结果发现FOXC2在两种细胞株中的表达均明显高于16HBE(均P<0.05),见图1。
2.2 FOXC2在肺癌组织中的表达与肺癌病理因素相关性
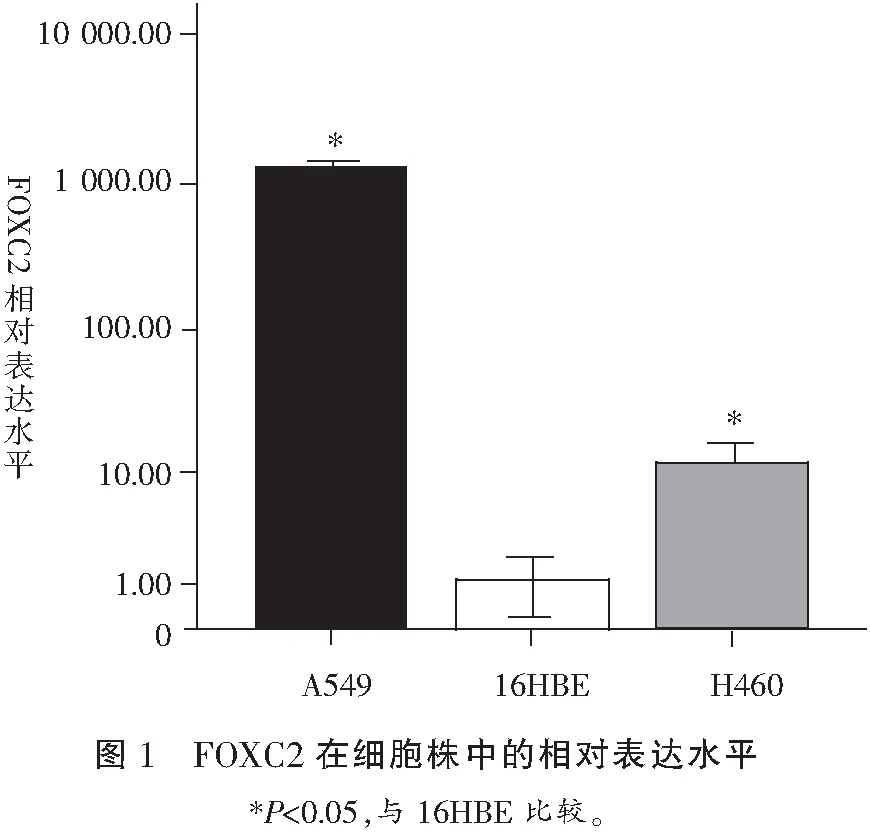
癌旁肺组织中FOXC2蛋白不表达或仅有少量表达(图2A)。在NSCLC组织中的主要显示胞浆阳性(图2B、2C),其阳性表达率为31.82%;FOXC2蛋白表达水平与肺癌组织淋巴结转移密切相关(P<0.05),而与患者年龄、性别、吸烟、组织学类型、分化程度和TNM分期无明显相关(P>0.05)。见表1。

表1 FOXC2表达与肺癌各项病理因素相关性(例)
3 讨论
肺癌是肿瘤所致死亡的首要原因,NSCLC约占总数的85%。尽管在治疗策略上有了很大的进展,但肺癌患者的预后仍然很差,5年生存率小于15%。肺癌的发生是一个多步骤、多阶段和多基因参与的过程,在此过程中常常伴有癌基因激活、抑癌基因失活、凋亡调节基因、DNA修复基因改变以及端粒酶活性的增加。肺癌的转移机制也十分复杂,涉及癌细胞和宿主两方面之间的相互作用,细胞黏附下降、细胞运动能力增强、细胞骨架改变、上皮间质转化、肿瘤微环境的变化等在转移的过程中发挥着重要的作用。虽然现阶段已知有很多癌基因和抑癌基因如Kras、EGFR、P53等参与了NSCLC 的发生、发展,但针对NSCLC的异常信号通路研究及靶向治疗还处于初始阶段,这就提示我们寻找新的有意义的分子标记物,对预测患者预后,开发有效的治疗措施、提高NSCLC的生存率具有重要的临床价值和社会效益。
FOXC2属叉头框(Forkhead box,Fox)蛋白家族的一员。FOX蛋白家族是一类DNA 结合区具有翼状螺旋结构的转录因子,至少有34个家族成员,其功能涉及发育、细胞周期、脂类代谢等生物学特性[2]。文献报道FOXC2可通过激活起动子直接诱导CXCR4和integrin-β3转录,促进血管和淋巴管生成[3]。FOXC2还可通过诱导Wnt5a基因调节骨母细胞分化[4]。多项研究显示,FOXC2在胃癌[1]、乳腺癌[5]、食管癌[6]等多种肿瘤中表达异常,FOXC2高表达与肝外胆管癌[7]、胃癌[1]和乳腺基底样细胞癌[8]临床进展和不良预后有关。近年来的研究表明上皮间质转化(epithelial-mesenchymal transition,EMT)与肿瘤的迁移和侵袭能力密切相关,是肿瘤细胞发生转移中被激活的关键过程。相关研究发现,FOXC2是EMT的重要调节者,在乳腺基底细胞癌中,FOXC2可诱导EMT的转录因子Twist,Snail,Goosecoid和转化生长因子β1表达,FOXC2的过表达还能促进间质分化,并诱导MMP2和MMP9的表达[8-9]。EMT也在NSCLC的发生、发展和转移的过程中扮演着重要角色,其中FOXC2参与了这一重要的过程[10]。Mortazavi 等[11]证明FOXC2 在NSCLC细胞直接下调p120-catenin 的表达量来影响E-cad 的作用,导致细胞间粘附稳定性缺失,上皮细胞极性丧失,EMT 发生。
本实验结果显示,FOXC2在肺癌细胞株A549和H460中mRNA的表达水平明显高于永生化人支气管上皮细胞株16HBE,提示FOXC2基因可能参与了肺癌的发生发展。免疫组化则显示,FOXC2 在肺癌组织伴淋巴结转移组病例中表达率增高,推测与其两作用机制有关:(1)FOXC2可促进血管和淋巴管生成,有助于肺癌细胞淋巴结转移;(2)FOXC2参与EMT的发生,促进转移。尽管有文献报道FOXC2蛋白表达与TNM分期、吸烟史和患者生存期相关,本实验受样本量少、缺少随访资料等条件限制,未能观察到上述结论,但根据现有结果初步推断过表达的FOXC2很有可能参与了肺癌的淋巴结转移,预示患者有不良预后。
综上所述,本实验结果表明,FOXC2可能参与NSCLC的发生、进展和转移;检测FOXC2 表达有助于判断患者的病情进展,也为寻找NSCLC的预后指标提供了新方向。
[1] Zhu JL,Song YX,Wang ZN,etal.The clinical significance of mesenchyme forkhead 1 (FoxC2) in gastric carcinoma[J].Histopathology,2013,62(7):1038-1048.
[2] Carlsson P,Mahlapuu M.Forkhead transcription factors:key players in development and metabolism[J].Dev Biol,2002,250(1):1-23.
[3] Hayashi H,Sano H,Seo S,etal.The Foxc2 transcription factor regulates angiogenesis via induction of integrin beta3 expression[J].J Biol Chem,2008,283(35):23791-23800.
[4] Park SJ,Gadi J,Cho KW,etal.The forkhead transcription factor Foxc2 promotes osteoblastogenesis via up-regulation of integrin β1 expression[J].Bone,2011,49(3):428-438.
[5] Mani SA,Yang J,Brooks M.Mesenchyme Forkhead 1 (FOXC2) plays a key role in metastasis and is associated with aggressive basal-like breast cancers[J].Proc Natl Acad Sci USA,2007,104(24):10069-10074.
[6] Nishida N,Mimori K,Yokobori T,etal.FOXC2 is a novel prognostic factor in human esophageal squamous cell carcinoma[J].Ann Surg Oncol,2011,18(2):535-542.
[7] Watanabe A,Suzuki H,Yokobori T,etal.Forkhead box protein C2 contributes to invasion and metastasis of extrahepatic cholangiocarcinoma,resulting in a poor prognosis[J].Cancer Sci,2013,104(11):1427-1432.
[8] Li Y,Yang W,Yang Q,etal.Nuclear localization of GLI1 and elevated expression of FOXC2 in breast cancer is associated with the basal-like phenotype[J].Histol Histopathol,2012,27(4):475-484.
[9] Hollier BG,Tinnirello AA,Werden SJ,etal.FOXC2 expression links epithelial-mesenchymal transition and stem cell properties in breast cancer[J].Cancer Res,2013,73(6):1981-192.
[10] Jiang W,Pang XG,Wang Q,etal.Prognostic role of Twist,Slug,and Foxc2 expression in stage I non-small-cell lung cancer after curative resection[J].Clin Lung Cancer,2012,13(4):280-287.
[11] Mortazavi F,An J,Dubinett S,etal.p120-catenin is transcriptionally downregulated by FOXC2 in non-small cell lung cancer cells[J].Mol Cancer Res,2010,8(5):762-774.
ExpressionofFOXC2incelllinesandtissuesofnonsmallcelllungcanceranditsclinicalsignificance
LIU Shu-guang1,ZHANG Si-si2,ZOU Zhen-ning3,MA Hong-mei1,ZHOU You-jian1
(DepartmentofPathology,1.TheEighthAffiliatedHospital,SunYat-senUniversity,Shenzhen518033;2.SouthernMedicalUniversity,Guangzhou510515;3.DepartmentofPathology,GuangdongMedicalCollege,Zhanjiang524023,Guangdong,China)
Objective:To explore the expression of FOXC2 in NSCLC cell lines and tissues,and analyze the correlation between FOXC2 protein expression and clinicopathological factors.MethodsThe expressions of FOXC2 mRNA in NSCLC cell lines A549 and H460 were detection by RT-PCR,and 16HBE cell line were compared,Then,the expression of FOXC2 proteins in 66 non small cell lung cancer tissues and 8 paracancerous tissues were determined with immunohistochemical study,and the relationship between the expression of FOXC2 and clinical pathological factors in NSCLC patients was analyzed.ResultsThe expression levels of FOXC2 mRNA in A549 and H460 cell lines were significantly higher than that in 16HBE cell line,and the difference was statistically significant(P<0.05).The expression of FOXC2 protein in NSCLC was higher than that in paracancerous tissues,and was closely related to lymph node metastasis in lung cancer tissues (P<0.05),but was not related to age,gender,smoke history,histological type,differentiation and TNM stage.ConclusionFOXC2 overexpression may play an important role in the malignant progression of NSCLC,and may be used as an index to evaluate the prognosis of patients with lung cancer.
Non small cell lung cancer;FOXC2;Cell line;Immunohistochemistry
10.3969/j.issn.1005-3697.2017.05.002
深圳市福田区卫生公益性科研项目(FTWS2015017)
2017-05-28
刘曙光(1971-),男,博士,副主任医师。E-mail:SGL3016@163.com
时间: 2017-10-10 02∶27
http://kns.cnki.net/kcms/detail/51.1254.R.20171010.0227.006.html
1005-3697(2017)05-0656-03
R734.2
A
(学术编辑何欣蓉)
本刊网址:http://www.nsmc.edu.cn作者投稿系统http://noth.cbpt.cnki.net邮箱xuebao@nsmc.edu.cn

