Sonic Hedgehog信号通路分子及胰岛素增强子结合蛋白在小鼠胚胎心流出道发育的早期表达
李慧超,师 亮,杨艳萍,马玉祥,于翠萍
(1长春医学高等专科学校人体解剖学教研室,长春 130031;2山西医科大学组织学与胚胎学教研室;*通讯作者,E-mail:lhc1304@163.com)
SonicHedgehog信号通路分子及胰岛素增强子结合蛋白在小鼠胚胎心流出道发育的早期表达
李慧超1*,师 亮2,杨艳萍2,马玉祥1,于翠萍1
(1长春医学高等专科学校人体解剖学教研室,长春 130031;2山西医科大学组织学与胚胎学教研室;*通讯作者,E-mail:lhc1304@163.com)
目的 探讨胰岛素增强子结合蛋白(ISL-1)及音速波状蛋白(Sonic Hedgehog,Shh)信号通路分子在小鼠胚胎心流出道的早期表达特点与其发育的关系。 方法 取胚龄8-13 d小鼠胚胎心脏40例制作连续石蜡切片,应用抗音速波状蛋白(Shh)、抗Smoothened(Smo)、抗Patched(Ptc1)、抗Patched 2(Ptc2)、抗ISL-1、抗心肌肌球蛋白重链(MHC)、抗α-平滑肌肌动蛋白(α-SMA)抗体进行免疫组织化学及免疫荧光化学染色。 结果 胚龄8-9 d,Shh阳性表达于前肠腹侧内胚层,Ptc1和Ptc2在心管心肌呈较强阳性表达,ISL-1阳性细胞自心包腔背侧壁、前肠两侧间充质延伸至心管动脉端。胚龄10-13 d,前肠内胚层向腹侧延伸形成喉气管沟,并呈Ptc1和Ptc2强阳性表达,ISL-1和Smo双阳性细胞围绕喉气管沟形成对称的锥体形结构,其顶端突入动脉囊腔,形成主肺动脉隔,随发育进行,主肺动脉隔由ISL-1阳性表达逐渐转为α-SMA强阳性表达,并将动脉囊分隔为MHC阴性的心包内升主动脉和肺动脉干。 结论 Shh信号通路与ISL-1阳性细胞共同参与小鼠胚胎心流出道的正常形态发生。
胰岛素增强子结合蛋白; 音速波状蛋白; 心流出道; 胚胎发育; 小鼠
Sonic Hedgehog(Shh)信号转导通路在胚胎多种器官发育过程中发挥作用[1],Shh是该信号通路重要的分泌型配体,表达于脊索、底板和腹侧前肠内胚层,Smo是Shh信号传递所必需的受体[2],Ptc1是胚胎发育过程中Shh的主要受体,Ptc1根据组织中是否存在Shh配体从而调节Smo的活性[3]。基因敲除内胚层Shh基因和Smo基因,小鼠胚胎心脏形态发生异常[2,4]。胰岛素增强子结合蛋白(ISL-1)基因敲除小鼠胚胎右心室、大部分心房组织及心管流出道缺失,胚胎于第9天死亡,故ISL-1是心肌前体细胞重要的标记蛋白[2,5,6]。有研究表明,全基因敲除小鼠ISL-1基因,内胚层Shh基因表达下调,提示ISL-1可能与Shh相互作用,调控第二生心区的发育、增生及特异性的保持[7]。本研究旨在观察正常小鼠胚胎心脏发育过程中,Shh信号通路分子及转录因子ISL-1在心流出道发育早期的表达特点。
1 材料和方法
1.1 实验动物
8-12周龄雌性昆明小鼠40只(山西医科大学实验动物中心提供,生产许可证号:SCXK2009-0001),体质量25-30 g,与同种雄鼠合笼过夜,次晨发现阴栓者为妊娠0.5 d。收集40例8-13 d胚胎,制作6 μm厚连续石蜡切片。每隔6片取1片做HE染色。
1.2 主要试剂
山羊抗Ptc1多克隆抗体、抗Ptc2多克隆抗体、抗Smo多克隆抗体(Santa Cruz,美国),小鼠抗Shh单克隆抗体(Developmental Studies Hybridoma Bank,美国)、小鼠抗MHC单克隆抗体(Upstate,美国)、小鼠抗α-SMA(Sigma,美国)单克隆抗体,兔抗ISL-1(ABcam,英国)多克隆抗体,兔抗羊IgG(武汉博士德生物工程有限公司),兔抗小鼠IgG(荷兰阿姆斯特丹大学解剖学教研室Lamers WH教授赠送),羊抗兔IgG(Lamers WH教授赠送),兔过氧化物酶抗过氧化物酶复合物(Lamers WH教授赠送),混合二抗:Cy3—驴抗山羊IgG(康为世纪生物有限公司)和FITC—驴抗兔IgG(Santa Cruz公司,美国)。
1.3 免疫组织化学染色方法
切片经脱蜡、水化后,3%过氧化氢和TENG-T[8,9]各封闭30 min。处理后切片分别用山羊抗Ptc1(1 ∶100)、抗Ptc2(1 ∶50)、抗Smo(1 ∶150)多克隆抗体,小鼠抗Shh(1 ∶40)单克隆抗体、抗MHC(1 ∶1 000)单克隆抗体、抗α-SMA(1 ∶1 000)单克隆抗体,兔抗ISL-1(1 ∶200)多克隆抗体室温孵育过夜。依次经兔抗羊IgG(1 ∶1 500)或兔抗小鼠IgG(1 ∶7 500)、羊抗兔IgG(1 ∶250)和兔过氧化物酶-抗过氧化物酶复合物(1 ∶750)分别孵育[10]。DAB显色,脱水,透明,封片。
1.4 免疫荧光化学染色方法
切片脱蜡、水化、封闭处理后,兔抗ISL-1(1 ∶100)多克隆抗体与抗Smo(1 ∶50)多克隆抗体混合,切片室温孵育过夜。混合二抗孵育,复染,封片,Leica荧光显微镜照相,Confocal Assistant软件处理。
2 结果
2.1 Shh信号通路分子在流出道发育早期的分布规律
胚龄8 d,直管状的原始心管借心背系膜续于前肠腹侧间充质,Shh受体Ptc1和Ptc2在原始心管心肌较强表达(见图1A,1B),Smo自胚龄8-13 d广泛表达于各胚层细胞。胚龄9 d,原始心管弯曲成襻,前肠内胚层可见Shh阳性表达(见图2),其腹侧间充质细胞数量仍较少。胚龄10 d,前肠腹侧间充质增多,前肠腹侧壁内胚层增厚,突入间充质形成喉气管沟雏形,并呈Ptc1和Ptc2阳性表达(见图3A),流出道长度增加,其动脉端为动脉囊。胚龄11 d,前肠发育为背腹方向的长椭圆形管腔结构,喉气管沟继续发育,其腹侧顶端形成实心内胚层细胞索,向动脉囊背侧壁延伸,前肠腹侧较厚的内胚层上皮和实心内胚层细胞索呈较强的Ptc1、Ptc2阳性表达(见图4A,4B),免疫荧光双染色可见,ISL-1阳性细胞同时表达Smo(见图4D)。胚龄11.5 d,逐渐形成的气管食管隔将前肠分隔为背侧的食管和腹侧的气管(见图5A),至胚龄12 d,气管食管隔在流出道水平已将气管与食管完全分离,气管腹侧仍可见Ptc1和Ptc2阳性的短粗内胚层细胞索(见图6A)。变短粗的细胞索周围ISL-1阳性锥体形结构细胞(见图6B),亦呈Smo阳性表达(见图6C),锥体顶端伸向主肺动脉隔。胚胎发育第13天,气管腹侧内胚层细胞索消失,Ptc1和Ptc2在完整的气管上皮上不表达(见图7A),气管腹侧ISL-1阳性间充质细胞密度显著降低(见图7B)。

A. Ptc1染色; B. Ptc2染色,Ptc1和Ptc2均在原始心管显较强表达; C. ISL-1染色,阳性表达于前肠两侧间充质、心包腔背侧壁脏壁中胚层及流出道远端壁; D. MHC染色,于流出道远端壁阳性表达; fg:前肠,ht:心管,pc:心包腔,dm:心背系膜,spm:脏壁中胚层图1 胚龄8 d心横切面免疫组织化学染色Figure 1 Immunohistochemistry of transversal sections of the mouse embryonic heart at ED8
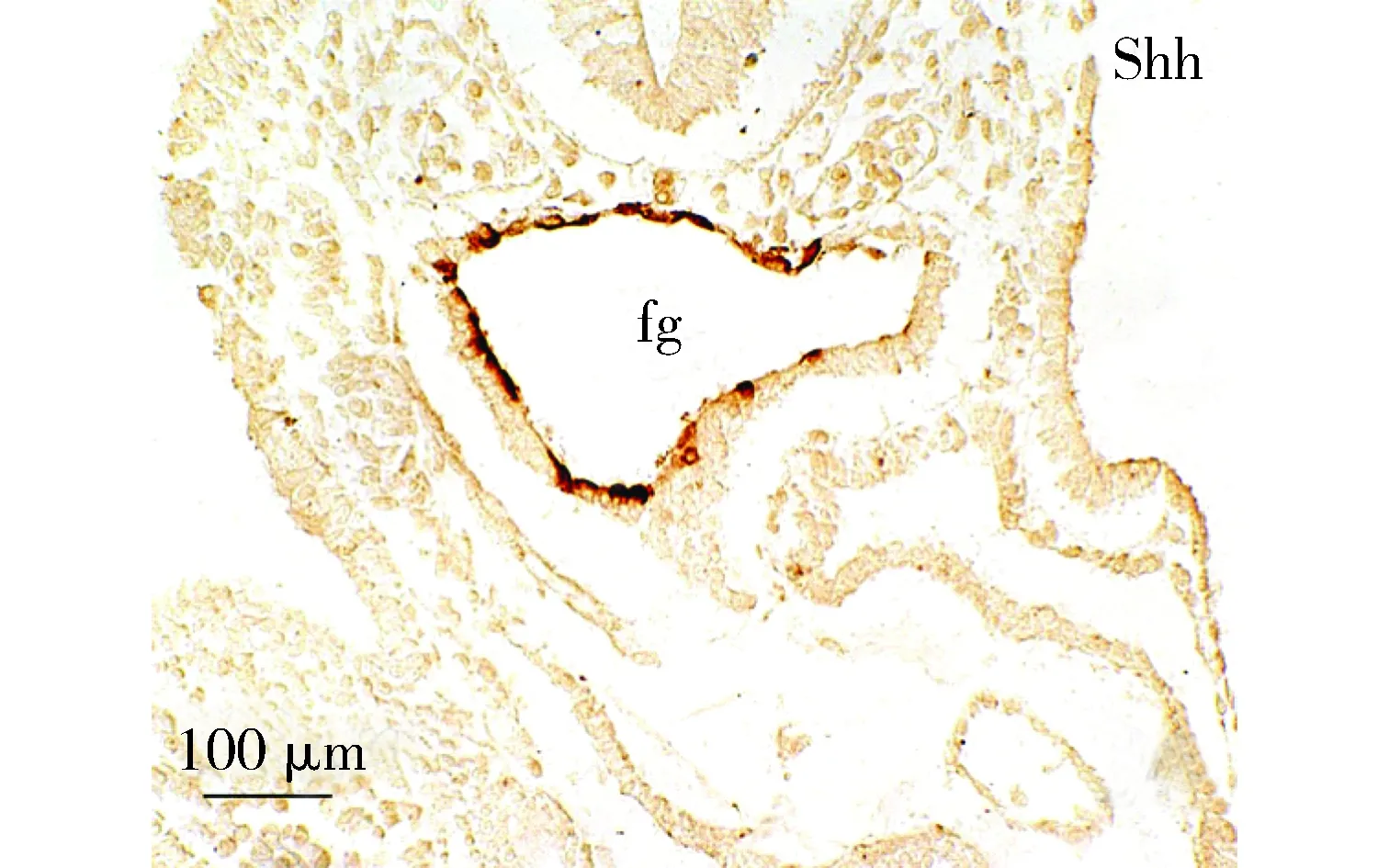
Shh染色,于前肠内胚层阳性表达; fg:前肠图2 胚龄9 d心横切面免疫组织化学染色Figure 2 Immunohistochemistry of transversal sections of the mouse embryonic heart at ED9

A. Ptc1染色; B. ISL-1染色,前肠腹侧ISL-1阳性间充质细胞数量增多,伸入动脉囊腔; fg:前肠图3 胚龄10 d心横切面免疫组织化学染色Figure 3 Immunohistochemistry of transversal sections of the mouse embryonic heart at ED10

A,B.分别为Ptc1和Ptc2免疫组织化学染色,均于前肠腹侧内胚层上皮和实心内胚层细胞索呈较强表达,箭头为实心内胚层细胞索; C. ISL-1免疫组织化学染色; D. ISL-1与Smo免疫荧光化学染色,ISL-1阳性细胞同时表达Smo图4 胚龄11 d心横切面免疫组织化学及免疫荧光化学染色Figure 4 Immunohistochemistry and immunofluorescence of transversal sections of the mouse embryonic heart at ED11
2.2 ISL-1阳性细胞与流出道发育关系
胚龄8-9 d,ISL-1阳性细胞分布于前肠两侧间充质及心包腔背侧壁脏壁中胚层(见图1C),延续至流出道远端,参与流出道的延长。MHC阳性表达于流出道远端壁的心肌中(见图1D)。胚龄10-11 d,前肠腹侧ISL-1阳性间充质细胞数量逐渐增多(见图3B、4C),并伸入动脉囊背侧壁,形成主肺动脉隔原基,与发育中的心内膜垫相延续,在流出道远端壁逐渐失去MHC阳性表达。胚龄12 d,主肺动脉隔将动脉囊分隔为MHC阴性的心包内升主动脉和肺动脉干,其自身表达由ISL-1阳性变为α-SMA强阳性(见图6B、6D、6E)。

箭头示气管食管隔;es:食管;t:气管图5 胚龄11.5 d心横切面HE染色Figure 5 HE staining of transversal sections of the mouse embryonic heart at ED11.5
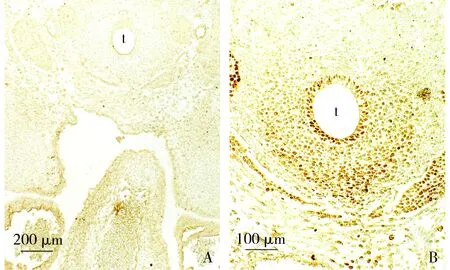
A. Ptc1染色,于气管上皮表达消失; B. ISL-1染色,于气管腹侧阳性细胞密度明显降低;t:气管图7 胚龄13 d心横切面免疫组织化学染色Figure 7 Immunohistochemistry of transversal sections of the mouse embryonic heart at ED13
3 讨论
近年研究表明,胚盘半月形的原始生心板构成第一生心区,其卷褶融合成的原始心管主要发育为左心室。第二生心区包括早期鳃弓核心间充质和覆盖在前肠内胚层腹侧的脏壁中胚层,通过发育中的心背系膜向原始心管添加心肌细胞,形成流出道、右心室及部分心房心肌[11-13]。本实验观察到,胚胎发育第8-9天,原始心管表达心肌早期分化特异性蛋白质MHC、α-SMA,在心管与心包腔背侧脏壁中胚层返折处,α-SMA与ISL-1表达重叠,提示ISL-1阳性心肌前体细胞开始向心肌细胞分化,而心包腔背侧脏壁中胚层上皮参与心肌的发育。有研究表明,前肠内胚层细胞能够分泌Shh信号分子[14,15],Ptc1、Ptc2和Smo都是与Shh配体结合发挥作用的重要组成部分,而此时Ptc1阳性细胞出现在前肠内胚层,与ISL-1阳性的第二生心区紧密相邻。胚龄第10天始,Ptc1阳性细胞逐渐集中于不断增生的前肠内胚层腹侧中央的上皮细胞并形成突起,随上皮细胞继续增生,突起变为Ptc1阳性的内胚层细胞索并逐渐延长,向喉气管沟发育,ISL-1阳性间充质细胞围绕喉气管沟形成特征性锥体结构[16],共同向动脉囊背侧壁方向生长,进而融合心内膜垫,向主肺动脉隔原基发育,开始分隔动脉囊腔,使主动脉和肺动脉分离。前肠腹侧内胚层细胞的增生和喉气管沟的发育,可能使内胚层分泌Shh信号分子的量增多,对ISL-1阳性间充质细胞的增生和扩展起到了促进作用,保证向流出道分化、迁移的心前体细胞数量充足。喉气管沟顶端的实心内胚层细胞索可能扩大了Shh信号的作用范围,或缩短了ISL-1阳性细胞与流出道的距离,有利于其向心动脉端迁移。胚龄11-12 d,已分隔的气管腹侧上皮及内胚层细胞索仍表达较强的Ptc1和Ptc2,免疫荧光双染色仍可见ISL-1与Smo双阳性的锥体形结构,顶端指向主肺动脉隔。MHC在流出道远端的阳性表达逐渐消失,而ISL-1与α-SMA同时表达于主动脉和肺动脉壁,提示ISL-1阳性细胞不再向心肌细胞转化,而是继续分化为平滑肌细胞,但升主动脉及肺动脉干壁未见Ptc1阳性表达,可能由于Shh信号通路调节前肠内胚层自身及其细胞索的发育是借助自分泌或旁分泌的方式[4],并与ISL-1阳性第二生心区间充质细胞偶联,参与流出道的分隔及延长。
本实验观察到,Smo散在分布于整个胚胎,但在前肠内胚层腹侧,Smo阳性细胞排列紧密,阳性较强。有研究报道,特异性敲除前肠内胚层Shh基因或条件性敲除ISL-1表达区域中的Smo基因,引起弓动脉发育不良、大动脉转位、动脉干永存,及肺动脉狭窄或闭锁、单流出道等流出道发育和分隔畸形[17],据此,我们认为产生此类流出道发育和分隔畸形可能由于ISL-1阳性锥体形结构和主肺动脉隔形成障碍,有待进一步研究。
[1] 史美艳,边雅敬,魏巍,等.吉西他滨介导胰腺癌细胞三磷酸腺苷结合转运体G2质膜移位诱发耐药的研究[J].现代药物与临床,2015,30(3):241-248.
[2] Hoffmann AD, Peterson MA, Friedland-Little JM,etal. Sonic hedgehog is required in pulmonary endoderm for atrial septation[J]. Development,2009,136(10):1761-1770.
[3] Cohen MM Jr. Hedgehog signaling update[J]. Am J Med Genet,2010,152A(8):1875-1914.
[4] Goddeeris MM, Schwartz R, Klingensmith J,etal. Independent requirements for Hedgehog signaling by both the anterior heart field and neural crest cells for outflow tract development[J]. Development,2007,134(8):1593-1604.
[5] Johnson RL, Tabin C. The long and short of hedgehog signaling[J]. Cell,1995,81(3):313-316.
[6] Golzio C, Havis E, Daubas P,etal. ISL-1 directly regulates FGF10 transcription during human cardiac outflow formation[J]. PLoS One,2012,7(1):e30677.
[7] Lin LZ, Bu L, Cai CL,etal. ISL1 is upstream of sonic hedgehog in a pathway required for cardiac morphogenesis[J]. Dev Biol,2006,295(2):756-763.
[8] Yang YP, Li HR, Cao XM,etal. Second heart field and the development of the outflow tract in human embryonic heart[J]. Dev Growth Differ,2013,55(3):359-367.
[9] 武姗姗,景雅,杨艳萍,等.神经嵴细胞和胰岛因子1阳性细胞与小鼠胚胎心流出道发育的关系[J].解剖学报,2011,42(5):684-689.
[10] Liang S, Li HC, Wang YX,etal. Pulmonary endoderm, second heart field and the morphogenesis of distal outflow tract in mouse embryonic heart[J]. Dev Growth Differ,2014,56(4):276-292.
[11] Cai CL, Liang X, Shi Y,etal. ISL1 identifies a cardiac progenitor population that proliferates prior to differentiation and contributes a majority of cells to the heart[J]. Dev Cell,2003,5(6):877-889.
[12] Buckingham M, Meilhac S, Zaffran S. Building the mammalian heart from two sources of myocardial cells[J]. Nat Rev Genet,2005,6(11):826-835.
[13] Meilhac SM, Esner M, Kelly RG,etal. The clonal origin of myocardial cells in different regions of the embryonic mouse heart[J]. Dev Cell,2004,6(5):685-698.
[14] 师亮,李慧超,陈浩,等.小鼠胚胎呼吸内胚层相关第二生心区的发育[J].解剖学报,2016,47(6):818-823.
[15] 蔡玉瑾,李慧超,张宏权,等.音猬因子与胰岛增强子结合蛋白在小鼠胚胎呼吸系统的早期表达[J].解剖学报,2016,47(5):678-682.
[16] 蔡玉瑾,景雅,乔爱秀,等.小鼠胚胎心流出道的形态发生与呼吸内胚层发育耦联[J].解剖学报,2012,43(6):802-806.
[17] Li Y, Zhang H, Choi SC,etal. Sonic hedgehog signaling regulates Gli3 processing, mesenchymal proliferation, and differentiation during mouse lung organogenesis[J]. Dev Biol,2004,270(1):214-231.
ExpressionofSonicHedgehogsignalingmembersandISL-1inmorphogenesisoftheoutflowtractinmouseembryonicheart
LI Huichao1*,SHI Liang2,YANG Yanping2,MA Yuxiang1,YU Cuiping1
(1DepartmentofAnatomy,ChangchunMedicalCollege,Changchun130031,China;2DepartmentofHistologyandEmbryology,ShanxiMedicalUniversity;*Correspondingauthor,E-mail:lhc1304@163.com)
ObjectiveTo explore the relationship of the early morphogenesis of the outflow tract in mouse embryonic heart with the expression of Sonic Hedgehog signaling members and ISL-1.MethodsSerial sections of 40 mouse embryos from embryonic day(ED)8 to ED13 were stained by immunohistochemistry and immunofluorescence with antibodies against Shh, Smoothened, Patched, Patched 2, ISL-1, MHC and α-SMA.ResultsAt ED8 and ED9, Shh positive cells distributed in the forgut endoderm, Ptc1 and Ptc2 expressed strongly in the heart tube, and ISL-1 was detected in bilateral mesenchyme to the foregut, the splanchnic mesoderm of the pericardial cavity dorsal wall, and extended distally to the primary heart tube. From ED10 to ED13, the foregut endoderm extended ventrally to form laryngotracheal groove, Ptc1and Ptc2 expressed strongly in the laryngotracheal groove,ISL-1 positive cells surrounding the laryngotracheal groove formed a symmetrical cone-shaped structure to form the aorta-pulmonary septum, the aorta-pulmonary septum was gradually transferred from ISL-1 positive expression to α-SMA positive expression, and the arterial sac was separated into MHC negative ascending aorta and pulmonary trunk.ConclusionSonic Hedgehog signaling pathway and ISL-1 positive cells participate in the normal morphogenesis of outflow tract in mouse embryonic heart .
ISL-1; Shh; outflow tract of the heart; embryonic development; mice
吉林省教育厅“十二五”科学技术研究项目(2015461);国家自然科学基金资助项目(31200899);山西省自然科学基金资助项目(2015021189);山西省优势重点学科建设经费(转化医学)资助项目;山西医科大学博士启动基金资助项目(03201410),山西医科大学基础医学科技培植基金资助项目(201423)
李慧超,女,1986-02生,硕士,讲师,E-mail:lhc1304@163.com
2017-08-25
R321
A
1007-6611(2017)11-1087-05
10.13753/j.issn.1007-6611.2017.11.001

