CYP2C9和VKORC1基因多态性对华法林稳态治疗剂量及个体化抗凝疗效的影响
寇惠娟,邓 捷,朱参战,李永勤,马 瑞,张 岩,张春艳,郑强荪
(西安交通大学第二附属医院心内科,西安 710004;*通讯作者,E-mail:zhengqs@mail.xjtu.edu.cn)
CYP2C9和VKORC1基因多态性对华法林稳态治疗剂量及个体化抗凝疗效的影响
寇惠娟,邓 捷,朱参战,李永勤,马 瑞,张 岩,张春艳,郑强荪*
(西安交通大学第二附属医院心内科,西安 710004;*通讯作者,E-mail:zhengqs@mail.xjtu.edu.cn)
目的 探讨非瓣膜病房颤患者华法林CYP2C9和VKORC1基因多态性对药物稳态治疗剂量及个体化抗凝疗效的影响。 方法 收集2015-06~2017-03在西安交通大学第二附属医院心内科门诊及住院的非瓣膜病房颤患者,应用CHA2DS2-VASc和HAS-BLED评分系统进行评估。将接受口服抗凝治疗患者分为传统对照组(从小剂量1.5-3.0 mg/d开始的传统给药方案)和个体化治疗组(采用国际权威推荐的华法林个体化剂量预测模型计算华法林初始抗凝治疗剂量),进行华法林CYP2C9和VKORC1基因多态性检测,监测国际标准化比值(INR),计算服药后INR达标时间,观察华法林稳态治疗剂量与初始推荐治疗剂量的相关性,以及药物相关不良事件发生。 结果 共纳入非瓣膜病房颤患者678例,134例患者接受口服华法林抗凝药物治疗方案,约占19.8%。传统对照组(n=65)和个体化治疗组(n=69)患者在年龄(P=0.016)、华法林初始推荐治疗剂量(P<0.001)和达标时间(P<0.001)方面差异具有统计学意义,随访期间均未观察到药物相关不良事件的发生。CYP2C9*2(R144C,C>T)野生CC型,杂合突变CT型和纯合突变TT型分别为100%,0%和0%;CYP2C9*3(I359L,A>C)野生AA型,杂合突变AC型和纯合突变CC型分别为95.7%,4.3%和0%;VKORC1(1639,G>A)野生GG型,杂合突变GA型和纯合突变AA型分别为0%,17.4%和82.6%。计算的华法林推荐治疗剂量CYP2C9*2 CC型为(3.24±0.91)mg/d,CYP2C9*3 AA型和AC型分别为(3.31±0.90)mg/d和(2.24±0.16)mg/d,VKORC1 GA型和AA型分别为(3.81±1.34)mg/d和(3.10±0.75)mg/d。线性相关分析显示华法林稳态治疗剂量与年龄呈显著负相关(r=-0.589,P<0.001),与身高(r=0.384,P=0.033)和基于公式计算的华法林初始推荐治疗剂量(r=0.935,P<0.001)呈显著正相关。多元线性回归分析结果显示,年龄、CYP2C9*3和VKORC1是华法林推荐治疗剂量的独立影响因素。两组患者均未观察到药物相关血栓栓塞及出血事件的发生。 结论 在非瓣膜病房颤患者中进行华法林CYP2C9和VKORC1基因多态性的检测,能够缩短达标时间、指导确定药物抗凝治疗剂量,有助于更好地指导华法林药物个体化抗凝治疗策略。
华法林; 房颤; CYP2C9基因型; VKORC1基因型; 抗凝治疗
华法林是常用的口服抗凝药物,多用于房颤、肺栓塞及血栓栓塞性等疾病的抗凝治疗,国际标准化比值(international standard ratio,INR)是监测其抗凝疗效的指标。目前,INR值控制在2.0-3.0得到了国外指南推荐和国内专家的认可[1-4]。华法林因其治疗窗狭窄、个体差异大、需频繁抽血检测INR、易受遗传及环境因素(如:年龄、身高、体重、药物等)的影响,导致患者依从性差,限制了其在临床的应用。近年来随着药物基因组学的深入研究和发展,华法林药代动力学和药效学通路上的某些基因的遗传变异可能是造成个体间华法林剂量差异的主要原因之一。CYP2C9和VKORC1是与华法林作用代谢靶点密切相关的基因,CYP2C9*2(R144C,C>T)存在野生CC型、杂合突变CT和纯合突变TT型,CYP2C9*3(I359L,A>C)存在野生AA型、杂合突变AC和纯合突变CC型,VKORC1(1639,G>A)存在野生GG型、杂合突变GA型和纯合突变AA型。既往有研究表明CYP2C9*2、CYP2C9*3、VKORC1基因的多态性会对华法林的个体化药物治疗产生重要影响[5-14]。既往有研究[8,14]采用国际权威推荐的华法林个体化剂量预测模型,纳入患者的年龄、性别、身高、体重、基线INR、合并用药、CYP2C9*2、CYP2C9*3、VKORC1基因的多态性等因素预测华法林初始抗凝治疗剂量,不仅能够促进患者获得满意疗效,而且可以减少药物不良反应的发生。本研究旨在探讨非瓣膜病房颤患者华法林CYP2C9和VKORC1基因的多态性,观察患者的临床特征和药物基因多态性对华法林抗凝治疗剂量及个体化抗凝疗效的影响。
1 资料与方法
1.1 研究对象
收集2015-06~2017-03在西安交通大学第二附属医院心内科门诊及住院的非瓣膜病房颤患者678例,其中口服华法林(华法林钠片,芬兰奥立安公司,规格:3 mg/片)接受抗凝治疗患者134例。入选标准:年龄18岁以上,汉族人(相互间无血缘关系及异族通婚史)、INR值控制在2.0-3.0之间。剔除标准:肝、肾及甲状腺功能异常;恶性肿瘤;血液系统疾病;服用利福平及巴比妥等影响华法林药动学效果的药物;服用阿司匹林、氯吡格雷、肝素及维生素K等影响INR的药物;服用新型口服抗凝药物治疗,如达比加群酯等。
1.2 研究方法
入组非瓣膜病房颤患者,采集其基线的一般临床资料,包括年龄、身高、体重、服药史等,并留取血样送检获得血常规、肝肾功能、凝血功能(包括INR值等)等结果,以上患者血样检测工作由西安交通大学第二附属医院检验科专业人员负责;应用CHA2DS2-VASc评分系统评估房颤患者卒中的风险,从主要危险因素(既往曾发生脑卒中、短暂性脑缺血、血栓史及年龄>75岁,均为2分)和次要危险因素(高血压、糖尿病、心力衰竭、女性、年龄65-74岁及血管疾病,均为1分)进行综合评分;应用HAS-BLED评分系统进行出血风险评估,从高血压、脑卒中、肝功能不全、肾功能不全、出血病史或倾向、异常INR、年龄≥65岁、药物和饮酒进行综合评分,每项均为1分。如无禁忌,CHA2DS2-VASc≥2、HAS-BLED<3的非瓣膜病房颤患者均应接受长期的口服抗凝药物治疗(见图1)。

图1 本临床研究技术路线图Figure 1 Flow chart of the clinical trial
1.3 观察指标及判定标准
接受口服抗凝治疗患者分为两组,即传统对照组和个体化治疗组,监测INR值,计算服用华法林后INR达标(2.0-3.0)所需的时间,INR达标时华法林稳态抗凝治疗剂量与基因检测推荐初始治疗剂量的相关性,以及药物相关不良事件发生情况。传统对照组:按照传统给药方案从小剂量开始(1.5-3.0 mg/d)开始华法林抗凝治疗;个体化治疗组:基于检测华法林的CYP2C9和VKORC1基因型,根据华法林药物基因组学公式模型计算华法林初始推荐抗凝治疗剂量。
1.4 华法林基因型检测及抗凝剂量的预测
晨起采集受试者的静脉血(EDTA抗凝血)3 ml,血样标本送西安交通大学第二附属医院临床药学室,应用焦磷酸测序方法检测CYP2C9及VKORC1基因型,采用国际推荐的权威华法林药物基因组学的模型公式(www.warfarindosing.org)计算预测华法林的初始抗凝治疗剂量。
1.5 统计学分析
采用SPSS13.0软件进行统计分析。计数资料以频数(%)表示,组间比较采用χ2检验;计量资料正态分布数据用均数±标准差表示,非正态分布数据用中位数(P25,P75)表示。数据呈正态分布且方差齐时,采用独立样本t检验或方差分析,否则采用非参数Wilcoxon秩和检验。多因素采用Spearman相关和线性回归分析。P<0.05表示差异有统计学意义。
2 结果
2.1 一般临床资料
本研究观察非瓣膜病房颤患者678例,分别进行CHA2DS2-VASc和HAS-BLED评分系统的评估。其中134例患者,CHA2DS2-VASc评分4(3,5)分,HAS-BLED评分1(1,2)分,接受口服华法林抗凝药物治疗方案;544例患者,CHA2DS2-VASc评分4(3,6)分,HAS-BLED评分2(1,2)分,未接受口服抗凝药物治疗方案。其中,接受口服抗凝药物治疗方案组患者的平均年龄(67岁vs71岁,P=0.002)和HAS-BLED评分(1分vs2分,P=0.007)均显著低于未接受口服抗凝药物治疗方案组,两者在身高、体重和CHA2DS2-VASc评分方面差异未见有统计学意义(P>0.05,见表1)。
表1接受和未接受口服抗凝药物治疗患者一般资料比较
Table1Comparisonofdemographiccharacteristicsbetweenoralanticoagulanttherapygroupandnon-treatmentgroup
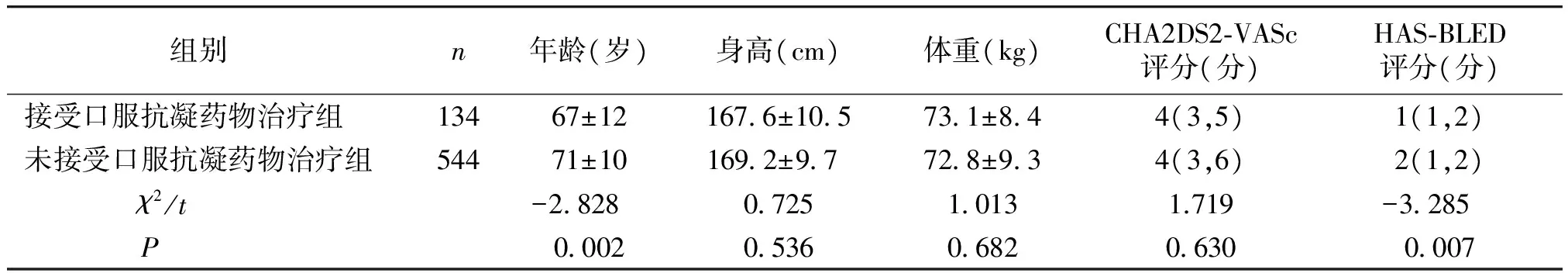
组别n年龄(岁)身高(cm)体重(kg)CHA2DS2⁃VASc评分(分)HAS⁃BLED评分(分)接受口服抗凝药物治疗组13467±121676±105731±844(3,5)1(1,2)未接受口服抗凝药物治疗组54471±101692±97 728±934(3,6)2(1,2) χ2/t-2828 072510131.719-3285 P 0002 053606820630 0007
2.2 个体化治疗组和传统对照组疗效及安全性评估
接受口服抗凝药物治疗的患者共134例,分为个体化治疗组(n=69)和传统对照组(n=65),前者的平均年龄小于后者(62岁vs71岁,P=0.016)。个体化治疗组华法林初始治疗剂量显著高于传统治疗组(3.24 mg/dvs1.63 mg/d,P<0.001),而达标时间明显短于传统对照组(5.39 dvs8.03 d,P<0.001),在身高、体重和华法林稳态治疗剂量方面差异未见有统计学意义(P>0.05,见表2);两组患者在口服华法林抗凝治疗初始至INR达标随访期间,均未观察到药物相关血栓栓塞及出血事件的发生。
表2个体化治疗和传统对照组疗效及安全性评估
Table2Efficacyandsafetyevaluationbetweenindividualgroupandconventionalgroup

组别n男性[例(%)]年龄(岁)身高(cm)体重(kg)华法林初始推荐治疗剂量(mg/d)华法林稳态治疗剂量(mg/d)达标时间(d)不良事件(例) 个体化治疗组6946(667)62±141691±85711±94 324±091313±068539±2580 传统治疗组6538(585)71±9 1674±97698±102163±036301±038803±2420 χ2/t0963-293909520780101490909-4432 P0326 000402860573<0001 0367<0001
2.3 个体化治疗组基因型及等位基因频率与华法林推荐治疗剂量的关系
个体化治疗组患者69例,分别进行华法林相关CYP2C9*2、CYP2C9*3和VKORC1基因型检测,并根据华法林药物基因组学公式模型计算华法林初始推荐抗凝治疗剂量。CYP2C9*2(R144C,C>T)野生CC型69例,占100%,计算的华法林推荐治疗剂量为(3.24±0.91)mg/d,杂合突变CT和纯合突变TT型各为0例;CYP2C9*3(I359L,A>C),野生AA型66例,占95.7%,计算的华法林推荐治疗剂量为(3.31±0.90)mg/d,杂合突变AC型3例,占4.3%,计算的华法林推荐治疗剂量为(2.24±0.16)mg/d,纯合突变CC型0例,占0%;VKORC1(1639,G>A),野生GG型0例,占0%,杂合突变GA型12例,占17.4%,计算的华法林推荐治疗剂量为(3.81±1.34)mg/d,纯合突变AA型57例,占82.6%,计算的华法林推荐治疗剂量为(3.10±0.75)mg/d,见表3。
表3华法林基因型、等位基因频率及推荐个体化治疗剂量比较
Table3Genotyping,allelefrequenciesandindividualizedrecommendedtreatmentdoseofwarfarin
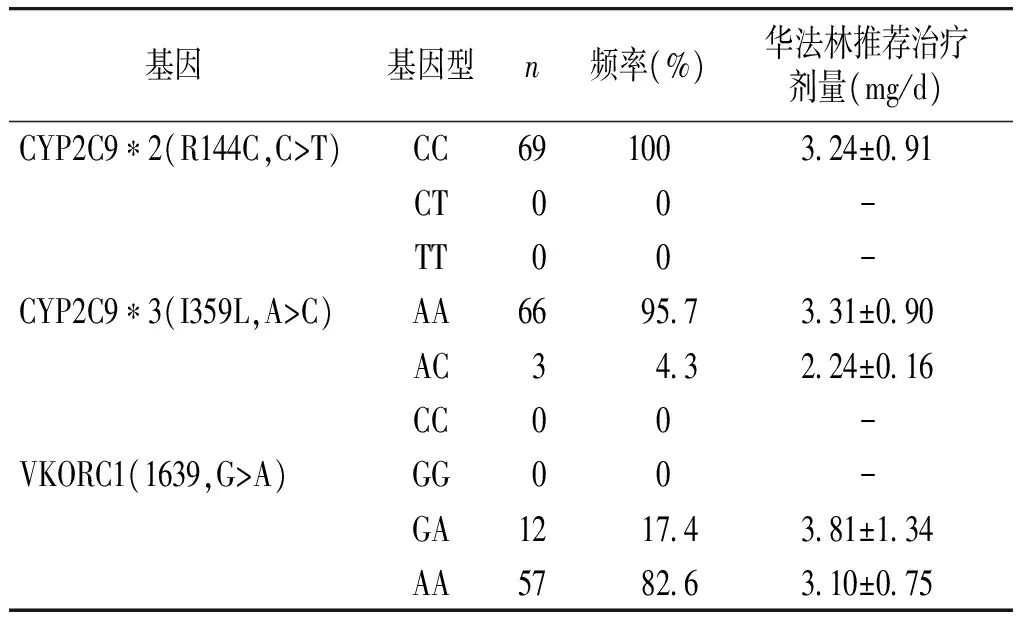
基因基因型n频率(%)华法林推荐治疗剂量(mg/d)CYP2C9∗2(R144C,C>T)CC69100324±091CT00-TT00-CYP2C9∗3(I359L,A>C)AA66957331±090AC343224±016CC00-VKORC1(1639,G>A)GG00-GA12174381±134AA57826310±075
2.4 多因素相关与线性回归分析
华法林稳态治疗剂量与年龄呈显著负相关(r=-0.589,P<0.001),与身高(r=0.384,P=0.033)和基于公式计算的华法林初始推荐治疗剂量(r=0.935,P<0.001)呈显著正相关。以华法林稳态治疗剂量为因变量,以年龄、身高、体重、CYP2C9*2、CYP2C9*3和VKORC1基因型为自变量,进行多元线性回归分析,结果显示年龄、CYP2C9*3和VKORC1是华法林推荐治疗剂量的独立影响因素(见表4)。
表4多元线性回归分析
Table4Multivariatelinearregressionanalysis
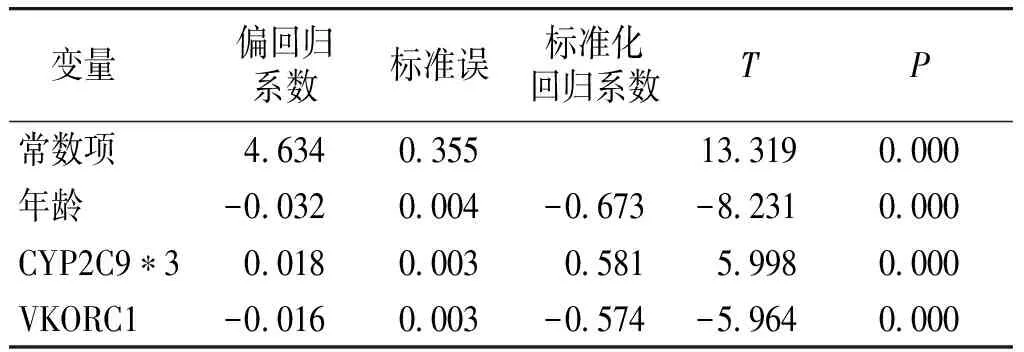
变量偏回归系数标准误标准化回归系数TP常数项46340355133190000年龄-00320004-0673-82310000CYP2C9∗300180003058159980000VKORC1-00160003-0574-59640000
3 讨论
合理有效的抗凝治疗可以预防房颤患者血栓栓塞事件的发生,监测INR值控制在2.0-3.0得到了国外指南推荐和国内专家的认可[1-4]。CHA2DS2-VASc和HAS-BLED评分体系是近年来国内外指南推荐的临床最广泛应用的评估工具,如无禁忌,CHA2DS2-VASc≥2、HAS-BLED<3的房颤患者均应接受长期的口服抗凝药物治疗。
华法林是最早应用于房颤抗凝治疗的药物,可以降低房颤患者脑卒中发病风险。但华法林的疗效容易受食物、药物、环境、遗传等因素的影响,且该药半衰期长,治疗窗窄,需频繁监测患者INR值,谨慎控制剂量,否则会增加血栓栓塞及出血风险,从而导致患者依从性差,药物剂量掌握困难,临床应用受限制。有研究显示欧美等发达国家接受有效抗凝治疗的房颤患者不足50%,而我们国家则更低为10%-20%左右[4,6]。基于我们课题组的数据分析,我们医院心内科接受有效口服药物抗凝治疗的房颤患者约为19.8%,与国内情况相当。
近些年,发现华法林代谢相关基因的多态性对其临床药代和药效学的个体差异会产生影响[6,15],研究遗传药物基因组学在华法林药物的合理使用和个体化用药上具有重要意义。华法林药物相关基因主要可以分为两类,一类是与华法林作用代谢和作用靶点相关的基因,如CYP2C9和VKORC1等[7];另一类是与体内维生素K1代谢循环相关的基因,如GGCX、CYP4F2、EPHX1、APOE等[16]。其中,最重要的是CYP2C9基因*2、*3等位基因型和VKORC1基因1639,G>A基因型。
目前临床使用的华法林是由S-对映体和R-对映体组成的外消旋体化合物,而前者的抗凝活性是后者的2-5倍,S-对映体也主要由CYP2C9代谢。CYP2C9是编码细胞色素P450酶2C9的基因,其基因多态性的分布存在种族差异。Miao等[5]对178例中国汉族人群的研究中发现CYP2C9等位基因*1、*2和*3频率分布为95.5%,0%和4.5%。陈晓英等[8]观察了湖北地区435例行心脏机械瓣膜置换术的患者,CYP2C9基因型检测显示402例为*1/*1型、30例为*1/*3型、3例*3/*3型,以等位基因A为主其基因型频率分别为92.41%,6.90%,0.69%。薛乾等[11]报道将226例服用华法林的患者按CYP2C9(1061,A>C)基因型进行分组,观察华法林剂量的差异,结果发现AA型患者华法林维持量高于AC型患者(P<0.05)。Mazzaccara等[17]研究了266例意大利患者,发现基因型为CYP2C9*1/*3、*2/*3和*3/*3患者所需华法林的剂量小于其野生型等位基因,每周剂量分别为(22.03±8.80)mg、(13.4±10.10)mg、(9.74±3.25)mg和(32.11±13.98)mg。本研究中CYP2C9*2(R144C,C>T)野生CC型69例,占100%,杂合突变CT和纯合突变TT均为0%;CYP2C9*3(I359L,A>C)野生AA型66例,占95.7%,杂合突变AC型3例,占4.3%,纯合突变CC,占0%。计算的华法林推荐治疗剂量CYP2C9*2野生CC型为(3.24±0.91)mg/d;CYP2C9*3野生AA型(3.31±0.90)mg/d和杂合突变AC型(2.24±0.16)mg/d,与既往研究结果相似。
VKORC1是维生素K代谢循环中的限速酶,其基因的多态性与华法林临床应用剂量个体化有关。蒋年新等[18]对102例中国汉族人群的研究中发现VKORC1 1639携带AA型的患者较之于GG型可以更快捷进入治疗窗(INR≥2)以及更低的华法林稳定剂量,差异均具有统计学意义(P<0.01)。Mazzaccara等[17]研究发现,VKORC1-1639G>A所需华法林的剂量低于野生型。李胜军等[10]通过基因检测发现,当VKORC1-1639位G基因突变后,其转录活性下降,抵抗华法林的能力降低,从而影响华法林的药效;VKORC1-1639的变异型(GA型和AA型)与野生纯合型(GG型)比较,所需华法林的剂量显著减少。都丽萍等[9]研究发现VKORC1-1639 AA型患者所需华法林平均剂量显著低于GA+GG型患者(2.61 mg/d比4.44 mg/d,P<0.005),降低幅度高达41.2%,VKORC1基因型解释了约39.4%的华法林剂量个体差异。本研究观察69例患者,VKORC1(1639,G>A),野生GG型0例,占0%;杂合突变GA型12例,占17.4%,计算的华法林推荐治疗剂量为(3.81±1.34)mg/d;纯合突变AA型57例,占82.6%,计算的华法林推荐治疗剂量为(3.10±0.75)mg/d。组间差异均未见统计学意义(P>0.05),与既往研究结果相似。
本研究采用的华法林预测模型中纳入了遗传因素以及相关的临床因素,其中包含患者年龄、身高、体重、基线INR、CYP2C9*2、CYP2C9*3和VKORC1基因型以及合并用药情况等。随访观察研究发现利用药物基因组学信息和临床环境相关因素建立的华法林剂量运算预测模型,能够准确地估算华法林的初始推荐抗凝治疗剂量,其与稳态抗凝治疗剂量呈显著正相关(r=0.935,P<0.001)。而且药物基因多态性的检测可以降低治疗引导阶段华法林过量的风险,缩短华法林达到稳定治疗的时间[(5.39±2.58)dvs(8.03±2.42)d,P<0.001],从而避免或减少临床不良事件的发生。影响华法林剂量的因素主要有遗传因素以及年龄、身高、体重、药物等环境因素。本研究中对患者的年龄、身高、体重、华法林初始推荐治疗剂量与华法林稳态治疗剂量分别行相关分析,结果显示华法林稳态治疗剂量与年龄呈显著负相关,与身高和基于公式计算的华法林初始推荐治疗剂量呈显著正相关;行多元线性回归分析显示结果显示年龄、CYP2C9*3和VKORC1是华法林推荐治疗剂量的独立影响因素。
综上所述,进行华法林CYP2C9*2、CYP2C9*3和VKORC1基因多态性的检测,能够准确预测华法林初始抗凝治疗剂量,避免和减少药物相关不良事件的发生,有助于更好地指导临床口服抗凝药物的治疗策略。但是,本研究也存在不足之处,扩大样本量、延长随访地时间、更多华法林药物相关的基因型检测以及多中心前瞻性研究的应用,能够为华法林个体化的抗凝治疗提供更重要的依据。
[1] Camm AJ, Kirchhof P, Lip GY,etal. Guidelines for the management of atrial fibrillation: the Task Force for the Management of Atrial Fibrillation of the European Society of Cardiology (ESC)[J]. Eur Heart J,2010, 31 (19):2369-2429.
[2] Gao Q, Fu X, Wei JW,etal. Use of oral anticoagulation among stroke patients with atrial fibrillation in China: the ChinaQUEST(Quality evaluation of stroke care and treatment) registry study[J]. Int J Stroke,2013, 8 (3):150-154.
[3] January CT, Wann LS, Alpert JS,etal. 2014 AHA/ACC/HRS guideline for the management of patients with atrial fibrillation: a report of the American College of Cardiology/American Heart Association Task Force on practice guidelines and the Heart Rhythm Society[J]. Circulation,2014, 130 (23):e199-267.
[4] Sanoski CA. Current approaches to anticoagulation for reducing risk of atrial fibrillation-related stroke[J]. J Pharm Pract,2013, 26 (3):204-213.
[5] Miao L, Yang J, Huang C,etal. Contribution of age, body weight, and CYP2C9 and VKORC1 genotype to the anticoagulant response to warfarin: proposal for a new dosing regimen in Chinese patients[J]. Eur J Clin Pharmacol,2007, 63 (12):1135-1141.
[6] Johnson JA, Gong L, Whirl-Carrillo M,etal. Clinical Pharmacogenetics Implementation Consortium Guidelines for CYP2C9 and VKORC1 genotypes and warfarin dosing[J]. Clin Pharmacol Ther,2011, 90 (4):625-629.
[7] Huang SW, Chen HS, Wang XQ,etal. Validation of VKORC1 and CYP2C9 genotypes on interindividual warfarin maintenance dose: a prospective study in Chinese patients[J]. Pharmacogenet Genomics,2009, 19 (3):226-234.
[8] 陈晓英,彭齐,胡大清,等.CYP2C9及VKORC1基因多态性对华法林稳态剂量和模型预测剂量的相关性研究[J].华中科技大学学报(医学版),2015,44(1):92-95.
[9] 都丽萍,梅丹,刘昌伟,等.CYP2C9及VKORC1基因多态性对华法林剂量和抗凝效果的影响[J].中国药学杂志,2010,45(21):1628-1633.
[10] 李胜军,盛红专.CYP2C9和VKORC1基因多态性与华法林抗凝剂量的研究[J].天津医药,2010,38(8):670-673.
[11] 薛乾,李伟,张宇峰,等.CYP2C9和VKORC1基因多态性对华法林抗凝强度的影响[J].第二军医大学学报,2016,37(5):640-644.
[12] 刘俊,徐航,葛卫红,等.华法林基于药物基因组学个体化给药方案的评价[J].中国医院药学杂志,2013,33(22):1857-1862.
[13] 刘佳,朱华,陆强,等.基因多态性对华法林稳态剂量和模型预测剂量的相关性研究[J].中国医院药学杂志,2017,37(11):1078-1081.
[14] 邹朗,赵莉.基因检测预测华法林给药剂量准确性的研究[J].中国医院药学杂志,2017,37(9):851-854+873.
[15] 冯频频,彭文星,石秀锦,等.基因多态性对华法林剂量影响的研究进展[J].中国药房,2017,28(11):1581-1584.
[16] McDonald MG, Rieder MJ, Nakano M,etal. CYP4F2 is a vitamin K1 oxidase: An explanation for altered warfarin dose in carriers of the V433M variant[J]. Mol Pharmacol,2009, 75 (6):1337-1346.
[17] Mazzaccara C, Conti V, Liguori R,etal. Warfarin anticoagulant therapy: a Southern Italy pharmacogenetics-based dosing model[J]. PLoS One,2013, 8 (8):e71505.
[18] 蒋年新,宋杰,徐标.维生素K环氧化物还原酶复合体1基因多态性对华法林维持剂量的影响[J].中华心血管病杂志,2007,35(7):652-654.
EffectofCYP2C9andVKORC1genepolymorphismonwarfarinsteady-statetherapeuticdoseandindividualanticoagulationefficacy
KOU Huijuan,DENG Jie,ZHU Canzhan,LI Yongqin,MA Rui,ZHANG Yan,ZHANG Chunyan,ZHENG Qiangsun*
(DepartmentofCardiology,SecondAffiliatedHospital,Xi’anJiaotongUniversity,Xi’an710004,China;*Correspondingauthor,E-mail:zhengqs@mail.xjtu.edu.cn)
ObjectiveTo explore the effect of CYP2C9 and VKORC1 gene polymorphism on warfarin steady-state therapeutic dose and individual anticoagulation therapy in patients with non-valvular atrial fibrillation.MethodsThe subjects with non-valvular atrial fibrillation were enrolled from cardiovascular clinic and in-patient wards from June 2015 to March 2017. After using the CHA2DS2-VASc and HAS-BLED system to evaluate the risks of stroke and bleeding, the patients with oral anticoagulant therapy were divided into conventional group(initial dose of 1.5-3.0 mg/d) and individual group(the individualized recommended treatment dose of warfarin based on CYP2C9 and VKORC1 genotyping). The genotype and allele frequency of CYP2C9 and VKORC1, the time required for INR 2.0-3.0 after taking warfarin, association between individualized recommended treatment dose and warfarin steady-state therapeutic dose, and the incidence of drug-related side effects in individual group and conventional group were explored in the clinical study. All data were analyzed using SPSS 13.0 software.ResultsA total of 678 participants were enrolled into the study, and 134 patients
the oral anticoagulant therapy finally. The age(P=0.016), individualized recommended treatment dose(P<0.001) and the time required for INR 2.0-3.0 after taking warfarin(P<0.001) were significantly different between individual group and conventional group. The CYP2C9*2(R144C, C>T) genotyping showed that the allele frequencies of CC, CT and TT were 100%, 0% and 0%, respectively. CYP2C9*3 (I359L, A>C) genotyping showed that the allele frequencies of AA, AC and CC were 95.7%, 4.3% and 0%, respectively. VKORC1(1639, G>A) genotyping showed that the allele frequencies of GG, GA and AA were 0%, 17.4% and 82.6%, respectively. The warfarin dose was (3.24±0.91)mg/d in CYP2C9*2 CC, (3.31±0.90)mg/d and (2.24±0.16)mg/d in CYP2C9*3-I359L AA and AC, (3.81±1.34)mg/d and (3.10±0.75)mg/d in VKOR C1-1639 GA and AA, respectively. The warfarin steady-state therapeutic dose was negatively with age(r=-0.589,P<0.001), but positively with height(r=0.384,P=0.033) and individualized recommended treatment dose(r=0.935,P<0.001). After adjusting for confounders via multivariate linear regression, the age, genotype of CYP2C9*3 and VKORC1 values remained independently associated with warfarin steady-state therapeutic dose for patients receiving oral anticoagulantion. No drug-related thromboembolism and haemorrhage were observed in two groups.ConclusionCYP2C9 and VKORC1 gene polymorphism can help to shorten the standard time, predict the warfarin steady-state treatment dose and optimize the therapeutic strategies of oral anticoagulant therapy in patients with non-valvular atrial fibrillation.
warfarin; atrial fibrillation; CYP2C9 genotype; VKORC1 genotype; anticoagulant therapy
中央高校基本科研业务费资助项目(0817-1191320079);西安交通大学第二附属医院科技新苗基金资助项目(RC(XM)201608);西安交通大学第二附属医院青年科研基金资助项目(YJ(QN)201419)
寇惠娟,女,1983-10生,博士,主治医师,E-mail:khjsarah@163.com
2017-06-18
R541.7
A
1007-6611(2017)11-1102-06
10.13753/j.issn.1007-6611.2017.11.004

