胰岛素抵抗对小鼠哮喘模型气道高反应性及肺部炎症的影响
周宁娟,张 娟,马婧一,郭 颖,汤丽萍,苏 慧,孙 新*
(1第四军医大学西京医院儿科,西安 710032;2西京医院老年病科;*通讯作者,E-mail:sunxin6@fmmu.edu.cn)
胰岛素抵抗对小鼠哮喘模型气道高反应性及肺部炎症的影响
周宁娟1,张 娟1,马婧一1,郭 颖1,汤丽萍1,苏 慧2,孙 新1*
(1第四军医大学西京医院儿科,西安 710032;2西京医院老年病科;*通讯作者,E-mail:sunxin6@fmmu.edu.cn)
目的 探讨胰岛素抵抗对小鼠哮喘模型气道高反应性(AHR)及肺部炎症的影响。 方法 3周龄C57BL/6J雄性小鼠60只随机分为4组:正常对照组(HC)、哮喘组(NIRA)、胰岛素抵抗组(IRNA)、胰岛素抵抗+哮喘组(IRA),每组15只。HC组、NIRA组均给予普通饲料喂养;IRNA组、IRA组均给予高脂饲料喂养,共喂养9周后,计算各组小鼠稳态模型胰岛素抵抗评价指数(HOMA-IR),评估胰岛素抵抗程度;在小鼠胰岛素抵抗模型建立成功后,NIRA组和IRA组小鼠给予卵清蛋白(OVA)致敏、激发,分别建立哮喘模型;HC组和IRNA组小鼠给予生理盐水作为对照。末次激发24 h内,依次雾化吸入浓度为0,3,6,12,25,50,100 mg/ml Mch,测定气道高反应性,制作肺病理切片,计数肺泡灌洗液中白细胞总数及分类,检测血清和肺泡灌洗液(BALF)中相关炎性因子的含量,对各组小鼠气道高反应性及炎性因子水平的变化情况进行统计学分析。 结果 与NIRA组相比,在吸入乙酰甲胆碱(Mch)浓度为12,25,50,100 mg/ml时,IRA组小鼠气道阻力明显升高(P<0.05);肺组织病理切片中,HC组、IRNA组小鼠肺组织无炎症改变,NIRA组、IRA组炎细胞浸润明显,尤以IRA组更甚。与HC组比较,NIRA组、IRA组BALF中白细胞总数、嗜酸性粒细胞比例明显增高(均P<0.01);血清中抗OVA特异性IgE和IgG1水平显著升高(P<0.01或P<0.05);BALF中IL-4、IL-17的水平明显升高(P<0.01或P<0.05),且IRA组明显高于NIRA组(P<0.05);IFN-γ的水平明显降低(P<0.05),且IRA组明显低于NIRA组(P<0.05)。 结论 胰岛素抵抗促进哮喘小鼠炎症因子的释放,加重肺部炎症,增加气道高反应性,加重哮喘的发生和发展。
胰岛素抵抗; 哮喘; 气道高反应性; 炎性因子
支气管哮喘(bronchial asthma,BA)是一种以慢性气道炎症和气道高反应性为特征的异质性疾病[1]。气道高反应(airway hyperresponsiveness,AHR)又称为支气管高反应性,是指哮喘患者对多种刺激物的反应性异常增高,吸入刺激性物质后,更易出现支气管平滑肌的收缩、黏液分泌增多及免疫炎性介质的释放,气道阻力急速短暂或较长时间的上升、肺通气功能下降[2]。世界范围内支气管哮喘的发病呈逐年增高的趋势,尤其是儿童[3],大量流行病学资料表明,儿童期肥胖是哮喘发病的一个重要危险因素,慢性炎症导致机体代谢紊乱可能是导致其发生的原因,但具体作用机制尚不明确[4-6]。然而,近期有研究显示肥胖不一定都能加重哮喘,只有在胰岛素抵抗和(或)糖耐量调节异常的状态下,才可能加重哮喘的发生,胰岛素抵抗或代谢综合征是发生肥胖哮喘的重要危险因素[7,8]。胰岛素抵抗(insulin resistance,IR)是指机体胰岛素作用的靶器官对胰岛素作用的敏感性下降,即正常剂量的胰岛素产生低于其正常生物学效应的一种状态,可诱发心肺血管疾病、糖尿病、肥胖、血糖异常、血脂紊乱等疾病或生理紊乱状态[9]。近年来研究发现胰岛素抵抗、高胰岛素血症与支气管哮喘的慢性炎症状态发生发展密切相关。相关的临床研究表明,肺功能受损与糖尿病和血糖水平升高密切相关[10,11]。此外,流行病学调查表明:胰岛素抵抗和高胰岛素血症与肺功能的下降密切相关[12,13]。IR在哮喘发生、发展中的作用越来越被重视,但是目前有关IR对肺功能以及肺部炎症的动物实验研究较少且差异很大。因此,本研究通过建立稳定的胰岛素抵抗哮喘小鼠模型,探讨胰岛素抵抗对气道高反应性及肺部炎症的影响。
1 材料与方法
1.1 主要试剂与仪器
卵清蛋白(ovalbumin,OVA)(美国Sigma公司),高脂饲料:D12492(开源动物饲料有限公司),乙酰甲胆碱(acetyl-β-methylcholinechloride,Mch)(美国Sigma公司),氢氧化铝(天津市天力化学试剂公司),IgE、IgG1、IL-4、IL-10、IL-17、INF-γ、小鼠胰岛素酶联免疫试剂盒(美国R&D Systems公司),小鼠肺功能仪(加拿大SCIREQ公司),空气压雾缩化器(欧姆龙大连有限公司),酶标分析仪(无锡华卫德郎仪器有限公司),超净工作台(苏州净化设备厂)。
1.2 实验动物及饲料
3周龄SPF级雄性C57BL/6J小鼠60只[SCXK(军)2012-0007],体质量(10.93±0.64)g,购自第四军医大学实验动物中心,饲养于西京医院实验动物中心,恒定室温(21-25 ℃),湿度50%-65%,光照10-12 h/d。饲料共两种:为普通饲料和纯化高脂饲料(D12492)。普通饲料热量构成比为:脂肪10%,蛋白质24%,碳水化合物66%,总热量为348 kcal/100 g,由第四军医大学实验动物中心提供;高脂饲料热量构成比为:脂肪60%,碳水化合物20%,蛋白质20%,总热量为524 kcal/100 g,由开源动物饲料有限公司提供。饲养过程遵循西京医院实验动物中心动物保护和使用指南。
1.3 胰岛素抵抗小鼠模型的建立

1.4 哮喘模型的建立
致敏:在确定胰岛素抵抗模型成功后的第0,7,14天,NIRA组、IRA组采用含OVA[100 μg OVA+1.5 mg Al(OH)3]的生理盐水配成的200 μl致敏液腹腔注射致敏。HC组、IRNA组采用仅含有Al(OH)3,不含OVA的生理盐水200 μl腹腔注射,注射方法,部位相同。
激发:NIRA组、IRA组于第21-28天放在雾化箱中,用1%OVA雾化液连续雾化吸入激发8 d,每天1次,每次30 min,HC组、IRNA组用生理盐水在相同条件下雾化激发,激发次数、持续时间相同。
1.5 肺气道高反应性的测定
4组小鼠在末次雾化吸入激发24 h内,每组随机取5只小鼠,在麻醉状态下进行气管插管,启动小鼠肺功能仪FlexiVent软件系统并进行校正,将插管成功的小鼠链接于Y型管,依次雾化吸入浓度为0,3,6,12,25,50,100 mg/ml Mch,每次间隔2 min,测定小鼠气道总阻力(Rrs),记录小鼠气道阻力值。
1.6 血清的收集及BALF中白细胞计数及分类

1.7 肺组织病理学检查
肺泡灌洗完毕后,暴露小鼠肺部,取小鼠左肺组织,将其固定在4 ml 4%多聚甲醛溶液中至少24 h,常规石蜡包埋、切片后进行HE染色,光镜下观察病理改变。
1.8 细胞因子的检测
用酶联免疫吸附试验法(ELISA)检测血清中抗OVA特异性IgE及IgG1水平;用ELISA法检测肺泡灌洗液中IL-4、IL-10、IL-17、INF-γ的水平。
1.9 统计学分析

2 结果
2.1 小鼠体质量的比较
随着饲养时间的延长,各组小鼠体质量逐渐增加,从第2周开始,与HC组相比,IRNA组、IRA组鼠体质量明显增加(均P<0.01,见图1)。第5周末,IRNA组、IRA组小鼠肥胖度均超过20%,可认为肥胖。
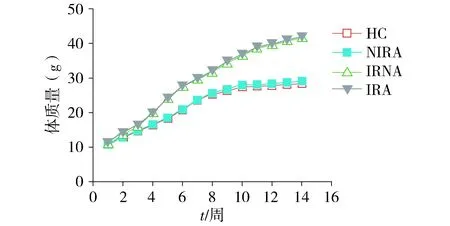
第2-14周IRNA组和IRA组与HC组比较均P<0.01图1 各组小鼠体质量的变化 (n=15)Figure 1 Changes of the body weight in different groups (n=15)
2.2 小鼠空腹血糖、空腹胰岛素、胰岛素抵抗指数的比较
造模第9周末,分别测定4组小鼠FPG、FINS,采用稳态模式评估法计算HOMA-IR。IRNA组(2.82±0.30)和IRA组(2.89±0.37)HOMA-IR均>2.5(见表1),可确定胰岛素抵抗模型建立成功。



组别nFPG(mmol/L)FINS(mIU/L)HOMA⁃IR(mmol·mIU/L2)HC组15509±052325±044074±013NIRA组15499±043∗327±046∗073±012∗IRNA组15785±056∗808±075∗282±030∗IRA组15803±063∗810±084∗289±037∗
与HC组比较,*P<0.05
2.3 哮喘急性发作症状
NIRA组、IRA组小鼠在雾化过程中均出现不同程度的烦躁或安静少动、全身瘙痒、抓脸、呼吸加快、点头呼吸、弓背直立、前肢缩抬、腹肌抽搐等哮喘速发相表现,HC组、IRNA组小鼠雾化过程中活动自如,无上述表现。
2.4 小鼠气道高反应性
随着吸入Mch浓度的增加,NIRA组、IRA组小鼠气道阻力逐渐增高,HC组和IRNA组小鼠气道阻力没有明显变化。与HC组相比,1.5,3,6,12,25,50,100 mg/ml Mch时NIRA组和IRA组小鼠气道阻力明显升高(P<0.05);与NIRA组相比,12,25,50,100 mg/ml Mch时IRA组小鼠气道阻力明显升高(P<0.05,见图2)。
2.5 肺组织病理损害
HC组、IRNA组小鼠肺组织整体结构基本正常,肺泡无明显萎缩或扩张,肺泡隔正常,组织无明显炎症细胞浸润。NIRA组、IRA组可见细小支气管及伴行血管周围有较多的炎性细胞浸润,IRA组炎症细胞浸润更明显(如黑色箭头所示,见图3)。
2.6 支气管肺泡灌洗液中白细胞总数及炎性细胞分类
与HC、IRNA组小鼠相比,NIRA、IRA组小鼠白细胞总数均明显增多(P<0.01),主要表现为嗜酸粒细胞、中性粒细胞的增多;与NIRA组相比,IRA组小鼠白细胞总数增多更为明显(P<0.01),其中嗜酸性粒细胞的增高更明显(P<0.05,见图4,5)。

与HC组比较,#P<0.05;与NIRA组相比,*P<0.05图2 各组小鼠气道阻力的变化Figure 2 The changes of Rrs in four groups
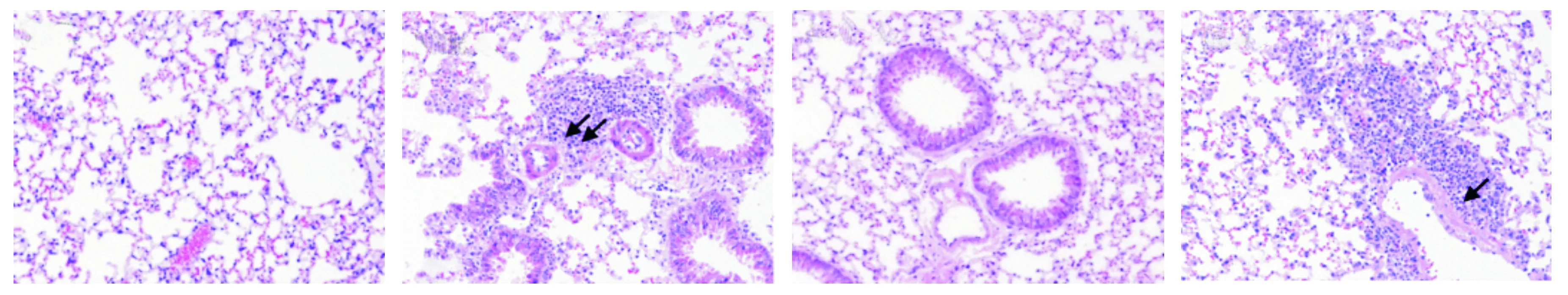
A.HC组 B.NIRA组 C.IRNA组 D.IRA组图3 各组小鼠肺组织病理变化 (HE染色,×200)Figure 3 Pathological changes of lung tissues in each group (HE staining,×200)

与HC组比较,#P<0.01;与NIRA组相比,*P<0.01图4 四组BALF中白细胞计数比较 (n=9)Figure 4 The total white blood cell count in the BALF in four groups (n=9)

与HC组比较,#P<0.01;与NIRA组相比,*P<0.05图5 各组小鼠BALF中白细胞分类计数结果 (n=9)Figure 5 The defferential leukocyte counts in the BALF in four groups (n=9)
2.7 血清中抗OVA特异性IgE及IgG1水平
与HC组和IRNA组相比,NIRA组和IRA组小鼠血清中IgE(P<0.01)及IgG1(P<0.05)水平显著升高,表明小鼠哮喘模型复制成功。与NIRA组相比,IRA组小鼠血清中IgE(P<0.01)及IgG1(P<0.05)水平升高更显著,差异具有统计学意义(见图6)。
2.8 小鼠肺泡灌洗液中IL-4、IL-17、INF-γ的浓度
与HC组和IRNA组相比,NIRA组和IRA组小鼠BALF中IL-4(P<0.01)、IL-17(P<0.05)的浓度明显升高,而INF-γ的浓度明显降低(P<0.05);与NIRA组相比,IRA组小鼠BALF中IL-4(P<0.01)、IL-17(P<0.05)的升高更明显,INF-γ的降低更明显(P<0.05,见图7)。
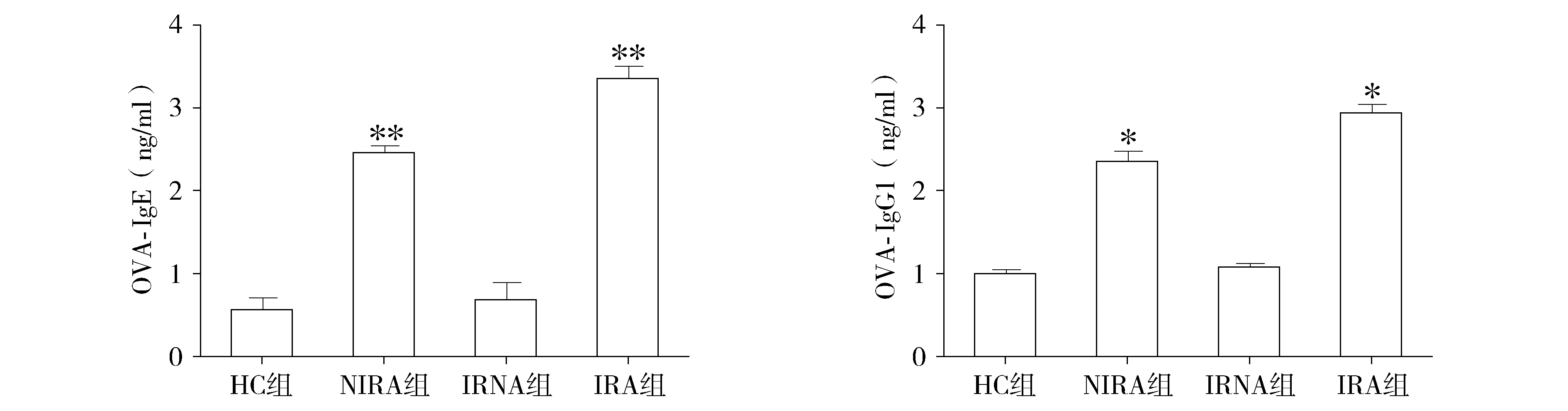
与HC组比较,*P<0.05,**P<0.01图6 小鼠血清抗OVA特异性IgE和IgG1水平 (n=9)Figure 6 The levels of serum OVA specific IgE and IgG1 in four groups (n=9)

与HC组比较,*P<0.05,**P<0.01;与IRNA组相比,#P<0.05,##P<0.01图7 四组小鼠肺泡灌洗液中IL-4、IL-17、INF-γ的浓度 (n=9)Figure 7 The concentrations of IL-4,IL-17 and INF-γ in the BALF in four groups (n=9)
3 讨论
哮喘是全球最常见的慢性疾病之一,据估计,全球大约3亿人患有哮喘,每年约有25万人死于哮喘[2]。哮喘是一种慢性气道炎症性疾病,气道高反应性是支气管哮喘肺功能最典型的病理生理特征之一。AHR的改善程度是评估哮喘治疗效果的重要指标[17]。近年来,大量流行病学调查和研究显示:存在胰岛素抵抗、高胰岛素血症的患者,肺功能均受到不同程度的损伤[12,13]。胰岛素抵抗已成为肥胖儿童哮喘发病增加的重要危险因素,但它们之间的作用机制尚不清楚。我们课题组研究的结果进一步证实了它们之间的相互作用,为进一步机制研究奠定基础。在本次实验中,随着饲养时间的延长,各组小鼠体质量逐渐增加,第5周末,IRNA组、IRA组小鼠肥胖度均超过20%,然而,在第9周末时高脂饮食组(IRNA和IRA组)小鼠才出现胰岛素抵抗,IRNA组(2.82±0.30)、IRA组(2.89±0.37)HOMA-IR值>2.5。结果表明:肥胖不一定伴有胰岛素抵抗,这可能与肥胖持续的时间和程度有关。
众多研究表明,体内Th1/Th2比例失调是导致哮喘发病的重要因素,在哮喘发病过程中Th1细胞功能降低,Th2细胞功能亢进[18]。Th1细胞主要分泌INF-γ等细胞因子,Th2细胞主要产生IL-4、IL-5及IL-13等细胞因子。其中,IFN-γ、IL-4分别是Th1和Th2细胞的特征性细胞因子,嗜酸性粒细胞是哮喘发病的关键效应细胞[19]。在本实验中,经OVA致敏、激发,NIRA组和IRA组小鼠BALF中IL-4(P<0.01)、IL-17(P<0.05)的水平较HC组明显升高,且IRA组明显高于NIRA组(P<0.01);IFN-γ的水平明显降低(P<0.05),且IRA组明显低于NIRA组(P<0.05)。NIRA组和IRA组小鼠均出现不同程度的烦躁或安静少动、全身瘙痒、抓脸、呼吸加快、点头呼吸、弓背直立、前肢缩抬、腹肌抽搐等哮喘速发相表现,HC组和IRNA组小鼠活动自如,无上述表现。与HC组相比,NIRA组和IRA组小鼠血清中IgE(P<0.01)及IgG1(P<0.05)水平显著升高;肺组织病理切片中炎症细胞浸润明显,BALF中白细胞总数、嗜酸性粒细胞百分比明显高于其他各组(P<0.01),且与NIRA组相比,IRA组上述表现更加显著。这些实验室结果表明与单纯哮喘(NIRA)小鼠相比,胰岛素抵抗哮喘(IRA)小鼠哮喘症状、体内炎性因子的改变更为显著,证实了胰岛素抵抗可能通过改变相关炎性因子的水平而加重气道炎症的产生,使气管平滑肌收缩力增加,加重哮喘。
在测定小鼠气道高反应性时,随着吸入Mch浓度的增加,NIRA组、IRA组小鼠气道阻力逐渐增高,而HC组、IRNA组小鼠气道阻力没有明显变化。与HC组相比,在吸入Mch浓度为1.5,3,6、12,25,50,100 mg/ml时,NIRA组和IRA组小鼠气道阻力明显升高(均P<0.05),说明哮喘小鼠和胰岛素抵抗哮喘小鼠的气道高反应性明显增高;与NIRA组相比,在吸入Mch浓度为12,25,50,100 mg/ml时,IRA组小鼠气道阻力明显升高(P<0.05),结果表明在吸入相同浓度的Mch时,胰岛素抵抗哮喘小鼠的气道高反应性增高更为显著,进而说明存在胰岛素抵抗可能会增加气道高反应性,加重哮喘。
综上所述,本实验证实了肥胖不一定存在胰岛素抵抗,这与肥胖持续的时间和程度有关;胰岛素抵抗可以增加哮喘小鼠气道高反应性;同时促进OVA诱导的小鼠哮喘模型中炎性因子IL-4、IL-17的释放,降低IFN-γ的水平,加重气道炎症反应,进而加重哮喘。此次实验为下一步研究胰岛素抵抗和哮喘之间的发病机制奠定基础。
[1] Horak F, Doberer D, Eber E,etal. Diagnosis and management of asthma-Statement on the 2015 GINA Guidelines[J]. Wien Klin Wochenschr, 2016, 128(15-16):541-554.
[2] Bateman ED, Hurd SS, Barnes PJ,etal. Global strategy for asthma management and prevention: GINA executive summary[J]. Eur Respir J, 2008, 31(1):143-178.
[3] Global Initiative for Asthma.Global strategy for asthma management and prevention[EB/OL]. http://ginasthma.org/2017-gina-report/wmsGINA-2017-main-report-final-V2.
[4] Beuther DA, Sutherland ER. Overweight, obesity, and incident asthma: a meta-analysis of prospective epidemiologic studies[J]. Am J Respir Crit Care Med, 2007, 175(7):661-666.
[5] Lang JE, Feng H, Lima JJ. Body mass index-percentile and diagnostic accuracy of childhood asthma[J]. J Asthma, 2009, 46(3):291-299.
[6] Ross KR, Hart MA, Storfer-Isser A,etal. Obesity and obesity related co-morbidities in a referral population of children with asthma[J]. Pediatr Pulmonol, 2009, 44(9):877-884.
[7] Zhang Y, Zhang J, Tian C,etal. The-308 G/A polymorphism in TNF-alpha gene is associated with asthma risk: an update by meta-analysis[J]. J Clin Immunol, 2011, 31(2):174-185.
[8] Karampatakis N, Karampatakis T, Galli-Tsinopoulou A,etal. Impaired glucose metabolism and bronchial hyperresponsiveness in obese prepubertal asthmatic children[J]. Pediatr Pulmonol, 2017, 52(2):160-166.
[9] Gast KB, Tjeerdema N, Stijnen T,etal. Insulin resistance and risk of incident cardiovascular events in adults without diabetes: meta-analysis[J]. PLoS One, 2012, 7(12):e52036.
[10] Walter RE, Beiser A, Givelber RJ,etal. Association between glycemic state and lung function: the Framingham Heart Study[J]. Am J Respir Crit Care Med, 2003, 167(6):911-916.
[11] Davis WA, Knuiman M, Kendall P,etal. Glycemic exposure is associated with reduced pulmonary function in type 2 diabetes: the Fremantle Diabetes Study[J]. Diabetes Care, 2004, 27(3):752-757.
[12] Lawlor DA, Ebrahim S, Smith GD. Associations of measures of lung function with insulin resistance and Type 2 diabetes: findings from the British Women's Heart and Health Study[J]. Diabetologia, 2004, 47(2):195-203.
[13] Engstrom G, Hedblad B, Nilsson P,etal. Lung function, insulin resistance and incidence of cardiovascular disease: a longitudinal cohort study[J]. J Intern Med, 2003, 253(5):574-581.
[14] Matthews D, Hosker J, Rudenski A,etal. Homeostasis model assessment:insulin resistance and B-cell function from fasting plasma glucose and insulin concentrations in man[J].Diabetologia,1985,2(8):412-419.
[15] Yeni-Komshian H, Carantoni M, Abbasi F,etal. Relationship between several surrogate estimates of insulin resistance and quantification of insulin-mediated glucose disposal in 490 healthy nondiabetic volunteers[J].Diabetes Care,2000,2(3):171-175.
[16] Jean PB, Veronique J, Pierre-Henri D. Modified quantitative insulin sensitivity check index is better correlated to hyperinsulinemic glucose clamp than other fasting-based index of insulin sensitivity in different insulin-resistant states[J].J Clin Endocrinol Metab,2003,88(10):4917-4923.
[17] Hospers JJ, Postma DS, Rijcken B,etal. Histamine airway hyper-responsiveness and mortality from chronic obstructive pulmonary disease: a cohort study[J]. Lancet, 2000, 356(9238):1313-1317.
[18] Wegmann M. Th2 cells as targets for therapeutic intervention in allergic bronchial asthma[J]. Expert Rev Mol Diagn, 2009, 9(1):85-100.
[19] Antoniu SA. Cytokine antagonists for the treatment of asthma: progress to date[J]. BioDrugs, 2009, 23(4):241-251.
Effectofinsulinresistanceonairwayhyperresponsivenessandpulmonaryinflammationinthemodelofinsulinresistanceasthma
ZHOU Ningjuan1,ZHANG Juan1,MA Jingyi1,GUO Ying1,TANG Liping1,SU Hui2,SUN Xin1*
(1DepartmentofPediatrics,XijingHospital,FourthMilitaryMedicalUniversity,Xi’an710032,China;2DepartmentofGeriatrics,XijingHospital;*Correspondingauthor,E-mail:sunxin6@fmmu.edu.cn)
ObjectiveTo explore the effects of insulin resistance on airway hyperresponsiveness(AHR) and pulmonary inflammation in the asthma mice.MethodsSixty 3-week-old specific pathogen free level male C57BL/6J mice were randomly divided into four groups: healthy control group(HC), non-insulin resistance asthmatic group(NIRA), insulin resistance non-asthmatic group(IRNA) and insulin resistance asthmatic group(IRA). The mice
a standard chow diet in HC group and NIRA group, and a high-fat diet(D12492) in IRNA group and IRA group. After feeding for 9 weeks, insulin resistance was assessed by homoeostasis model assessment-estimated insulin resistance(HOMA-IR). After insulin resistance mouse model was successfully established, the mice in NIRA group and IRA group were intraperitoneally sensitized and orally challenged with ovalbumin(OVA)respectively to induce allergic asthma, while the mice in HC group and IRNA group were treated with equal normal saline(NS)as control. In 24 h after the last challenge, the mice were successively given inhalation of 0, 3, 6, 12, 25, 50, 100 mg/ml Mch to detect the bronchial hyperreactivity and prepare lung tissue section for morphometrical lung analysis. Leukocyte and its subgroup populations in the bronchoalveolar lavage fluid(BALF) were counted, and the levels of inflammatory factors were detected.Changes of airway hyperresponsiveness and the levels of inflammatory cytokines were compared.ResultsCompared to NIRA group, AHR significantly increased at 12, 25, 50, 100 mg/ml in IRA group(P<0.05). There was no appreciable inflammatory cell infiltration in lungs in HC group and IRNA group. However, the inflammatory infiltration was obviously observed in both NIRA group and IRA group, especially IRA group. Compared to HC group, the number of total inflammatory cells and eosinophils increased in NIRA group and IRA group(P<0.01), OVA-specific IgE and IgG1 were also significantly elevated in NIRA group and IRA group(P<0.01 orP<0.05),Th2 cytokines(IL-4, IL-17) in the BALF were significantly increased in NIRA group and IRA group(P<0.01 orP<0.05), especially in IRA group,while the level of IFN-γ decreased in NIRA group and IRA group(P<0.05).ConclusionInsulin resistance can aggravate the occurrence and development of asthmais by promoting the release of inflammatory cytokines,increasing AHR, and promoting the airway remodeling.
insulin resistance; asthma; bronchial hyperreactivity; inflammatory cytokines
国家自然科学基金资助项目(81670449,31371151,31271219)
周宁娟,女,1985-02生,硕士,主治医师,E-mail:zhounjqm@163.com
2017-07-18
R562.25
A
1007-6611(2017)11-1129-06
10.13753/j.issn.1007-6611.2017.11.009

