杨树苗木完整植株根压的昼夜节律及其影响因素*
郭建荣 万贤崇
(中国林业科学研究院林业新技术研究所 北京 100091)
杨树苗木完整植株根压的昼夜节律及其影响因素*
郭建荣 万贤崇
(中国林业科学研究院林业新技术研究所 北京 100091)
【目的】 对84K杨树(Populusalba×P.glandulosa)苗木完整植株的根压进行连续测定,研究根压昼夜节律和蒸腾作用、木质部汁液渗透质的关系,为揭示在自然条件下完整植物的根压昼夜节律及发生规律提供参考。【方法】 在自然条件下,运用侧面开孔法对杨树苗木完整植株的根压昼夜周期进行测定,并测定叶片水势、根系和茎干木质部汁液的渗透势、无机离子及可溶性糖含量的日变化。【结果】 完整杨树植株的根压可以通过侧面开孔法进行监测,测定结果可靠性强。在自然条件下完整植株的根压和去顶根系的根压具有相似的昼夜节律,即昼高夜低,但是完整植株的最大根压值相对较小,且受蒸腾作用的影响。上午蒸腾拉力导致的水势下降并没有抑制根压的上升,中午水势降到一定程度后,根压才迅速下降。1天内任何时间,杨树苗木茎干不同部位木质部汁液存在自上而下渗透势梯度,越到上部渗透势越低,中午尤为突出。此外,茎干木质部汁液渗透势比根系木质部汁液低,根系木质部汁液渗透势在凌晨最低。根系木质部汁液的渗透物质主要是由矿质元素组成,其次是可溶性糖。【结论】 完整植株的根压和去顶根系的根压一样,具有明显的昼夜节律,但是在蒸腾作用的影响下最大根压值较小。根压具有较强的自主性,在一定程度上能够抗衡蒸腾拉力。茎干木质部汁液渗透势比根系木质部汁液低,根系木质部汁液的渗透势在凌晨最低,吸水动力最强。
完整植株; 根压; 84K杨; 渗透势; 无机离子; 可溶性糖
根压在植物体内水分吸收和运输过程中发挥着重要作用(Tyreeetal., 2002),在蒸腾作用变弱时蒸腾拉力变弱,根压成为水分向上运输的主要动力(Zimmermann, 2002),并且正的根压对导管中气穴栓塞修复也有积极作用(Fisheretal., 1997)。Sperry等(1987)对野葡萄(Vitislabrusca)冬季枝条萌发期间的木质部导水率和根压测定发现,在枝条萌发前木质部栓塞得到修复,根压为10~100 kPa,因此认为根压在栓塞修复过程中帮助气泡溶解并排出输水管道之外; 竹子(Bambusoideae)等单子叶植物的导管日栓塞修复也依赖于根压(Wangetal., 2011; Caoetal., 2012)。根压产生于根系木质部汁液溶质渗透势(Henzleretal., 1999; Ennsetal., 2000),广泛存在于植物中(Davis, 1961; Sperry, 1983; Putz, 1983; Ewersetal., 1997; Wangetal., 2011)。根压的日变化早有报道(Grossenbacher, 1938; Hagan, 1949),Henzler等(1999)通过根压探针研究唐本草(Lotusjaponicus)离体根系的根压、根系导水率等,发现根压存在明显的日变化。根压的产生依赖于根系外皮层消耗ATP(Ennsetal., 2000; Ewersetal., 2001)来主动吸收矿质元素并向中柱的转运过程(Tyreeetal., 1994; Krameretal., 1995)。呼吸代谢是植物ATP的来源,因此,呼吸作用在根系水分吸收中起着关键作用(Wilsonetal., 1949)。
以上关于根压的动态变化、产生机制和影响因素的研究绝大部分都是通过对离体根系的研究取得的,而对完整植株根压及水分、物质运输关系的研究少有报道。传统根压测定通常是用去顶的根系或离体根段来实现(Cochardetal., 1994; Fisheretal., 1997; Ewersetal., 2001),这样测定的根压昼高夜低周期性明显(Henzleretal., 1999),然而在完整的植株中,白天有强烈的蒸腾作用,根压是否存在昼高夜低现象还不得而知。Clearwater(2007)用侧面开孔的方法对猕猴桃(Actinidiachinensis)嫁接后砧木的根压进行长期监测,发现其根压在叶片萌发期间昼高夜低,而在叶片展开后则是昼低夜高。
蒸腾作用强烈时,植物体内水分大量散失,会在木质部产生强大的蒸腾拉力,即由内聚力-拉力(CT)学说所假设(Tyree, 2003),这一拉力会驱动水分迅速提升,是蒸腾条件下水分运输的主要动力,此时茎、叶木质部都呈现负压。蒸腾作用在日间较高,夜间很低或没有(Granier, 1987)。目前,完整植株的蒸腾作用对根压的影响尚未见报道。蒸腾作用存在条件下,水分运输和物质合成运输都处在活跃状态下,有利于植株各器官水分及养分的供应,那么,蒸腾作用对根系活动可能也存在积极作用。本研究参照Clearwater等(2007)的方法测定杨树完整植株的根压昼夜节律,通过对叶片水势日周期的监测,了解蒸腾作用对叶片木质部压力的影响,并测定根木质部汁液的渗透势及其离子和可溶性糖含量的日变化,分析它们与根压之间的关系。
1 材料与方法
1.1试验材料
从中国林业科学研究院林木育种国家重点实验室获得84K杨(Populusalba×P.glandulosa)组培苗。试验时间为2015年。组培苗在培养杯中生长40天,约8 cm高时移栽至盛有珍珠岩的塑料钵中,钵的大小为10 cm×10 cm。幼苗成活后每周浇灌1次4倍液浓度的霍格兰氏营养液,每株施10粒控释肥(N-P-K∶16-9-12+2MgO+TE, Osmocote Extra, Everris Internation B.V., The Netherlands)。幼苗生长在温室中,自然光照,温度16~26 ℃,2周以后移栽到混合基质中继续培养3周。混合基质的组成是椰糠∶泥炭土∶砂=1∶1∶1,比例为质量比。之后,幼苗移至较大的135 cm×150 cm的容器内,并转移至室外养育3~4周。
1.2试验方法
1.2.1 离体根系根压的测定 参照Cao 等(2012)所描述的方法。运用低能耗热电偶压力转换器(CX136-4, OMEGA, Canada)测定根压,以与大气压的相对值表示,压力转换器预先用压力表(Cole-Parmer)进行校准。将压力转换器连接到数据采集器(CR1000, Campbell Scientific, USA)上进行数据记录,数据每分钟记录1次。试验从傍晚开始,将苗木从室外苗圃带回实验室,每株浇水80 mL,从距离地面约7 cm处剪去地上部分,套上注满除气水的管子,此过程在水面下完成。之后将压力转换器与管子连接,整个系统内注满除气水,避免气泡存在。
1.2.2 完整植株根压的测定 完整植株根压的测定参照Clearwater等(2007)的方法,采用侧面开孔法选择基茎1.5 cm左右的苗木,距地面约8 cm处侧面,用直径为2 mm的钻头打1个深约8 mm的小孔,孔钻好之后立即用除气蒸馏水冲洗干净并注满,插入cole-parmer两向接头,用封口膜辅助密封和固定,再连接三向接头,之后与压力转换器相连。为了证实这种方法的可靠性做了验证试验: 取高约40 cm的苗木,像通常的离体根压测定一样,距地面约7 cm,剪去地上部分,在顶端切口连接1个压力转换器。另外,在茎基的侧面开直径2 mm孔口,如上连接另一个压力转换器。2个压力转换器同时监测根压的变化,其结果(图1)证明侧面开孔测定的方法是可靠的。此后用侧面开孔的方法测定完整植株的根压,测定在室外自然条件下进行,同时记录根压和气温的变化。根压测定在人工培养箱(RXZ-500C, Ningbo Southeast Instrument Co., LTD)中进行,培养箱设置: 昼夜(15 h/9 h)温度(25 ℃/25 ℃),相对湿度65%,光照强度为100 mmol·m-2s-1。测定时间均为72 h。
1.2.3 叶片水势日变化 用压力室(SAPSⅡ, 3115,SEC,USA)法测定叶片水势。从凌晨开始,在室外苗圃,每小时随机取8片叶子(不同植株)测定叶片水势,测定持续至次日凌晨。
1.2.4 根系木质部汁液的取样方法及渗透压的测定 苗木生长至40 cm左右时,将其转移到人工培养箱(RXZ-500C, Ningbo Southeast Instrument Co., LTD)中培养1周。培养箱设置: 昼夜(15 h/9 h)温度(25 ℃/19 ℃),相对湿度65%,光照强度为100 mmol·m-2s-1。木质部汁液的取样采用加压法。试验前确保苗木培养基湿润,距地面6 cm处剪去整个地上部分,根系连同培养基一起放置到压力室中,基茎穿过压力室盖上面的橡胶密封塞通到压力室外,茎上端除去5 mm的树皮,套上一段橡胶管。首先,测定根系的平衡压,然后上调1 bar,开始收集汁液。将最初1 min收集到的汁液舍弃,然后收集之后5 min渗出的汁液,置入离心管中,称量,用渗压计(Osmomat 030,Gonotec,Germany)测定渗透压,剩余样品冷冻保存,备用。每小时取样1次,每次测定6株苗木。
渗压计测得的渗透压单位是osmol·kg-1,表示每千克溶液中所含能够产生渗透压力的溶质的摩尔数,通过下式换算成渗透势:
Ψs=-iCRT。
其中:i为溶质的解离系数,C为质量摩尔浓度,R为气体常数,T为热力学温度。测得的结果通过计算,得出汁液的渗透势,单位表示为kPa。
1.2.5 茎干木质部汁液的取样方法及渗透压的测定 凌晨5:00开始取样,取样时从距茎杆基部8 cm处剪取地上部分,迅速除去叶片,将茎杆按长度平均分成顶端、中间和基部3部分,标记,置入放有湿润滤纸的自封袋内,放入冰盒,立即带回实验室。然后将每个茎段分别除去皮层和韧皮部,剪成5 cm长的茎段,放入带有支架的15 mL离心管中,8 000 r·min-1离心(Allegra X-22R, Beckman Coulter, USA)10 min收集汁液,置入2 mL的离心管中,12 000 r·min-1再次离心10 min去除沉淀,将上清液转移至新的离心管,标记,用渗压计(Osmomat 030,Gonotec,Germany)测定渗透压,剩余样品冷冻保存。枝条的取样和汁液收集过程尽量迅速,以减少木质部导管内汁液与周围薄壁细胞间的物质转运。5:00、12:00和20:00各取样1次,每次测定6~7株。
渗透压的测定及渗透势的计算同1.2.4。
1.2.6 无机离子和可溶性糖含量的测定 无机离子的测定参考Secchi等(2012)的方法,用电导电极(In Lab Ultra-Micro, Mettler Toledo)测定样品的电导率,每个样品测定结束后,用去离子水清洗电极并自然晾干。每个样品的取样均为5 min,为便于比较统一转换为mmol·min-1。用硫酸蒽酮法测定可溶性糖含量,参照Secchi等(2012)方法,分别取50 μL对照和样品, 然后加入150 μL蒽酮试剂, 4 ℃10 min, 100 ℃温育20 min, 室温冷却20 min, 用96孔板在A620读数,重复3次,单位mg·mL-1,需要制作糖标准曲线,测定结果统一表示为mmol·min-1。
1.3统计分析
用SPSS(IBM SPSS Statistics 20)软件进行单因子方差分析及差异性比较。用Sigma Plot (Sigma Plot 10.0) 软件作图。除特别注明外,所有测定均为6个重复。
2 结果与分析
2.1完整植株根压测定方法验证
用顶端和侧面开孔2种方法连接根压力转换器测定同一株苗木的离体根系根压,结果显示: 2种方法测得的离体根系根压,表现出的一致规律,即昼高夜低,在上午达到最大值,在20:00达到最低值。侧面开孔测得的根压值略高(图1)。
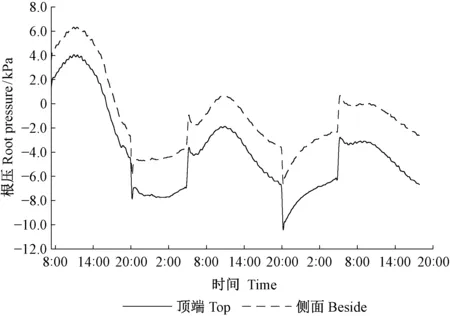
图1 苗木茎杆顶端和侧面测定离体根系的根压(n=1)Fig.1 Root pressure of excised roots measured from top and beside (n=1)
2.2室外自然条件下完整植株的根压
自然条件下完整植株的根压从凌晨至正午迅速升高,在11:30左右达到最高峰,之后逐渐下降,至17:00左右到达谷值,之后又开始逐渐上升(图2A)。气温最高在中午12:00左右,最低在凌晨5:00左右(图2B)。
2.3完整植株根压与叶片水势的关系
在室外自然条件下完整植株根压从午夜至凌晨变化较小,之后逐渐上升;08: 00—11:00迅速上升达到最大值,之后又迅速下降;在午后15:00达到最低值,之后缓慢波动上升(图3A)。叶片水势从午夜到凌晨变化不大,自凌晨开始逐渐降低,从8: 00—11: 00迅速下降,之后继续缓慢下降,在16:00降至最低值,接着开始迅速上升,到19:00在较高水平上趋于平缓,之后慢慢上升,到凌晨达到最高值。从凌晨开始,随日时间进程,叶片水势逐渐降低,而根压逐渐上升,当叶片水势降至一定程度时(-12 kPa),根压开始下降,午后一直保持较低水平,傍晚当叶片水势回升至-4 kPa时,根压略有上升(图3B)。
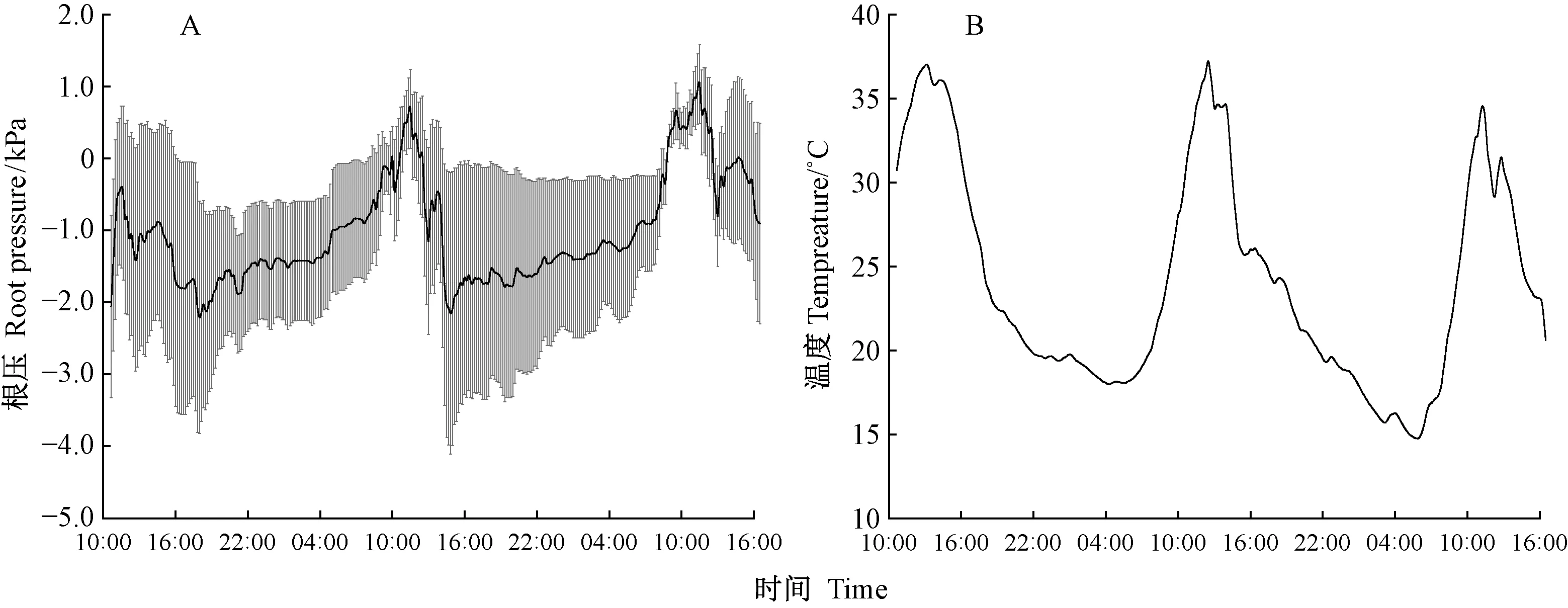
图2 室外条件下测定的完整植株根压(n=4)和温度Fig.2 Root pressure of intact seedlings (n=4) and temperature measured under natural condition outside
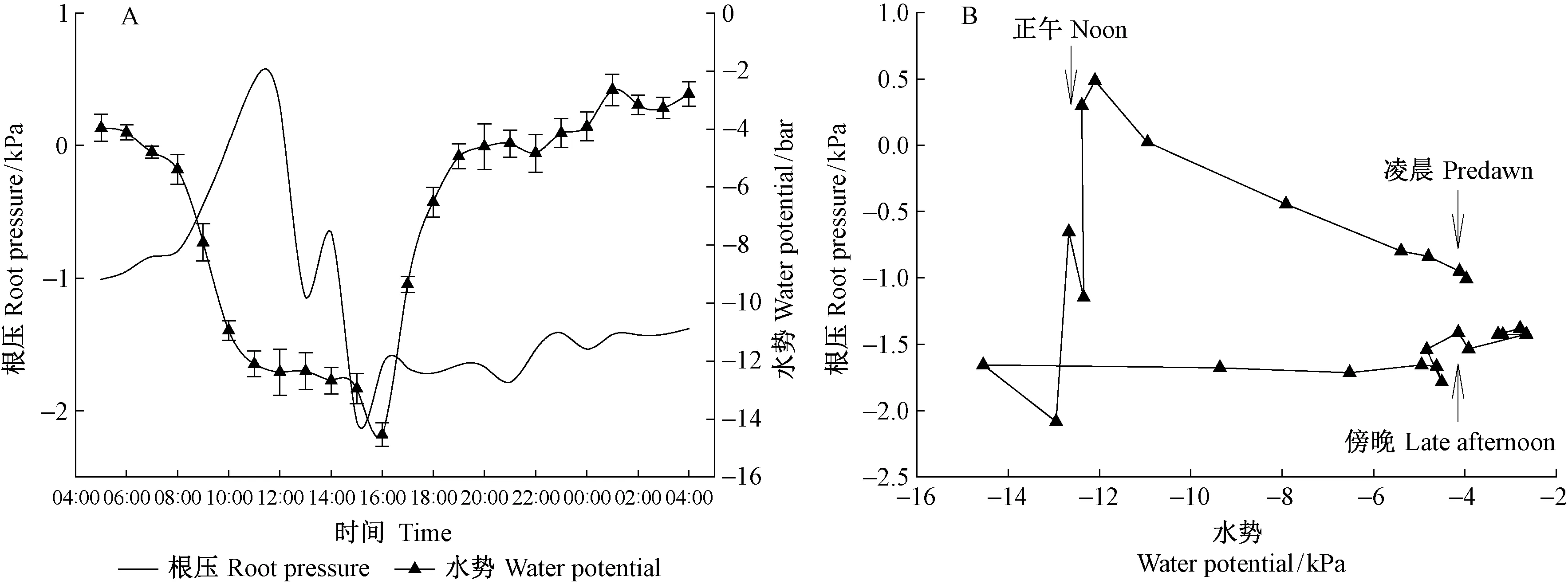
图3 根压与叶片水势的日变化(n=8)及二者的关系Fig.3 Diurnal variation (n=8) and relationshipof root pressure and leaf water potential
2.4根系木质部汁液渗透势的日变化
根系木质部汁液的渗透势整体处在动态变化中,可以分为3个阶段: 5:00—10:00的快速上升期; 之后整个白天乃至午夜都维持在较高水平,期间15:00—22:00有1次下降和上升; 0:00—5:00的迅速下降期(图4)。完整植株自然条件下5:00—11:00测得的根压在与渗透势的表现较为一致,迅速升高。
2.5根系木质部汁液无机离子和可溶性糖含量的日变化
根系木质部汁液无机离子含量在凌晨4:00—5:00最高,之后逐渐下降,在午后15:00达到最低值,之后一直处在波动上升过程(图5A)。可溶性糖含量是在6:00—9:00迅速上升,在9:00—10:00急剧下降,在13:00达到谷值,之后开始缓慢波折上升,直至凌晨5:00(图5B)。
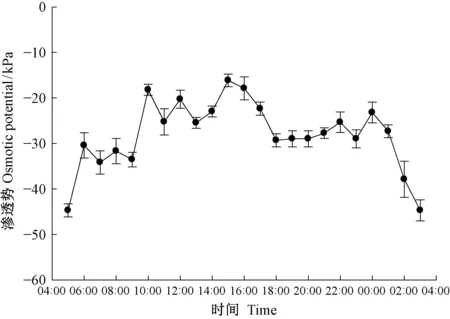
图4 根系木质部汁液渗透势的日变化Fig.4 Diurnal variation of osmotic potential of xylem sap from the roots
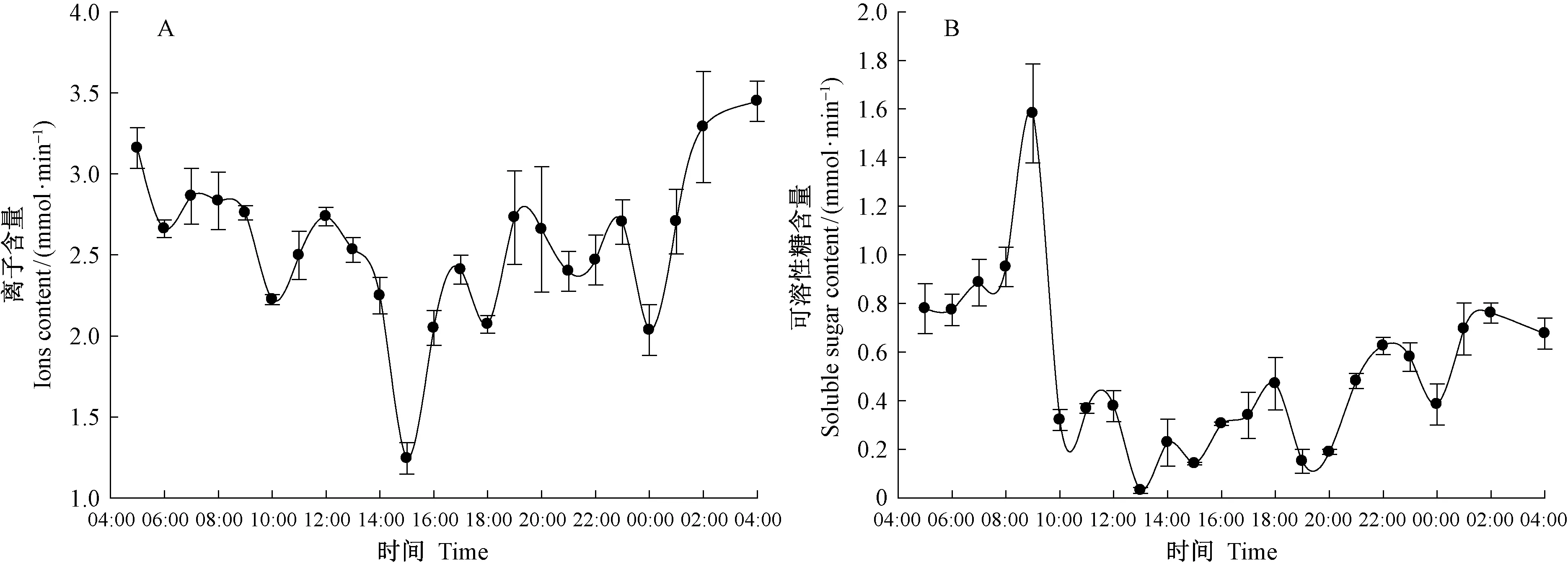
图5 根系木质部汁液中无机离子、可溶性糖含量日变化Fig.5 Diurnal variation of ions and soluble sugar content of xylem sap from the roots
2.6茎干不同部位木质部汁液渗透势的日变化
茎干顶端、中部、基部木质部汁液渗透势均是在正午最低,傍晚较低,凌晨最高(图6)。其中顶端木质部汁液渗透势在傍晚和凌晨差异不显著(Pgt;0.05),正午显著降低(Plt;0.05); 中部木质部汁液渗透势凌晨与正午存在显著差异,和傍晚差异不显著,正午与傍晚也差异不显著; 基部木质部汁液渗透势在3个时间点之间均无显著性差异。不同部位比较表明,无论是凌晨、中午、还是傍晚,顶端木质部汁认渗透势都是最低,中部次之,基部最高。

图6 凌晨、正午、傍晚取样茎不同部位木质部汁液的渗透势Fig.6 Osmotic potential of xylem sap of stem from different part sampled at predawn, noon and late afternoon
3 讨论
在本研究中,运用侧面开孔法对完整植株根压周期性进行研究。为验证这种方法的可靠性,用去顶根系的顶端和其下部侧面开孔分别连接1个压力转换器,监测同1株苗木根压周期变化,2种方法所得结果显示出一致的规律,侧面开孔测得的根压值略大于顶端连接。由此可见,侧面开孔方法连接根压力转换器,测量系统内的液体可以与茎木质部汁液较好联通,而且打孔对根压的规律不产生影响,此方法可行。这是因为测量位置离根系越近,测得的根压值就越大(Ewersetal., 2001),因此侧面开孔方法测得的根压值略大是合理的。
完整植株的根压呈现出昼夜周期性,其节律和去顶根系的一样,昼高夜低,但完整植株根压的日振幅小,根压一直在上下震荡,致使整个曲线不光滑,剧烈波动。尽管在不同生长环境下,或在不同生长阶段,杨树根压值自身会有较大变异,但是完整植株和去顶根系相比,最大根压值相对较小(图1,2)。温度的周期性和根压的周期有相似的趋势,但可以看出,根压周期并不是由温度周期决定的,根压和温度的变化不同步,根压的峰值、谷值都比温度峰值、谷值出现得早。
白天随着气孔张开,蒸腾速度上升,蒸腾拉力导致植物叶片水势持续下降。当蒸腾拉力超过根压,根压随之变为负值。从试验结果来看,整个上午蒸腾拉力并没有抑制根压,只是到中午,水势降到一定程度后,根压迅速下降,此后直至凌晨之前根压一直为负值。从这个结果可以看出,根压从下(根系)往上传递,而蒸腾拉力从上(叶片)往下传递。即使在蒸腾旺盛的上午,根压仍然为正值,保持自身昼高夜低的节律。不过蒸腾拉力可能在一定程度减小根压。
杨树茎干不同部位木质部汁液存在自上而下渗透势梯度,越到上部渗透势越低,且在1天内任何时间都维持这个梯度,这个结果支持先前提出的假说(Zimmermannetal., 2002; Braun, 1984)。内聚力学说(Steudle, 2001)认为,木质部汁液存在沿树木高度的张力梯度,而这种渗透梯度和张力梯度相符,可见渗透梯度可能参与木质部水势梯度的维持。越在高处水势越小,以保证导管或管胞中的水不下落。即使在凌晨蒸腾速率很低的情况下,顶部比中、下部都低,不过此时中、下部之间渗透势没有明显区别,这时可能是由于根系的渗透强度在1天中最大、离子浓度最高所致(图4)。这一结果说明在木质部导管系统中,从上到下、从地上到地下部分,其汁液存在渗透梯度。根系吸收、积累渗透物质,降低其木质部汁液的水势,使之产生根系木质部和土壤溶液之间的渗透梯度,导致根系吸水。但根系渗透强度始终低于植物地上部分。
人们普遍接受的根压产生机制是渗透理论(Krameretal., 1995),根压依赖于根系内皮层内外的水势差,外皮层消耗ATP主动运输无机离子至中柱,以降低中柱的渗透势,渗透势越低越能产生较大的根压(Clearwateretal., 2007)。根系木质部汁液渗透势在凌晨最低,吸水动力最强。根系木质部汁液渗透物质主要是矿质元素组成,不过可溶性糖也扮演重要的角色。需要指出,虽然6:00之后整个上午的根系木质部汁液渗透强度也有所下降,但下降并不多,根系木质部汁液的渗透强度始终保持较高水平,克服蒸腾流带走的渗透物质,同时还产生并维持较高的根压。说明根系产生渗透物质具有很强的节律性。午后,根压迅速下降并一直处在较低状态,在此段时间内,植株主要通过蒸腾拉力进行水分补充。由于蒸腾作用,植株顶端木质部积累大量无机离子,渗透势降低,而根系木质部渗透势一直处在较高水平,因此植株木质部从上到下存在渗透梯度,驱动水分提升。
根系木质部汁液可溶性糖一方面可以提供渗透作用,另一方面为根系活动提供了能量。可溶性糖含量峰值出现在根压峰值之前,表明可溶性糖大量被根系消耗,可能用于转运矿质元素使之提高并保持根压。
4 结论
完整杨树植株根压可以通过侧面开孔法进行监测,测定结果可靠性强。在自然状态下完整植株的根压和去顶根系的根压具有相似的昼夜节律,即昼高夜低,但是受蒸腾作用影响,完整植株的最大根压值相对较小。根压具有较强自主性,整个上午蒸腾拉力导致的水势下降并没有很快地抑制根压,中午水势降到一定程度后,根压才迅速下降。另外,发现杨树茎干不同部位木质部汁液存在自上而下渗透势梯度,越上部渗透势越低,而且在1天内任何时间都维持这个梯度,中午尤为突出,这个结果支持内聚力学说,且茎干木质部汁液渗透势比根系木质部汁液低。根系木质部汁液的渗透势在凌晨最低,吸水动力最强。根系木质部汁液的渗透物质主要是由矿质元素组成,其次是可溶性糖。
Braun H. 1984. The significance of the accessory tissues of the hydrosystem for osmotic water shifting as the second principle of water ascent, with some thoughts concerning the evolution of trees. IAWA Bull (NS), 5(4):275-94.
Cao K F, Yang S J, Zhang Y J,etal. 2012. The maximum height of grasses is determined by roots. Ecology Letters, 15(7):666-672.
Clearwater M J, Blattmann P, Luo Z,etal. 2007. Control of scion vigour by kiwifruit rootstocks is correlated with spring root pressure phenology. Journal of Experimental Botany, 58(7):1741-1751.
Cochard H, Ewers F, Tyree M. 1994. Water relations of a tropical vine-like bamboo (Rhipidocladumracemiflorum): root pressures, vulnerability to cavitation and seasonal changes in embolism. Journal of Experimental Botany, 45(8):1085-1089.
Davis T. 1961. High root-pressures in palms. Nature, 192(4799):277-278.
Enns L, Canny M, McCully M. 2000. An investigation of the role of solutes in the xylem sap and in the xylem parenchyma as the source of root pressure. Protoplasma, 211(3/4):183-197.
Ewers F W, Cochard H, Tyree M T. 1997. A survey of root pressures in vines of a tropical lowland forest. Oecologia, 110(2):191-196.
Ewers F W, Améglio T, Cochard H,etal. 2001. Seasonal variation in xylem pressure of walnut trees: root and stem pressures. Tree Physiology, 21(15):1123-1132.
Fisher J B, Angeles G A, Ewers F W. 1997. Survey of root pressure in tropical vines and woody species. International Journal of Plant Sciences, 158(1):44-50.
Granier A.1987. Evaluation of transpiration in a Douglas-fir stand by means of sap flow measurements. Tree Physiology. 3(4):309-320.
Grossenbacher K A. 1938. Diurnal fluctuation in root pressure. Plant Physiology, 13(4):669-676.
Hagan R M. 1949. Autonomic diurnal cycles in the water relations of nonexuding detopped root systems. Plant Physiology, 24(3):441-454.
Henzler T, Waterhouse R N, Smyth A J,etal. 1999. Diurnal variations in hydraulic conductivity and root pressure can be correlated with the expression of putative aquaporins in the roots ofLotusjaponicus. Planta, 210(1):50-60.
Kramer P J, Boyer J S. 1995. Water relations of plants and soils. Orlando: Academic Press.
Putz F E. 1983. Liana biomass and leaf area of a ‘tierra firme’ forest in the Rio Negro Basin, Venezuela. Biotropica, 15(3):185-189.
Secchi F, Zwieniecki M A. 2012. Analysis of xylem sap from functional (nonembolized) and nonfunctional (embolized) vessels ofPopulusnigra: chemistry of refilling. Plant Physiology, 160 (2):955-964.
Sperry J S. 1983. Observations on the structure and function of hydathodes inBlechnumlehmannii. American Fern Journal, 73(3):65-72.
Sperry J S, Holbrook N M, Zimmermann M H,etal. 1987. Spring filling of xylem vessels in wild grapevine. Plant Physiology, 83(2):414-417.
Steudle E. 2001. Thecohesion-tension mechanism and the acquisition of water by plant roots. Annual Review of Plant Physiology and Plant Molecular Biology, 52:847-875.
Tyree M T. 2003. Plant hydraulics: the ascent of water. Nature, 423(6943):923.
Tyree M T, Yang S, Cruiziat P,etal. 1994. Novel methods of measuring hydraulic conductivity of tree root systems and interpretation using AMAIZED (A maize-root dynamic model for water and solute transport). Plant Physiology, 104(1):189-199.
Tyree M T, Zimmermann M H. 2002. Xylem structure and the ascent of sap. Berlin: Springer.
Wang F, Tian X, Ding Y,etal. 2011. A survey of root pressure in 53 Asian species of bamboo. Annals of Forest Science, 68(4):783-791.
Wilson C, Kramer P. 1949. Relation between root respiration and absorption. Plant Physiology, 24(1): 55-59.
Zimmermann U, Schneider H, Wegner L H,etal. 2002. What are the driving forces for water lifting in the xylem conduit? Physiologia Plantarum, 114(3):327-335.
(责任编辑 王艳娜 郭广荣)
CircadianRhythmofRootPressureinIntactPoplarSeedlingsandtheInfluencingFactors
Guo Jianrong Wan Xianchong
(InstituteofNewForestryTechnology,ChineseAcademyofForestryBeijing100091)
【Objective】 In this study, we continuously measured the root pressure of intact seedlings of 84 K popular (Populusalba×P.glandulosa) with the pressure transducer technique, and investigated relationships between diurnal rhythm of root pressure and transpiration and xylem sap osmotic osmolytes, in order to reveal the diurnal rhythm of root pressure and its occurrence pattern in intact plants under natural conditions.【Method】 A hole was drilled through the bark into the xylem of the stemnear the base, and a compression fitting was inserted into the hole and connected to a pressure transducer. With this method, we measured in situ the diurnal rhythm of root pressure of intact popular seedlings in field. We also measured diurnal variations of the leaf water potential, as well as the osmotic potential, ions and soluble sugarscontent in xylem sap from roots and stems. 【Result】 The root pressure of intact seedling could be measured in situ by side hole opening method, and the result was reliable.The root pressure of intact plantshad similar diurnal rhythm to that obtained with the decapitated root systems, that is, root pressure was high in daytime and low at night. However, the maximum root pressure of intact plants was relatively lower than that by the decapitation method, which might be due to the influence of transpiration. The reduction of water potential caused by transpiration in the morning did not conceal the root pressure. Until noon,when water potential descended to a threshold,the root pressure declined rapidly. There existed a top down osmotic potential gradient in xylem sap across popular stem,and it was lower in the upper position and higher in the bottom of the stem.The gradient maintained at any point within a day, particularly at noon. Osmotic potential of stem xylem sap was lower than that of roots. Osmotic potential of root xylem sap was lowest at the predawn time. The osmotic substance inxylem sap from roots was mainly composed by mineral ions,but the role of soluble sugar couldnot be ignored too. 【Conclusion】 Root pressure of intact seedlings possesses a similar daily rhythm with that of decapitated roots, but the maximum value of intact root pressure is lower than that by the traditional destructive method, possibly due to the influence of transpiration.Root pressure can counter-balance the transpiration to a certain extent. Osmotic potential in root xylem sap was lowest at the predawn time,thereby providing the maximum driving force for upward water transport due to the existence of a osmotic gradient between stem and root. The osmotic substance in xylem sap from roots was mainly composed by mineral ions but the soluble sugars components can not be ignored.
intact seedling; root pressure;Populusalba×P.glandulosa; osmotic potential; ions; soluble sugar
10.11707/j.1001-7488.20171003
2016-03-25;
2016-04-21。
国家自然科学基金项目 (31270648)。
*万贤崇为通讯作者。
S792.12
A
1001-7488(2017)10-0022-07

