化学反应原理综合测评
化学反应原理综合测评

( )


( )
A.ΔS1>0,ΔS2>0 B.ΔS1<0,ΔS2<0
C.ΔS1<0,ΔS2>0 D.ΔS1>0,ΔS2<0
3.下列措施中,能减慢化学反应速率的是
( )
A.用4 mol/L H2SO4溶液代替1 mol/L H2SO4溶液与锌粒反应
B.将块状固体药品研细后再反应
C.用FeCl3溶液作H2O2分解反应的催化剂
D.食物存放在温度低的地方
4.(甘肃一诊)下列有关电解质溶液的说法正确的是
( )
A.在蒸馏水中滴加浓H2SO4,Kw不变
B.CaCO3不易溶于稀硫酸,也不易溶于醋酸
C.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
D.在Na2S稀溶液中,c(H+)=c(OH-)-2c(H2S)-c(HS-)
5.(北京西城期末考试)用如图所示装置进行实验,下列叙述不正确的是
( )
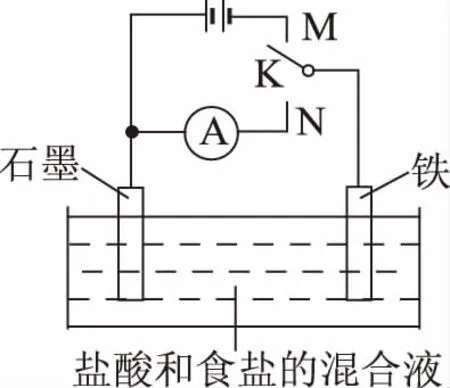
A.K与N连接时,铁被腐蚀
B.K与N连接时,石墨电极产生气泡
C.K与M连接时,一段时间后溶液的pH增大

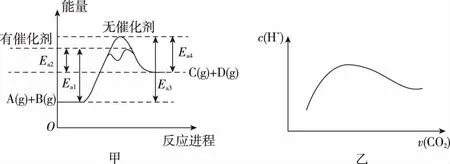
6.根据如图提供的信息,下列所得结论正确的是
( )

A.该反应一定能自发
B.该反应向外界放出的热量为E2-E3
C.该反应向外界放出的热量为E1-E3
D.该反应一定可以设计成为原电池
7.(太原第二学段测评)已知25℃时Mg(OH)2的Ksp为1.8×10-11,MgF2的Ksp为6.4×10-9。下列说法正确的是
( )
A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者c(Mg2+)大
B.25℃时,Mg(OH)2固体在氨水中的Ksp比在NH4Cl溶液中的Ksp小
C.25℃时,向Mg(OH)2的饱和溶液中加入少量NH4Cl固体,c(Mg2+)减小
D.25℃时,饱和Mg(OH)2溶液与0.1 mol·L-1NaF溶液等体积混合,能生成MgF2沉淀
8.(陕西西工大附中适应性训练四)室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示。下列说法正确的是
( )

A.稀释前,c(A)=10c(B)
B.稀释前,A溶液中由水电离出的OH-的浓度大于10-7mol/L
C.用醋酸中和A溶液至恰好完全反应时,溶液的pH为7
D.在M点,A、B两种碱溶液中阳离子的物质的量浓度相等
9.下列叙述不正确的是
( )

B.常温常压下,向Na2CO3溶液中通入CO2,溶液中由水电离出的c(H+)变化如图乙所示
C.已知CaCO3的Ksp=2.8×10-9,现将等体积的Na2CO3溶液与CaBr2溶液混合,若CaBr2溶液的浓度为5.6×10-5mol/L,则生成沉淀所需Na2CO3溶液的最小浓度为2×10-4mol/L
D.某温度下,某浓度的氨水和pH=1的盐酸等体积混合后(不考虑混合后溶液体积的变化)恰好完全反应,反应后的溶液中NH+4、NH3·H2O与NH3三种微粒的平衡浓度之和为0.05 mol·L-1
10.(贵阳适应性监测一)图中A、B两烧杯分别盛有100 g 10%的NaOH溶液和足量CuSO4溶液,用惰性电极按如图装置进行实验。实验中,观察到d电极上有红色固体析出。请回答下列问题:

(1)装置中电源的Q极为________极。
(2)装置B中发生的总反应的离子方程式为________________。
(3)通电一段时间后,测得A烧杯溶液中NaOH的质量分数为10.47%,此时a极产生气体的体积为____________L(标准状况),d极上析出固体的质量为____________g。若此时测得A溶液密度为1.112 g/cm3,则A中溶质的物质的量浓度约为____________(计算结果保留一位小数)。


时间(s)n(mol) 020406080100n(N2O4)0.40a0.20cden(NO2)0.000.24b0.520.600.60
(1)计算0~20 s内用N2O4表示的平均反应速率为________;80℃时该反应的平衡常数为____________。(答案均保留两位有效数字)
(2)要增大N2O4的转化率,同时增大该反应的K值,可采取的措施是________________。
(3)图甲是80℃时容器中N2O4物质的量的变化曲线,请在图中补画出该反应在60℃时N2O4物质的量的变化曲线。


(4)写出该反应的热化学方程式:________________。
(5)已知该反应中相关的化学键键能数据如下:

化学键H—HC—OH—OC—HE/(kJ·mol-1)436343465413
则CO中C≡O的键能为________kJ·mol-1;图乙中的曲线Ⅱ表示________(填反应条件)的能量变化。
(6)写出O2作氧化剂的CH3OH燃料电池,以KOH溶液作为电解质时,负极的电极反应式:________________。
12.(陕西西工大附中适应性训练四)Ⅰ.CO和H2的混合气体俗称合成气,是一种重要的工业原料气,工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气。
(1)用甲烷与水蒸气制备合成气,每生成1 mol合成气,需要供给51.5 kJ热量。该反应的热化学方程式为________________。


时间/min 浓度(mol/L) 物质 01234CH40.20.130.10.10.09H200.210.30.30.33
①该反应第一次达到平衡时的平衡常数K=________。
②3 min时改变的反应条件是
(只填一种条件的改变即可)。
(3)已知一定压强下,温度、投料比X[n(CH4)/n(H2O)]对该反应的影响如图所示。
图中的两条曲线所示投料比的关系X1________(填“=”“>”或“<”)X2。



(6)常温下,在amol/L的HCOOH溶液中加入等体积的bmol/L的NaOH溶液至溶液呈中性,此时溶液中HCOOH的物质的量浓度为________________。
参考答案及提示
1.A 【命题意图】本题考查化学平衡图象的分析。
【解题思路】A项,该反应的正反应为吸热反应,升高温度,平衡正向移动,A%减小,正确;B项,该反应的正反应为吸热反应,升高温度,v(正)、v(逆)均增大,平衡正向移动,则v(正)>v(逆),错误;C项,升高温度,反应速率加快,达到平衡的时间缩短,错误;D项,平衡后,增大压强,v(正)、v(逆)均增大,平衡正向移动,则v(正)>v(逆),错误。
2.B 【命题意图】本题考查熵。
【解题思路】熵即混乱度,一般而言熵值:气体>液体>固体,所以反应①和②都是熵减小的反应。
3.D 【命题意图】本题考查影响化学反应速率的因素。
【解题思路】A项,硫酸浓度增大,反应速率加快,错误;B项,增大反应物的接触面积,反应速率加快,错误;C项,使用催化剂,反应速率加快,错误;D项,温度降低,反应速率减慢,正确。
4.D 【命题意图】本题考查化学基本概念、弱电解质的电离、溶液中离子浓度大小。
【解题思路】A项,在蒸馏水中加浓硫酸,会放出热量,溶液温度升高,所以Kw增大,错误;B项,碳酸钙不易溶于稀硫酸是由于生成的硫酸钙微溶,阻止了反应的进一步进行,但是碳酸钙易溶于醋酸,生活中可以用醋酸除去水垢,错误;C项,NaCl为强酸强碱盐,在水中不水解,对水的电离无影响,CH3COONH4为弱酸弱碱盐,水溶液显中性的原因为醋酸根离子的水解程度和铵根离子的水解程度相同,促进了水的电离,错误;D项,Na2S溶液中的质子守恒,正确。
5.D 【命题意图】本题考查原电池及电解原理,考查考生对电化学原理的应用。
【解题思路】A项,当K与N连接时,该装置为原电池,铁棒作负极,由于溶液为酸性,发生析氢腐蚀;B项,石墨棒为正极,析出氢气;C项,K与M连接时,该装置为电解池,铁棒作阴极,石墨棒为阳极,被电解的物质为HCl,由于H+放电其浓度减小,溶液pH增大;D项,石墨棒上放电的为Cl-。
6.C 【命题意图】本题考查化学反应与能量。
【解题思路】A项,该反应为放热反应,但不一定能自发;B项,该反应向外界放出的热量为E1-E3;D项,原电池利用的是自发进行的氧化还原反应,该反应不一定能设计成原电池。
7.D 【命题意图】本题考查沉淀溶解平衡。

8.D 【命题意图】本题考查盐类的水解、弱电解质的电离。
【解题思路】A项,由稀释相同倍数后pH的变化不同可知碱性:A>B,再由开始时pH相差1可知c(A)>10c(B),错误;B项,碱抑制水的电离,所以不管A溶液稀释与否,由水电离出的OH-的浓度均小于10-7mol/L,错误;C项,不知道CH3COO-与A溶液中阳离子水解程度如何,所以无法确定溶液的pH,错误;D项,当pH相同时,两溶液中的c(H+)和c(OH-)也各自相等,再由电荷守恒可知A、B两种碱溶液中阳离子的物质的量浓度相等,正确。
9.B 【命题意图】本题考查化学反应原理。

10.(1)负
(3)2.8 16 2.9 mol/L
【命题意图】本题考查电解池。

11.(1)0.003 0 mol·L-1·s-11.8 mol/L
(2)升高温度
(3)如图所示


(5)1 084 提供正催化剂

【命题意图】本题考查化学反应速率、化学平衡、热化学方程式的书写、化学反应与能量变化、原电池原理的应用。


(2)①0.135 ②升高温度或增大H2O(g)的浓度或减小CO的浓度
(3)>
(4)5×10-11
(5)c(HCOO-)>c(Na+)>c(H+)>c(OH-)

【命题意图】本题考查化学平衡、盐类的水解、弱电解质的电离。

[本文选自西藏人民出版社出版的《2018全国各省市名校高考单元专题训练》(化学),有删改]

