载自杀基因的靶向微泡联合超声辐照抑制视网膜母细胞瘤的实验研究
伍 瑛 陈永东 李 凡 张会萍 白 敏 金利芳 李云华 杜联芳
载自杀基因的靶向微泡联合超声辐照抑制视网膜母细胞瘤的实验研究
伍 瑛 陈永东 李 凡 张会萍 白 敏 金利芳 李云华 杜联芳
目的 探讨载自杀基因的靶向微泡联合超声辐照对视网膜母细胞瘤(RB)的抑制作用。方法 制备携带单纯疱疹病毒Ⅰ型胸苷激酶(HSV1-tk)质粒和血管内皮细胞生长因子受体2抗体的靶向微泡,分为空白对照组、细胞+质粒组、细胞+质粒+SonoVue组、细胞+靶向微泡组、细胞+质粒+超声辐照组、细胞+质粒+SonoVue+超声辐照组及细胞+靶向微泡+超声辐照组进行实验。荧光显微镜观察各组基因转染情况,流式细胞仪检测转染率,加入丙氧鸟苷(GCV)后检测细胞的抑制率。结果 细胞+靶向微泡+超声辐照组的转染率为(24.78±1.04)%,高于细胞+质粒+SonoVue+超声辐照组(14.31±0.69)%,差异有统计学意义(Plt;0.05)。随着GCV浓度的增加和培养时间的延长,各组抑制率逐渐升高。当GCV浓度为100 mg/L,培养96 h后,细胞+靶向微泡+超声辐照组对RB细胞的抑制率达(92.91±1.71)%。结论 加入GCV后,携带HSV1-tk基因的靶向微泡联合超声能有效地抑制RB细胞。
靶向,微泡,超声破坏;视网膜母细胞瘤;基因转染
目前单纯疱疹病毒胸苷激酶/丙氧鸟苷(HSV-tk/GCV)自杀基因系统在基因治疗中极有价值,为视网膜母细胞瘤(retinoblastoma,RB)的治疗带来了新的希望[1-2]。本课题组前期体外实验研究[3]针对 RB 筛选出了合适的超声和微泡配比条件,并制备了携带单纯疱疹病毒Ⅰ型胸苷激酶(HSV1-tk)基因的靶向微泡,在体实验研究[4]发现该微泡对RB的增强程度和显影效果与SonoVue相当,且持续时间更长,更加稳定。本实验采用这种携HSV1-tk基因的靶向微泡联合超声靶向微泡破坏(ultrasound-targeted microbubble destruction,UTMD),旨在评估其对RB细胞的转染率和抑制作用。
材料与方法
一、主要材料及仪器
RB细胞(HXO-RB44,美国ATCC公司);HSV1-tk(上海生工生物工程有限公司);p-IRES2-EGFP质粒(上海舜百生物科技有限公司);生物素化的血管内皮细胞生长因子受体2(VEGFR 2)抗体(美国Biolegend公司);双标记微泡TargesphereSA(美国Targeson公司);SonoVue(意大利Bracco公司);丙氧鸟苷(GCV,湖北潜龙药业有限公司)。PHYSIOMED-Expert超声波治疗仪(德国Physiomed公司);CKX41倒置荧光显微镜(日本奥林巴斯公司);EPICSALTRA流式细胞仪(美国Beckman Coulter公司);I-MARK Bio-med酶标仪(日本Bio-med公司)。
二、实验方法
1.真核表达载体的构建和酶切鉴定:HSV1-tk由生工合成,5’端和3’端分别加有BglⅡ和EcoRⅠ酶切位点。合成的HSV1-tk与p-IRES2-EGFP质粒经BglⅡ和EcoRⅠ双酶切后连接。连接产物转化大肠杆菌DH5a,挑选单克隆抽提质粒,经BglⅡ和EcoRⅠ按以下反应体系进行双酶切鉴定:p-IRES2-EGFPHSV1-tk质粒1μg,BglⅡ1μl(10 U/μl),EcoRⅠ1μl(10 U/μl),10X BamHIBuffer内切酶 5 μl,双蒸水补足至50μl,以上体系放入37℃恒温仪器中反应4 h,酶切结束后电泳观察目的片段和载体片段。鉴定后质粒抽提用于实验。
2.双标记微泡Targesphere SA与质粒和抗体连接:双标记微泡Targesphere SA轻微振摇混匀后加入p-IRES2-EGFP-HSV1-tk质粒(500μg/ml),轻微振荡混匀后室温孵育20 min。随后加入50μg生物素化的VEGFR 2抗体,再次轻微振荡混匀,室温孵育20 min,离心5 min(1500 r/min),PBS溶液洗涤3次以去除未结合的质粒和抗体。
3.实验分组:共分为7组,分别为空白对照组(A组);细胞+质粒组(B组);细胞+质粒+SonoVue组(C组);细胞+靶向微泡组(D组);细胞+质粒+超声辐照组(E组);细胞+质粒+SonoVue+超声辐照组(F组);细胞+靶向微泡+超声辐照组(G组)。HXO-RB44细胞悬液用细胞计数器计数细胞后移入24孔细胞培养板,每孔细胞约2×105个,每组10孔。B、C、E及F组质粒用量每孔1μg,C组和F组SonoVue用量每孔30μl,D组和G组靶向微泡用量每孔30μl。按实验分组依次加入质粒和微泡,最后各组加入培养液使每孔体积为150μl。加入质粒后置于37℃、5%CO2恒温孵育箱中孵育5 min。
4.超声辐照:采用前期实验[3]优化的超声和造影剂配比条件,即探头频率1 MHz,脉冲重复频率100 Hz,占空比 20%,声强 1.5 W/cm2,辐照时间 60 s;SonoVue浓度20%。超声辐照结束后置于37℃、5%CO2恒温孵育箱中培养4 h,然后每孔加入培养液配平至总体积为500μl后继续培养。
5.转染率检测:处理后12、24、48 h使用倒置荧光显微镜观察各组绿色荧光蛋白表达情况;处理后72 h每组取5孔收集细胞,应用流式细胞仪测量基因转染率。
6.GCV加入后对细胞杀伤作用的评价:每组取5孔细胞,培养48 h后按每孔1×104个接种于96孔培养板,分别加入浓度为 0、1、10、50、100、500、1000 mg/L 的GCV(每组5孔)。培养至 24、48、72、96 h时,每孔再加入噻唑蓝20μl(5 mg/ml),4 h后弃上清加入二甲基亚砜200μl,振荡10min,于酶标仪570nm波长处测定各孔的吸光度值,并计算各组抑制率:抑制率=(1-存活率)×100%。
三、统计学处理
应用SPSS 19.0统计软件,计量资料以x±s表示,各组比较采用方差分析,两两比较行LSD-t检验。P<0.05为差异有统计学意义。
结 果
一、各组倒置荧光显微镜下观察
在各时间点,A、B、C、D组RB细胞镜下均未见绿色荧光。12 h后,E、F、G组有小部分细胞显示绿色荧光;24 h后,三组显示绿色荧光的细胞数明显增加,高倍镜下荧光多出现于细胞的边缘;48 h后荧光亮度达高峰,可充满整个细胞;72 h后细胞生长非常密集,已不宜再培养和观察。其中G组出现荧光的细胞数最多,荧光亮度最强。见图1。
二、各组基因转染率比较
A、B、C、D 组转染率均为 0,E 组转染率为(1.08±0.19)%,E组与A、B、C、D组比较,差异均有统计学意义(均 P<0.05);F组转染率为(14.31±0.69)%,较 E 组升高,差异有统计学意义(P<0.05);G 组转染率为(24.78±1.04)%,较 F 组更高,差异有统计学意义(P<0.05)。

图1 48 h后各组荧光显微镜和光镜对照图(×200)
三、各组加入GCV后对RB细胞的抑制率
随着GCV浓度的增加和培养时间的延长,各组抑制率逐渐升高,组间比较差异均有统计学意义(均P<0.05),见表1,2。当GCV 浓度≥1 mg/L时,E、F、G 组的抑制率在不同GCV浓度下均明显高于A、B、C、D组,差异均有统计学意义(均 P<0.05),A、B、C、D 组的抑制率两两比较差异均无统计学意义,E、F、G组抑制率两两比较差异均有统计学意义(均P<0.05)。当GCV浓度为100 mg/L时,培养不同的时间后,E、F、G组的抑制率均明显高于A、B、C、D组,差异均有统计学意义(均P<0.05),E、F、G组之间的抑制率两两比较差异均有统计学意义(均P<0.05)。96 h后,G组对RB细胞的抑制率达到(92.91±1.71)%,高于 F组(65.17±1.68)%,差异有统计学意义(P<0.05)。E组对RB细胞的抑制率为(45.26±0.40)%,高于 A、B、C、D 组,低于 F组和 G 组,差异均有统计学意义(均P<0.05)。
讨 论
HSV-tk/GCV自杀基因系统在抑制RB基因治疗中研究较多,效果较好。Chévez-Barrios等[1]以腺病毒为载体装载tk基因,通过向玻璃体腔内注射来治疗播散到玻璃体腔的RB肿瘤,效果满意,但部分病例出现炎症反应、角膜水肿及眼压升高等副作用。季迅达等[2]研究条件复制型腺病毒联合HSV-tk/GCV自杀基因系统对人RB细胞的杀伤作用,发现在病毒高剂量时,条件复制型腺病毒联合HSV-tk/GCV自杀基因可导致80%的RB细胞死亡。虽然条件复制型腺病毒可以在细胞内大量复制,具有溶瘤作用,但其单独应用时杀伤力较低,而GCV既是自杀基因发挥作用的药物前体,又是抗病毒制剂,可以降低病毒的作用,因此病毒联合HSV-tk/GCV自杀基因的抗肿瘤作用取决于GCV的毒性作用与GCV的抗病毒作用之间的平衡。
本研究采用UTMD进行HSV1-tk基因转染的方法,避免了上述病毒转染的不足,且UTMD具有无免疫原性、无细胞毒性、转染效率较高、操作简单及可重复等优势。超声和微泡单独或联合使用,可以增加细胞膜的通透性,促进基因或药物传递[5],且超声微泡也可作为一种治疗性基因的载体,但单纯的超声微泡造影剂无组织特异性,在体循环维持的时间较短,不能自动寻靶,基因转染率低,若在微泡造影剂外壳连接上靶向配体,主动识别并结合到靶组织中,将较大地提高UTMD介导基因的转染效率。
靶向配体的选择在靶向微泡的制备中至关重要,多项研究[6-8]发现血管内皮生长因子与RB的发生、发展密切相关,在RB的肿瘤组织中表达明显升高,在肿瘤组织中VEGFR 2受体的水平亦相应显著上调。据此本实验选取了VEGFR 2作为靶点,有利于超声微泡识别并聚集到RB的肿瘤组织内。本实验采用双标记微泡Targesphere SA,将携带HSV1-tk基因的质粒和VEGFR 2抗体结合到微泡上。此超声微泡可通过生物素和亲和素结合的方式连接靶向抗体,并通过正负电荷结合的方式结合治疗性质粒[9],在小鼠肾癌和RB的移植瘤动物模型中均能明显增强显影强度,延长显影时间[4,10]。本实验结果表明,携带 HSV1-tk 基因和VEGFR 2抗体的靶向微泡联合超声辐照组质粒荧光蛋白表达情况最好,对RB细胞的转染率较非靶向的超声微泡造影剂SonoVue更高。分析其原因可能是肿瘤细胞生长过程中缺氧,VEGFR 2受体的表达上调,携带VEGFR 2抗体的靶向微泡通过与受体结合,更多的微泡集聚到肿瘤细胞周围,经超声辐照后微泡破裂,使携带HSV1-tk基因的质粒进而较多地进入到细胞内。
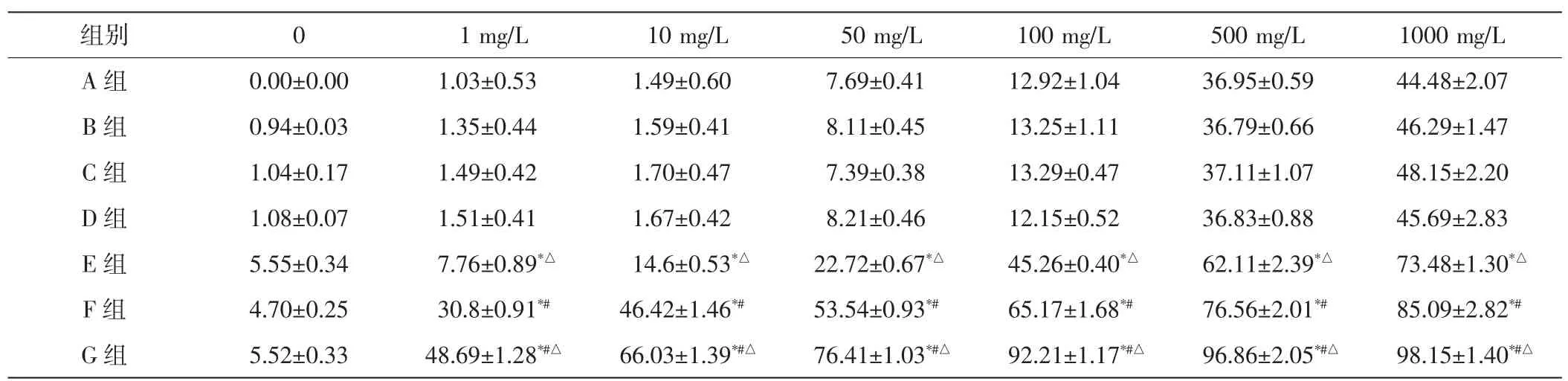
表1 实验各组在不同GCV浓度下培养96 h的抑制率比较(x±s) %
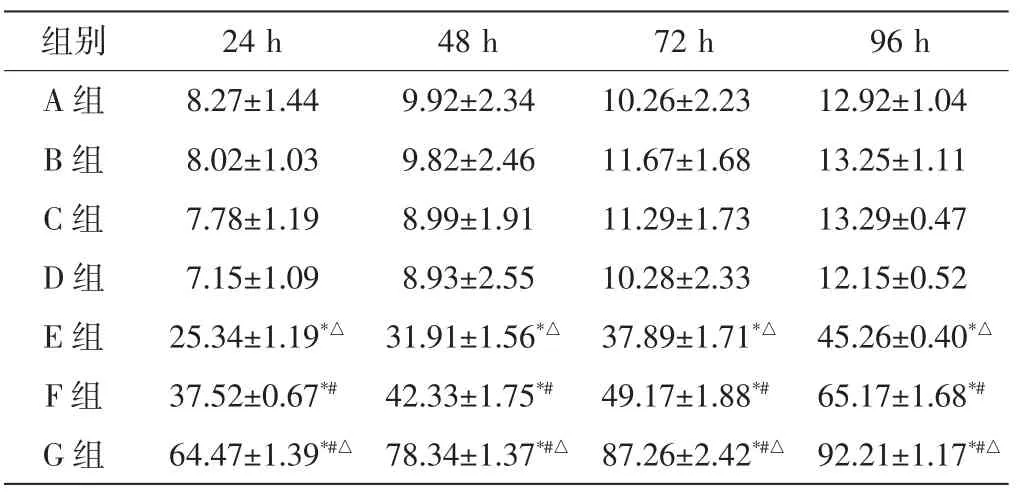
表2 实验各组在GCV浓度为100 mg/L培养不同时间的抑制率比较(x±s)%
本实验结果显示载HSV1-tk基因的靶向微泡组的转染率为(24.78±1.04)%,虽不及病毒介导的转染率高,但是在前体药物GCV加入后,随着浓度的增加和培养时间的延长,携带HSV1-tk基因的靶向微泡较非靶向造影剂SonoVue能更有效地抑制RB细胞的生长,在GCV浓度≥100 mg/L时,RB细胞的抑制率达到90%以上。由此可见,在自杀基因治疗系统中,前体药物GCV的加入非常重要,在合适的时间点加入一定剂量的GCV可以极大地发挥旁观者效应,最大程度杀死肿瘤细胞。本实验采取此策略弥补了转染率不高的缺陷,证实了携带HSV1-tk基因和VEGFR 2抗体的超声微泡造影剂联合超声能高效杀死RB细胞,为RB的基因治疗研究提供了一种更加安全和有效的方法。
[1] Chévez-Barrios P,Chintagumpala M,Mieler W,et al.Response of retinoblastoma with vitreous tumor seeding to adenovirus-mediated delivery of thymidinekinase followed by ganciclovir[J].JClin Oncol,2005,23(31):7927-7935.
[2] 季迅达,陈霞芳,闫慧,等.条件复制型腺病毒联合HSVtk/GCV自杀基因系统对视网膜母细胞瘤细胞的杀伤性研究[J].中华眼视光学与视觉科学杂志,2010,12(6):433-437.
[3] 贾晓,高璐,杜联芳,等.声诺维联合超声辐照介导载单纯疱疹病毒Ⅰ型胸苷激酶基因质粒转染HXO-44视网膜母细胞的实验研究[J].中华医学超声杂志(电子版),2013,10(5):415-419.
[4] 伍瑛,杜联芳,陈永东,等.小鼠视网膜母细胞瘤的靶向超声造影成像研究[J].中华医学超声杂志(电子版),2014,11(11):937-941.
[5] 江云,龚兰.超声介导药物或基因传递的机制及研究进展[J].临床超声医学杂志,2016,18(5):333-335.
[6] Missotten GS,Schlingemann RO,Jager MJ.Angiogenesis and vascular endothelial growth factors in intraocular tumors[J].Dev Ophthalmol,2010,46(1):123-132.
[7] Youssef NS,Said AM.Immunohistochemical expression of CD117 and vascular endothelial growth factor in retinoblastoma:possible targets of new therapies[J].Int JClin Exp Pathol,2014,7(9):5725-5737.
[8] Lee SY,Kim DK,Cho JH,et al.Inhibitory effect of bevacizumab on theangiogenesis and growth of retinoblastoma[J].Arch Ophthalmol,2008,126(7):953-958.
[9] Warram JM,Sorace AG,Saini R,et al.A triple-targeted ultrasound contrast agent providesimproved localization to tumor vasculature[J].JUltrasound Med,2011,30(7):921-931.
[10] Wei SP,Fu NH,Sun Y,et al.Targeted contrast-enhanced ultrasound imaging of angiogenesis in an orthotopic mouse tumor madel of renal carcinoma[J].Ultrasound Med Biol,2014,40(6):1250-1259.
Study on ultrasound targeted carry HSV1-tk targeted microbubble destruction inhibition retinoblastoma
WUYing,CHENYongdong,LIFan,ZHANGHuiping,BAIMin,JINLifang,LIYunhua,DULianfang
Department of Ultrasound,Renji Hospital,Shanghai Jiaotong University School of Medicine,Shanghai200127,China
Objective To evaluate inhibitory effect of retinoblastoma(RB) by ultrasound targeted carry HSV1-tk targeted microbubble destruction.Methods Targeted microbubble carrying HSV1-tk and VEGFR 2 antibody was prepared.All the RBcells were divided into 7 groups:control group,cells+plasmid,cells+plasmid+SonoVue,cells+targeted microbubble,cells+plasmid+ultrasound,cells+plasmid+SonoVue+ultrasound,cells+targeted microbubble+ultrasound.Gene transfection results was observed under the inverted fluorescent microscope.Gene transfection rates was measured by flow cytometry.Inhibitory rate of RB cells was measured after GCV was added.Results The transfection rate of cells+targeted microbubble+ultrasound group was(24.78±1.04)%,which was higher than that of cells+plasmid+SonoVue+ultrasound group(14.31±0.69)%,there was significant difference(Plt;0.05).With the increase of GCV concentration and the prolongation of culture time,the inhibitory rate of each group increased gradually.When the GCV concentration was 100 mg/L,afer 96 h culture time,inhibitory rate of cells+targeted microbubble+ultrasound group was (92.91±1.71)%.Conclusion Combination ultrasound and targeted microbubble carrying HSV1-tk destruction can effectively inhibit RBcells with introduction of GCV.
Targeted,microbubble,ultrasonic destruction;Retinoblastoma;Gene transfection
R-331;R445.1
A
国家自然科学基金青年科学基金项目(81000617);上海市自然科学基金(15ZR1433700)
200127 上海市,上海交通大学医学院附属仁济医院超声医学科(伍瑛);上海交通大学附属第六人民医院眼科(陈永东);上海交通大学附属第一人民医院超声医学科(李凡、张会萍、白敏、金利芳、李云华、杜联芳)
杜联芳,E mail:du_lf@163.com
2017-06-01)

