阿魏酸钠对慢性脑缺血大鼠的神经保护作用机制研究
陈爱春 舒化青 周志鸿 肖瑞
阿魏酸钠对慢性脑缺血大鼠的神经保护作用机制研究
陈爱春 舒化青 周志鸿 肖瑞
目的探讨阿魏酸钠对慢性脑缺血大鼠的神经保护作用及其机制。方法以双侧颈总动脉结扎(2-VO)法制备慢性脑缺血模型,于术后6周分别给予阿魏酸钠和PBS干预,分为阿魏酸钠干预组和模型对照组。另设假手术组(仅分离双侧颈总动脉,但不结扎)作为空白对照。术后8周行Morris水迷宫实验,评价大鼠的空间学习记忆功能,同时观察双侧颞叶内侧缺血区脑组织血管密度、激光共聚焦法检测毛细血管内径、缺血边界地区的毛细血管分支点数目和微血管总面积等指标、海马细胞增殖情况(免疫组化法)和血浆血管内皮生长因子(VEGF)水平(ELISA法检测),以探讨其可能的机制。结果Morris水迷宫结果显示,阿魏酸钠干预组第2、3、4、5天逃避潜伏期〔分别为(43.55±6.34)s、(38.11±1.20)s、(34.75±5.30)s、(24.39±3.93)s〕明显短于模型对照组〔分别为(50.89±6.31)s、(43.72±8.21)s、(50.79±9.36)s、(44.39±3.93)s,均P<0.01〕;阿魏酸钠干预组第一象限游泳时间明显长于模型对照组〔分别为(27.36±3.89)s、(14.68±2.36)s,P=0.002〕。阿魏酸钠干预组毛细血管内径与模型对照组比较变短〔分别为(3.02±0.21)μm、(3.35±0.18)μm,P=0.003〕,阿魏酸钠干预组缺血边界地区的毛细血管分支点数目与模型对照组同源组织区比较显著增加(分别为205.80±12.70、158.42±10.92,P=0.001),0.002 mm3体积内阿魏酸钠干预组微血管总面积与模型对照组比较明显增加〔分别(83389±4026)μm2、(73349±3986)μm2,P=0.004〕。 阿魏酸钠干预组缺血脑组织内的BrdU阳性细胞数明显高于模型对照组(分别为23.82±3.05、10.26±2.89,t=18.26,P=0.004)。阿魏酸钠干预组VEGF水平明显高于模型对照组〔分别为(67.58±9.61)pg/mL、(21.90±5.16)pg/mL,P=0.008〕。结论阿魏酸钠可以显著改善慢性脑缺血大鼠的空间学习记忆能力,其机制可能与VEGF介导的血管密度增加有关。
阿魏酸钠;脑缺血;水迷宫;血管内皮生长因子;神经保护
慢性脑缺血是一种常见的病理学状态,其早期以认知功能损害为主要表现,并最终导致持久或进展性神经功能缺损。尽管近几十年来已完成了大量针对慢性缺血性脑血管病的基础和临床研究,但慢性脑缺血预后仍相当差,而且仍缺乏有效的干预手段。阿魏酸钠(sodium ferulate),又名当归素,其主要功效之一是作为一种非肽类内皮素拮抗剂发挥生物学活性。现有研究显示阿魏酸钠对动物不仅具有抗炎、抗氧化应激及调节神经免疫作用,还可以发挥调节脂质过氧化代谢、抗凋亡及抑制动脉粥样硬化的作用[1-4]。既往研究还发现阿魏酸钠能减轻人脑缺血再灌注损伤,对急性脑梗死患者具有神经保护作用[5-6],但有关其对于对慢性脑缺血影响的研究探讨,目前国内外相关报道较少。
本实验首先诱导慢性脑缺血模型大鼠,后给予阿魏酸钠进行干预,首先观察大鼠的空间学习记忆能力的变化,并从脑内缺血区细胞的增生分化、缺血区毛细血管变化情况、海马细胞增殖情况和血浆血管内皮生长因子(VEGF)的水平等方面来探讨其可能的机制,期望为临床应用阿魏酸钠治疗慢性缺血性脑血管病进行一些有益的探索。
1 材料和方法
1.1材料
1.1.1实验动物:体重220~250 g、8~10周龄雄性Sprague-Dawley(SD)大鼠60只,购自武汉大学动物试验中心,合格证编号:SUXK(鄂)4200391798。饲养于武汉大学中南医院动物实验中心,SPF级饲养条件,所有的实验过程均遵循科技部《关于善待实验动物的指导性意见》。
1.1.2主要试剂与仪器:阿魏酸钠(重庆莱美药业股份有限公司,国药准字H20056281),异硫氰酸荧光素-FITC F8070-50、5-溴脱氧尿嘧啶核苷(BrdU)及抗BrdU抗体(美国Sigma公司),TUNEL检测试剂盒(罗氏公司),兔抗大鼠VEGF抗体(北京博奥森生物公司),SABC免疫组化试剂盒(武汉博士德生物公司),DAB试剂盒(南京凯基生物公司),其他免疫组化试剂(福州迈新生物公司);2432-50型北京沙东线栓(北京沙东生物技术有限公司),MRi23型高速多功能冷冻离心机(美国JOUAN公司),SW-CJ-IF型超净工作台(苏净集团安泰公司),XDS-1B型倒置相差显微镜(重庆光学仪器厂),OLYMPUS FLUOVIEW FV1000型激光共聚焦显微镜(日本OLYMPUS公司),CUT 6062石蜡切片机(德国SLEE公司)。人来源抗大鼠IgG一抗(武汉博士德生物公司)。
1.2方法
1.2.1动物模型的制备及分组:采用改良后的双侧颈总动脉结扎(2-VO)法[7]制作慢性脑缺血模型。将大鼠随机分为假手术组(只分离出双侧颈总动脉,不造模、不予干预,作为空白对照)、模型对照组(造模,进行PBS干预,作为模型对照)和阿魏酸钠组(造模,予阿魏酸钠干预)每组20只。造模术前12 h禁食不禁水;术后1周内死亡大鼠8只,其中阿魏酸钠组4只,模型对照组3只,假手术组死亡1只。
自术后6周开始,阿魏酸钠组以阿魏酸钠〔50 μmol/L,按体质量10 mL/(kg·d)〕灌胃,1次/d,以PBS(体积等量于实验组,灌胃)为模型对照组,干预1次/ d,连续5 d。其中死亡大鼠3只,假手术组1只,模型对照组2只。此时假手术组18只,模型对照组15只,阿魏酸钠组16只。
1.2.2Morris水迷宫行为学实验:自术后8周(即开始干预2周后)进行Morris水迷宫检测[7]。实验分为两个阶段,第一阶段为定位航行实验,记录逃避潜伏期。从实验第一天开始,共进行5 d,记录逃避潜伏期为60 s,记录大鼠在60 s时间内在第一象限内游泳的时间。每次训练间隔时间为60 s;第二阶段为空间探索试验,空间探索试验主要考察大鼠对平台的记忆能力:记录各组大鼠在30 s内在原有平台的第一象限游泳时间,取平均值。实验最后1 d,撤除平台,记录30 s内大鼠在第一象限(NE)内的游泳时间和游泳轨迹。实验过程中排除不能完成水迷宫行为学检测的大鼠共5只,其中阿魏酸钠组1只,模型对照组1只,假手术组3只。最终假手术组15只,模型对照组14只,阿魏酸钠组15只进行后叙实验。
1.2.3缺血区脑内细胞的增生和分化:自手术后8周,取模型对照组和阿魏酸钠组缺血区(双侧颞叶内侧海马部位)脑组织,以免疫组化法进行新生细胞检测,操作过程按照试剂盒说明书进行[7]。BrdU可以在S期掺入到DNA链中,参与新增生细胞的合成,可以有效的标记新增殖的细胞,在免疫组化中,BrdU标记细胞的细胞核被染色成褐色,该细胞被认为是新生的细胞或正在分化的细胞。 在每一个相同的皮层缺血区(海马皮层相同平面切片,厚度5 μm、数量10片)选择200倍镜下5个视野摄像,利用HPIAS 2000软件分析每个组大鼠脑组织缺血皮质BrdU阳性细胞数,记取平均数(均数±标准差)。以对侧同源区(同源区指双侧相对称部位)细胞为阴性对照,空白对照以PBS替代一抗(人来源抗大鼠IgG)。
1.2.4缺血区脑组织的血管密度检测:自手术后8周,取每组4只鼠,取材及处理同1.2.3。按照Chen等[8]研究方法,以共聚焦三维脑血管成像检测三组大鼠缺血区脑部的血管情况。用激光扫描共聚焦显微镜观察,共扫描100个层面,层厚0.5 mm。以绿色荧光(免疫荧光物质结合软件显示)所占体积表示血浆灌注量(volumes of plasma perfusion),观察40倍镜下图像分析直径小于8 mm血管的形态、血管内径、血管密度及局部血管密度情况。以荧光物质点数代表血管分支点数,由LCSlite软件计算每0.002 mm3范围内的血管分支点数目,以微血管总表面积(μm2/0.002 mm3)来间接反映局部血管密度。为了避免未配对数据分析产生的错误,三维脑血管统计进一步计算了新增加血管的数据。
1.2.5血浆VEGF水平检测:自手术后8周,以ELISA法检测三组大鼠血浆VEGF水平,主要依照操作说明书进行测定。用酶标仪测定450 nm处吸光度〔D(λ)〕值,采用软件(Curve Expert 1.4)计算样品水平。D(λ)值增高表示VEGF水平增高。

2 结果
2.1Morris水迷宫行为学实验
2.1.1定位航行实验结果:如具体结果见表1。三组大鼠间平均逃避潜伏期的差异有统计学意义(均P<0.05)。在训练的第2、3、4、5 天阿魏酸钠组明显短于模型对照组(均P<0.01);除了第2天外,其余3天假手术组逃避潜伏期与其他2组相比时间较短(均P<0.05)。

表1 各组大鼠Morris水迷宫逃避潜伏期比较 (±s, s)
注:F、P值:三组间比较所得。P1值:假手术组与模型对照组比较所得;P2:阿魏酸钠组与模型对照组比较所得;P3:阿魏酸钠组与假手术组比较所得

表2 血管结构三维定量检测结果(n=4, ±s)
注:P1值:模型对照组与假手术组组比较所得;P2:阿魏酸钠组与模型对照比较所得;P3:阿魏酸钠组与假手术组组比较所得
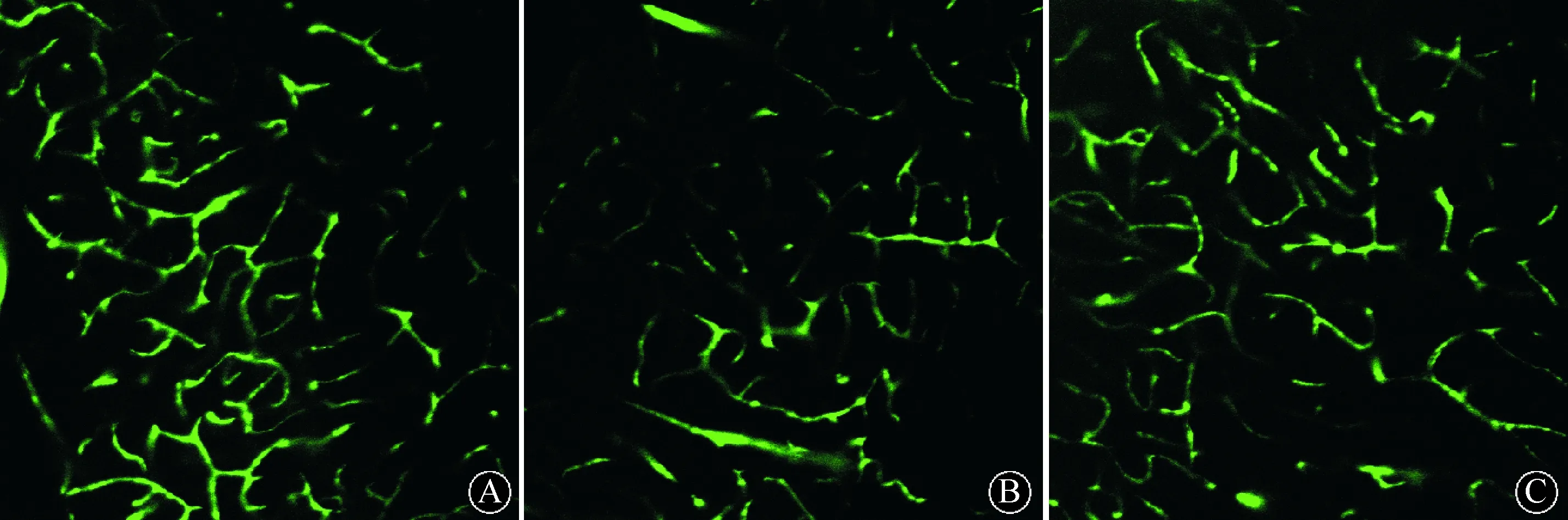
A:假手术组;B:模型对照组; C:阿魏酸钠组 图 1 各组大鼠脑血管三维共聚焦成像表现(激光共聚焦×400)

A:假手术组;B:模型对照组;C:阿魏酸钠组 图 2 各组大鼠脑内缺血区新增生细胞比较(免疫组化×200倍)
2.1.2空间探索实验结果:第一象限游泳时间假手术组为(32.48±8.60)s,阿魏酸钠组为(27.36±3.89)s,模型对照组(14.68±2.36)s 三组差异有统计学意义(F=12.39,P=0.002),且阿魏酸钠组与模型对照组比较明显延长(P<0.001)。
2.2缺血区脑血管密度比较具体结果见表2、图1。与模型对照组比较,阿魏酸钠组毛细血管内径显著变小(P=0.003),血管密度(缺血边界区的分支点的数目)显著增加(P=0.001),微血管总的表面积显著增加(P=0.004)。
2.3脑内缺血区细胞增生分化结果比较具体见图2。 阿魏酸钠组可见染色成褐色的阳性染色细胞数明显多于模型对照组(分别23.82±3.05、10.26±2.89,t=18.26,P=0.004)。
2.4各组血浆VEGF水平比较阿魏酸钠组、模型对照组、假手术组三组间血浆VEGF水平比较差异有统计学意义〔分别为(67.58±9.61)pg/mL、(21.90±5.16)pg/mL、(4.42±0.67)pg/mL,F=13.26,P=0.001〕,阿魏酸钠组和模型对照组血浆VEGF水平均高于假手术组〔分别P=0.006、P=0.005〕,阿魏酸钠组VEGF水平亦高于模型对照组(P=0.008)。
3 讨论
本实验中,采用2-VO模型来模拟慢性脑缺血所引起的一系列病理生理变化过程,通过经胃肠道给予阿魏酸钠进行连续干预。干预后2周,进行Morris水迷宫实验检测各组大鼠的空间学习和记忆行为能力,结果显示实验组大鼠的空间学习和记忆功能均较模型对照组有显著的改善,这说明阿魏酸钠干预后有利于改善慢性脑缺血大鼠的空间学习和记忆能力。
阿魏酸钠发挥空间学习和记忆能力保护作用的可能机制如下:第一,促进和恢复血管的血液供应,减少缺血范围,延缓缺血区神经细胞的缺血坏死。据报道,血管新生后可促进神经功能的恢复[6]。本研究中,阿魏酸钠组大鼠脑缺血区脑组织新生的细胞和血管密度较模型对照组大鼠有显著的增加,这也表明阿魏酸钠有利于促进缺血区域脑组织细胞的增生分化及血管新生,进而有利于缺血区脑组织的血流恢复。第二,促进神经营养介质分泌VEGF、生长因子和胰岛素样生长因子,这些因子可促进神经、血管再生,为组织代谢和功能恢复提供需要的更丰富的环境[9]。VEGF是一种较为经典的血管生成因子(angiogenesis growth factor, AGF),其可以有效作用于血管内皮细胞,调节内皮细胞的增生、迁移、分化和凋亡,诱导内皮细胞形成血管,促进缺血区脑组织侧支循环的生成[10]。本研究中发现阿魏酸钠组血浆VEGF水平明显高于模型对照组,也支持上述观点。
阿魏酸钠还可能通过其他途径发挥神经保护作用,如:(1)阿魏酸钠可以通过抗炎减轻炎性反应[1]、抗免疫诱导细胞氧化应激[2]、抗脂质过氧化作用[3]等发挥神经保护作用。上述保护作用可以有效的减轻神经细胞和血管内皮细胞的损伤,进而有利于缺血后局部血流的恢复,减轻神经功能损伤。(2)阿魏酸钠可以通过发挥抗凋亡作用来发挥神经保护作用[4]。既往研究表明,阿魏酸钠具有抗肿瘤细胞的凋亡作用,并可以抑制神经细胞的死亡作用[2,4]。既往研究结果显示,阿魏酸钠可以有效的减少平滑肌细胞的凋亡,发挥对动脉粥样硬化的保护作用[4]。(3)其他各种未知因素:阿魏酸钠还可能通过其他特别的机制,如抗吞噬作用、抗免疫、抗菌、改善脂代谢等机制,起到神经保护作用。
总之,本研究发现,阿魏酸钠对慢性脑缺血大鼠空间学习记忆行为有着显著的改善作用,这可能是阿魏酸钠可以促进缺血部位细胞增生,新生血管增加,减轻缺血区脑组织的神经细胞凋亡和炎性水肿,从而发挥血管神经保护作用,其可能机制与VEGF促进血管新生所致的血管密度增加有关。但是本研究尚有许多不足之处,如未进行进一步的分子生物学机制研究、未定量检测细胞死亡数量、未定量进行细胞炎性水肿检测等,因而有关阿魏酸钠用于治疗缺血性脑血管病的机制尚需进一步研究。
[1]Xu M, Wang W, Pei X, et al. Protective effects of the combination of sodium ferulate and oxymatrine on cecal ligation and puncture-induced sepsis in mice[J]. Exp Ther Med, 2014, 7(5): 1297-1304.
[2]Li Y, Yan YE, Wang H. Enhancement of placental antioxidative function and P-gp expression by sodium ferulate mediated its protective effect on rat IUGR induced by prenatal tobacco/alcohol exposure[J]. Environ Toxicol Pharmacol, 2011, 32(3): 465-471.
[3]Yuan X, Wang Y, Du D, et al. The effects of the combination of sodium ferulate and oxymatrine on lipopolysaccharide-induced acute lung injury in mice[J]. Inflammation, 2012, 35(3):1161-1168.
[4]Wu ZJ, Yu J, Fang QJ, et al. Sodium ferulate protects against daunorubicin-induced cardiotoxicity by inhibition of mitochondrial apoptosis in juvenile rats[J]. J Cardiovasc Pharmacol,2014,63(4): 360-368.
[5]Zhao Y, Guan Y, Xu Y, et al. Sodium ferulate combined with bone marrow stromal cell treatment ameliorating rat brain ischemic injury after stroke[J]. Brain Res,2012, 1450(23): 157-165.
[6]Zhao Y, Lai W, Xu Y, et al. Exogenous and endogenous therapeutic effects of combination sodium ferulate and bone marrow stromal cells (BMSCs) treatment enhance neurogen-esis after rat focal cerebral ischemia[J]. Metab Brain Dis, 2013, 28(4): 655-666.
[7]孔朝红,刘煜敏,朱江,等. 粒细胞集落刺激因子对慢性脑缺血大鼠神经功能的影响[J]. 中华老年医学杂志,2013, 32(8): 882-885.
[8]Chen J, Zhang ZG, Li Y, et al. Intravenous administration of human bone marrow stromal cells induces angiogenesis in the ischemic boundary zone after stroke in rats[J]. Circ Res, 2003, 92(6): 692-699.
[9]Popa-Wagner A,Dinca I,Yalikun S,et al. Accelerated delimitation of the infarct zone by capillary—derived nestin-positive cells in aged rats[J]. Curr Neurovasc Res, 2006, 3(1): 3-13.
[10]Arakawa H, Ikeda U, Hojo Y, et al. Decreased serum vascular endothelial growth factor concentrations in patients with congestive heart failure[J]. Heart,2003,89(2):207-209.
Experimentalstudyofthesodiumferulateinchroniccerebralischemicrats
CHENAichun,SHUHuaqing*,ZHOUZhihong,XIAORui*.
DepartmentofPediatricIntensiveCareUnit,UnionHospital,TongjiMedicalCollege,HuazhongUniversityofScience&Technology,HubeiWuhan430022,China
SHU Huaqing,Email: huaqingshu_2005@hotmail.com
ObjectiveTo explore the effect of Sodium ferulate on chronic cerebral ischemia in rats, and its possible mechanism.MethodsChronic cerebral ischemia (2-VO) model were prepared and given Sodium ferulate or PBS after 6 weeks. 8 weeks after the operation, Morris water maze were carried out to evaluate the learning and memory ability of the rats. The cell proliferation, diameter of capillaries,the number of capillary branches, the total area of capillaries, cell morphological changes in ischemic area, and the plasma vascular endothelial growth factor (VEGF) were detected to explore the possible mechanisms. Results Morris water maze test showed that the escape latency in the sodium ferulate group (for the 2ndto the 5thday of the Morris water maze test were:(43.55±6.34)s,(38.11±1.20)s, (34.75±5.30)s, (24.39±3.93) s respectively, which were significantly shorter than the control group[ (50.89±6.31)s, (43.72±8.21)s, (50.79±9.36)s, (44.39±3.93) s respectively], F value were10.277,23.530,38.312,35.045,respectively,Pvalue were 0.007,0.004,0.005,0.002,respectively. The first quadrant swimming time in the experimental group was significantly longer than the control group [(27.36 ± 3.89) s , (14.68±2.36) s ,P=0.002]. Cerebrovascular confocal detection results showed that: the sodium ferulate group had a shorter diameter of capillaries than the control group[(3.02±0.21)μm,(3.35±0.18)μm,P=0.003]. In the ischemic border regions, the number of capillary branches in the sodium ferulate group (205.80±12.70) was significantly increased than the control group (158.42±10.92,P=0.001), the sodium ferulate group had significantly increased total area of capillaries compared with the control group [(83389±4026) μm2/0.002 mm3, (73349±3986) μm2/0.002mm3,P=0.004).The difference of BrdU-positive cell numbers in ischemic brain tissue between the control group(10.26±2.89) and the sodium ferulate group(23.82±3.05) was statistically significant (t=18.26,P=0.004). VEGF concentration in the sodium ferulate group was higher than the control group[(67.58±9.61)pg/mL, (21.90±5.16)pg/mL,P=0.008].ConclusionsSodium ferulate can significantly improve the learning and memory ability of the chronic cerebral ischemic rat, and its possible mechanism maybe involve the nerve protection and regeneration of the vascular .
sodium ferulate; cerebral ischemia; morris water maze; vascular endothelial growth factor;neuro-protection
10.3969/j.issn.1006-2963.2017.06.007
430063 武汉市武昌医院重症医学科(陈爱春、周志鸿、肖瑞);430022华中科技大学附属协和医院重症医学科(舒化青)
舒化青,Email:huaqingshu_2005@hotmail.com
R734.1
A
1006-2963(2017)06-0411-05
2015-12-21)
邹晨双)

