NMOSD患者外周血滤泡辅助性T细胞及其亚群的表达研究
杨彬彬 吴茜 孙林 郁迪 刘磊 乔志新 王佳伟
NMOSD患者外周血滤泡辅助性T细胞及其亚群的表达研究
杨彬彬 吴茜 孙林 郁迪 刘磊 乔志新 王佳伟
目的通过研究视神经脊髓炎谱系疾病(NMOSD)患者外周血中滤泡辅助性T(Tfh)细胞的表达,探讨Tfh细胞与NMOSD发病的关系。方法采用流式细胞术分别检测53例NMOSD急性发作期患者(NMOSD组)和20名健康对照(对照组)的外周血中不同表型的Tfh细胞占CD4+T细胞的比例及其三个亚群Tfh1、Tfh2、Tfh17占CD4+CXCR5+T细胞的比例。结果NMOSD组CD4+CXCR5+Tfh细胞、CD4+CXCR5+PD-1+Tfh细胞占CD4+T细胞的比例均高于健康对照组〔分别(22.80±6.78)%vs.(18.94±3.84)%,t=3.042,P=0.003;(9.54±3.29)%vs. (4.21±1.31)%,t=9.914,P=0.000〕。在CD4+CXCR5+T细胞中,NMOSD患者组Tfh17细胞所占比例高于对照组〔(30.70±4.56)%vs.(27.33±2.89)%,t=3.071,P=0.003〕, Tfh1细胞比例低于对照组〔(26.41±4.42)%vs. (30.26±3.66)%,t=-3.474,P=0.001〕,Tfh2细胞比例与对照组差异无统计学意义(P=0.127);(Tfh2细胞比例+Tfh17细胞比例)/Tfh1细胞比例的比值高于对照组(2.41±0.65vs.1.88±0.39,t=4.264,P=0.000)。结论NMOSD急性发作期患者外周血中Tfh 细胞比例增高,同时存在着Tfh细胞的三个亚群的比例失调,尤其是Tfh17细胞比例显著增高,推测Tfh 细胞与NMOSD的发病存在一定关系。
视神经脊髓炎谱系疾病;滤泡辅助性T细胞;CXC趋化因子受体5;程序性死亡受体1
视神经脊髓炎(neuromyelitis optica,NMO)和NMO谱系疾病(NMO spectrum disorders,NMOSD)是一类以视神经炎和(或)急性横贯性脊髓炎为典型临床表现的自身免疫性炎性脱髓鞘疾病。2004年,Lennon等[1]在NMO患者血清中发现了一种特异性抗体,并于随后证实该抗体的靶抗原为位于星形胶质细胞(astrocyte,AS)足突上的水通道蛋白-4(aquaporin-4,AQP-4)[2],提示NMOSD是一种以体液免疫反应为主的自身免疫反应性疾病,但对于自身抗体产生机制仍了解较少。近年来发现滤泡辅助性T细胞(follicular helper T cell,Tfh) 定位于淋巴滤泡,主要功能是辅助B细胞产生抗体参与体液免疫反应。Tfh细胞属于CD4+T淋巴细胞,表达CXC趋化因子受体5(CXC chemokine receptor 5,CXCR5),可诱导共刺激因子(inducible costimulator,ICOS)、程序性死亡受体1(programmed death 1,PD-1)等表面分子[3]。由于人类的淋巴组织标本不能轻易获得,所以大部分关于Tfh细胞的研究采用外周血标本[4-10]。研究表明人类外周血中存在Tfh细胞,并根据其表面趋化因子受体CCR6和CXCR3的表达情况,被分为Tfh1(CXCR3+CCR6-)、Th2(CXCR3-CCR6-)和Thf17(CXCR3-CCR6+)三个亚群[4]。本文通过检测NMOSD患者急性发病期外周血中Tfh细胞及其各亚群细胞的比例,分析其在NMOSD患者发病过程中的变化,初步探讨其与NMOSD发病的关系,期望有助于从新的视角认识NMOSD的发病机制,为治疗方面提供新的方向和思路。
1 对象和方法
1.1研究对象选择2016-05—2017-04期间在北京同仁医院神经内科住院的NMOSD患者53例,其中男5例、女48例,年龄19~64岁,平均(39.83±15.13)岁,诊断均符合2015年Wingerchuk修订的NMOSD的诊断标准[11],入选患者均处于急性发作期,且近1个月内未应用大剂量糖皮质激素冲击治疗及其他免疫抑制剂。患者中AQP-4抗体阳性50例、阴性3例。患者近1个月内均无感染性疾病及妊娠,无家族性遗传病史。同时选择同期同仁医院健康体检者20名为对照组,男5名、女15名,年龄22~75岁,平均(34.20±13.83)岁,均无自身免疫性疾病史,近1个月内无感染性疾病史。两组在年龄、性别构成上差异均无统计学意义(P>0.05)。本研究经北京同仁医院伦理委员会批准,研究对象均签署知情同意书。
1.2主要试剂和仪器FITC-Anti-Human CD4、PE-Anti-Human PD-1及其同型对照抗体、PE-Anti-Human CCR6及其同型对照抗体、PerCP-Cy5.5-Anti-Human CXCR3及其同型对照抗体、Alexa Fluor 647 anti-human CXCR5及其同型对照抗体、溶血素及流式细胞仪FACS Calibur购自美国Becton Dickinson公司。
1.3方法采集患者及健康人外周血2 mL,EDTA抗凝,流式细胞术检测其外周血的Tfh细胞及其各亚群,并进行分析。具体步骤:(1)Tfh细胞及其同型对照管:两管各加入5 μL FITC-Anti-Human CD4,Tfh细胞管中加入5 μL Alexa Fluor 647 Anti-humanCXCR5、10 μL PE-Anti-Human PD-1,同型对照管中加入相同体积的同型对照抗体;(2)Tfh细胞亚群及其同型对照管:两管各加入5 μL FITC-Anti-Human CD4和Alexa Fluor 647 Anti-human CXCR5,Tfh细胞亚群管中再加入5 μL PerCP-Cy5.5-Anti-Human CXCR3和PE-Anti-Human CCR6,同型对照管中加入相同体积的同型对照抗体;(3)各管均加入100 μL 外周血,混匀,室温避光孵育15 min;各管均加入1 mL溶血素,振荡混匀静置10 min,使红细胞裂解;以1500 r/min离心5 min;弃上清PBS洗涤1次后,加入300 μL PBS重悬细胞,上流式细胞仪检测;(4)数据经CellQuest软件获取和分析:①分析外周血不同表型的Tfh细胞占CD4+T细胞比例:先在由前向角散射光(forward scatter, FSC)和侧向散射光(side scatter, SSC)两个参数组成的散点图上圈出淋巴细胞,再在由CD4和SSC两个参数组成的散点图上圈出CD4+T细胞,以CD4+T细胞设门,分析CD4+CXCR5+Tfh细胞、CD4+CXCR5+PD-1+Tfh细胞占CD4+T细胞比例;②分析外周血中Tfh细胞各亚群占CD4+CXCR5+T细胞比例:先在由FSC和SSC两个参数组成的散点图上圈出淋巴细胞,再在由CD4和CXCR5组成的散点图上圈出CD4+CXCR5+T细胞,以CD4+CXCR5+T细胞设门,分析Tfh1(CXCR3+CCR6-)、Tfh2(CXCR3-CCR6-)以及Tfh17(CXCR3-CCR6+)细胞占CD4+CXCR5+T细胞比例。③计算(Tfh2细胞比例+Tfh17细胞比例)/Tfh1细胞比例的比值。
1.4统计学处理采用SPSS17.0软件进行分析。计量资料数据经检验均呈正态分布,以均数±标准差表示;NMOSD患者组与健康对照组计量资料比较采用两独立样本t检验;两组男女比例比较采用X2检验。以P<0.05为差异有统计学意义。
2 结果
2.1不同表型的外周血Tfh细胞在NMOSD组和健康对照组中的表达以CD4+T细胞设门,NMOSD组CD4+CXCR5+细胞及CXCR5+PD-1+细胞占CD4+T淋巴细胞的比例均高于健康对照组(均P<0.05;表1、图1)。

表1 两组不同表型外周血Tfh细胞表达比较(±s,%)
2.2外周血Tfh细胞的不同亚群在NMOSD组和健康对照组中的表达NMOSD组Tfh1细胞比例低于健康对照组(P<0.05),Tfh17细胞比例及(Tfh2细胞比例+Tfh17细胞比例)/Tfh1细胞比例的比值高于健康对照组(均P<0.05),Tfh2细胞比例也高于健康对照组,但两组差异无统计学意义(P>0.05;图2、表2)。
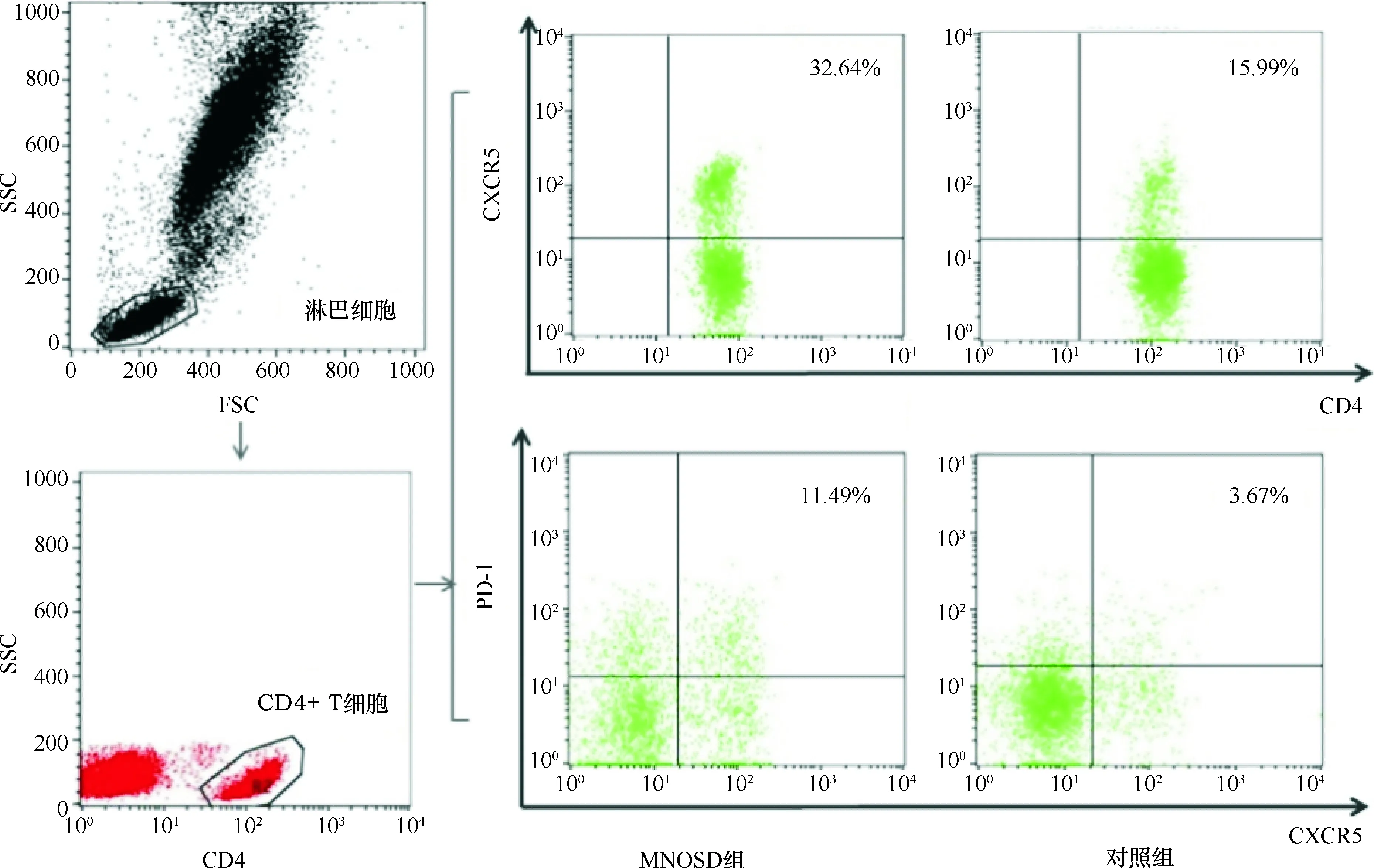
FSC:前向角散射光;SSC:侧向散射光 图 1 两组不同表型外周血Tfh细胞的流式细胞仪分析图

FSC:前向角散射光;SSC:侧向散射光 图 2 两组外周血Tfh1、Tfh2、Tfh17细胞流式细胞仪分析图

组别例数Tfh1比例(%)Tfh2比例(%)Tfh17比例(%)比值aNMOSD53 2641±4423022±5493070±456241±065健康对照组203026±3662817±3712733±289188±039t值-3474154330714264P值0001012700030000
注:a(Tfh2细胞比例+Tfh17细胞比例)/Tfh1细胞比例的比值
3 讨论
目前认为NMOSD主要致病机制为自身反应性抗AQP4抗体(AQP4-IgG)与AS突触表面AQP4蛋白结合后,激活补体,导致血-脑屏障破坏、AS细胞损伤及继发脱髓鞘病变[12],致病性自身抗体AQP4-IgG的异常产生在NMOSD的病理发展过程中至关重要。该抗体是由浆细胞产生的,此过程依赖于T细胞的帮助。Tfh作为一个新发现的T淋巴细胞亚群,在生发中心(germinal centre,GC)形成,直接辅助于B细胞产生抗体,是体液免疫调节机制中的重要因素,Tfh异常增多或相关效应分子异常表达可以导致自身免疫性疾病的发生[3]。CXCR5是识别Tfh细胞最常用的标志分子,CXCR5可以辅助Tfh细胞从淋巴组织中的T细胞区域迁移出来并进入B细胞滤泡[3],这种移动对于CD4+T细胞定位于邻近的原始B细胞并辅助其产生抗体至关重要。PD-1调节生发中心B细胞的存活和选择,是浆细胞形成的必要因素[13]。因此常用CD4+CXCR5+T细胞和CD4+CXCR5+PD-1+T细胞来定义Tfh细胞。传统意义上的Tfh细胞位于次级淋巴组织的GC中,随着对Tfh细胞的认识,在人外周血中也检测到表型为CD4+CXCR5+,并与GC-Tfh功能相似的Tfh细胞[14],包括Tfh1、Tfh2、Tfh17三个亚群。研究显示,Tfh2和Tfhl7可有效诱导幼稚B细胞分化为浆细胞,而Tfh1则无此功能[4]。近年来的研究表明Tfh细胞可能参与神经免疫疾病的发病机制[15-16],但仅有少量有关Tfh细胞及其相关分子在NMOSD患者中表达情况的研究报道,且其结论尚存在着分歧[5-6],这提示仍需要进一步的实验研究来验证Tfh细胞在NMOSD发病中的变化。
本研究通过流式细胞技术检测了CD4+CXCR5+Tfh细胞和CD4+CXCR5+PD-1+Tfh细胞的表达情况,发现在NMOSD患者外周血中两种不同表型的Tfh细胞占CD4+T细胞的比例均明显高于对照组。之前Li等[5]研究指出NMOSD患者外周血中CD4+CXCR5+PD-1+Tfh细胞比例较健康对照和多发硬化患者明显增高,这与本研究结果一致;FAN等[6]研究显示NMOSD患者ICOS+外周血记忆Tfh细胞比例较健康对照明显增高,而PD-1+外周血记忆Tfh细胞比例与健康对照比较无明显差异,这与本研究结果不一致。分析这两项研究结果不同的原因可能是选取的样本量都比较小,并且样本之间存在异质性,在后续的研究中我们会继续增加样本量进一步深入研究。由于Tfh细胞可以辅助B细胞产生抗体,NMOSD患者外周血Tfh细胞比例明显升高,对B细胞产生过强的辅助信号,这有可能是NMOSD患者B细胞的过度活化及自身抗体的大量产生而造成体液免疫紊乱的直接原因之一。
有研究报道外周血Tfh细胞中Tfh1、Tfh2、Tfh17三个亚群在某些自身免疫性疾病如系统性红斑狼疮、干燥综合征、多发性硬化和类风湿关节炎中出现比例失调[7-10]。然而这三个亚群在NMOSD患者中是否会出现比例失调尚不清楚。既往研究发现,外周血Tfh细胞这三个亚群中只有Tfh2和Tfh17 细胞具有传统Tfh细胞的功能并可以诱导初始B细胞分化成熟并产生抗体[4]。本研究结果显示,与健康对照比较,NMOSD患者Tfh17细胞亚群占Tfh细胞的比例增高;Tfh2细胞亚群也呈增高的趋势,但差异无统计学意义;Tfh1细胞亚群比例明显低于健康对照组,而且(Tfh2细胞比例+Tfh17细胞比例) /Tfh1细胞比例的比值显著高于健康对照组。以上结果提示在NMOSD疾病活动期也存在着这三个亚群的比例失调。另外,有研究报道在外周循环Tfh细胞中,Tfh17细胞的比率在免疫缺陷的情况下会明显下降,提示其在辅助B细胞功能中发挥着重要作用[17],并且多篇报道指出Tfh17可能参与一些自身免疫性疾病的发病[7,9-10]。本研究观察到NMOSD患者中Tfh17显著升高,推测Tfh17与NMOSD发病有一定关系,可能通过有效地诱导B细胞产生抗体引起NMOSD的发病。此外,不容忽视的是Tfh2细胞亚群也呈增高的趋势,一项对于系统性红斑狼疮患者外周血中Tfh细胞三个亚群的研究发现患者组Tfh2和Tfh17比例较健康对照均增高,但只有Tfh2比例与疾病活动度、IgG表达水平呈正相关,推测Tfh2在发病中起着关键作用[8],对此有待于后续进一步深入研究。
综上所述,本研究结果显示,NMOSD患者外周血Tfh17细胞比例高于健康对照,而且NMOSD疾病活动期存在着Tfh细胞三个亚群的比例失调,推测Tfh 细胞与NMOSD的发病存在一定关系。上述发现对于从新的视角探索NMOSD的发病机制和治疗方法可能具有一定的积极意义。
[1]Lennon VA,Wingerchuk DM,KryzerTJ,et al. A serum autoantibody marker of neuromyelitis optica:distinction from multiple sclerosis[J]. Lancet,2004,364(9451): 2106-2112.
[2]Lennon VA, Kryzer TJ, Pittock SJ, et al. IgG marker of optic-spinal multiple sclerosis binds to the aquaporin-4 water channel[J]. J Exp Med,2005,202(4):473-477.
[3]Ma CS, Deenick EK, Batten M, et al. The origins, function, and regulation of T follicular helper cells[J]. J Exp Med,2012,209(7):1241-1253.
[4]Morita R, Schmitt N, Bentebibel S, et al. Human blood CXCR5+CD4+T cells are counterparts of T follicular cells and contain specific subsets that differentially support antibody secretion[J]. Immunity,2011,34(1):108-121.
[5]Li Y, Zhang F, Qi Y, et al. Association of circulating follicular helper T cells with disease course of NMO spectrum disorders[J]. J Neuroimmunol,2015,278:239-246.
[6]Fan X, Jiang Y, Han J, et al. Circulating memory T follicular helper cells in patients with neuro-myelitis optica/neuromyelitis optica spectrum disorders [J]. Mediators Inflamm,2016,2016:3678152.
[7]Romme Christensen J, Börnsen L, RatzerR,et al. Systemic inflammation in progressive multiple sclerosis involves follicular T-Helper, Th17- and activated B-Cells and correlates with progression[J]. PLoS One,2013,8(3):e57820.
[8]Le Coz C, Joublin A, Pasquali JL,et al. Circulating TFH subset distribution is strongly affected in lupus patients with an active disease[J]. PLoS One,2013,8(9):e75319.
[9]Li XY, Wu ZB, Ding J,et al. Role of the frequency of blood CD4+CXCR5+CCR6+T cells in autoimmunity in patients with Sjögren’s syndrome[J]. Biochem Biophys Res Commun,2012,422(2):238-244.
[10]Arroyo-Villa I, Bautista-Caro MB, Balsa A, et al. Constitutively altered frequencies of circulating follicular helper T cell counterparts and their subsets in rheumatoid arthritis[J]. Arthritis Res Ther,2014,16(6):500.
[11]Wingerchuk DM, Banwell B, Bennett JL, et al. International consensus diagnostic criteria for neuromyelitis optica spectrum disorders[J]. Neurology, 2015,85(2):177-189.
[12]Wingerchuk DM,Lennon VA,Lucchinetti CF,et al.The spectrum of neuromyelitisoptica [J]. Lancet Neurol,2007,6 (9):805-815.
[13]Good-Jacobson KL, Szumilas CG, Chen L, et al. PD-1 regulates germinal center B cell survival and the formation and affinity of long-lived plasma cells[J]. Nat Immunol,2010,11(6):535-542.
[14]Schmitt N, Ueno H. Blood Tfh cells come with colors[J]. Immunity,2013,39(4):629-630.
[15]张晓燕,常婷,刘沙沙,等. Tfh细胞在重症肌无力患者胸腺中的表达及作用机制[J]. 中国神经免疫学和神经病学杂志,2015,22(5):309-314.
[16]Fan X, Lin C, Han J, et al. Follicular helper CD4+T cells in human neuroautoimmune diseases and their animal models[J]. Mediators Inflamm,2015,2015: 638968.
[17]Vinuesa CG, Fagarasan S, Dong C. New territory for T follicular helper cells[J]. Immunity,2013,39(3):417-420.
ConstitutivelyalteredfrequenciesofcirculatingfollicularhelperTcellandtheirsubsetsinneuromyelitisopticaspectrumdisorders
YANGBinbin,WUQian,SUNLin,YUDi,LIULei,QIAOZhixin,WANGJiawei*.
*MedicalResearchCenter,TongrenHospital,CapitalMedicalUniversity,Beijing100730,China;DepartmentofNeurology,TongrenHospital,CapitalMedicalUniversity,Beijing100730,China
WANG Jiawei, Email:wangjwcq@163. com
ObjectiveThe study was aimed at exploring the relationship between Tfh cells and the pathogenesis of neuromyelitis optica spectrum disorders (NMOSD)by studying the expression of Tfh in the peripheral blood of NMOSD patients.MethodsBy the means of flow cytometry, the percentages of different phenotypes of Tfh cells and three distinct Tfh cell subsets( Tfh1, Tfh2 and Tfh17 )in the peripheral blood of 53 NMOSD patients with acute episodes(NMOSD group)and 20 sex and age-matched healthy controls(control group)were examined.ResultsThe percentages of CD4+CXCR5+Tfh cells and CD4+CXCR5+PD-1+Tfh cells among CD4+T cells was significantly increased in the peripheral blood of the NMOSD group compared with control group,[(22.80±6.78)%vs.(18.94±3.84)%,P=0.003;(9.54±3.29)%vs.(4.21±1.31)%,P=0.000;respectively]. Among CD4+CXCR5+T cells, the percentage of Tfh17 cell subset〔(30.70±4.56)%〕in the NMOSD group was significantly higher than that in the control group[(27.33±2.89)%](P=0.003),while the percentage of Tfh1 cell subset[(26.41±4.42)%]in the NMOSD group was lower than that in the control group〔(30.26±3.66)%〕(P=0.001). In addition,the percentage of Tfh2 cell subset in the NMOSD group showed no significant statistical difference by compared with the control group (P=0.127). Moreover, the ratio of (%Tfh2 + %Tfh17)/%Tfh1 in the NMOSD group was found to be significantly higher that than in the control group(2.41±0.65vs.1.88±0.39,P=0.000).ConclusionsIn acute episodes, the percentage of Tfh cells increased significantly in the peripheral blood of the NMOSD patients. At the same time, the balance of three Tfh cell subsets (Tfh1, Tfh2 and Tfh17) was altered in NMOSD patients, especially the percentage of Tfh17 cell subset was significantly increased. These data indicats that certain relationship exists between Tfh cells and the pathogenesis of NMOSD.
neuromyelitis optica spectrum disorders; T follicular help cell(Tfh); CXC chemokine receptor 5; programmed death 1
10.3969/j.issn.1006-2963.2017.06.002
100730 首都医科大学附属北京同仁医院:中心实验室(杨彬彬、郁迪、乔志新、王佳伟),神经内科(吴茜、孙林、刘磊、王佳伟)
王佳伟,Email:wangjwcq@163. com
R744.5+2
A
1006-2963(2017)06-0385-05
2017-05-09)
邹晨双)

