β-环糊精与双金属石墨烯复合材料对酪氨酸对映体的电化学选择性作用
马 骄,陈奕环,杨成成,宋金奕,夏 巧,傅英姿
(西南大学化学化工学院,重庆400715)
0 引言
手性是自然界的一种普遍现象。构成生物体的基本物质,如核酸、蛋白质、脂肪、糖类等都是手性分子[1-2]。手性化合物与生命过程联系紧密,不同构型的手性异构体在生物体内的药理作用、生理活动、代谢过程等都有着明显的差异,但由于手性对映异构体有着相似的物化性质,很难将其区分开,因此,发展简单、快速、灵敏的手性识别方法至关重要[3-4]。酪氨酸(tyrosine,Tyr)作为一种非必需氨基酸,常被用作原料药和食品添加剂,是酪氨酸酶单酚酶功能的催化底物,也是很多试剂药物(比如抗生素、肾上腺素、多巴等)的合成前体。酪氨酸是最终形成优黑素和褐黑素的主要原料,可减轻白癜风症状,且与美白化妆品的研发息息相关[5-6]。作为一种手性氨基酸,酪氨酸具有D/L两种构型。L-Tyr在生命系统中有重要的作用,若缺乏L-Tyr可能会导致抑郁等心理疾病,但过量则会增加姐妹染色的交换几率,从而致使遗传性疾病的产生[7-8]。D-Tyr作为L-Tyr的对映异构体不天然存在,主要用于生化研究。手性氨基酸的研究有着重要的意义,现如今已经有许多方法对酪氨酸对映体进行检测和手性识别,其中包括分子印迹[9]、质谱法[10]、荧光法[11]和电化学[12]等方法。而电化学手性传感器具有准确度高、灵敏度高、选择性好、操作便捷、价格低廉等优点,已逐渐发展成一种重要的手性识别方法[13]。
还原氧化石墨烯(rGO)是一种是由碳原子以sp2杂化方式连接而成的二维材料,具有大的比表面、高的导电性及生产的成本低等优点,在纳米技术、传感器、电催化等领域都有广泛应用[13]。纳米金属合金具有独特的电子结构和较大的比表面积,且在催化、生物传感等领域表现出比单金属纳米材料更好的催化特性[14-15]。金铂合金纳米粒子(Au-PtNPs)呈现出良好的生物相容性和导电性并且具有较大的比表面积,作为电极修饰材料在电化学手性识别研究中有着好的应用前景[16]。环糊精(CD)具有外缘亲水内部疏水结构,能与许多分子形成包合物,常被用作手性选择剂[17]。 而β-环糊精(β-CD)作为环糊精的衍生物之一,具有外亲水、内疏水的特殊性质,使其可通过范德华力、疏水作用、氢键等分子间作用力选择性地与目标分子结合,形成稳定的主客体包合物,因此它具有很好的分子识别性能[18]。
该实验合成了金铂纳米合金与还原氧化石墨烯纳米复合材料 (Au-PtNPs/rGO),并将其修饰于玻碳电极表面,随后将手性选择剂β-环糊精(β-CD)滴涂在上诉修饰电极表面,得到β-CD/Au-PtNPs/rGO修饰电极并研究了其对酪氨酸对映体的电化学作用。
1 实验部分
1.1 试剂和仪器
四水氯金酸,六水氯铂酸及硼氢化钠购买于Sigma Chemical Co.(St.Louis,MO,美国),D/L-酪氨酸,氧化石墨烯和β-环糊精分别购自百灵威科技有限公司(中国,北京),纳米先锋试剂公司(中国,南京)和上海晶纯生化科技股份有限公司(中国,上海)。工作缓冲溶液为0.1mol/L磷酸缓冲溶液(PBS,pH=7.4)制备的 5.0×10-3mol/L铁氰化钾溶液。其余化学试剂均为分析纯,可直接使用无需进一步纯化。所有实验用水均为二次蒸馏水。
所有电化学测试都在CHI440A电化学工作站(上海辰华,中国)上进行,标准三电极体系中,铂丝电极做为对电极,饱和甘汞电极为参比电极,玻碳电极和修饰过的玻碳电极均为工作电极。扫描电子显微镜照片由扫描电子显微镜S-4800(SEM,日立,日本)测得。
1.2 制备Au-PtNPs/rGO复合材料
还原石墨烯和金铂纳米复合材料的制备参照文献方法并有稍许变动[19]。具体操作如下:3 mg氧化石墨烯加入3mL水中,超声0.5 h使其分散均匀,随后将1mL六水氯铂酸(1%)和1mL四水氯金酸(1%)加入到棕色的氧化石墨烯溶液中,在持续搅拌条件下,向上述混合溶液逐滴加入10mL新制备硼氢化钠(0.48mol/L)溶液。室温条件下,搅拌24 h。在反应过程中可观察到溶液颜色由浅棕色渐变为黑色,表明氧化石墨烯被成功还原。最后,反复多次离心分离所得溶液,并用二次蒸馏水洗涤晾干。所得产品标记为Au-PtNPs/rGO。
1.3 传感界面的制备
裸玻碳电极(GCE,Φ=4mm)分别用1.0、0.3和0.05 nm的Al2O3抛光粉打磨抛光,并依次在乙醇和二次蒸馏水中超声清洗5min,除去Al2O3粉末。自然晾干后取10μLAu-PtNPs/rGO分散液滴涂到干净的玻碳电极表面,室温下晾干。随后,取相同量的0.5mg/mLβ-CD滴涂于上述修饰电极上,于室温下晾干,备用。进行测试时,修饰电极用二次蒸馏水冲洗以除去表面未作用的材料,于室温下晾干使用。电极构建示意图如图1所示。
2 结果分析与讨论
2.1 纳米材料表征

图1 传感界面构建过程图Fig.1 Procedures for the preparation ofβ-CD/Au-PtNPs/rGO nanohybrids and the sensing platform
GO及Au-PtNPs/rGO复合纳米材料的表面形貌可由扫描电子显微镜技术(SEM)进行表征。图2A为氧化石墨烯(GO)的SEM图,从图中可以看到GO表面有轻微起伏不平的皱纹,与已有文献报道相符。将氯铂酸、氯金酸和GO混合还原后(图2B),可发现在石墨烯片层上附着有大量的金铂纳米颗粒,且金铂纳米颗粒分散均匀。为进一步表征Au-PtNPs/rGO复合纳米材料上附着的Au-Pt纳米颗粒,实验中应用了X-射线能谱 (EDX)对复合材料的金属元素进行了分析(图2C),结果证实金、铂两种金属元素的存在,从而表明了Au-PtNPs/rGO复合纳米材料的成功合成。

图2 (A)GO,(B)Au-PtNPs/rGO的SEM形貌;(C)Au-PtNPs/rGO的EDX图像Fig.2 SEM images of(A)GO,(B)Au-PtNPs/rGO and(C)EDX image of Au-PtNPs/rGO
2.2 不同修饰界面的电化学响应

图3 不同材料与工作溶液的电化学响应:(a)裸玻碳电极,(b)Au-PtNPs/rGO,(c)β-CD/Au-PtNPs/rGOFig.3 CVs of different electrodes:(a)bare glassy carbon electrode,(b)Au-PtNPs/rGO and(c)β-CD/Au-PtNPs/rGO
采用循环伏安技术(CV)研究了不同界面在5 mmol/L的铁氰化钾缓冲溶液(pH=7.4)中的电化学行为(扫速 0.1 V/s,范围-0.2V 到 0.6V),图 3记录了每步修饰过程的循环伏安曲线。从图中可以看出裸玻碳电极呈现出一对对称的氧化还原峰 (曲线a),而Au-PtNPs/rGO修饰电极(曲线b)的峰电流比裸玻碳电极(曲线a)高,这是由于Au、Pt纳米粒子和rGO具有良好的电子传输能力。由于β-CD阻碍电子传递,因此,β-CD/Au-PtNPs/rGO修饰电极(曲线c)的峰电流比Au-PtNPs/rGO修饰电极(曲线b)的低。这一结果也说明了修饰电极的成功构建。
2.3 传感器界面对酪氨酸对映体的选择性作用
应用差分脉冲伏安 (DPV)技术测试了5 mmol/L酪氨酸(溶于0.25mol/L硫酸)对映体与不同修饰电极作用时的电化学行为。如图4所示,酪氨酸对映体在0.8~1.0 V电位范围内出现了一个氧化峰。在裸GCE(图4A)上,D-酪氨酸(曲线a)和L-酪氨酸(曲线b)的电流响应曲线几乎重合,说明裸GCE不能有效区分酪氨酸对映体。在Au-PtNPs/rGO/GCE(图 4B)上,D-酪氨酸和 L-酪氨酸的氧化峰出现不明显的细微差异,但在Au-PtNPs/rGO/GCE上酪氨酸对映体的峰电流相对裸GCE有明显升高,这是由于Au-PtNPs/rGO复合材料促进了电极表面的电子传输。在β-CD/Au-PtNPs/rGO/GCE修饰电极上(图4C),氧化峰出现了明显的电流差异,且电流差(ΔIp=IpL-Tyr-IpD-Tyr)为9.5μA。这表明β-CD在对酪氨酸对映体的选择作用中起着重要作用,且Au-PtNPs/rGO起到了促进电子传递的作用,从而对酪氨酸对映体的选择作用有信号放大的效果。并且从图中可以看出, 相比于 D-Tyr,β-CD/Au-PtNPs/rGO/GCE对L-Tyr的选择作用更强。

图4 手性传感界面对5mmol/L(a)D-Tyr和(b)L-Tyr的DPV响应:(A)裸GCE,(B)Au-PtNPs/rGO/GCE,(C)β-CD/Au-PtNPs/rGO/GCEFig.4 DPVsof5mmol/L(a)D-Tyrand(b)L-Tyron(A)bareGCE,((B)Au-PtNPs/rGO/GCE and(C)β-CD/Au-PtNPs/rGO/GCE
可能的机理设想如下:酪氨酸对映体与β-CD作用时,其分子可能被包络在β-CD的疏水腔内部[20],由于Tyr对映体两种构型的空间结构存在差异,致使它们与β-CD之间的作用力(如:范德华力、氢键等)不一样,而L-Tyr可能跟β-CD的腔体大小更匹配,导致β-CD对L-Tyr具有更强的选择作用。
2.4 线性
为了进一步研究电流响应与酪氨酸对映体浓度的关系,在最佳实验条件下,进行了β-CD/Au-PtNPs/rGO/GCE修饰电极与一系列浓度的酪氨酸对映体作用后的差分脉冲伏安测试。如图5所示,在0.1 mmol/L至5.0mmol/L浓度范围内,D-Tyr(曲线 a)和 L-Tyr(曲线 b)的电流响应值与其浓度呈现线性关系,且二者的线性方程分别为IpD-Tyr(μA)=(7.74±0.50)+(9.62±0.18)cD-Tyr(r2=0.9991)和 IpL-Tyr(μA)=(10.51± 1.11)+(10.91±0.39)cL-Tyr(r2=0.9946)。同时,在该浓度范围内,LTyr的电流响应始终大于D-Tyr,由此说明该传感器可以在0.1mmol/L至5.0mmol/L浓度范围内用于酪氨酸对映异构体的识别和检测。
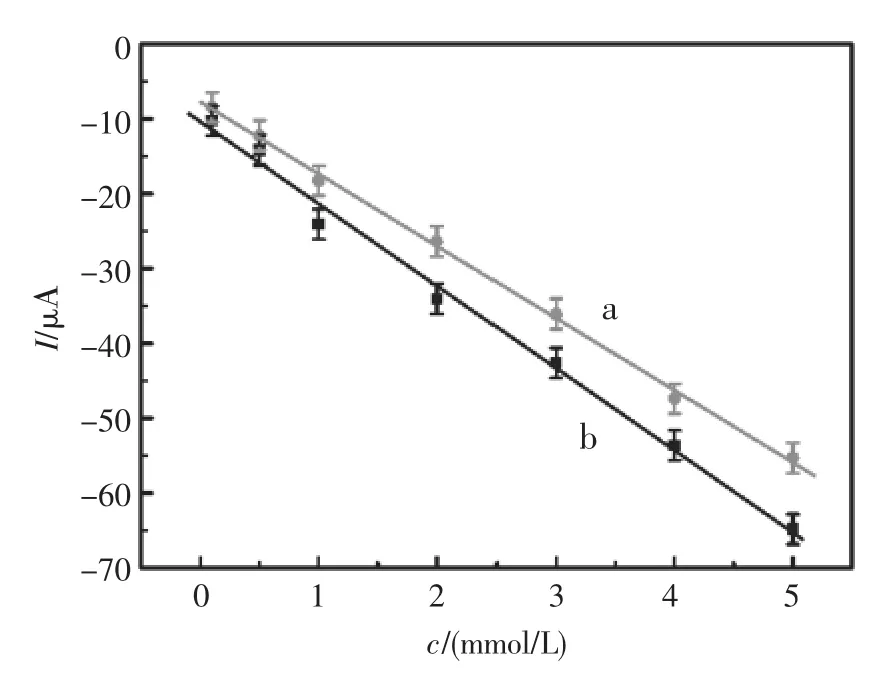
图5 β-CD/Au-PtNPs/rGO/GCE对不同浓度酪氨酸对映体的DPV响应:(a)D-Tyr,(b)L-TyrFig.5 Calibration curves of the stereos elective sensor for Tyrenantiomers discrimination:(a)D-Tyr and(b)L-Tyr
3 结论
实验将β-CD自组装在Au-PtNPs/rGO复合材料修饰的玻碳电极表面,构建了一个简单可靠的电化学传感界面,并将其用于与D-Tyr与LTyr的手性识别研究。实验中由于D-Tyr和L-Tyr的空间结构差异,导致其与β-CD的作用程度不同,因此在DPV中得到不同的峰电流,从而可以进行手性识别研究。该传感器不仅能实现对酪氨酸对映体的选择性识别,而且为其他手性氨基酸或手性小分子与β-CD的作用提供了一定的理论基础,具有潜在的应用价值。
[1]Tang K,Gan H,Y Li,et al.Stereoselective interaction between DNA and chiral surfaces[J].J.Am.Chem.Soc.,2008,130:11284-11285.
[2]Maier NM,Franco P,Lindner W.Separation of enantiomers:needs,challenges,perspectives[J].Chromatogr.A.,2001,906:3-33.
[3]Zhang M,Ye B C.Colorimetric chiral recognition of enantiomers using the nucleotide-capped silver nanoparticles[J].Anal.Chem.,2011,83: 1504-1509.
[4]Liu C,LiB,Xu C.Colorimetric chiral discrimination and determination of enantiometric excess of D/L-tryptophan using silver nanoparticles[J].Microchim.Acta.,2014,181:1407-1413.
[5]Resnick S I,Hernandez L,Chen J,etal.Effect of the anorectic drug,phenyl propanolamine,on blood glucose in rats[J].Pharmacology,1978,17:157-162.
[6]Meyer JS,Welch K M A,Deshmukh V D,et al.Neurotransmitter Precursor Amino Acids in the Treatment of Multi‐Infarct Dementia and Alzheimer's Disease[J].J.Am.Geriatr.Soc.,1977,25:289-298.
[7]Gelenberg A J,Gibson C J,Wojcik JD.Neurotransmitter precursors for the treatment of depression[J].Psychopharmacol.Bull.,1982,18:7.
[8]LiC.Voltammetric determination of tyrosine based on an l-serine polymer film electrode[J].Colloids.Surf.B.,2006,50:147-151.
[9]Lin JM,Nakagama T,Wu X Z,et al.Capillary electrochromatographic separation ofamino acid enantiomers withmolecularly imprinted polymersas chiral recognition agents[J].Fresen.J.Anal.Chem.,1997,357:130-132.
[10]DiMarco T,Giulivi C.Current analytical methods for the detection of dityrosine,a biomarker of oxidative stress,in biological samples[J].Mass.Spectrum.Rev.,2007,26:108-120.
[11]Tsourkas A,Newton G,Perez JM,et al.Detection of peroxidase/H2O2-mediated oxidation with enhanced yellow fluorescentprotein[J].Anal.Chem.,2005,77:2862-2867.
[12]Ma Q,Ai S,Yin H,et al.Towards the conception of an amperometric sensor of l-tyrosine based on Hemin/PAMAM/MWCNT modified glassy carbon electrode[J].Electrochim.Acta.,2010,55:6687-6694.
[13]Zhou J,Chen Q,Wang Y,et al,Stereoselectivity of tyrosine enantiomers in electrochemical redox reactions on goldmatrices[J].Electrochim.Acta.,2012,59:45-48.
[14]Allen M J,Tung V C,Kaner R B.Honeycomb carbon:a review of graphene[J].Chem.Rev.,2009,110:132-145.[15]Mahshid SS,Mahshid S,Dolati A,et al.Template-based electrodeposition of Pt/Ninanowires and its catalytic activity towards glucose oxidation[J].Electrochim.Acta.,2011,58:551-555.
[16]Lee Y J,Park JY.A coral-likemacroporous gold-platinum hybrid 3D electrode for enzyme-free glucose detection[J].Sensor Actuat.B.Chem.,2011,155:134-139.
[17]Szente L,Szemán J.Cyclodextrins in analytical chemistry:Host–guest typemolecular recognition[J].Anal.Chem.,2013,85:8024-8030.
[18]Mura P.Analytical techniques for characterization of cyclodextrin complexes in aqueous solution:a review[J].J.Pharm.Biomed.Anal.,2014,101:238-250.
[19]Chen X M,Cai Z X,Huang Z Y,et al.Non-enzymatic oxalic acid sensor using platinum nanoparticles modified on graphene nanosheets[J]. Nanoscale,2013,5:5779-5783.
[20]Serno T,Carpenter JF,Randolph TW,etal.Inhibition of agitation-induced aggregation of an IgG-antibody by hydroxypropyl-β-cyclodextrin[J].J.Pharm.Sci-us.,2010,99:1193-1206.

