基于半胱胺修饰传感器对五羟色胺的测定研究
宋泽萱,刘 肖,康维钧,牛凌梅*
(河北医科大学公共卫生学院,河北石家庄050017)
0 引言
5-羟色胺 (5-hydroxytryptamine,5-HT)亦称血清素(serotoin),是色胺酸的代谢产物。色胺酸在组织中经过色胺酸羟化酶和5-羟色胺酸脱羧酶的作用生成5-羟色胺,又经单胺氧化酶作用生成5-羟色醛;进一步氧化成5-羟吲哚乙酸[1]。5-羟色胺是人体内重要的神经递质,其参与睡眠、摄食、体温、学习、记忆等多种生理过程。中枢神经系统5-HT含量异常与重性抑郁障碍和自杀行为有着极其重要的联系,同时也可以影响血脑屏障通透性的改变[2]。
目前,测定5-HT含量的方法有很多,例如:免疫法[3-4]、荧光法[5]、高效液相色谱法[6-8]、电化学方法[9-11]等。免疫荧光法灵敏度较差,高效液相色谱法费时繁琐,多需要样品前处理。而电化学方法简便、快速、灵敏等优点吸引了研究者很大兴趣。迄今为止,已有很多用修饰电极测定5-HT的报道,例如:以聚酚红花红修饰电极[12]、碳纳米管膜修饰玻碳电极[13]、 碳纳米管插层石墨电极[14]、铁酞菁配合物修饰碳糊电极[15]测定5-HT,但用半胱胺(CYS)修饰金电极的方法还未曾报道,5-HT反应机理也未曾探究。该实验拟利用CYS修饰金电极,制备自组装膜传感器,并在此基础上建立5-HT的定量检测方法。
1 实验部分
1.1 仪器与实验材料
CHI650D电化学工作站(上海辰华仪器有限公司);采用三电极系统:铂丝为对电极,Ag/AgCl电极为参比电极,CYS/Au电极为工作电极。扫描电镜:日本日立公司S-4800型扫描电镜,扫描电位0~3 kV。
半胱胺(0.01mol/L)购于Sigma试剂公司,5-HT(0.001mol/L)购于中国药检所,其余试剂为分析纯,实验用水为超纯水。
1.2 半胱胺修饰电极的制备
分别用0.3,0.05μm三氧化铝悬浆将裸金电极(直径 2mm)打磨至镜面,浸入在Piranha溶液中15min,再分别用无水乙醇和超纯水各超声5 min。清洗后的金电极置于0.1mol/L硫酸溶液中,在-0.2~1.6 V电位范围内扫描至稳定[16-17]。将清洗好的电极浸入到0.01mol/LCYS溶液中6 h,取出反复用超纯水冲洗以除去物理吸附的物质,得到半胱胺修饰金电极(CYS/Au)。
2 结果与讨论
2.1 扫描电镜对CYS/Au电极的表征

图1 裸电极(A)和CYS修饰电极(B)的扫描电镜图Fig.1 Scan electron microphoto graph of bare(A)and CYSmodified electrode(B)
利用扫描电镜对裸金电极和CYS/Au修饰电极的表面形貌进行了探究。如图1(A)所示,未修饰任何物质时,裸金电极表面呈不规则、不平整、较粗糙的状态,可见明显沟壑。经半胱胺修饰后,电极表面粗糙不规则的状态大大改善,表面光滑平整,沟壑基本消失(如图1(B)所示),可推测半胱胺已经修饰于金电极表面。
2.2 5-HT在半胱胺修饰金电极上的电化学响应利用差分脉冲法研究了5-HT在裸金电极及
修饰电极上的电化学响应(图2)。在裸金电极表面,5-HT的氧化峰电流为3.195×10-7A。而在半胱胺修饰电极表面,5-HT氧化电流大大增加(6.686×10-7A),峰电流增加了109%,而且氧化峰电位有了一定的降低。这可能是由于半胱胺修饰膜中的羧基与5-HT中的羟基形成了分子内氢键,从而加速了电子的传递,提高了识别的灵敏度。可见,修饰电极对5-HT的氧化能够起到明显的电催化作用,灵敏度大大增加。
2.3 半胱胺修饰时间对5-HT测定的影响
利用差分脉冲伏安法研究了半胱胺修饰膜组装时间对5-HT测定的影响。将处理好的电极分别组装 4 h,5 h,6 h,12 h,20 h,30 h 进行修饰,并测量5-HT电流峰值。如图3所示,随着半胱胺组装时间的延长,5-HT的响应峰电流也随之增大,这可能是由于随着半胱胺组装时间的延长,其所吸附的量也随之增加,对5-HT测定的催化能力也逐渐增加,因此电流逐渐增大。但当时间超过6 h后,氧化电流增加趋于平缓,说明电极表面吸附的半胱胺已趋于饱和。因此,选用6 h作为最佳组装时间。

图2 裸电极(b)和CYS/Au(a,c)电极在5-HT溶液中(b,c)和空白溶液(a)中差分脉冲曲线。 浓度:1.0×10-4 mol/L;缓冲溶液pH:7.0;扫描速度:0.1 V/sFig.2 Differential pulse voltammetry(DPV)curves at bare gold electrode(b)and CYS/Au electrode(a,c)in the presence(b,c)and absence(a)of1.0×10-4 mol/L 5-HT.pH of phosphate buffer:7.0;Scan rate:0.1 V/s
2.4 支持电解质pH对5-HT测定的影响

图3 半胱胺修饰时间对5-HT氧化峰电流的影响5-HT 浓度:1.0×10-4 mol/L ;缓冲溶液 pH:7.0;扫描速度:0.1 V/sFig.3 Effect of modification time of CYS on the anodic peak current of5-HT in phosphate buffer.5-HTconcentration:1.0×10-4 mol/L;pH of phosphate buffer:7.0;Scan rate:0.1 V/s
在不同pH值的磷酸缓冲溶液中用差分脉冲伏安法研究了支持电解质对5-HT测定的影响。如图4(A)所示,当底液pH值从4.5增至5.5时,峰电流也随之增加,然而当底液pH值进一步增加时,峰电流却逐渐下降,因此试验选择pH5.5的磷酸盐缓冲溶液作为底液来检测五羟色胺。如图4(B)所示,在pH4.5~pH7.5范围内,随着pH增加,5-HT的氧化峰电位逐渐减小且呈良好的线性关系,线性回归方程为Ep=-0.062pH+0.77(r:0.9949),斜率为62mV/pH,与能斯特方程理论值(59mV/pH)接近,这表明电子转移数与质子转移数相等[18-20]。

图4 (A)缓冲溶液pH对5-HT氧化峰电流的影响;(B)缓冲溶液pH对5-HT氧化电位的影响5-HT 浓度:1.0×10-4 mol/L;扫描速度:0.1V/sFig.4 (A)Effect of pH on the anodic peak current in phosphate buffer;(B)Effect of pH on the anodic peak potential in phosphate buffer.5-HT concentration:1.0×10-4 mol/L;Scan rate:0.1 V/s
2.5 扫描速率对电极响应的影响
利用循环伏安法考察了扫描速率对5-HT在半胱胺修饰电极表面电化学响应的影响。所有的峰电流均与扫描速率的平方根呈线性关系,线性回归方程为ip=0.84v1/2+4.7(r:0.9957;ip:10-7A)表明电极反应是受扩散控制的过程。5-HT在修饰电极上,峰电流随扫描速度的变化如图5。
2.6 分析应用

图5 扫描速度对5-HT氧化峰电流的影响。5-HT浓度:1.0×10-4 mol/L;缓冲溶液 pH:5.5Fig.5 Effect of the scan rate on the anodic peak current in phosphate buffer.5-HT concentration:1.0×10-4 mol/L;pH of phosphate buffer:5.5
利用差分脉冲法(DPV)研究了5-HT在半胱胺修饰电极上检测的线性关系。实验结果如图6所示,发现5-HT的氧化峰电流在5.0×10-7~7.0×10-5mol/L范围内均随着其浓度的增加而线性增加,线性方程为ip=0.046 c+0.058(r:0.9966,c:10-6mol/L,ip:10-7A),检出限为 2.8×10-8mol/L。
2.7 CYS/Au电极的稳定性
在1.0×10-5mol/L的5-HT溶液中考察了半胱胺修饰金电极的稳定性。10次连续测定之后,5-HT的峰电流变化在5%以内。将此修饰电极置于蒸馏水中40 d后,仍保留99.5%的电催化活性。以上结果均表明此修饰电极有着很好的稳定性。
2.8 电化学参数计算及反应机制研究

图6 5-HT不同浓度的差分脉冲法曲线图。缓冲溶液pH:5.5;扫描速度:0.1V/sFig.6 DPV curves of the various concentration of5-HT.pH of phosphate buffer:5.5;Scan rate:0.1 V/s
为了进一步探讨5-HT在CYS/Au电极上的反应过程,对5-HT反应的电化学参数进行了计算。根据公式[21-22],计算了5-HT的扩散系数(D),

A表示修饰电极的表面积 (d=2mm),n表示电子转移数,此处n=2[23],D表示扩散系数,c表示5-HT溶液浓度(1.0×10-4mol/L)。由此,计算得出5-HT的扩散系数D为1.2×10-9cm2/s。
根据Ep-pH呈线性关系的实验结果,5-HT的氧化过程可推测为失去两个电子且同时伴随着两个质子的转移,反应机理方程式可表示为
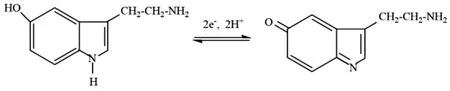
2.9 干扰物质的测定
研究了各种干扰物对5-HT测定的影响。在相对误差 5%限度之内,500 倍的 Na+、Ca2+、K+、Mg2+、SO42+、Cl-,100 倍的谷氨酸、甘氨酸,等倍的肾上腺素,对于测定不产生干扰,说明此电极有很好的选择性。
2.10 样品测定
取3.00mL人体血清加入等体积的甲醇离心沉淀,取出4.00mL上清加入等体积的PBS(pH=5.5)混匀,利用DPV方法进行样品测定。由于5-HT在人体血清中含量极低,故采用加标回收方法验证此修饰电极的稳定性。测得结果如表1所示。

表1 血样中5-HT的测定结果Tab.1 Results for the determination of5-HT in serum samples
3 结论
制备了半胱胺修饰的金电极,并用差分脉冲伏安法研究了5-HT在此修饰电极上的电化学行为。实验结果证明半胱胺修饰金电极与裸金电极相比,对5-HT的氧化起到明显的电催化作用,测定的灵敏度大大提高,且稳定性良好。在此基础上考察了测定5-HT的优化条件以及线性范围,结果发现,5-HT的氧化峰电流与其浓度在5.0×10-7~7.0×10-5mol/L范围内呈良好的线性关系,检出限达到2.8×10-8mol/L,准确度高,可广泛应用于样品测定。
[1]周翔,辛中国,孙国光.血清5-羟色胺的测定及其意义[J].白求思医科大学学报,1984,10(1):1-5.
[2]张远冬,张有金,郭延垒,等.HPLC-UV法测定大鼠脑组织中5-羟色胺含量[J].中国现代药物应用,2012,6(21):14-16.
[3]黄建国,陆世华,王晓春.酶免试验法测定全血5-羟色胺[J].临夏医学杂志,2002,24(9):545-546.
[4]李建刚,张巧俊,高敬龙,等.脑卒中后抑郁患者5-羟色胺含量的研究[J].中国临床神经科学,2007,15(2):129-132.
[5]张秀明,顾仁俊,张中兴,等.荧光分光光度法测定血清5-羟色胺的实验研究及临床应用[J].陕西医学检验,2009,9(1):14-16.
[6]鲁燕侠,崔佳蔺,兴谣,等.RP-HPLC-荧光检测法测定小鼠脑组织5种神经递质的含量[J].解放军药学学报,2003,19(4):262.
[7]Mu S,LiY,Tang AG,etal.Simultaneous determination of tyrosine,tryptophan and 5-hydroxytryptamine in serum of MDD patients by high performance liquid chromatography with fluorescence detection[J].Clin.Chim.Acta,2012,413(11-12):973-977.
[8]Zhen QN,Xu B,Ma L,etal.Simultaneous determination of tryptophan,kynurenine and 5-hydroxytryptamine by HPLC:Application in uremic patients undergoing hemodialysis[J].Clin.Biochem.,2011,44(2-3):226-230.
[9]冯德香,黄蕾,张少君.铂纳米/碳纳米管电化学方法研究及血样中Sal和5-HT的测定[J].药物分析杂志,2013,33(12):2051-2055.
[10]Hu L,Wang Q,Qin Z,et al.Detection of 5-hydroxytryptamine (5-HT)in vitro using a hippocampal neuronal network-based biosensor with extracellular potential analysis of neurons[J].Biosens.Bioelectron., 2015,66:572-578.
[11]Yang J,Yang X L.Electrochemical determination of 5-hydroxytryptamine using mesoporous SiO2modified carbon paste electrode[J].Russ.J.Electrochem.,2009,45(12):1346-1350.
[12]Selvaraju T,Ramaraj R.Simultaneous determination of ascorbic acid, dopamine and serotonin at poly(phenosafranine)modified electrode[J].Electrochem.Commun.,2003,5(8):667-672.
[13]Bruno C J,Rasa P,Mariana E G,et al.Direct electron transfer of glucose oxidase at glassy carbon electrode modified with functionalized carbon nanotubes within a dihexadecyl phosphate film[J].Sens.Actuators B-Chem.,2011,158(1):411-417.
[14]Wang Z H,Liang Q L,Wang Y M,et al.Carbon nanotube-intercalated graphite electrodes for simultaneous determination of dopamine and serotonin in the presence of ascorbic acid[J].J Electroanal.Chem.,2003,540:129-134.
[15]Oni J,Nyokong T.Simultaneous voltammetric determination of dopamine and serotonin on carbon paste electrodes modified with iron(Ⅱ)phthalocyanine complexes[J].Anal.Chim.Acta,2001,434(1):9-21.
[16]Wang SF,Du D,Zou Q C.Electrochemical behavior of epinephrine at L-cysteine self-assembled monolayers modified gold electrode[J].Talanta,2002,57(4):687-692.
[17]Wang SF,Du D.Differential pulse voltammetry determination of ascorbic acid with ferrocene-L-cysteine self assembled supramolecular film modified electrode[J].Sens.Actuator B-Chem.,2004,97(2-3):373-378.
[18]Narayana,Madhusudana R,Gopal,et al.Electrocatalytic boost up of epinephrine and its simultaneous resolution in the presence of serotonin and folic acid atpoly(serine)/multi-walled carbon nanotubes composite modified electrode:A voltammetric study[J].Mat.Sci.Eng.CBio.,2015,56:57-65.
[19]Zheng L Z,Wu SG,Lin XQ,et al.Selective Determination of Uric Acid by Using aβ-Cyclodextrin Modified Electrode[J].Electroanal.,2001, 13(16):1351-1354.
[20]Khadijeh E,Hedayatollah G.Structural changes of glucose oxidase upon interaction with gold-coatedmagnetic nano-particles[J].Int.J.Biol.Macromol.,2012,51(5):998-1002.
[21]Niu LM,Luo H Q,LiN B.Electrochemical Behavior of Uric Acid at a Meso‐2,3‐Dimercaptosuccinic Acid Self‐Assembled Gold Electrode[J]. Instrum.Sci.Technol.,2007,35(1):59-73.
[22]Niu LM,Luo H Q,LiN B.Electrochemical Behavior of Epinephrine at a Penicillamine Self-Assembled Gold Electrode,and its Analytical Application[J].Microchim.Acta,2005,150(1):87-93.
[23]Chen G N,Zhao Z F,Wang X L,et al.Electrochemical behavior of tryptophan and its derivatives at a glassy carbon electrode modified with he min[J].Anal.Chim.Acta,2002,452(2):245-254.

