青龙衣化学成分及生物活性研究进展
宫俊杰 ,宫学斌 *,张敏 ,赵煜炜 ,姜建波
(1.烟台龙大核中宝食品有限公司,山东烟台 265229;2.龙大食品集团有限公司,山东烟台 265231)
青龙衣化学成分及生物活性研究进展
宫俊杰1,宫学斌1*,张敏2,赵煜炜2,姜建波2
(1.烟台龙大核中宝食品有限公司,山东烟台 265229;2.龙大食品集团有限公司,山东烟台 265231)
青龙衣是胡桃科胡桃属植物胡桃和胡桃楸未成熟果实的干燥果皮,是核桃加工产业的副产物。青龙衣含有醌类、黄酮类、二芳基庚烷类、萜类、苯丙素类、有机酸及其酯类等营养成分,具有抗肿瘤、抑菌、抗氧化等多种生物活性。本文就青龙衣的化学成分和生物活性作用进行整理总结,并对青龙衣的开发利用进行展望,为青龙衣的进一步开发和利用提供依据。
青龙衣;化学成分;生物活性;研究进展
青龙衣是胡桃科胡桃属植物胡桃(Juglands mandshuricaMaxim.)和胡桃楸(Juglands ragiaL.)未成熟果实的干燥果皮,是核桃加工产业的副产物。始载于《开宝本草》,命名为“胡桃青龙”,《救急方》中称之“青胡桃皮”,后于《山东中草药手册》中称为“青龙衣”,现多沿用此名,主要用于治疗脘腹疼痛,水痢不止,痈肿疮毒,白癜风、牛皮癣等[1]。本文就青龙衣的化学成分及生物活性的研究进行整理总结,以期为农产品副产物的进一步开发和利用提供依据。
1 化学成分
青龙衣的化学成分丰富,目前从青龙衣中分离得到的化合物主要有醌类、黄酮类、苯丙素类、有机酸及其酯类和酚类化合物等。
1.1 醌类化合物
醌类化合物是一类分子内具有不饱和环二酮类的化合物,主要由苯醌、蒽醌、萘醌、菲醌四类组成。目前,青龙衣中发现的醌类化合物有70余种,主要为萘醌、蒽醌以及蒽醌的还原产物萘酚及萘酮等(见表1)。其中胡桃醌具有明确的细胞毒作用,是中药抗肿瘤的研究热点。

表1 青龙衣中的醌类化合物
1.2 黄酮类化合物
黄酮类化合物是天然产物中普遍存在的一种以2-苯基色原酮为母核的化学成分。青龙衣中含多种黄酮类化合物,这些物质主要为黄酮醇、二氢黄酮醇、双氢山奈酚、汉黄芩素以及其苷类,也是青龙衣的重要的活性物质,见表2。

续表2
1.3 二芳基庚烷类化合物
二芳基庚烷类化合物是指两个芳环的1,7位被一条7碳原子脂肪链连接而成的一类化合物的总称,因其具有独特的化学结构与立体构型,生物活性广泛,主要体现在抗癌、抗衰老、镇痛抗炎、提高免疫力等方面。青龙衣中二芳基庚烷类化合物种类也很多,具体见表3。

表3 青龙衣中的二芳基庚烷类化合物
1.4 萜类及甾体类化合物
萜类化合物以异戊二烯为单位聚合而成,甾体类化合物的骨架则为环戊烷骈多氢菲,这两类化合物也是青龙衣中发现较多的天然成分,是挥发油中沸点较低部分的主要组成部分。青龙衣中的萜类及甾体类化合物见表4。

表4 青龙衣中的萜类及甾体类化合物
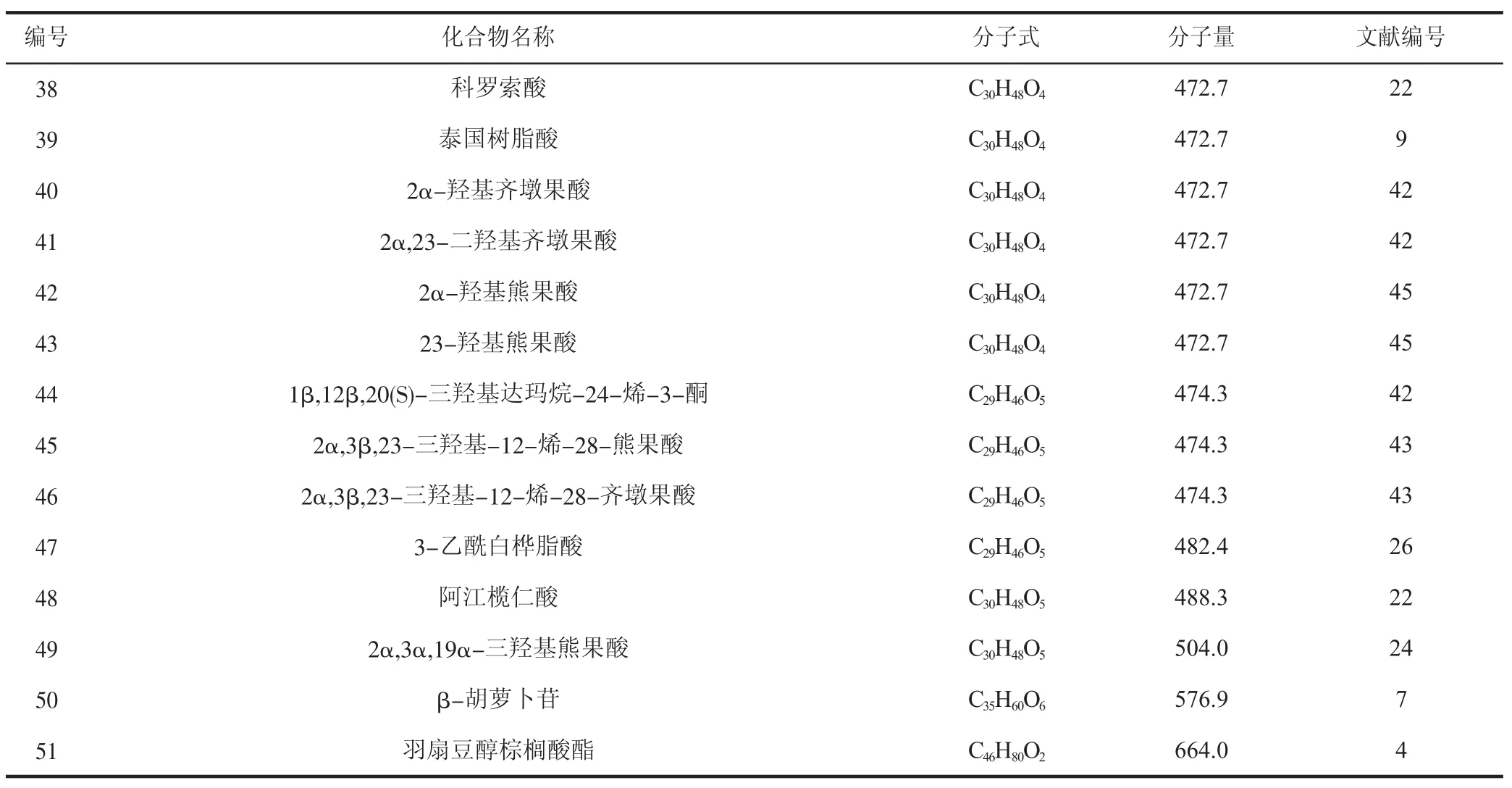
续表4
1.5 苯丙素类化合物
苯丙素类化合物是苯环的C3-C6位与三个碳原子组成的直链连接而成的一类化合物。青龙衣中的该类化合物大多为绿原酸及其异构体等,具有较强的抗氧化活性(见表5)。
1.6 有机酸及其酯类
目前,在青龙衣中分离得到的有机酸及其酯类化合物约为17种,其中没食子酸具有明确的抗氧化活性,具体见表6。
1.7 酚类化合物
酚类化合物是指芳香烃环上的氢被羟基取代的一种芳香族化合物,青龙衣中的酚类化合物主要为酚及酚苷类见表7。

表5 青龙衣中的苯丙素类化合物
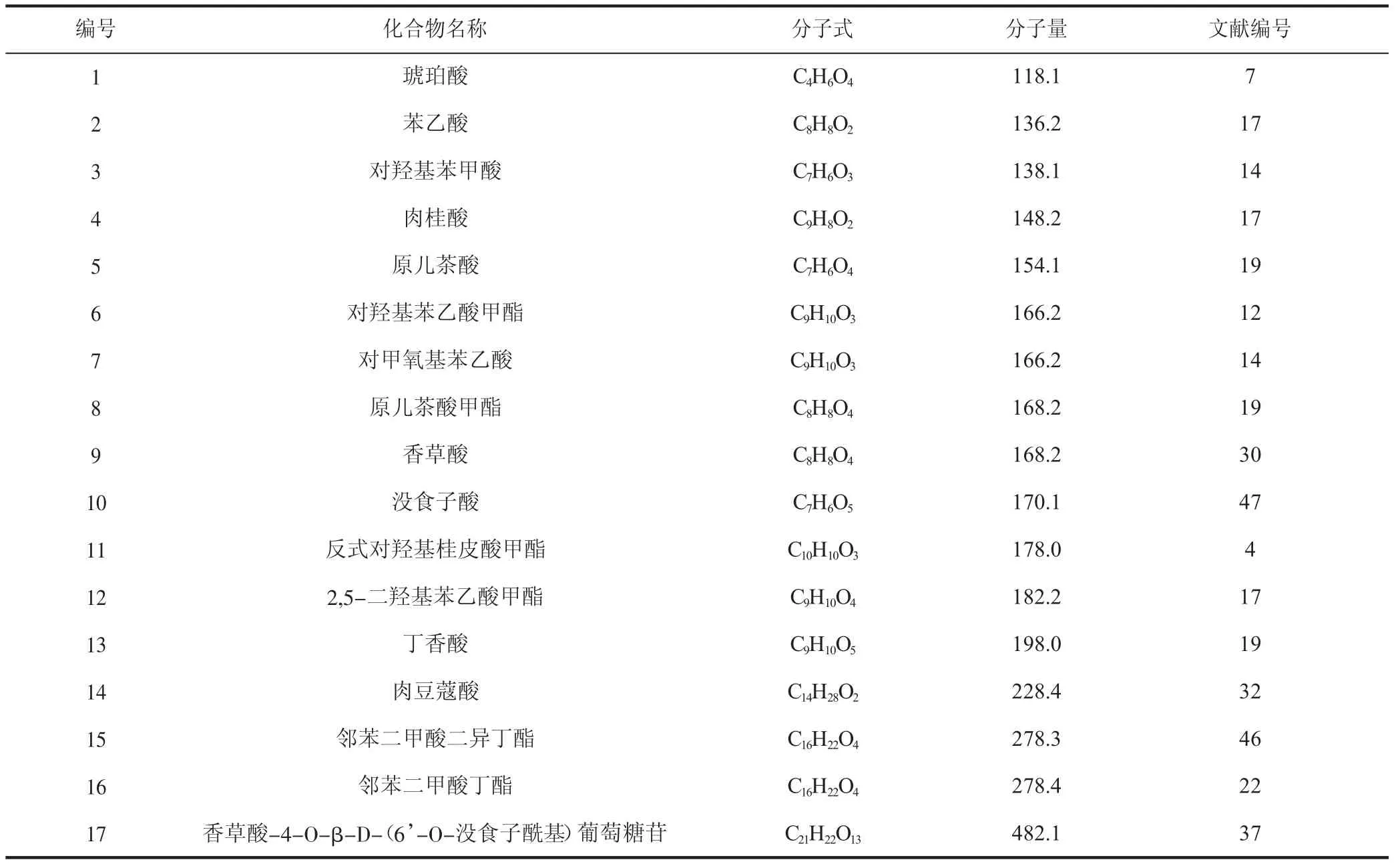
表6 青龙衣中的有机酸及其酯类物质

表7 青龙衣中的酚类化合物
2 生物活性
2.1 抗肿瘤活性
青龙衣在临床中用于治疗多种癌症,特别对消化道肿瘤治疗效果显著[49]。曲中原等[50]利用四甲基偶氮唑蓝(MTT)比色法,对青龙衣的醇提物以及不同溶剂萃取部位进行了体外抗肿瘤实验,结果表明青龙衣的醇提物以及其石油醚、氯仿、乙酸乙酯萃取部位对四种肿瘤细胞株(SGC-7901、HepG-2、HCT-8、Capan-2) 均有细胞毒作用,是青龙衣抗肿瘤的主要活性部位。青龙衣石油醚部位还对人肝癌细胞Huh7.5.1和人宫颈癌细胞Hela抑制作用显著,且高于氯仿及乙酸乙酯部位,其IC50分别为124.99μg/mL和45.33μg/mL,并可诱导人肝癌细胞Huh7.5.1凋亡[51]。青龙衣氯仿和乙酸乙酯部位对白血病细胞HL60和人胃癌细胞BGC823的抑制率均大于50%,其IC50<100μg/mL[52]。另外,李福荣[53]对青龙衣进行抗白血病细胞K562活性部位筛选,发现青龙衣乙酸乙酯部位对白血病细胞K562抑制作用显著。张丽杰等[54]利用大孔树脂对青龙衣乙醇提取物进行初步分离,通过MTT法进行人胃癌细胞BGC803的体外抑制活性实验,实验表明青龙衣30%乙醇洗脱组分的细胞毒作用最为显著。随后刘丽娟等[55,56]对青龙衣30%乙醇洗脱组分进行分离,得到4个萘酚苷类化合物,提示萘酚苷类化合物可能为青龙衣抗肿瘤的活性单体,进一步研究发现萘酚的单糖苷对人肝癌细胞SMMC 7721和人乳腺癌细胞MCF-7的抑制活性大于双糖苷,其IC50<100μg/mL,同时没食子酰基可能在抑瘤活性中发挥了重要作用。
青龙衣中的胡桃醌也是重要的具有明确抗肿瘤活性的有效成分,姬艳菊[57]研究了胡桃醌、亚砷酸注射液、奥沙利铂及氟尿嘧啶对人肝癌细胞SMMC 7721的抑制效果,得出其抑制强度大小分别为奥沙利铂>胡桃醌≈氟尿嘧啶>亚砷酸注射液,同时胡桃醌对人乳腺癌细胞和人宫颈癌细胞也有不同程度的抑制作用[58,59]。季雨彬等[60]以S180肉瘤小鼠为模型,考察胡桃醌的抗肿瘤效果及机制,研究表明胡桃醌对S180肉瘤小鼠的抑瘤作用显著,其作用途径是胡桃醌可以阻滞细胞生长的G2/M期。Kamei等[61]研究发现胡桃醌还可以通过抑制肿瘤细胞生长的S期,发挥抗肿瘤作用,其细胞毒强度与酚羟基个数呈正相关。Varga等[62]发现胡桃醌可以堵塞Ca2+通道,抑制细胞生长和T细胞增殖,从而诱导肿瘤细胞的凋亡。另外,胡桃醌还可以通过诱导肿瘤细胞DNA损伤以及抑制mRNA合成起到抗肿瘤作用[63,64]。
另外,青龙衣中多糖类成分也具有抗肿瘤作用,汲晨锋等[65-68]作了一系列研究后提出,青龙衣多糖可以增强红细胞功能,提高免疫能力,发挥抗肿瘤作用。
2.2 抑菌活性
青龙衣提取物对植物病原菌、细菌、真菌均有显著的抑制作用。翟梅枝等[69]考察了青龙衣乙醇提取物及不同溶剂萃取物对34种常见植物病原菌的抑制活性,结果表明青龙衣乙醇提取物对34种供试菌均表现出不同程度的抑制作用,其中乙酸乙酯部位抑菌效果最好,对番茄灰霉、棉花立枯和小麦纹枯的抑制率可达到100%。任先伟等[70]采用管碟法和最低抑菌浓度(MIC)实验研究了青龙衣不同极性提取物对7种细菌的抑菌活性,抑菌效果强弱分别为乙酸乙酯部位>氯仿部位>正丁醇部位>石油醚部位,其中乙酸乙酯相具有广谱抑菌作用,对金黄色葡萄球菌的抑制效果最好,MIC为0.781mg/mL,抑菌机制主要是通过破坏菌体的细胞壁和细胞膜结构,影响细菌的生长繁殖。另有研究表明,胡桃醌是青龙衣发挥抑菌作用的有效成分,它可以抑制幽门螺杆菌中的酶HpCGS、HpFabD及HpFabZ达到抗幽门螺杆菌的作用[71]。同时,高浓度的胡桃醌可以抑制黄曲霉素的生长,而低浓度的胡桃醌则会对黄曲霉素的生长起到促进作用[72]。另外,胡桃醌还能够通过抑制DNA聚合酶的活性,从而阻断HIV病毒的复制[74]。
2.3 抗氧化活性
植物多酚因其羟基中的邻位酚羟基极易被氧化,具有很强的清除自由基能力,是天然的抗氧化剂,植物多酚主要包括酚酸类、苯丙素类、黄酮类、木质素、大分子色素及鞣质等[74]。刘艳等[75]研究了青龙衣乙醇提取物和乙酸乙酯提取物对菜籽油的抗氧化作用,结果表明乙醇提取物的抗氧化活性高于乙酸乙酯提取物,且呈与浓度呈正相关。李利华[76]以清除·OH、O2-·以及NO2-的能力为指标,考察了青龙衣70%乙醇提取物、水提物、正丁醇提取物和乙酸乙酯提取物的抗氧化能力,研究显示70%乙醇提取物清除自由基能力最强,且多酚含量高于其他提取物。万政敏[77]对核桃不同部位的抗氧化成分进行分离,从青龙衣中检测到9种多酚类物质,分别为没食子酸、绿原酸、咖啡酸、对羟基苯甲酸、香豆酸、阿魏酸、芦丁、桑色素、槲皮素。田平平等[78]以DPPH自由基清除能力为指标,利用UPLC-MS法从青龙衣中检测到7中抗氧化活性成分,分别为绿原酸、短叶苏木酚羧酸、花靛-葡萄糖/半乳糖、鞣花、槲皮素-阿拉伯糖、表儿茶素或儿茶素、槲皮素-3-O-葡萄糖苷等。
2.4 其他
青龙衣中的无机成分钾盐具有镇痛活性[79],青龙衣与其它中药配伍还可用于治疗Ⅱ型糖尿病[80]。
3 研究展望
青龙衣作为我国传统中药,近年来国内外学者对其进行了广泛而深入的研究,分离得到丰富的化学成分,在抗肿瘤活性的研究上也取得了较大进展;也应用到食品等其他领域。但青龙衣的资源问题一直不被重视,常被视为废弃物得不到相应保护,目前急需更好的开发利用其生物活性的途径和方法,充分利用这一宝贵的自然资源,减少浪费。
[1]南京中医药大学.中药大辞典(下册)[M].上海:上海科学技术出版社,2005.
[2]王艳秋.北青龙衣抗氧化活性谱效关系的研究 [D].哈尔滨:黑龙江大学,2013.
[3]王宏歌.核桃楸外果皮活性成分的研究 [D].哈尔滨:东北林业大学,2013.
[4]周媛媛,刘兆熙,孟颖,等.青龙衣乙酸乙酯部位的化学成分研究[J].中医药信息,2015,32(3):20-22.
[5]Min B S,Norio N R,Hirotsugu M,et al.Inhibition of Human ImmunodeficiencyVirusType 1 ReverseTranscriptase and Ribonuclease H Activities byConstituents ofJuglans Mandshurica[J].ChemPharmBull,2000,48(2):194-200.
[6]李海洋.核桃青皮有效化学成分及抑菌性研究 [D].咸阳:西北农林科技大学,2012.
[7]董梅,袁日,齐凤琴,等.青龙衣中细胞毒活性成分的研究[J].天然产物研究与开发,2011,23(5):805-808.
[8]黄柳舒.山核桃果皮活性成分的研究 [D].杭州:浙江工商大学,2011.
[9]张建斌.甘肃青龙衣(核桃青皮)化学成分的研究[D].兰州:西北师范大学,2009.
[10]Binder R G,Benson M E,Flath R A.Eight 1,4-naphth-Oquinones from Juglans[J].Phyto Chem,1989,28(10):2799-2801.
[11]王海香,中照静,杜艳丽,等.胡桃属植物青皮的化学成分及作用机理研究进展[J].生物质化学工程,2008,42(1):47-52.
[12]周媛媛,刘雨新,蒋艳秋,等.青龙衣抗肿瘤有效部位的化学成分研究[J].中草药,2016,47(17):2979-2983.
[13]Machida K,Matsuoka E,Kasahara T,et al.Studies on the constituents of Juglans species.I.Structural determination of(4S)-and (4R)-4-hydroxy-alpha-tetralone derivatives from the fruit of JuglansmandshuricaMAXIM.var.sieboldianaMAKINO[J].Chemical&Pharmaceutical Bulletin,2005,53(8):934-937.
[14]周媛媛,刘兆熙,孟颖.青龙衣有效部位化学成分研究[J].中草药,2014,45(16):2303-2306.
[15]王红萍,尹江艳.核桃青皮的有效成分及综合利用 [J].安徽农业科学,2013,(24):10129-10131.
[16]曲中原.青龙衣抗肿瘤活性成分及其作用机制研究 [D].北京:北京中医药大学,2010.
[17]周媛媛,蒋艳秋,孟颖,等.青龙衣活性部位的化学成分研究[J].中成药,2015,37(2):332-335.
[18]刘元慧.山核桃外果皮的化学成分及生物活性研究 [D].杭州:浙江林学院,2009.
[19]周媛媛,刘雨新,蒋艳秋,等.青龙衣的化学成分[J].中成药,2015,37(12):2669-2673.
[20]王艳梅.核桃楸青果皮生物活性及活性成分研究 [D].哈尔滨:东北林业大学,2008.
[21]管小玉,曲中原,邹翔,等.胡桃楸的化学成分研究进展[J].中草药,2009,(s1):35-38.
[22]皮新梅.青龙衣化学成分及杀虫活性的研究[D].北京:北京化工大学,2014.
[23]周媛媛,刘雨新,孟颖,等.青龙衣中的醌类成分研究 [J].中医药学报,2015,(3):8-10.
[24]周媛媛,孟颖,蒋艳秋,等.青龙衣化学成分研究[J].中药材,2014,37(11):1998-2001.
[25]戚雅君,翁琳,王增.山核桃的化学成分及药理活性研究进展[J].中国医院药学杂志,2010,30(19):1682-1685.
[26]张建斌,柳军玺,查飞,等.青龙衣的化学成分研究 [J].中草药,2009,40(6):847-849.
[27]许绍惠,唐婉屏,韩忠环.核桃楸毒性成分研究[J].沈阳农业大学学报,1986(2):38-43.
[28]Min B S,Lee S Y,Kim J H,et al.Anti-complement activity of constituents from the stem-bark ofJuglans mandshurica.[J].Biological&Pharmaceutical Bulletin,2003,26(7):1042.
[29]Liu L,Li W,Koike K,et al.New alpha-tetralonyl glucosides from the fruit ofJuglans mandshurica[J].Chemical&Pharmaceutical Bulletin,2004,52(5):566.
[30]周媛媛,王栋.青龙衣化学成分的研究 [J].中医药信息,2010,27(2):18-20.
[31]李静,徐康平,邹辉,等.胡桃楸青果皮化学成分研究 [J].中南药学,2013,11(1):1-3.
[32]周晔,王伟,王成章,等.核桃属(Juglans)植物多酚类物质研究进展 [J].南京林业大学学报(自然科学版),2013,37(5):146-152.
[33]吴晓骏,吴威,赵余庆.山核桃化学成分和生物活性研究进展[J].食品研究与开发,2013,(12):127-130.
[34]高树赢.北青龙衣的化学成分及质量标准的研究 [D].哈尔滨:黑龙江大学,2009.
[35]周媛媛,王栋.青龙衣中二芳基庚烷类成分研究 [J].中国实验方剂学杂志,2011,17(22):92-93.
[36]张丽杰.北青龙衣细胞毒活性部位谱效关系的研究 [D].哈尔滨:黑龙江大学,2011.
[37]杨炳友,蒋艳秋,孟颖,等.青龙衣正丁醇部位化学成分研究[J].中草药,2015,46(4):481-485.
[38]柳军玺,邸多隆.核桃青皮中的二芳基庚烷类化合物[C]//中国化学会学术年会有机化学分会场.2008.
[39]Liu J X,Di D L,Huang X Y,et al.Two new diarylheptanoids fromthe pericarps ofJuglans regiaL[J].中国化学快报(英文版),2007,39(8):943-946.
[40]黄成钢,阎新佳,邹晓祺,等.青龙衣的化学成分和抗肿瘤活性研究 [J].哈尔滨商业大学学报(自然科学版),2014,(5):517-521.
[41]Buttery R G,Light D M,Nam Y,et al.Volatile components of green walnut husks.[J].Journal of Agricultural&Food Chemistry,2000,48(7):2858-61.
[42]李鑫,霍金海,郭丽娜,等.青龙衣的化学成分及其抗癌作用的研究进展[J].黑龙江中医药,2016,45(5):59-60.
[43]周媛媛,王栋,牛峰.抗肿瘤中药青龙衣化学成分的研究[J].中草药,2010,41(1):11-14.
[44]刘全宇.青龙衣化学成分的研究[D].哈尔滨:黑龙江中医药大学,2007.
[45]杨炳友,孟颖,刘兆熙,等.青龙衣中三萜类化合物的分析[J].中国实验方剂学杂志,2015,21(2):49-52.
[46]周媛媛,付蕾,金阳,等.青龙衣抗肿瘤成分的研究 [J].中医药学报,2013,41(4):70-71.
[47]司传领,刘忠,惠岚峰,等.核桃楸树皮提取物的化学成分及其抗氧化活性研究(英文)[J].林产化学与工业,2008,28(1):29-32.
[48]Machida K,Yogiashi Y,Matsuda S,et al.A new phenolic glycoside syringate from the bark ofJuglans mandshuricaMAXIM.var.sieboldiana MAKINO[J].Journal of Natural Medicines,2009,63(2):220-222.
[49]张洪娟,桑树荣.高奎滨用青龙衣制剂治疗肿瘤用药经验[J].黑龙江中医药,2000,(2):62.
[50]曲中原,邹翔,崔兰,等.青龙衣不同萃取部位抗肿瘤活性研究[J].上海中医药杂志,2009,(1):87-90.
[51]段燕玲,魏晓璐,任先伟,等.青龙衣提取物的抗真菌和抗肿瘤活性研究[J].食品工业科技,2016,37(13):77-82.
[52]刘薇,林文翰,季宇彬.青龙衣毒性作用及体外抗肿瘤作用的实验研究[J].哈尔滨商业大学学报(自然科学版),2004,29(1):4-10.
[53]李福荣,王庆国,韩纪举,等.青龙衣有效成分的初步提取分离及体外抗肿瘤活性研究 [J].时珍国医国药,2011,22(3):608-609.
[54]张丽杰,关健,刘丽娟.北青龙衣抗肿瘤谱效关系研究初探[J].现代生物医学进展,2010,10(4):751-752.
[55]刘丽娟,王常禹,麻风华.北青龙衣细胞毒活性部位中的萘酚苷[J].中国现代应用药学,2010,27(8):704-708.
[56]刘丽娟,齐凤琴,龚显峰.北青龙衣中萘醌类衍生物的细胞毒活性研究[J].中国现代应用药学,2010,(7):574-577.
[57]姬艳菊,徐巍.青龙衣提取物对人肝癌细胞株抑制作用的实验研究[J].中医药学报,2014,(5):30-34.
[58]许绍惠,许弘.胡桃属植物毒性成分及其应用 [J].沈阳农业大学学报,1990,(2):167-170.
[59]RyoA,Liou Y C,Lu K P,et al.Prolyl isomerase Pin1:a catalyst for oncogenesis and a potential therapeutic target in cancer[J].Journal ofCell Science,2003,116(5):773-783.
[60]季宇彬,曲中原,邹翔,等.青龙衣中胡桃醌对S180肉瘤小鼠的抑瘤作用研究[J].中国药学杂志,2009,44(3):195-199.
[61]Kamei H,Koide T,Kojima T,et al.Inhibition of cell growth in culture byquinones[J].Cancer Biotherapy&Radiopharmaceuticals,1998,13(3):185.
[62]Varga Z,Bene L,Pieri C,et al.The effect of juglone on the membrane potentialand whole-cellK+currentsofhuman lymphocytes [J]. Biochemical & Biophysical Research Communications,1996,218(3):828.
[63]Paulsen M T,Ljungman M.The natural toxin juglone causes degradation of p53 and induces rapid H2AX phosphorylation and cell death in human fibroblasts [J].Toxicology& Applied Pharmacology,2005,209(1):1.
[64]Munday R,Munday C M.Induction of quinone reductase and glutathione transferase in rat tissues by juglone and plumbagin[J].Planta Medica,2000,66(05):399-402.
[65]王晓晶,季宇彬.青龙衣多糖对荷瘤小鼠红细胞膜流动性及封闭度的影响[J].药品评价,2005,2(4):76-79.
[66]季宇彬,陈海继,汲晨锋.青龙衣多糖对H22型肿瘤细胞ATP酶活性的影响[C]//全国化学生物学学术会议,2007:12.
[67]汲晨锋,肖凤,季宇彬.青龙衣多糖对S180小鼠红细胞Ca2+,Mg2+-ATP酶活性及[Ca2+]i的影响[J].中草药,2008,39(12):1842-1844.
[68]俞文婕,王添敏,翟延君.胡桃楸抗肿瘤作用及其机制研究概况[J].中国实验方剂学杂志,2012,18(20):329-332.
[69]翟梅枝,王磊,何文君,等.核桃青皮乙醇提取物抑菌活性研究[J].西北植物学报,2009,29(12):2542-2547.
[70]任先伟,魏晓璐,黄鑫,等.核桃青皮提取物抑菌活性及抑菌机理研究[J].食品工业科技,2015,36(18):93-98.
[71]Kong Y H,Zhang L,Yang Z Y,et al.Natural product juglone targets three key enzymes from Helicobacter pylori:inhibition assay with crystal structure characterization[J].Acta Pharmacologica Sinica,2008,29(7):870-876.
[72]Mahoney N,Molyneux R J,Campbell B C.Regulation of aflatoxin production by naphthoquinones of walnut(Juglans regia)[J].Journal ofAgricultural&Food Chemistry,2000,48(9):4418-4421.
[73]Min B,Miyashiro H,Hattori M.Inhibitory effects of quinones on RNase H activity associated with HIV-1 reverse transcriptase[J].PhytotherapyResearch Ptr,2002,16(S1):57.
[74]刘畅,周家春.植物多酚抗氧化性研究 [J].粮食与油脂,2011,(2):43-46.
[75]刘艳,方晨,曹凯,等.新疆核桃青皮提取物抗氧化作用研究[J].食品工业,2012,(9):114-116.
[76]李利华.不同溶剂核桃青皮提取物抗氧化性能研究[J].食品工业,2017,(5):126-128.
[77]万政敏.核桃青皮中多酚类物质及其抗氧化性的分析[D].呼和浩特:内蒙古农业大学,2007.
[78]田平平,李仁宙,简永健,等.核桃青皮的强抗氧化活性成分及其抗氧化稳定性[J].中国农业科学,2016,49(3):543-553.
[79]杜旭,王明晶,姜力伟,等.中药青龙衣镇痛作用机理的研究[J].中国中医药科技,1997,(3):155-156.
[80]吴学勤.青龙衣治疗Ⅱ型糖尿病临床观察 [C]//全国中药研究与开发学术研讨会论文摘要集[A],2001.
Research Progress of Chemical Constituents and Biological Actions of Pericarps ofJuglans mandshurica
GONG Jun-jie1,GONG Xue-bin1*,ZHANG Min2,ZHAO Yu-wei2,JIANG Jian-bo2
(1.Yantai Longda Hezhongbao Food Co.,Ltd,Yantai 265229,China;2.Longda Foodstuff Group Co.,Ltd,Yantai 265231,China)
Qinglongyi is dry peelJuglandaceaewalnut plant walnuts and walnut immature fruit,is a by-product of walnut processing industry.Several different classes of compounds have been separated from Pericarps ofJuglans mandshurica,including quinones,flavonoids,diarylheptanoids,terpenoids,phenylpropanoids and organic acids and their esters,ect.The modern biological studies show that Pericarps ofJuglans mandshuricahas various biological actions,such as anti-tumor,antimicrobial,antioxidant and other activities,which is widely used in clinical.This article aimed at reviewing the recent literatures on chemical constituents and biological actions while analyzing and expecting the research status of Pericarps of Juglans mandshurica,in order to provide reference for its further development and utilization.
Pericarps ofJuglans mandshurica;chemical constituents;biological actions;research progress
Q946.91
A
1008-1038(2017)12-0021-11
10.19590/j.cnki.1008-1038.2017.12.007
2017-09-19
宫俊杰(1973—),男,工程师,研究方向为农产品加工与安全控制
*通讯作者:宫学斌(1937—),男,高级工程师,研究方向为农产品加工与安全
1 5,7-二羟基色原酮 C9H6O4 178.2 7 2 5-羟基-7-甲氧基黄酮 C16H12O4 268.1 30 3山姜素 C16H14O4 270.1 31 4乔松酮 C16H14O4 270.3 8 5(2S)-5,7,4′-三羟基二氢黄酮 C15H12O5 272.1 3 6柚皮素 C16H12O5 272.1 26 7双氢山奈酚 C15H12O5 272.1 18 8汉黄芩素 C16H12O5 284.1 31 9山奈酚 C15H10O6 286.0 18 10 樱花亭 C16H14O5 286.3 13 11 3,5,7-三羟基-4'-甲氧基黄酮 C16H12O6 300.1 30 12 (2S)-5-羟基-6,7-二甲氧基二氢黄酮 C17H16O5 300.1 31 13 5-羟基-7,8-二甲氧基二氢黄酮 C17H16O5 300.1 31 14 5-羟基-7,4′-二甲氧基黄烷酮 C17H16O5 300.1 13 15 槲皮素 C15H10O7 302.0 32 16 桑色素 C15H10O7 302.0 32 17 黄杉素 C15H12O7 304.3 5 18 黄卡瓦胡椒素 C18H18O5 314.1 33 19 杨梅素 C15H10O8 318.0 5 20 5-羟基 -3,7,3″,4″-四甲氧基黄酮 C19H18O7 358.1 3 21 5-羟基-3,7,3′,4′-四甲氧基黄酮 C20H20O7 372.1 3 22 胡桃苷 C20H18O10 418.4 13 23 柚皮素-7-O-β-D-吡喃葡萄糖苷 C22H24O9 432.1 26 24 山奈酚-3-O-α-L-鼠李糖苷 C21H20O10 432.4 12 25 阿福豆苷 C21H20O10 432.4 34 26 扁蓄苷 C20H18O11 434.4 13 27 槲皮素-3-木糖苷 C20H18O11 434.4 13 28 6,5’-二异戊烯基槲皮素 C25H26O7 438.0 12 29 山奈酚-3-O-β-D-葡萄糖苷 C23H24O9 444.1 35 30 山奈酚-3-O-α-L-鼠李糖 C22H23O10 447.1 36 31 山奈酚-3-O-β-D-吡喃葡萄糖苷 C21H20O11 448.4 37 32 槲皮苷 C21H20O11 448.4 34 33 槲皮素-3-阿拉伯吡喃糖苷 C21H21O11 449.1 32 34 槲皮素-3-O-α-L-鼠李糖苷 C22H23O11 463.1 32

