FOXC2对肺腺癌细胞恶性增殖及侵袭迁移能力的影响
饶习敏 邢时云 欧阳瑶 (遵义医学院附属医院呼吸内科,贵州 遵义 563000)
FOXC2对肺腺癌细胞恶性增殖及侵袭迁移能力的影响
饶习敏 邢时云1欧阳瑶 (遵义医学院附属医院呼吸内科,贵州 遵义 563000)
目的探究叉头框C2蛋白(FOXC2)对肺腺癌细胞恶性增殖及侵袭迁移能力的影响。方法利用慢病毒转染的方法在人肺腺癌细胞系A549中构建过表达FOXC2细胞(实验组)及相应对照细胞系(对照组),Western印迹检测两组细胞FOXC2及干性相关分子Oct4、Sox2及Nanog的表达水平,MTT法检测两组细胞0、24、48、72、96 h的恶性增殖能力,Transwell侵袭及迁移实验检测两组细胞侵袭迁移能力。结果与对照组细胞比较,实验组细胞FOXC2、Oct4、Sox2及Nanog表达水平均显著上调(P<0.05),细胞恶性增殖能力在48、72及96 h出现显著升高(P<0.05),细胞侵袭及迁移能力均显著上调(P<0.05),差异均有统计学意义。结论FOXC2可促进肺腺癌细胞恶性增殖及侵袭迁移能力,其机制与介导肿瘤细胞干细胞特性形成有关。
叉头框C2蛋白;肺腺癌;恶性增殖;侵袭迁移;肿瘤干细胞
肺腺癌发病占全部肺癌的50%以上,是肺癌主要的病理类型〔1〕。肺腺癌多起源于小支气管,为周围型肺癌,故早期临床症状较轻,但肺腺癌细胞增殖转移能力强,部分早期即发生血行转移,故多数患者就诊时已处于中晚期。因此,明确影响肺腺癌细胞增殖转移能力的关键因子对临床诊断及治疗工作具有重要意义。叉头框C2蛋白(FOXC2)在正常机体内参与棕色脂肪代谢及血管生成等生物学过程〔2〕,在多种恶性肿瘤的发生发展中起促进作用,但对于肺腺癌恶性行为的影响尚不清楚。本研究拟探讨FOXC2对人肺腺癌细胞A549增殖转移能力的影响及机制。
1 材料与方法
1.1材料 仪器:ECO1.8垂直流超净工作台及3110生化培养箱(美国Thermo),5417R高速离心机(德国Eppendorf),DM1000光学显微镜(德国Leica),TC20细胞计数仪及Tek多孔酶标仪(美国Bio-Rad),电泳槽、电泳仪、转膜仪及转印夹等(上海天能),Gel Doc XR凝胶成像仪(美国Bio-Rad)。
细胞:人肺腺癌细胞系A549及人胚胎肾细胞293T(上海细胞生物研究所)。
试剂:DMEM培养基、DMEM/F12培养基、小牛血清及胎牛血清(美国Hyclone),胰蛋白酶(美国Sigma)转染脂质体Lipofectamine 2000(美国Thermo),慢病毒包装载体pLP1-gag/pol、REV和VSV-G(美国Addgene),FOXC2全长载体及空白对照载体(上海吉玛基因),嘌呤霉素(美国Sigma),MTT细胞增殖及毒性检测试剂盒(美国Promega),Transwell小室及24孔板、Matrigel基质胶(美国BectonDickinson),RIPA蛋白裂解液、蛋白酶抑制剂(cocktail)及考马斯亮蓝BCA蛋白浓度测定试剂盒(上海碧云天生物),甲醇等无机试剂(国药集团化学试剂),abcam抗体:一抗:β-actin(ab8226)、FOXC2(ab24340)、Oct4(ab18976)、Sox2(ab92494)及Nanog(ab21624);二抗:鼠二抗(ab6728),兔二抗(ab150077)。PierceECL化学发光液(美国Thermo)。
1.2方法
1.2.1细胞的培养及实验组与对照组的构建 人肺腺癌细胞系A549采用DMEM/F12+10%胎牛血清培养,1∶3传代;人胚胎肾细胞293T采用DMEM+10%胎牛血清培养,1∶3传代。培养环境:37℃,5%CO2,100%相对湿度。
慢病毒包装:培养对数生长期的293T细胞于6孔板中,当细胞密度达到70%以上时,弃去上清并加入1 ml DMEM培养基备用。将pLP1-gag/pol、REV和VSV-G按0.75 μg、0.45 μg及0.30 μg的比例混合于2支含500 μl无血清DMEM的1.5 ml Eppendorf管中,并将1.5 μg FOXC2全长载体及空白对照载体分别加入2支Eppendorf管中,室温静置5 min后与10 μl Lipofectamine 2000充分混合,室温静置30 min,将上述混合液缓慢均匀滴加入293T细胞中,生化培养箱中培养6 h,更换DMEM+10%胎牛血清培养基继续培养48 h后,收集病毒悬液并过滤。慢病毒感染:将制备好的病毒悬液与DMEM/F12+10%胎牛血清1∶2混合培养A549细胞3 d,感染携带FOXC2全长载体的A549细胞为实验组,感染携带空白对照载体的A549细胞为对照组,1 μg/μl嘌呤霉素筛选细胞至生长状态良好。
1.2.2Western印迹检测两组细胞FOXC2、Oct4、Sox2及Nanog的表达 收集融合度约为80%,培养于10 cm培养皿中的各组细胞:PBS洗细胞2次,600 μl胰蛋白酶消化,1 ml DMEM/F12+10%胎牛血清培养基终止消化加入Eppendorf管,800 r/min室温离心5 min,去上清后PBS洗细胞2次,加入RIPA蛋白裂解液及蛋白酶抑制剂混合液500 μl,充分混匀后冰上裂解2 h,13 000 r/min,4℃离心细胞悬液15 min,取上清液置于新的Eppendorf管中,作为抽提的蛋白,经BCA试剂盒进行蛋白定量分析,配平体系后,配置10%聚丙烯酰胺凝胶,上样量50 μg,80 V稳压电泳至条带出积层胶,调整电压至120 V稳压电泳1 h,260 mA稳流转聚偏氟乙烯(PVDF)膜2 h,丽春红染色,根据染色情况剪取β-actin、FOXC2、Oct4、Sox2及Nanog所在目的条带,相应抗体室温孵育2 h(工作浓度为1∶1 000),PBS洗膜3次,每次10 min;二抗孵育1 h(工作浓度为1∶2 000),PBS洗膜3次,每次10 min,电化学发光法(ECL)曝光显影,ImageLab4.2软件分析各条带相比内参基因β-actin的相对灰度值。
1.2.3MTT实验检测细胞恶性增殖能力 培养对数生长期的各组细胞于10 cm培养皿中,将待检测细胞消化,重悬并进行细胞计数,以2×103个细胞/孔的浓度接种至96孔板中,设置5个时间点(0、24、48、72、96 h)及5个重复孔,待细胞贴壁后,以此时为0 h时间点,弃去细胞上清液,将MTT试剂与DMEM/F12+10%胎牛血清培养基1∶5混合加入0 h时间点的孔中,设置空白孔,检测各孔与空白孔490 nm吸光度,以各孔与空白孔OD值的差值作为增殖能力。同样,在24、48、72、96 h检测细胞的OD值,以各时间点细胞OD值与0 h细胞OD值的比值表示细胞恶性增殖能力。
1.2.4Transwell侵袭实验检测两组细胞侵袭能力 将50 mg/L基质胶与DMEM/F12培养基1∶8混合均匀,100 μl加至小室中央,置于37℃孵育6 h后取出备用。将各组细胞消化,PBS洗细胞3次后,DMEM/F12+1%小牛血清重悬细胞并进行细胞计数,取5×104个细胞/孔加入铺好基质胶的上小室中,下小室加入500 μl DMEM/F12+10%胎牛血清,生化培养箱孵育24 h后,棉签擦去上室面未穿透的细胞,10%甲醇固定细胞15 min,0.1%结晶紫染色30 min,PBS洗细胞3次,200倍光镜下计数,随机统计中间和四周5个视野的细胞数,求其均值及标准差。
1.2.5Transwell迁移实验检测细胞迁移能力 将Transwell侵袭实验中DMEM/F12+1%小牛血清重悬后的细胞取5×104个细胞/孔加入未铺胶的上小室中,下小室同样加入500 μl DMEM/F12+10%胎牛血清,生化培养箱孵育24 h后,固定、染色及计数方法同Transwell侵袭实验。
1.3统计学方法 应用SPSS17.0统计学软件对数据的组间比较行t检验。
2 结 果
2.1各组细胞FOXC2、Oct4、Sox2及Nanog的表达比较 实验组细胞FOXC2相对灰度值显著高于对照组细胞,且细胞干性相关分子Oct4、Sox2及Nanog相对灰度值均显著高于对照组(P<0.05),见表1,图1。
2.2两组细胞的恶性增殖能力比较 实验组细胞在48、72、96 h时增殖能力显著高于对照组(P<0.05),见表2。
2.3实验组及对照组细胞的侵袭及迁移能力比较 Transwell侵袭实验结果显示,实验组侵袭基底膜的细胞数为(83.7±10.3)个,显著多于对照组(54.8±9.5)个(P<0.05);Transwell迁移实验结果显示,实验组细胞迁到下室的细胞数为(119.2±13.6)个,显著多于对照组(66.3±11.2)个(P<0.05),见图2。
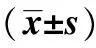
表1 两组细胞FOXC2、Oct4、Sox2及Nanog的表达比较

图1 两组细胞FOXC2、Oct4、Sox2及Nanog的表达情况比较

组别24h48h72h96h对照组1926±03113892±04266921±080413574±2162实验组2050±03354473±04938772±103417520±2643t/P值0607/02801994/00403160/00072584/0016

图2 两组细胞的侵袭及迁移能力比较(×200)
3 讨 论
FOXC2是人叉头框蛋白家族转录因子之一,在人体生长发育及代谢中发挥重要作用,包括促进胚胎组织的成熟及棕色脂肪组织的代谢,也可增强组织胰岛素敏感性及血管的生成〔3~5〕。近年有研究显示FOXC2参与多种恶性肿瘤的发生发展,包括乳腺癌、结直肠癌、胃癌及前列腺癌等:①FOXC2与乳腺癌:FOXC2被发现在乳腺癌组织中表达上调,且其蛋白表达与肿瘤高组织学分级、TNM分期、早期复发、患者不良预后及原癌基因Twist表达均密切相关〔6〕,提示FOXC2对乳腺癌发生发展的促进作用。另外体外研究显示,FOXC2可通过激活乳腺癌细胞上皮间充质转化(EMT)过程促进肿瘤干细胞(CSC)样特性,进而介导乳腺癌细胞增殖转移及化疗抵抗的形成〔7〕。②FOXC2与结直肠癌:FOXC2在结直肠癌组织中高表达,并与患者淋巴结转移、高TNM分期及不良预后密切相关〔8,9〕,FOXC2还可在体外促进结直肠癌细胞侵袭转移能力,其机制与促进原癌基因肝细胞生长因子(HGF)-酪氨酸激酶受体EMT的信号通路表达有关〔10〕。③FOXC2与胃癌:FOXC2在胃癌中同样高表达,高FOXC2表达与胃癌细胞低分化程度、高TNM分期及不良预后正相关,是影响患者预后的独立危险因素〔11〕。④FOXC2与前列腺癌:雄激素受体(AR)阴性的前列腺癌中FOXC2表达较高,此类细胞具有干细胞特性,是前列腺癌药物去势抵抗形成的关键因素,体外敲降FOXC2表达后,前列腺癌细胞EMT进程减弱且药物去势敏感性增强,表明FOXC2对前列腺癌发生发展的促进作用〔12〕。⑤FOXC2与卵巢癌:FOXC2在卵巢癌转移灶中高表达,体外下调FOXC2表达后,细胞EMT进程及侵袭转移能力均显著减弱〔13〕。另外,FOXC2可通过促进EMT进程介导卵巢癌细胞体内外顺铂抵抗的发生〔14,15〕。⑥FOXC2与肺癌:FOXC2在非小细胞肺癌组织中高表达,且与患者肺腺癌发生、淋巴结转移及TNM分期呈正相关,是影响患者预后的独立危险因素〔16〕。
Oct4基因是POU转录因子家族中的一员,主要表达于胚胎干细胞、生殖干细胞以及多种恶性肿瘤细胞中,是肿瘤干细胞样表型的标志物之一〔17〕;Sox2及Nanog是维持干细胞的多功能性、祖细胞自我更新能力的重要基因,同时也在多种恶性肿瘤细胞中表达上调并促进其发生发展〔18,19〕。本研究结果显示,FOXC2可显著上调肺腺癌细胞干性相关分子Oct4、Sox2及Nanog的表达,提示FOXC2可促进肺腺癌细胞干性的维持,进而发挥相应的生物学功能;同时,FOXC2可促进肺腺癌细胞恶性增殖及侵袭迁移能力,在体外揭示了FOXC2的促癌作用。
1杨清海,陈惠玲,郑智勇.肺腺癌临床病理研究新进展〔J〕.临床与实验病理学杂志,2014;30(1):53-5.
2Xue Y,Cao R,Nilsson D,etal.FOXC2 controls Ang-2 expression and modulates angiogenesis,vascular patterning,remodeling,and functions in adipose tissue〔J〕.Proc Nat Acad Sci U S A,2008;105(29):10167-72.
3Ddin MK,Kimura W,Ishikura T,etal.Foxc2 in pharyngeal arch mesenchyme is important for aortic arch artery remodelling and ventricular septum formation〔J〕.Biomed Res,2015;36(4):235-45.
4Kanady JD,Munger SJ,Witte MH,etal.Combining Foxc2 and connexin37 deletions in mice leads to severe defects in lymphatic vascular growth and remodeling〔J〕.Dev Biol,2015;405(1):33-46.
5Lidell ME,Seifert EL,Westergren R,etal.The adipocyte-expressed forkhead transcription factor foxc2 regulates metabolism through altered mitochondrial function〔J〕.Diabetes,2011;60(2):427-35.
6Lim JCT,Koh VCY,Tan JSY,etal.Prognostic significance of epithelial-mesenchymal transition proteins Twist and Foxc2 in phyllodes tumours of the breast〔J〕.Breast Cancer Res Treat,2015;150(1):19-29.
7Hollier BG,Tinnirello AA,Werden SJ,etal.FOXC2 expression links epithelial-mesenchymal transition and stem cell properties in breast cancer〔J〕.Cancer Res,2013;73(6):1981-92.
8Watanabe T,Kobunai T,Yamamoto Y,etal.Gene expression of mesenchyme forkhead 1 (FOXC2) significantly correlates with the degree of lymph node metastasis in colorectal cancer〔J〕.Int Surg,2011;96(3):207-16.
9Li Q,Wu J,Wei P,etal.Overexpression of forkhead Box C2 promotes tumor metastasis and indicates poor prognosis in colon cancer via regulating epithelial-mesenchymal transition〔J〕.Am J Cancer Res,2015;5(6):2022-34.
10Cui YM,Jiao HL,Ye YP,etal.FOXC2 promotes colorectal cancer metastasis by directly targeting MET〔J〕.Oncogene,2015;34(33):4379-90.
11Zhu JL,Song YX,Wang ZN,etal.The clinical significance of mesenchyme forkhead 1 (FoxC2) in gastric carcinoma〔J〕.Histopathology,2013;62(7):1038-48.
12Paranjape AN,Soundararajan R,Werden SJ,etal.Inhibition of FOXC2 restores epithelial phenotype and drug sensitivity in prostate cancer cells with stem-cell properties〔J〕.Oncogene,2016;35(46):5963-76.
13Liu B,Han SM,Tang XY,etal.Overexpressed FOXC2 in ovarian cancer enhances the epithelial-to-mesenchymal transition and invasion of ovarian cancer cells〔J〕.Oncol Rep,2014;31(6):2545-54.
14Li C,Ding H,Tian J,etal.Forkhead box protein C2 (FOXC2) promotes the resistance of human ovarian cancer cells to cisplatin in vitro and in vivo〔J〕.Cell Phys Biochem,2016;39(1):242-52.
15Li C,Ding H,Tian J,etal.Forkhead box protein C2 promotes epithelial-mesenchymal transition,migration and invasion in cisplatin-resistant human ovarian cancer cell line (SKOV3/CDDP)〔J〕.Cell Phys Pharmacol,2016;39(3):1098-110.
16Wei J,Hong F,Cheng Q,etal.Prognostic value of high FoxC2 expression in resectable non-small cell lung cancer,alone or in combination with E-cadherin expression〔J〕.BMC Cancer,2016;16(1):1-9.
17陈 琛,孟凡荣,万海粟,等.MicroRNAs与OCT4基因之间的相互作用〔J〕.中国肺癌杂志,2015;26(1):55-8.
18滕 杨,陈公琰.恶性肿瘤中 SOX2基因的研究进展〔J〕.实用肿瘤学杂志,2014;28(2):173-6.
19季 文,姜 政.Nanog基因研究进展〔J〕.医学综述,2011;17(5):672-6.
R73
A
1005-9202(2017)24-6033-03;
10.3969/j.issn.1005-9202.2017.24.013
1 遵义医学院附属医院肿瘤科
欧阳瑶(1965-),女,硕士,主任医师,主要从事慢性阻塞性肺病发病机制研究。
饶习敏(1984-),女,硕士,主治医师,主要从事慢性阻塞性肺病基础与临床研究。
〔2017-02-11修回〕
(编辑 徐 杰)

