痛舒膏巴布剂作用及致敏性研究※
万思琦 魏宇斐 徐 延 徐京育
(黑龙江中医药大学临床医学院2017级硕士研究生,黑龙江 哈尔滨 150040)
实验研究
痛舒膏巴布剂作用及致敏性研究※
万思琦 魏宇斐 徐 延1徐京育△
(黑龙江中医药大学临床医学院2017级硕士研究生,黑龙江 哈尔滨 150040)
目的探讨痛舒膏巴布剂的镇痛抗炎作用及致敏性。方法将50只豚鼠随机分为5组,即痛舒膏巴布剂高剂量组(外贴痛舒膏,5.73 g生药/kg),痛舒膏巴布剂中剂量组(外贴痛舒膏,3.82 g生药/kg),痛舒膏巴布剂低剂量组(外贴痛舒膏,1.91 g生药/kg),地塞米松组(外贴巴布剂基质贴剂,地塞米松0.000 81 g/kg),赋形对照组(外贴巴布剂基质贴剂),每组10只,每日予相应药物贴于足底至足趾部位,并用无刺激性纱布及胶布固定,外敷6 h,7 d后用甲醛法致炎,测定豚鼠足肿胀度及血清中前列腺素E2(PGE2)和β-内啡肽(β-EP)的含量。将30只豚鼠随机分为3组,即痛舒膏巴布剂组(外贴痛舒膏,3.82 g生药/kg),赋形对照组(外贴巴布剂基质贴剂),阳性药物组(2,4-二硝基氯代苯),每组10只,痛舒膏巴布剂组贴药于豚鼠背部左侧脱毛区,赋形对照组贴药于豚鼠背部左侧脱毛区,阳性药物组在豚鼠背部左侧脱毛区涂抹1%的2,4-二硝基氯代苯0.2 mL外敷6 h,在第7 d和第14 d用同样方法给药。末次致敏后14 d,在3组动物背部右侧脱毛区给药,痛舒膏巴布剂组和赋形对照组给药方法同前,阳性药物组涂抹0.1%的2,4-二硝基氯代苯0.2 mL,并用无刺激性纱布胶布固定,通过致敏接触和激发接触给药进行皮肤过敏实验。结果甲醛致炎实验中,与赋形对照组比较,痛舒膏巴布剂高、中、低剂量组和地塞米松组能明显降低豚鼠足肿胀度(P<0.05,P<0.01)。致敏实验中,根据皮肤致敏性评分标准,痛舒膏巴布剂组动物皮肤受试区自激发给药后72 h内均未出现异常反应,致敏发生率为0.0±0.0。结论痛舒膏巴布剂具有很好的抗炎镇痛作用,在一定范围内具有浓度依赖性,且痛舒膏巴布剂对豚鼠皮肤无致敏作用,临床用药安全。
动物;豚鼠;超敏反应;镇痛;中医药疗法
痛舒膏巴布剂是由黑龙江省名老中医李延教授总结多年临床实践所得的经验方,由延胡索、金钱白花蛇、川芎等多味中药组成,具有行气活血、消瘀散结、通络止痛的功效。痛舒膏巴布剂依据内病外治的治疗原则,采用经皮给药系统,以水溶性高分子化合物作为基质,与中药提取物制成中药贴敷剂[1]。因中药巴布剂具有载药量大、透气性好、保湿型好、对皮肤无刺激性、可反复揭贴等优点[2],具有广阔的发展前景。本实验采用甲醛致炎法对豚鼠足跖关节及软组织造成急性损伤和致炎,从而探究痛舒膏巴布剂的抗炎镇痛作用。依据巴布剂基质原料选择条件,应着重检测材料对皮肤的刺激性,降低变态反应[3],通过豚鼠致敏实验对痛舒膏巴布剂进行安全性评价,为临床合理用药提供实验依据。
1 材料与方法
1.1 材料
1.1.1 动物 80只清洁级豚鼠,体质量(200±30)g,雌雄各半,购于哈尔滨医科大学实验动物学部,动物生产许可证号:SCXK(黑)2013-001。
1.1.2 药物与试剂 痛舒膏巴布剂(由延胡索、金钱白花蛇、葛根、鸡血藤、木瓜、白芍、姜黄、川芎、僵蚕、地龙、羌活、三七、炙甘草、穿山龙等合并煎煮,浓缩成稠膏,以氢氧化铝、柠檬酸、明胶、甘油等采用均匀设计法制成巴布剂,哈尔滨制药六厂,批准文号:黑卫健用字(2003)第017号)、地塞米松注射液(郑州卓峰制药有限公司,国药准字H41020055)、2,4-二硝基氯代苯(美国sigma公司)、甲醛(上海源叶生物公司)、水合氯醛(上海源叶生物公司)、前列腺素E2(PGE2)酶联免疫吸附法(ELISA)检测试剂盒(北京普博斯生物公司)、β-内啡肽(β-EP)ELISA检测试剂盒(北京普博斯生物公司)。
1.1.3 实验仪器 全自动酶标仪Infinite F50(瑞士TECAN公司)、高速冷冻离心机GL10M(凯特实验仪器有限公司)、电热恒温水浴箱HH-W600(瑞华仪器制造有限公司)、电子分析天平FA2104S(上海恒平科学仪器有限公司)、游标卡尺、手术线、毫米尺、手术器械等。
1.2 方法
1.2.1 甲醛致炎实验操作[4]取50只豚鼠,雌雄各半,随机分为5组,即痛舒膏巴布剂高剂量组(外贴痛舒膏,5.73 g生药/kg)、中剂量组(外贴痛舒膏,3.82 g生药/kg)、低剂量组(外贴痛舒膏,1.91 g生药/kg),地塞米松组(外贴巴布剂基质贴剂,地塞米松0.000 81 g/kg),赋形对照组(外贴巴布剂基质贴剂),每组10只,每组受试动物予相应药物贴于足底至足趾部位,并用无刺激性纱布及胶布固定,避免药物因豚鼠行走舔舐等原因脱落。外敷6 h,连续7 d。7 d后用5%的甲醛0.1 mL皮下注入豚鼠足跖部。
1.2.2 致敏实验操作 将30只豚鼠随机分为3组,即痛舒膏巴布剂组(外贴痛舒膏,3.82 g生药/kg),赋形对照组(外贴巴布剂基质贴剂),阳性药物组(2,4-二硝基氯代苯),每组10只。将3组动物于给受试药物前24 h背部两侧脱毛3 cm×3 cm。首先致敏,痛舒膏巴布剂组贴痛舒膏巴布剂2 cm×2 cm于豚鼠背部左侧脱毛区,赋形对照组贴巴布剂基质贴剂2 cm×2 cm于豚鼠背部左侧脱毛区,阳性药物组在豚鼠背部左侧脱毛区涂抹1%的2,4-二硝基氯代苯0.2 mL,给药后用无刺激性纱布及胶布固定,避免豚鼠因疼痛舔舐引起中毒。6 h后将残留药物用温水洗净。在第7 d和第14 d用同样方法给药。末次致敏后14 d,在3组动物背部右侧脱毛区给药,痛舒膏巴布剂组和赋形对照组给药方法同前,阳性药物组涂抹0.1%的2,4-二硝基氯代苯0.2 mL,并用无刺激性纱布胶布固定。
1.3 观察指标及检测方法
1.3.1 甲醛致炎实验检测指标
1.3.1.1 足跖关节及软组织肿胀度的测定[5]测量方法针对豚鼠参照文献[5]做了改进,于0 h(注射甲醛前)、30 min、1 h、2 h、4 h、6 h分别测定豚鼠足跖关节处周长及足跖软组织肿胀处厚度(每次测定位置固定),并计算肿胀率=(致炎后足跖厚度-致炎前足跖厚度)/致炎前足跖厚度×100%。以足跖关节处周长变化及肿胀率作为观察指标。
1.3.1.2 豚鼠血清PGE2和β-EP水平的测定[6]各组豚鼠用7%的水合氯醛豚鼠腹腔注射0.5 mL/100g,麻醉后由腹主动脉取血,采用ELISA法测定豚鼠血清PGE2和β-EP水平,具体操作流程严格按照试剂盒使用说明书进行。
1.3.2 致敏实验检测指标 6 h后去掉受试药并温水洗净残留药物。即刻观察并记录1、24、48及72 h皮肤出现红斑、水肿情况,同时观察动物是否有流涕、哮喘、喷嚏、站立不稳、休克等现象。评分按照文献[7]的评分标准进行评分(见表1、表2)。
过敏反应平均值=(红斑形成总分+水肿形成总分)/合计动物数
致敏反应发生率=有过敏反应动物数(无论程度轻重)/合计动物数×100%

表1 皮肤反应程度评分标准

表2 皮肤致敏性评分标准

2 结 果
2.1 甲醛致炎实验结果
2.1.1 各组不同时间跖周长比较 见表3及图1。
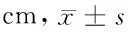
表3 各组不同时间足跖周长比较
与赋形对照组比较,*P<0.05,**P<0.01;与地塞米松组比较,△P<0.05
由见表3及图1可见,在足跖关节周长测定中,受试药物组足跖肿胀从2 h后开始逐渐缓解消退,赋形对照组足跖肿胀从4 h后开始逐渐缓解消退。与赋形对照组比较,痛舒膏巴布剂高、中剂量组和地塞米松组能明显降低豚鼠足跖关节肿胀度(P<0.05,P<0.01);痛舒膏巴布剂高剂量组作用效果优于地塞米松组(P<0.05),痛舒膏巴布剂中剂量组抗炎效果与地塞米松组比较差异无统计学意义(P>0.05),痛舒膏巴布剂低剂量组作用效果较地塞米松组弱(P<0.05);其中各剂量巴布剂组两两比较,随着剂量的增加,豚鼠足跖关节肿胀缓解度越大(P<0.05)。
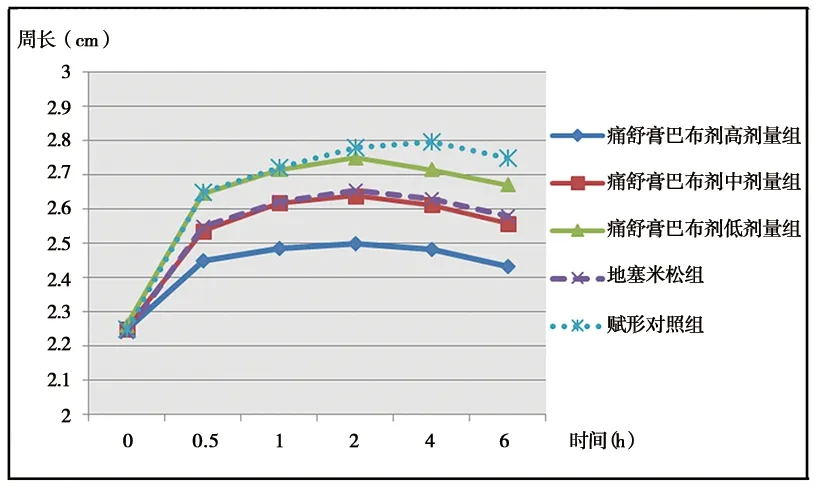
图1 豚鼠足跖周长变化折线图
2.1.2 各组不同时间足跖肿胀率比较 见表4。
由表4可见,在肿胀率的测定中,豚鼠足底软组织肿胀从2 h后开始逐渐缓解消退。与赋形对照组比较,痛舒膏巴布剂高、中剂量组和地塞米松组能明显降低豚鼠软组织肿胀度(P<0.05,P<0.01);痛舒膏巴布剂高剂量组效果优于地塞米松组(P<0.05),痛舒膏巴布剂中剂量组作用效果与地塞米松组相当(P>0.05),痛舒膏巴布剂低剂量组作用效果较地塞米松组弱(P<0.05);其中各剂量巴布剂组两两比较,随着剂量的增加,豚鼠足底软组织肿胀缓解度越大(P<0.05)。
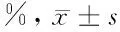
表4 各组不同时间足跖肿胀率比较
与赋形对照组比较,*P<0.05,**P<0.01;与地塞米松组比较,△P<0.05
与赋形对照组比较,*P<0.05,**P<0.01;与地塞米松组比较,△P<0.05
由表5可见,与赋形对照组比较,痛舒膏巴布剂高、中、低剂量组与地塞米松组豚鼠血清中PGE2含量均明显降低,差异有统计学意义(P<0.05,P<0.01),同时痛舒膏巴布剂高剂量组PGE2含量明显低于地塞米松组(P<0.05),痛舒膏巴布剂低剂量组PGE2含量高于地塞米松组(P<0.05),痛舒膏巴布剂中剂量组PGE2含量与地塞米松组比较差异无统计学意义(P>0.05)。与赋形对照组比较,痛舒膏巴布剂高、中、低剂量组与地塞米松组豚鼠血清中β-EP含量均明显升高,差异有统计学意义(P<0.05,P<0.01),同时痛舒膏巴布剂高剂量组β-EP含量明显高于地塞米松组(P<0.05),痛舒膏巴布剂低剂量组β-EP含量低于地塞米松组(P<0.05),痛舒膏巴布剂中剂量组β-EP含量与地塞米松组比较差异无统计学意义(P>0.05)。
2.2 各组不同时间致敏发生率比较 见表6。
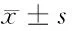
表6 各组不同时间致敏发生率比较 分,
由表6可见,阳性药物组动物皮肤受试区均出现不同程度的过敏反应,皮肤出现红斑及水肿,甚至出现站立不稳等现象,致敏发生率达100%,表现为极度致敏性。痛舒膏巴布剂组和赋形对照组动物皮肤受试区自激发给药后72 h内均未出现异常反应,致敏发生率为0.0±0.0,实验表明:痛舒膏巴布剂对皮肤无致敏性。
3 讨 论
软组织损伤是由于筋骨和脉络的损伤,血离经脉,凝聚成瘀,瘀积不散,经络受阻,气血不通,肿痛即作[8]。临床研究发现,五倍子膏巴布剂在临床使用中对于患者头痛、挫伤、骨病及风湿类疾病疗效显著[9]。研究表明,β-EP具有较强的中枢及外周镇痛作用,其镇痛机制是通过抑制神经元的痛觉传导和伤害性感受器的兴奋,从而抑制疼痛信息的传递[10]。PGE2是一种重要的疼痛介质,组织在收到损伤和炎症时局部可释放出PGE2等炎性致痛物质引起疼痛,且PEG2可直接刺激神经末梢引起疼痛,提高痛觉感受器对其他致痛因子的敏感性[11]。本实验通过测定甲醛致炎后各组豚鼠血清中PGE2和β-EP的水平,结果表明痛舒膏巴布剂高、中、低剂量组与地塞米松组豚鼠血清中PGE2含量较赋形对照组均明显降低(P<0.05),同时痛舒膏巴布剂高剂量组PGE2含量明显低于地塞米松组(P<0.05),痛舒膏巴布剂低剂量组PGE2含量明显高于地塞米松组(P<0.05),痛舒膏巴布剂中剂量组PGE2含量与地塞米松组比较差异无统计学意义(P>0.05)。说明痛舒膏巴布剂对软组织损伤引起的炎性反应有明显的抑制作用,一定程度上呈剂量依赖性,且痛舒膏高剂量组的抗炎作用优于地塞米松组,痛舒膏巴布剂中剂量组与地塞米松组抗炎作用程度相当,低剂量组的效果较地塞米松组差。豚鼠足跖关节周长及肿胀率的测定从宏观数据上印证了该结论。在β-EP的测定中,痛舒膏巴布剂高、中、低剂量组与地塞米松组豚鼠血清中β-EP含量均明显升高(P<0.05),同时痛舒膏巴布剂高剂量组β-EP含量明显高于地塞米松组(P<0.05),痛舒膏巴布剂低剂量组β-EP含量低于地塞米松组(P<0.05),痛舒膏巴布剂中剂量组β-EP含量与地塞米松组比较差异无统计学意义(P>0.05)。说明痛舒膏巴布剂具有明显的镇痛效果,一定程度上呈剂量依赖性,且痛舒膏巴布剂高剂量组镇痛作用优于地塞米松组。
现代医学中各种软组织和关节疾病,如风湿性关节炎、腰肌劳损、肩关节周围炎、颈椎病等均属于中医学痹证范畴。其病机主要为邪气痹阻经脉,即风、寒、湿、热、痰、瘀等邪气滞留于肢体筋脉、关节、肌肉、筋脉,气血闭阻不通,不通则痛。清代王清任强调血瘀发病的重要性,治疗上拟定以活血化瘀为主的身痛逐瘀汤,扩充了痹证方剂的思路。痛舒膏巴布剂方中延胡索为活血化瘀、行气止痛之妙品,能行血中气滞,故专治一身上下诸痛;川芎活血行气,祛风止痛,与延胡索配伍,既能行血中之气,又能行气中之血,气畅血行,通则不痛;鸡血藤活血舒筋,养血调经,白芍养血柔肝,缓急止痛,二者配伍,共奏和血养血、通络止痛之效;金钱白花蛇祛风通络,定惊止痉,地龙熄风止痉,通经活络,羌活发散风寒,胜湿止痛,三药合用,增加祛湿除痹、通络止痛之力;木瓜祛风舒筋,除湿通络;三七散瘀止血,活血定痛;穿山龙祛风除湿,消痈散结。全方配伍精妙,对于痹证所致的筋脉拘挛、气血瘀滞、为肿为痛具有良好的效果。
巴布剂通过透皮给药系统,可直接作用于靶部位发挥疗效,在较长时间内维持恒定的血药浓度,降低药物的毒副作用,临床用药方便[12-13]。巴布剂非常适合中药多组分、大剂量的用药特点,其发展潜力巨大[14]。2000年版《中华人民共和国药典》将巴布剂收入制剂通则,并在2015年版《中华人民共和国药典》第四部将“巴布剂”更名为“凝胶贴膏”,进一步规范了相应的质量标准[15]。本巴布剂对传统药物剂型进行了改革,充分体现活血化瘀、舒筋活络、行气止痛的思想,严格按照巴布剂的制备工艺标准,制成透皮给药贴剂。以往软组织损伤,中药治疗多用传统的中药与饴糖等介质调和而成的外敷药膏,虽然损伤部位也能直接给药、费用少、疗效明显,但临床应用污染衣物,且不易携带,同时易引起皮肤瘙痒、皮疹等过敏现象[16]。本实验研究显示,贴敷痛舒膏巴布剂的豚鼠均未出现红斑、水肿等过敏反应,其致敏率为0,表明痛舒膏巴布剂在透皮给药过程中安全性高,为后期进一步研究及临床用药提供安全依据。
[1] 马晓辉.中药透皮给药系统的研究进展[J].中国实用医药,2015,10(2):246-248.
[2] 孟凡敏,王延科,贺吉香.对近年国内中药巴布剂体外透皮吸收研究进展综述[J],2016,18(2):212-215.
[3] 张影,陈小勇.浅谈中药巴布剂的研究现状[J].中医药信息,2015,32(5):116-118.
[4] 陈奇.中药药理研究方法学[M].北京:人民卫生出版社,2006:107-109.
[5] 匡建军,张信成,蔡萍,等.肿痛消巴布膏镇痛抗炎作用实验研究[J].新中医,2012,44(2):113-115.
[6] 李永平,李向阳,洒玉萍,等.秦艽止痛巴布剂对大鼠佐剂性关节炎IL-1β、PGE2的影响[J].时珍国医国药,2013,24(2):287-288.
[7] 朱文翔,刘原君,程发峰,等.麻芥平喘巴布剂皮肤用药安全性实验研究[J].北京中医药大学学报,2016,39(5):372-375.
[8] 胡阳广,竹剑平.伤痛巴布剂治疗急性软组织损伤93例临床疗效观察[J].浙江中医药大学学报,2010,34(3):320-321.
[9] 崔岩飞,马国玲,胡欣,等.五倍子膏巴布剂治疗肺结核盗汗临床观察[J].浙江中西医结合杂志,2015,25(10):930-932.
[10] 王洋.中药止痛贴镇痛药效及作用机制的实验研究[D].沈阳:辽宁中医药大学,2012.
[11] 罗燕,赵林钢.清凉巴布剂镇痛作用及其机制的实验研究[J].江苏中医药,2013,45(2):74-75.
[12] 刘亚男,樊金伟.巴布剂的研究现状及发展前景[J].黑龙江医药,2010,23(5):766-768.
[13] 李光华.中药巴布剂的研究现状与展望[J].天津药学,2016,28(4):48-50.
[14] 白才堂,吕竹芬,谢清春,等.正交试验优选竭红跌打巴布剂基质处方[J].中国药房,2011,22(31):2911-2913.
[15] 国家药典委员会.中华人民共和国药典:四部[S].2015年版.北京:中国医药科技出版社,2015:22.
[16] 魏国俊,王志勇,董林,等.骨刺消巴布剂对大鼠急性软组织损伤模型的治疗作用及机理研究[J].西部中医药,2014,27(10):14-16.
StudyontheeffectsandsensitizationofTongshugaocataplasm
WANSiqi*,WEIYufei,XUYan,etal.*
2017-GradeMasterofClinicalMedicalCollegeofHeilongjiangUniversityofTraditionalChineseMedicine,Heilongjiang,Haerbin150040
ObjectiveTo explore the analgesic and anti-inflammation effects of Tongshugao cataplasm.Methods50 guinea pigs were randomly divided into five groups. The high dosage of Tongshugao cataplasm group was treated with Tongshugao for external by 5.73 g/kg of crude drug, the middle dosage of Tongshugao cataplasm group was treated with Tongshugao for external by 3.82 g/kg of crude drug, the low dosage of Tongshugao cataplasm group was treated with Tongshugao for external by 1.91 g/kg of crude drug, the dexamethasone group was treated with substrate patch of cataplasm by 0.000 81 g/kg, the shaped control group was treated with substrate patch of cataplasm, and 10 guinea pigs in each group. And giving the external application of corresponding drugs affixed to plantar and toe parts with non-irritating gauze and tape fixed for 6 h in each group. After 7 d, formaldehyde method was used to induce inflammation. The feet swelling degree and the content of serum prostaglandin E2(PEG2) and β-endorphin (β-EP) in guinea pigs was measured. 30 guinea pigs were randomly divided into three groups. The Tongshugao cataplasm group was treated with Tongshugao for external by 3.82 g/kg of crude drug, the shaped control group was treated with substrate patch of cataplasm, and the positive drug group was treated with 2, 4-Dinitrochlorobenzene, and 10 guinea pigs in each group. The paste of Tongshugao cataplasm group and shaped control group were posted on the left hair removal area on back of guinea pig. The paste of positive drug group was posted on the left hair removal area on back of guinea pig with smear 0.2 mL of 1% 2, 4-Dinitrochlorobenzene for 6 h, and the same method was used on the 7thd and 14thd. On the 14thday after the last sensitization, administration was given to the left hair removal area on back of guinea pig in three groups. The administration in Tongshugao cataplasm group and shaped control group were as the same as the previous one, the positive drug group was treated with 0.2 mL of 0.2% 2, 4-Dinitrochlorobenzene and fixed with non-irritating gauze. The skin allergy test was conducted by sensitized contact and stimulated contact.ResultsIn the experiment of formaldehyde induced inflammation, compared with the control group, the high, middle, and low dosage of Tongshugao cataplasm group and the dexamethasone group can significantly reduce the foot swelling degree of guinea(P<0.05,P<0.01).In the experiment of sensitization, the animal skin test area in Tongshugao cataplasm group has no abnormal reaction since the onset of drug administration within 72 h, and the allergic reaction rate was 0.0±0.0.ConclusionTongshugao cataplasm has good effects of anti-inflammatory and analgesic, which in a certain range with a concentration-dependent, and Tongshugao cataplasm has no sensitized effect on guinea pigs skin, clinical drug application safety.
Animal; Guinea pig; Hypersensitivity; Analgesia;Traditional Chinese medicine therapy
10.3969/j.issn.1002-2619.2017.12.021
R-332;R287;R392.33
A
1002-2619(2017)12-1852-06
※ 项目来源:黑龙江中医药大学科研基金项目(编号:035105)
△ 通讯作者:黑龙江中医药大学附属第一医院心血管四科,黑龙江 哈尔滨 150040
1 黑龙江省哈尔滨市中医医院急诊科,黑龙江 哈尔滨 150002
万思琦(1993—),女,硕士研究生在读,学士。研究方向:中医内科学。
2017-09-13)
董军杰)

