H2O2对人皮肤成纤维细胞衰老标记蛋白30及自噬相关蛋白LC3Ⅱ表达的影响
田黎明 彭圆 胡荣毅 程杨 姜红浩 陈红英 田庆均 张翀 王平
430022武汉,湖北中医药大学附属中西医结合医院 华中科技大学附属武汉中西医结合医院 武汉市第一医院皮肤科(田黎明、胡荣毅、程杨、姜红浩、陈红英、田庆均);湖北中医药大学基础医学院(彭圆、张翀、王平)
·论著·
H2O2对人皮肤成纤维细胞衰老标记蛋白30及自噬相关蛋白LC3Ⅱ表达的影响
田黎明 彭圆 胡荣毅 程杨 姜红浩 陈红英 田庆均 张翀 王平
430022武汉,湖北中医药大学附属中西医结合医院 华中科技大学附属武汉中西医结合医院 武汉市第一医院皮肤科(田黎明、胡荣毅、程杨、姜红浩、陈红英、田庆均);湖北中医药大学基础医学院(彭圆、张翀、王平)
目的探讨H2O2对人皮肤成纤维细胞(NHSF)衰老标记蛋白30(SMP30)以及细胞自噬相关蛋白微管相关蛋白1轻链3Ⅱ型(LC3Ⅱ)的影响。方法用150 μmol/L H2O2处理2~4代NHSF 2 h,构建细胞衰老模型作为H2O2组,而未处理的NHSF作为对照组。细胞衰老β半乳糖苷酶(SA⁃β⁃gal)染色法检测衰老细胞比例,间接免疫荧光检测自噬相关蛋白LC3的表达,反转录PCR(RT⁃PCR)检测SMP30 mRNA的表达,Western印迹法检测SMP30和LC3蛋白的表达。结果H2O2组NHSF的SA⁃β⁃gal染色阳性率(41.70% ±2.95%)显著高于对照组(3.03% ±0.25%,t=22.59,P<0.05)。间接免疫荧光结果显示,H2O2组NHSF LC3阳性率(12.60%±1.57%)明显低于对照组(23.67%±3.04%,t=5.61,P<0.05)。Western印迹显示,H2O2组LC3Ⅰ/GAPDH比值(0.40±0.02)与对照组(0.41±0.04)比较差异无统计学意义(P>0.05),而H2O2组LC3Ⅱ/GAPDH比值(0.20±0.02)明显低于对照组(0.80±0.03,t=29.69,P< 0.05),且H2O2组LC3Ⅱ/LC3Ⅰ比值(0.51±0.03)亦明显低于对照组(1.98±0.23,t=10.967,P<0.05)。H2O2组SMP30 mRNA和蛋白水平(与GAPDH mRNA和蛋白的比值分别为0.16±0.01和0.27±0.02)明显低于对照组(分别为0.35±0.01和0.63±0.02),均P<0.05。结论H2O2可降低NHSF中SMP30及LC3Ⅱ的表达水平,加速NHSF衰老。
皮肤衰老;过氧化氢;成纤维细胞;自噬;衰老标记蛋白30;LC3Ⅱ
在肝脏衰老相关研究中发现了一种新的衰老标记蛋白30(senescence marker protein 30,SMP30)[1],作为β联蛋白调控皮肤细胞衰老的重要下游因子,可能介导β联蛋白延缓氧化应激所致人皮肤成纤维细胞衰老[2],但其与人皮肤细胞衰老的具体关系还不清楚。Eliopoulos等[3]研究发现,自噬作为真核细胞清除无用细胞器及降解变性蛋白质聚集体的细胞途径,在各种真核生物衰老过程中发挥重要作用。我们的前期实验[4]证实,150 μmol/L过氧化氢(H2O2)处理2~4代正常人皮肤成纤维细胞(normal human skin fibroblasts,NHSF)2 h,可以成功诱导NHSF衰老。为进一步研究H2O2对NHSF衰老相关因子及细胞自噬的影响,在前期研究基础上,我们采用H2O2诱导NHSF提前衰老,观察SMP30及自噬相关蛋白微管相关蛋白1轻链3Ⅱ型(LC3Ⅱ)表达的变化。
材料与方法
一、材料
T⁃Gradient Thermoblock PCR仪(德国Denver公司),凝胶影像分析系统Jeldoc2000型(美国BioRad公司),DMEM培养基、胎牛血清(FBS)、胰蛋白酶(美国Gibco BRL公司),细胞衰老相关β半乳糖苷酶(SA⁃β⁃gal)染色试剂盒(美国CDK公司),SMP30抗体、3磷酸甘油醛脱氢酶(GAPDH)抗体(美国Santa Cruz生物公司),间接免疫荧光封闭液、异硫氰酸荧光素(FITC)标记山羊抗小鼠IgG(H+L)(上海碧云天生物技术有限公司),LC3抗体(美国Cell Signaling公司)。
二、方法
1.NHSF分离与培养[4]:分离小儿包皮获得NHSF,培养于含10%FBS的DMEM培养基中,细胞长至80%融合后,采用0.25%胰蛋白酶和0.02%乙二胺四乙酸(EDTA)以1∶1比例消化传代扩增,取2~4代NHSF用于实验。
2.H2O2处理NHSF诱导皮肤衰老模型:根据前期实验[4],采用150 μmol/L H2O2处理NHSF 2 h诱导人皮肤衰老模型,作为H2O2组;未处理的NHSF作为对照组。
3.SA⁃β⁃gal活性测定及细胞形态观察[4]:制作细胞爬片,在磷酸盐缓冲液(PBS)中冲洗,室温下以2%甲醛/0.2%戊二醛固定3~5 min,PBS清洗,在无CO2、37 ℃条件下以新鲜配制的SA⁃β⁃gal染色液孵育2~4 h,最长为12~16 h,中性树胶封片,光镜观察细胞染色情况及细胞形态。阳性细胞胞质呈淡蓝至深蓝色。200倍视野下阳性细胞占总细胞的百分比为阳性率。
4.间接免疫荧光检测LC3的表达[5]:NHSF按实验分组条件处理2 h后,每组接种5 ml(2×105个/ml)于共聚焦培养皿中,待细胞贴壁后,弃去原培养液,加入4%多聚甲醛室温固定30 min,弃固定液,加入免疫荧光封闭液封闭1 h,弃封闭液,加入1∶200稀释的LC3一抗4℃孵育过夜,弃染液,加入1∶200稀释的荧光二抗避光室温孵育2 h,加入DAPI室温避光孵育20 min,弃DAPI,PBS漂洗后在倒置激光共聚焦荧光显微镜下观察并采集图像。绿色荧光代表阳性细胞,400倍视野下阳性细胞占总细胞的百分比为阳性率。
5.RT⁃PCR测定NHSF中SMP30 mRNA表达:Trizol抽提细胞总RNA,RT⁃PCR检测对照组和H2O2组NHSF中SMP30 mRNA的表达。采用在线引物设计 软 件(http://frodo.wi.mit.edu/primer3/)设 计 人SMP30基因引物,正向:5′⁃CCGTGGATGCCTTTGAC TAT⁃3′;反向:5′⁃TCCAAAGCAGCATGAAGTTG⁃3′。GAPDH基因,正向:5′⁃ACCACAGTCCATGCCATCA C⁃3′;反向:5′⁃TCCACCACCCTGTTGCTGTA⁃3′。PCR反应体系和反应条件参考文献[4]。用凝胶分析系统扫描拍照,检测各电泳条带的灰度值,SMP30/GAPDH比值为SMP30 mRNA的相对含量。
6.Western印迹检测NHSF中SMP30、LC3蛋白表达:参考文献[4]。在冰上用无线电免疫沉淀反应试验(radio immunoprecipitation assay,RIPA)溶解细胞,旋转使细胞充分破碎,离心后的上清液分装到0.5 ml离心管中,测蛋白浓度或放入-70℃保存。取蛋白样品加入5×变性上样缓冲液,100 V电压跑胶,转聚偏二氟乙烯(PVDF)膜,室温振荡封闭1 h。分别加入一抗SMP30(1∶200)、LC3(1∶200)、GAPDH(1∶3 000),4℃过夜,吐温3缓冲液洗膜,每次10 min,洗3次,加入1∶10 000二抗辣根过氧化物酶,室温振荡孵育1 h。在PVDF膜上均匀涂抹化学发光底物,保持2 min。采用凝胶成像分析软件分析,记录每条蛋白电泳带的灰度值。
7.统计分析:采用SPSS 17.0软件进行统计分析。各组实验均重复3次,取平均值,数据以±s表示,两组间比较采用独立样本t检验,P<0.05为差异有统计学意义。
结 果
一、H2O2处理对NHSF细胞形态和SA⁃β⁃gal活性的影响
150 μmol/L H2O2处理 NHSF 2 h 后,显微镜下NHSF排列不规则,细胞变平、变大,出现空泡,轮廓不清楚,折光性差,符合衰老细胞特征(图1)。H2O2组SA⁃β⁃gal阳性率显著高于对照组(P< 0.05)。见表1。
表1 H2O2处理前后正常人皮肤成纤维细胞中β半乳糖苷酶(SA⁃β⁃gal)阳性率及LC3、SMP30 mRNA和蛋白的表达(±s)

表1 H2O2处理前后正常人皮肤成纤维细胞中β半乳糖苷酶(SA⁃β⁃gal)阳性率及LC3、SMP30 mRNA和蛋白的表达(±s)
注:n=3
组别H2O2组对照组t值P值SA⁃β⁃gal阳性率(%)41.70±2.95 3.03±0.25 22.59<0.05 LC3Ⅱ阳性率(%)12.60±1.57 23.67±3.04 5.60<0.05 LC3Ⅱ/GAPDH灰度比值0.20±0.02 0.80±0.03 29.69<0.05 LC3Ⅰ/GAPDH灰度比值0.40±0.02 0.41±0.04 0.21>0.05 LC3Ⅱ/LC3Ⅰ灰度比值0.51±0.03 1.98±0.23 10.97<0.05 SMP30 mRNA 0.16±0.01 0.35±0.01 24.39<0.05 SMP30蛋白0.27±0.02 0.63±0.02 26.03<0.05
二、H2O2处理前后NHSF中LC3的表达
间接免疫荧光结果显示,H2O2组NHSF中LC3阳性率显著低于对照组(P<0.05)。见表1、图2。
Western印迹结果显示,H2O2组LC3Ⅱ/GAPDH灰度比值明显低于对照组(P<0.05),而LC3Ⅰ/GAPDH比值与对照组比较差异无统计学意义(P>0.05),LC3Ⅱ/LC3Ⅰ比值显著低于对照组(P<0.05)。见表1、图3。

图1 光镜下观察两组正常人皮肤成纤维细胞(NHSF)形态及细胞衰老相关β半乳糖苷酶(SA⁃β⁃gal)活性(× 200) 对照组:细胞形态一致,呈长梭形,核呈卵圆形,呈放射状、编织状或漩涡状排列,轮廓清楚,折光性好;H2O2组:细胞排列不规则,细胞变平、变大,出现空泡,轮廓不清楚,折光性差,符合衰老的成纤维细胞形态特征
三、H2O2处理前后NHSF中SMP30 mRNA和蛋白的表达
RT⁃PCR和Western印迹显示,H2O2组SMP30 mRNA和蛋白水平均显著低于对照组(均P<0.05)。见表1、图4。
讨 论
皮肤衰老不仅能反映机体的健康状态,而且极大影响人们的美容意识和心理状况,因此皮肤衰老研究已成为当前的热点。H2O2、紫外线等氧化应激可以导致持续的活性氧(ROS)刺激,进一步加剧氧化应激损害,继而导致人皮肤细胞衰老,被认为是导致人细胞衰老的重要因素之一[6⁃7]。我们前期实验也证实,H2O2可诱导氧化应激损伤,导致NHSF衰老[4]。
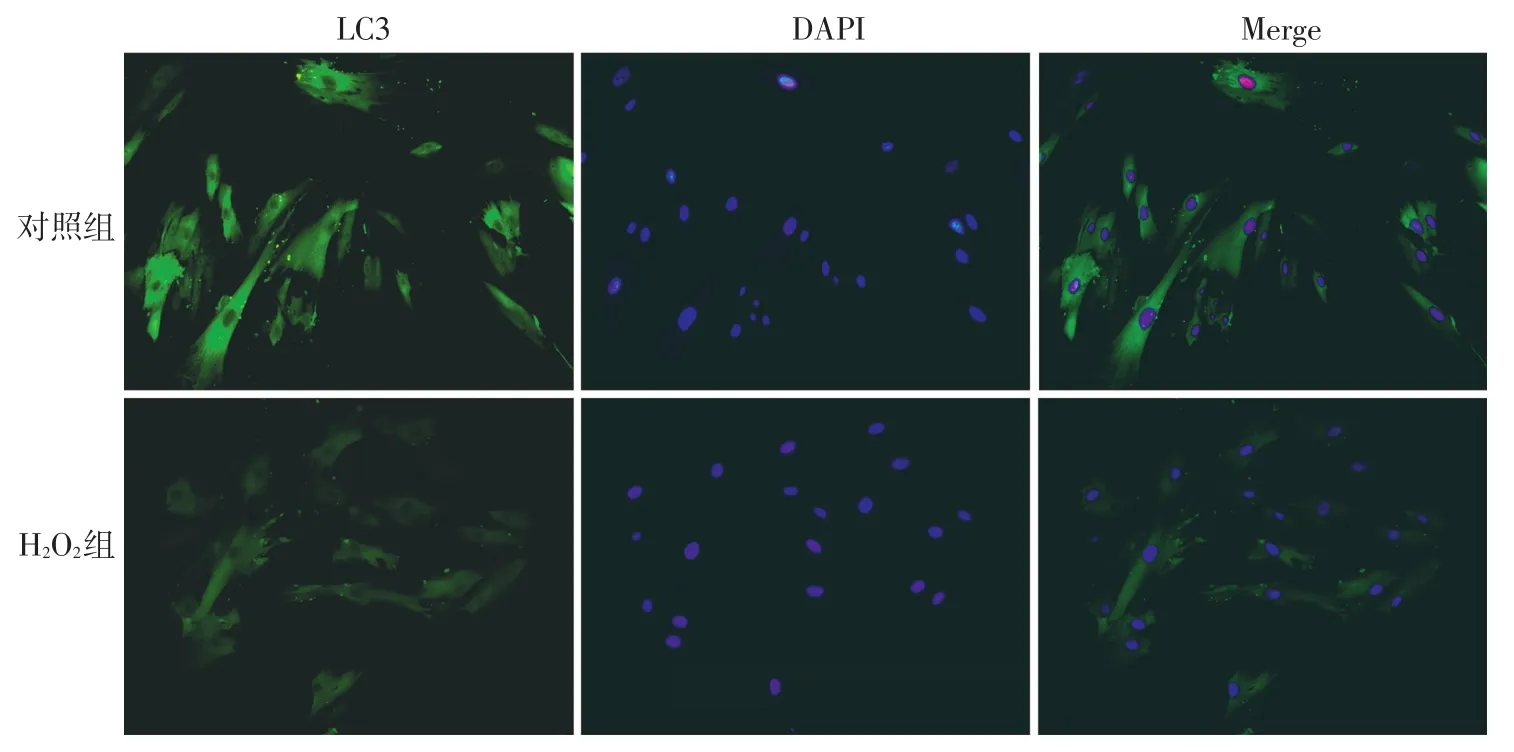
图2 激光共聚焦荧光显微镜下观察两组正常人皮肤成纤维细胞内自噬相关蛋白微管相关蛋白1轻链3(LC3)的表达(间接免疫荧光染色×400) 绿色荧光显示LC3表达,绿色荧光越强,LC3的表达量越高,自噬越强。DAPI:4,6-联脒-2-苯基吲哚,Merge代表LC3绿色荧光与DAPI蓝色荧光的融合

图3 H2O2处理对正常人皮肤成纤维细胞自噬相关蛋白LC3Ⅱ蛋白表达的影响 H2O2组与对照组比较,LC3Ⅰ蛋白表达无明显改变,而LC3Ⅱ蛋白表达明显下调

图4 H2O2处理对正常人皮肤成纤维细胞衰老标记蛋白30(SMP30)mRNA(4A)和蛋白(4B)表达的影响 H2O2组与对照组相比,SMP30表达明显下调
SMP30,又称为钙调素,是一种新发现的衰老标记蛋白,它通过调节细胞内钙离子的浓度来发挥生物学功能[1],同时又是衰老调控基因β联蛋白的重要下游调控因子[8]。本课题组前期研究发现,高表达β联蛋白可以激活衰老的NHSF中SMP30表达,从而延缓人皮肤细胞衰老[2]。国外学者研究也发现,在β联蛋白基因敲除的老鼠中SMP30表达下调,维生素C合成不足,其抗氧化应激能力减弱,自由基所致的损害加速,生命缩短,老鼠细胞衰老加速[9⁃10]。我们的前期研究发现,β联蛋白调控人皮肤细胞衰老的作用机制中,SMP30表达变化可能影响人皮肤细胞的衰老,为进一步探讨SMP30与人皮肤细胞衰老的作用关系,我们进行了相关探索。
一些研究发现,随着小鼠年龄的增长,氧化应激水平逐渐提高,SMP30的表达随之下降[1,11]。对小鼠冠状动脉痉挛机制研究发现,SMP30基因敲除后,小鼠生命力下降且细胞氧化应激损伤增强[12]。本研究中,H2O2组SMP30 mRNA和蛋白的表达较对照组的表达明显下调,并且β-半乳糖苷酶活性在H2O2组较对照组明显增强,表明H2O2加剧皮肤细胞衰老,继而导致SMP30表达下调。同时我们还发现,高表达SMP30对H2O2所致的NHSF衰老表型具有调控作用[13]。可见,SMP30与氧化应激和细胞衰老密切相关,即氧化应激损伤加剧,则SMP30表达减少,皮肤细胞衰老,而SMP30高表达则可以减轻氧化应激损失,延缓皮肤细胞衰老。
自噬是细胞内主要的代谢途径,可以分解受损的蛋白和细胞器进行能量循环利用,直接或间接参与衰老及衰老相关的病理生理过程,对保护细胞内环境稳定极为重要[14]。自噬体膜上标志性蛋白质有LC3,LC3分为LC3Ⅰ和LC3Ⅱ,当哺乳动物的细胞有自噬发生时,LC3Ⅰ经泛素样加工修饰,与自噬膜表面的磷脂酰乙醇胺结合形成LC3Ⅱ,定位于自噬体膜[15⁃16]。本实验中Western印迹和间接免疫荧光检测均显示,H2O2组LC3Ⅱ的表达明显低于对照组。王申等[5]发现,中波紫外线(UVB)诱导的提前衰老成纤维细胞条件上清液可以促使细胞自噬减少,加剧细胞提前衰老。Nopparat等[17]发现,祛黑素通过激活SIRT1信号通路增强自噬活性继而有效抑制H2O2诱导的细胞衰老。Tsuchihashi等[18]也发现,H2O2处理HEI⁃OC1细胞,导致细胞自噬功能缺失和4EBP1磷酸化,继而诱导HEI⁃OC1细胞提前衰老。基于以上研究,我们推测,在H2O2作用下,NHSF自噬可能受到明显的抑制,使细胞清除衰老细胞器的能力明显下降,不利于细胞内稳态的维持,继而进一步导致皮肤细胞衰老的发生。
目前国内外有关SMP30与细胞自噬之间的作用关系还不十分清楚。Zhu等[19]研究发现,氧化应激损伤导致细胞自噬水平下调。Song等[20]研究发现,自噬基因Atg7缺失加重小鼠角质形成细胞内氧化应激损失,导致细胞过早衰老。而本研究发现,氧化应激损伤同样可以导致SMP30表达下调,进一步促使细胞衰老。Park等[21]研究发现,阿霉素诱导的心肌细胞氧化应激损伤模型中,细胞自噬相关蛋白LC3和SMP30表达同时下调,并认为SMP30可能调控细胞内钙离子浓度,继而影响钙离子介导的细胞自噬信号通路。因此,我们推测,SMP30调控细胞内钙离子浓度可能与细胞自噬间具有协同作用,SMP30与细胞自噬交互作用共同抑制氧化应激损伤,延缓细胞衰老。
综上所述,H2O2诱导的NHSF衰老模型中,SMP30表达明显下调,细胞自噬相关蛋白LC3Ⅱ受到一定抑制,可能进一步促使NHSF提前衰老,但SMP30、细胞自噬与皮肤细胞衰老间的作用机制,还需进一步研究。
[1]Maruyama N,Ishigami A,Kondo Y.Molecular abnormality in aging:its contribution to clinical pathology[J].Rinsho Byori,2005,53(8):728⁃734.
[2]Tian LM,Xie HF,Xiao X,et al.Study on the roles of β⁃catenin in hydrogen peroxide⁃induced senescence in human skin fibroblasts[J].Exp Dermatol,2011,20(10):836⁃838.DOI:10.1111/j.1600⁃0625.2011.01324.x.
[3]Eliopoulos AG,Havaki S,Gorgoulis VG.DNA damage response and autophagy:a meaningful partnership[J].Front Genet,2016,7:204.DOI:10.3389/fgene.2016.00204.
[4]田黎明,谢红付,李吉,等.氧化应激所致的人皮肤成纤维细胞衰老中β-连环蛋白的表达研究[J].中华皮肤科杂志,2011,44(4):259⁃262.DOI:10.3760/cma.j.issn.0412⁃4030.2011.04.011.
[5]王申,周炳荣,骆丹,等.中波紫外线诱导的提前衰老成纤维细胞上清液对人真皮成纤维细胞增殖、老化及自噬的影响[J].中华皮肤科杂志,2015,48(7):485⁃489.DOI:10.3760/cma.j.issn.0412⁃4030.2015.07.011.
[6]Qin Z,Robichaud P,He T,et al.Oxidant exposure induces cysteine⁃rich protein 61(CCN1)via c⁃Jun/AP⁃1 to reduce collagen expression in human dermal fibroblasts[J/OL].PLoS One,2014,9(12):e115402[2016⁃10⁃04].http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0115402.DOI:10.1371/journal.pone.0115402.
[7]Shon MS,Lee Y,Song JH,et al.Anti⁃aging potential of extracts prepared from fruits and medicinal herbs cultivated in the Gyeongnam area of Korea[J].Prev Nutr Food Sci,2014,19(3):178⁃186.DOI:10.3746/pnf.2014.19.3.178.
[8]田黎明,谢红付,李吉.β-连珠蛋白及其信号通路和靶基因调控细胞衰老的研究进展[J].临床皮肤科杂志,2014,43(1):62⁃64.
[9]Nejak⁃Bowen KN,Zeng G,Tan X,et al.Beta⁃catenin regulates vitamin C biosynthesis and cell survival in murine liver[J].J Biol Chem,2009,284(41):28115 ⁃28127.DOI:10.1074/jbc.M109.047258.
[10]Mizukami H,Saitoh S,Machii H,et al.Senescence marker protein⁃30(SMP30)deficiency impairs myocardium⁃induced dilation of coronary arterioles associated with reactive oxygen species[J].Int J Mol Sci,2013,14(5):9408⁃9423.DOI:10.3390/ijms14059408.
[11]Kagami Y,Kondo Y,Handa S,et al.Senescence marker protein⁃30/gluconolactonase expression in the mouse ovary during gestation[J].Biol Pharm Bull,2013,36(12):2005⁃2008.DOI:10.1248/bpb.b13⁃00309.
[12]Hoshino Y,Yamada S,Saitoh S,et al.Age⁃related oxidant stress with senescence marker protein⁃30 deficiency plays a pivotal role in coronary artery spasm[J].Coron Artery Dis,2013,24(2):110⁃118.DOI:10.1097/MCA.0b013e32835c8f96.
[13]田黎明,彭圆,胡荣毅,等.衰老标记蛋白30对过氧化氢所致人皮肤成纤维细胞衰老表型的影响[J].新乡医学院学报,2016,33(6):452⁃456.DOI:10.7683/xxyxyxb.2016.06.002.
[14]Levine B,Mizushima N,Virgin HW.Autophagy in immunity and inflammation[J].Nature,2011,469(7330):323 ⁃335.DOI:10.1038/nature09782.
[15]Tanida I,Ueno T,Kominami E.LC3 conjugation system in mammalian autophagy[J].Int J Biochem Cell Biol,2004,36(12):2503⁃2518.DOI:10.1016/j.biocel.2004.05.009.
[16]Noda T,Fujita N,Yoshimori T.The late stages of autophagy:how does the end begin?[J].Cell Death Differ,2009,16(7):984⁃990.DOI:10.1038/cdd.2009.54.
[17]Nopparat C,Sinjanakhom P,Govitrapong P.Melatonin reverses H2O2⁃induced senescence in SH ⁃SY5Y cells by enhancing autophagy via sirtuin 1 deacetylation of the RelA/p65 subunit of NF⁃κB[J/OL].J Pineal Res,2017,63(1)[2017⁃11⁃16].http://onlinelibrary.wiley.com/doi/10.1111/jpi.12407/full.DOI:10.1111/jpi.12407.
[18]Tsuchihashi NA,Hayashi K,Dan K,et al.Autophagy through 4EBP1 and AMPK regulates oxidative stress⁃induced premature⁃senescence in auditory cells.Oncotarget,2015,6(6):3644⁃3655.DOI:10.18632/oncotarget.2874.
[19]Zhu Y,Xiong K,Shi J,et al.A potential role of microRNAs in protein accumulation in cellularsenescence analyzed by bioinformatics[J/OL].PLoS One,2017,12(6):e0179034[2017⁃07⁃27].https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5462445/.DOI:10.1371/journal.pone.0179034.
[20]Song X,Narzt MS,Nagelreiter IM,et al.Autophagy deficient keratinocytes display increased DNA damage,senescence and aberrant lipid composition after oxidative stressin vitroandin vivo[J].Redox Biol,2017,11:219⁃230.DOI:10.1016/j.redox.2016.12.015.
[21]Park JH,Choi SH,Kim H,et al.Doxorubicin regulates autophagy signals via accumulation of cytosolic Ca(2+)in human cardiac progenitor cells[J].Int J Mol Sci,2016,17(10).DOI:10.3390/ijms17101680.
Effect of hydrogen peroxide on senescence marker protein⁃30 and autophagy⁃related protein LC3⁃Ⅱin human skin fibroblasts
Tian Liming,Peng Yuan,Hu Rongyi,Cheng Yang,Jiang Honghao,Chen Hongying,Tian Qingjun,Zhang Chong,Wang Ping
Department of Dermatology,Wuhan No.1 Hospital,Hospital of Traditional Chinese and Western Medicine Affiliated to Hubei University of Chinese Medicine,Wuhan Hospital of Traditional Chinese and Western Medicine Affiliated to Huazhong University of Science and Technology,Wuhan 430022,China(Tian LM,Hu RY,Cheng Y,Jiang HH,Chen HY,Tian QJ);College of Basic Medicine,Hubei University of Chinese Medicine,Wuhan 430065,China(Peng Y,Zhang C,Wang P)
Wang Ping,Email:pwang@aliyun.com
ObjectiveTo evaluate the effect of hydrogen peroxide(H2O2)on a senescence marker protein⁃30(SMP30)and an autophagy⁃related protein microtubule⁃associated protein 1 light chain 3 typeⅡ(LC3⁃Ⅱ)in normal human skin fibroblasts(NHSFs).MethodsNHSFs were isolated from the foreskin of children,and subjected to culturein vitro.The second⁃to fourth⁃passage NHSFs were treated with 150 μmol/L H2O2for 2 hours to establish a model for cellular senescence,while un⁃treated NHSFs served as control group.Senescence⁃associated β⁃galactosidase(SA⁃β⁃gal)staining was performed to determine the percentage of senescent cells,indirect immunofluorescence assay to determine the expression of the autophagy⁃related protein LC3,reverse transcription PCR(RT⁃PCR)to measure the mRNA expression of SMP30,and Western blot analysis to measure the protein expression of SMP30 and LC3.ResultsThe percentage of senescent(SA⁃β⁃gal⁃positive)cells was significantly higher in the H2O2group than in the control group(41.70% ±2.95%vs.3.03% ±0.25%,t=22.59,P<0.05).Indirect immunofluorescence assay showed that the percentage of LC3⁃positive cells was significantly lower in the H2O2group than in the control group(12.60% ±1.57%vs.23.67% ±3.04%,t=5.61,P<0.05).As Western blot analysis showed,no significant difference in the expression of LC3⁃Ⅰ(LC3⁃Ⅰ/glyceraldehyde⁃3⁃phosphate dehydrogenase[GAPDH]ratio)was observed between the H2O2group and control group(0.40±0.02vs.0.41±0.04,P>0.05),while the H2O2group showed significantly lower expression of LC3⁃Ⅱ(LC3⁃Ⅱ/GAPDH ratio:0.20± 0.02vs.0.80± 0.03,t=29.69,P< 0.05)and lower LC3⁃Ⅱ/LC3⁃Ⅰratio(0.51±0.03vs.1.98±0.23,t=10.967,P<0.05)compared with the control group.Moreover,the mRNA and protein expression of SMP30(SMP30/GAPDH ratio)was significantly lower in the H2O2group than in the control group(mRNA:0.16±0.01vs.0.35±0.01;protein:0.27±0.02vs.0.63±0.02,bothP<0.05).ConclusionH2O2can decrease the expression of SMP30 and LC3⁃Ⅱ in NHSFs,and accelerate the senescence of NHSFs.
Skin aging;Hydrogen peroxide;Fibroblasts;Autophagy;SMP30;LC3⁃Ⅱ
Fund programs:National Natural Science Foundation of China(81101212,81574037,81674039);China Postdoctoral Science Foundation(2016M602271);Natural Science Foundation of Hubei Province of China(2012FFC83,2015CFB577);Science Foundation of Health and Family Planning Commission of Hubei Province(WJ2015MB203);Science Foundation of Health and Family Planning Commission of Wuhan Municipality(WX12B20,WX16D30);Training Project for Young and Middle⁃aged Core Talents of Health System of Wuhan City(2015)
王平,Email:pwang@aliyun.com
10.3760/cma.j.issn.0412⁃4030.2017.12.009
国家自然科学基金(81101212、81574037、81674039);中国博士后科学基金(2016M602271);湖北省自然科学基金(2012FFC83、2015CFB577);湖北省卫生计生委科学基金(WJ2015MB203);武汉市卫生计生委科学基金(WX12B20、WX16D30);武汉市中青年医学骨干人才培养工程基金(2015)
2016⁃12⁃19)
周良佳 颜艳)

