柳桉快速热裂解炭改性制取多级孔道活性炭的研究
殷 实 朱玲君 刘银聪 王小柳 王树荣
(浙江大学能源清洁利用国家重点实验室, 杭州 310027)
引言
生物质快速热裂解是以生物油为目标产物的生物质热化学转化技术[1]。通常热裂解过程中会产生10%~22%的固体副产物即生物质热裂解炭[2]。原始热裂解炭的特性与快速热裂解过程的具体参数密切相关,生物质种类、原料产地、热裂解温度和停留时间等条件都会造成生物炭性质的明显差异[3-6]。原始的生物质热裂解炭具有羟基和羧基等官能团结构[7],这些结构对热裂解炭后续改性利用具有良好的结构基础。但是原始热裂解炭孔隙结构极不发达,比表面积一般为1~10 m2/g,极大限制了其高值化利用[8]。原始的生物质热裂解炭通常只能作为燃料直接燃烧,改良后的生物炭具有丰富的孔结构,可作为土壤改性剂、水污染处理剂、催化剂或催化剂载体等应用,其中催化领域的应用包括焦油去除、C1合成烃类燃料、重整制氢、生物柴油、光化学催化和电化学催化等[9-11]。所以对生物炭进行高效利用的重要基础就是对原始生物炭进行一些增扩孔的处理。已有研究表明,催化剂的多级孔道结构有利于解决微孔中物质传递扩散受限等问题[12]。
目前发展炭材料的孔结构最常用的方法就是物理活化法、化学活化法和物理化学活化法[13-14]。其中加热方式有直接加热焙烧以及微波加热等方式。罗亚楠等[15]采用秸秆作为原料,通过磷酸活化和微波加热结合的方法制备活性炭,得到比表面积达到598 m2/g的活性炭。YANG等[16]以椰子壳为原料,用物理活化和微波加热结合的方法制备活性炭,其比表面积达到2 000 m2/g。但其微孔仍占绝对优势,且微波功率达到3 000 W,耗能较大。WILLIAMS等[17]采用物理法和化学法分别对以亚麻纤维为主要成分的生物质废弃物进行活化,物理法活化后的活性炭比表面积达到840 m2/g,孔道为介孔结构,采用化学法活化后的比表面积高达2 400 m2/g,但孔尺寸主要为微孔。因此,本文以柳桉热裂解炭为原料,以KOH为活化剂,采用不同的加热方式和不同的焙烧气氛,在较低能耗下制备具有多级孔结构以及热稳定性良好的生物炭,为后续生物炭的高值化利用提供基础。
1 实验部分
1.1 实验原料
研究所用的柳桉热裂解炭是柳桉在500℃下快速热裂解制油的固体副产物。热裂解实验在自行建造的给料量为5 kg/h的流化床生物质快速热裂解实验台上完成。将干燥后的生物质进行筛选,得到粒径为0.2~0.5 mm的物料,物料通过给料机在氮气吹送下进入流化床中进行快速热裂解反应,离开流化床的产物经过旋风分离器和冷凝器后得到生物油、生物质气和生物炭。
1.2 生物炭活化
为了研究微波和不同气氛焙烧对生物炭结构的影响,在碱处理的基础上,采取了不同活化方式对生物炭进行活化处理,将原始生物炭称为A0。采用微波预加热并结合CO2或N2气氛焙烧法得到的活化生物炭分别称为AM+CO2或AM+N2。具体操作步骤如下:首先采用KOH处理原始生物炭,将20 g原始生物炭样品浸渍于100 mL浓度5 mol/L的KOH水溶液中,在室温(20℃)下搅拌4 h确保KOH与生物炭充分接触,然后在110℃下干燥12 h。之后取10 g KOH生物炭混合物倒进三口烧瓶中,将三口烧瓶放进微波炉中,微波炉设定输出功率为300 W,微波加热时间10 min,微波反应在氮气气氛保护下进行。微波反应后将样品放置于马弗炉中,在CO2气氛下以7℃/min的升温速率升高至700℃活化2 h,活化后用去离子水洗涤,然后用浓度0.1 mol/L的HCl溶液浸渍3 h。之后用去离子水洗涤至中性,在110℃下干燥得到的活化样品称为AM+CO2。其他条件不变,马弗炉焙烧气氛换为N2活化得到的样品称为AM+N2。
不经过微波加热,直接将KOH/生物炭混合物放置于马弗炉中焙烧,在CO2气氛下焙烧活化得到的样品称之为ACO2,在N2气氛下焙烧活化得到的样品称之为AN2。直接经过微波处理得到的样品称之为AM。
1.3 生物炭结构表征
生物炭的表面形貌采用FEI公司生产的SIRION-100型扫描电子显微镜(SEM)进行检测,加速电压为10 kV。取少量样品固定在导电胶上,进行喷金,增强其导电性,而后送入电镜样品室。在Tristar 3000型比表面积分析仪上测试样品的Brunauer-Emmett-Teller (BET)比表面积SBET和其他物理参数。在测试之前样品首先经过300℃脱气3 h,在温度为-196℃下记录氮气吸附脱附曲线。X射线衍射(XRD)用于分析催化剂的物相、晶粒大小及结晶参数,测试在具有Cu极Kα射线辐射源的PANalytical X’Pert PRO型 X射线衍射仪上进行,操作条件为:功率40 kV×30 mA。晶粒大小由Scherrer公式计算得到。TGA8000型热失重分析仪用于分析生物炭的结构与热稳定性。在105℃预处理10 min,去除水分,然后以20℃/min的升温速率升到600℃,观测生物炭的失重率。FTIR(Fourier transform infrared)检测在Nexus670型傅里叶红外光谱仪上进行,分辨率为4 cm-1,检测范围为500~4 000 cm-1。
2 结果与讨论
2.1 BET分析
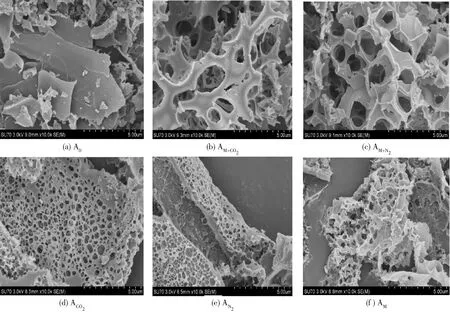
图1 生物炭活化前后的SEM图Fig.1 SEM images of biochar before and after activation
活化前后生物炭氮气物理吸附结果如表1所示,微孔比表面积和微孔孔容由t-Plot方法得到。从中可以看出,经过活化处理后生物炭的孔结构得到明显改善,SBET由活化之前的无孔结构增大至613 m2/g以上,其中经过微波预处理结合N2焙烧活化的生物炭比表面积最大,其值为1 224 m2/g,经过微波预处理和CO2焙烧活化的生物炭比表面积为1 042 m2/g。而没有经过微波预处理的生物炭,在经N2和CO2焙烧后,比表面积分别为908 m2/g和818 m2/g。以上结果表明,N2作为焙烧气氛能更好地增大生物炭比表面积。此外,经过微波预处理并结合焙烧活化的生物炭具有更佳的微孔和介孔比例,形成较好的多级孔道结构。比如AM+N2样品的比表面积为1 224 m2/g,而其微孔比表面积只有439 m2/g,微孔比表面积占比36%,AM+CO2样品的微孔比表面积占比也只有48%。而AN2样品的比表面积为908 m2/g,其微孔比表面积却达到了800 m2/g。而且经过微波预处理的AM+CO2和AM+N2样品的孔容和孔径要明显大于ACO2和AN2样品。但是从AM样品的数据可以看出,只经过微波加热处理的生物炭,其微孔比表面积占了BET比表面积的94%。这说明单独微波或者单独焙烧的方式都不能产生更多的中孔,而这主要是因为微波和传统加热方式的供热原理不同,微波的能量转移不是通过常规加热中的传导和对流,而是通过颗粒内部的偶极旋转和离子传导,直接作用于炭,产生孔结构。微波能量转移更加快速,分布均匀和可控[18]。经过预处理后,再通过传统方式焙烧,在原有孔结构的基础上进一步地扩大孔结构。因此只有将微波加热与气氛焙烧相结合才能进一步增大生物炭的比表面积和改善生物炭的孔径分布。
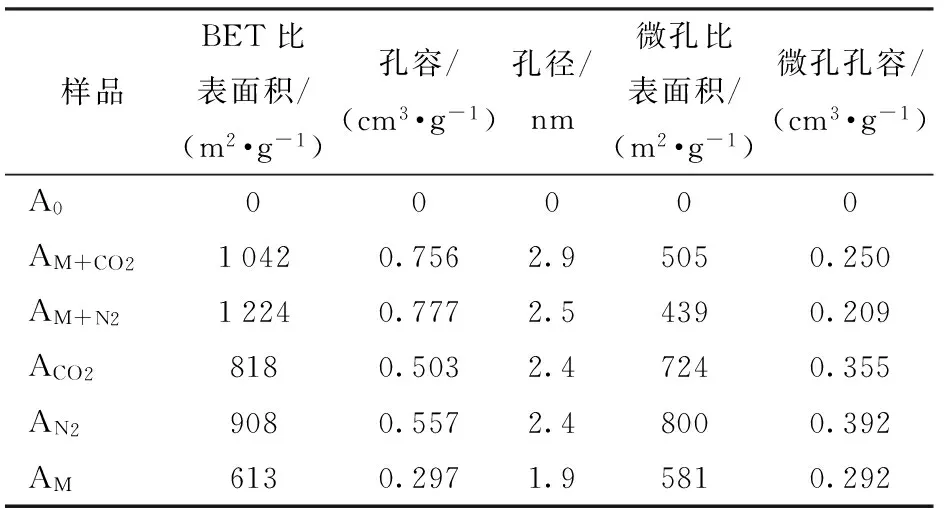
表1 柳桉生物炭活化前后孔特性对比Tab.1 Comparison of pore properties of lauanbiochar before and after activation
2.2 SEM分析
图1为生物炭活化前后的SEM结构形貌图。图1a为原始生物炭的形貌图,可以看出未活化的生物炭呈现较为光滑的植物纤维状。图1b~1f为经过微波加热和气氛焙烧处理的生物炭,具有丰富的孔道结构,且呈蜂窝状排列。与单一气氛焙烧处理或微波加热处理获得的生物炭相比,采用微波预处理与气氛焙烧相结合活化的生物炭具有更丰富的三维网状孔道结构,而单一气氛活化的生物炭孔道更多地形成于生物炭的表面。多孔结构的产生一方面是热裂解炭与KOH反应引起,导致碳的消耗和孔的产生[19];另一方面是微波作为一种高效、独特的加热方式在预处理中有效地在生物炭体相形成丰富的孔道结构,从而导致下一步焙烧活化可以进一步发展形成三维网状多级孔道结构[20]。
2.3 TG分析
活化前后生物炭的TG和DTG曲线如图2所示,从图2b看出原始生物炭初始分解温度为289℃,最大失重峰在365℃,最大失重速率为5.96%/min。说明原始生物炭中存在较多的挥发分。经过CO2焙烧活化的生物炭初始分解温度为330℃,最大失重峰在552℃,最大失重速率为2.17%/min。这说明经过CO2焙烧活化后,生物炭中的挥发分大大减少,最大失重峰往高温区移动,失重速率也远小于原始生物炭。经过N2焙烧活化的生物炭初始分解温度为325℃,最大失重峰在592℃,最大失重速率为0.64%/min。结合上述BET的分析结果,可以说明N2比CO2更适合作为焙烧气氛,活化后的生物炭热稳定性有了进一步的提高。经过微波处理的生物炭初始分解温度为265℃,失重速率比较均匀,不存在明显的失重峰。说明微波能够有效地分解生物炭中的易挥发组分,在热稳定上的效果甚至可以取代传统的N2焙烧效果。其余的2个样品为经过微波处理和气氛焙烧活化得到的生物炭。经过微波处理与N2焙烧和CO2焙烧活化的样品初始分解温度分别为348℃和321℃。其失重速率均匀,不存在最大失重峰。并且从图2a可以看出N2处理的生物炭的热稳定性依然要优于CO2处理的生物炭的热稳定性。
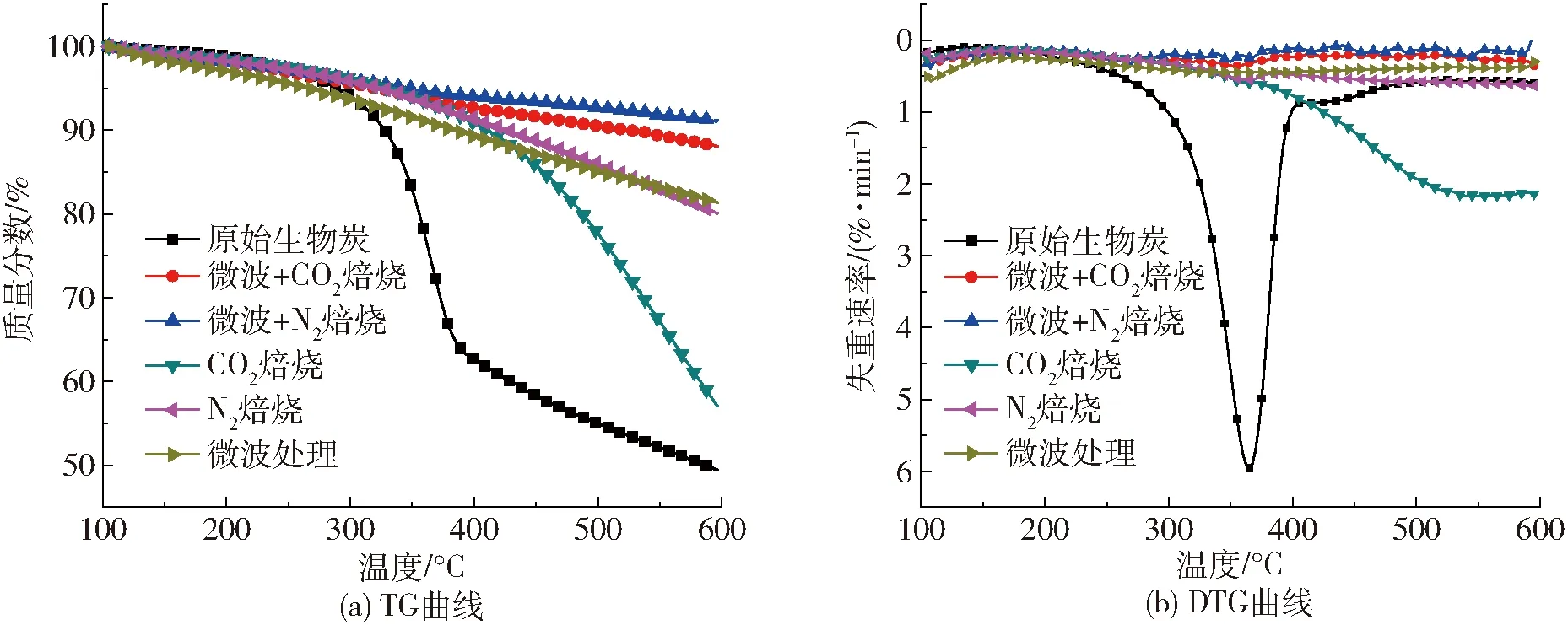
图2 生物炭活化前后的TG和DTG曲线Fig.2 TG and DTG curves of biochar before and after activation
2.4 XRD分析
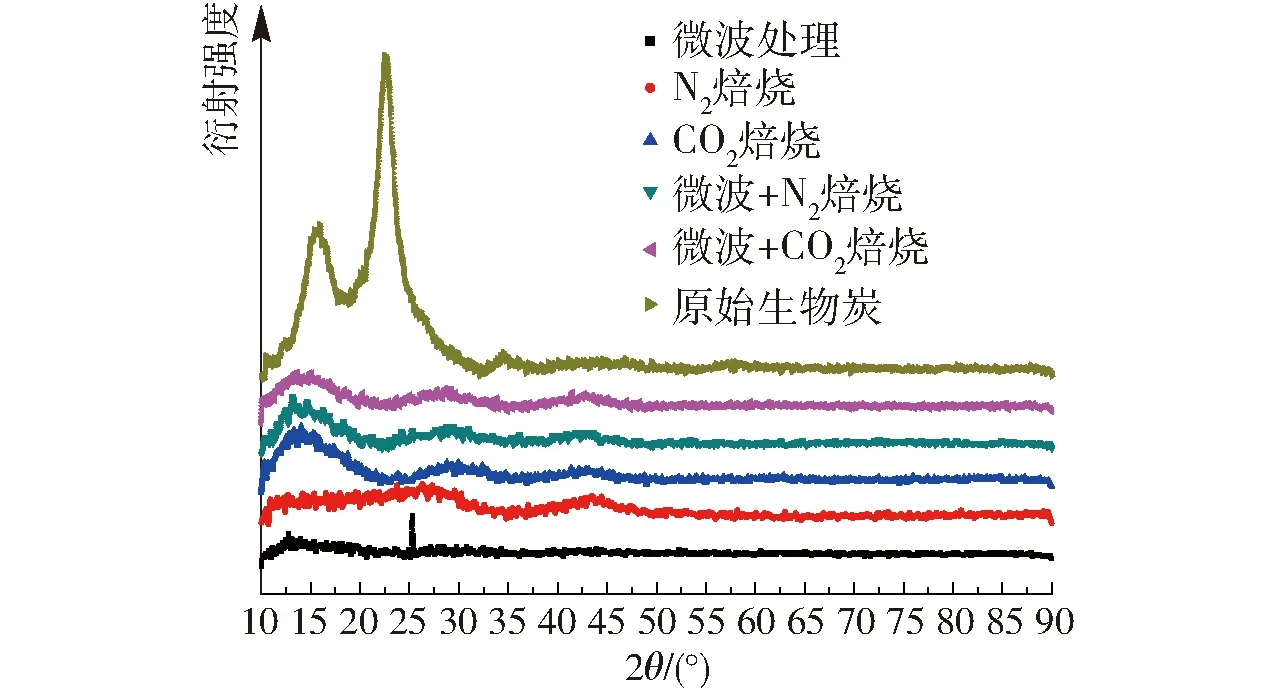
图3 生物炭活化前后的XRD图Fig.3 XRD patterns of biochar before and after activation
图3为活化前后柳桉生物炭的XRD衍射图。在2θ= 15 °(2θ为衍射角)附近出现的峰归结于生物质中残留的未热裂解完全的纤维素晶体,经过高温活化后该峰明显减弱。在2θ= 20°~30°处出现的衍射峰,归属于石墨化结构,该峰在未活化的生物炭中十分尖锐,而在活化炭中则大幅减弱。这说明生物炭活化后石墨化结构有一定破坏,表现为晶粒尺寸较小的石墨结构或为无定型碳结构。
2.5 FTIR分析
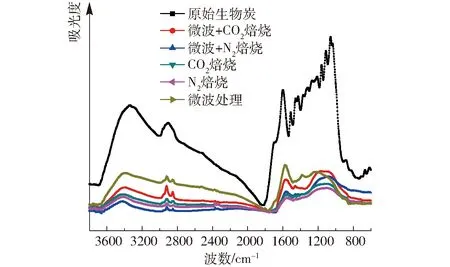
图4 生物炭活化前后的FTIR光谱图Fig.4 FTIR spectra of biochar before and after activation

2.6 生物炭的活化产率
生物炭的活化产率为活化后剩余炭的总质量占原始反应物质量的百分比。只经过微波处理的生物炭产率最高为65%。只经过N2或CO2气氛焙烧的生物炭活化产率分别为50%和46%,产率相比微波处理有所下降。经过微波和N2或CO2气氛焙烧结合的方式活化的生物炭得率进一步降低,分别为42%和38%。产率降低的原因是活化过程中原料在高温下停留时间较长,生物炭本身存在的一些未完全热裂解的有机物质进一步挥发逸出,而且炭也与KOH进行反应促进孔结构的发展,导致产率降低。
3 结论
(1)采用了多种活化方式对柳桉热裂解制取生物油的副产物生物炭进行活化处理,研究发现,采用KOH活化、微波预处理加氮气焙烧法制备的生物炭具有较好的多级孔道结构,比表面积达1 224 m2/g,其中微孔比表面积占36%。两种加热手段的协同作用可有效促进生物炭多级孔道结构的形成,并具有较高的比表面积。
(2)不同活化方式对于生物炭的红外特性有着显著影响,经过活化后的生物炭表面含氧基团大量减少。
(3)采用微波和N2焙烧法制备的活化生物炭,其热稳定性非常好,无明显失重峰,有利于后续开发作为催化剂载体。
1 王树荣, 骆仲泱, 谭洪, 等. 生物质热裂解生物油特性的分析研究[J]. 工程热物理学报, 2004, 25(6): 1049-1052.
WANG Shurong, LUO Zhongyang, TAN Hong, et al. The analyses of characteristics of bio-oil produced from biomass by flash pyrolysis[J]. Journal of Engineering Thermophysics, 2004, 25(6): 1049-1052.(in Chinese)
2 TRUBETSKAYA A, JENSEN P A, JENSEN A D, et al. Influence of fast pyrolysis conditions on yield and structural transformation of biomass chars[J]. Fuel Processing Technology, 2015, 140: 205-214.
3 WANG S R, LIU Q, LIAO Y, et al. A study on the mechanism research on cellulose pyrolysis under catalysis of metallic salts[J]. Korean Journal of Chemical Engineering, 2007, 24(2): 336-340.
4 LIU Q, WANG S R, WANG K G, et al. Mechanism of formation and consequent evolution of active cellulose during cellulose pyrolysis[J]. Acta Physico-Chimica Sinica, 2008, 24(11): 1957-1963.
5 WANG S R, LIN H, RU B, et al. Comparison of the pyrolysis behavior of pyrolytic lignin and milled wood lignin by using TG-FTIR analysis[J]. Journal of Analytical & Applied Pyrolysis, 2014, 108(7): 78-85.
6 CAZORLA-AMOROS D, ALCANIZ-MONGE J, LINARES-SOLANO A. Characterization of actived carbon fibers by CO2adsorption[J]. Langmuir, 1996, 12(11): 2820-2824.
7 SIENGCHUM T, ISENBERG M, CHUANG S S C. Fast pyrolysis of coconut biomass—an FTIR study[J]. Fuel, 2013, 105(2): 559-565.
8 QIAN K Z, KUMAR A, PATIL K, et al. Effects of biomass feedstocks and gasification conditions on the physiochemical properties of char[J]. Energies, 2013, 6(8): 3972-3986.
9 LIANG B, LEHMANN J, SOHI S P, et al. Black carbon affects the cycling of non-black carbon in soil[J]. Organic Geochemistry, 2010, 41(2): 206-213.
10 郑利剑, 马娟娟, 郭飞, 等. 基于水稳定同位素技术的生物炭对土壤持水性影响分析[J/OL]. 农业机械学报, 2016, 47(6): 193-198. http:∥www.j-csam.org/jcsam/ch/reader/view_abstract.aspx?file_no=20160625&flag=1&journal_id=jcsam. DOI:10.6041/j.issn.1000-1298.2016.06.025.
ZHENG Lijian, MA Juanjuan, GUO Fei, et al. Impact of biochar addition on soil water retention based on water stable isotopes[J/OL].Transactions of the Chinese Society for Agricultural Machinery, 2016, 47(6): 193-198.(in Chinese)
11 赵世翔, 姬强, 李忠徽, 等. 热解温度对生物质炭性质及其在土壤中矿化的影响[J/OL]. 农业机械学报, 2015, 46(6): 183-192. http:∥www.j-csam.org/ch/reader/view_abstract.aspx?file_no=2015 0626&flag=1&journal_id=jcsam. DOI:10.6041/j.issn.1000-1298.2015.06.026.
ZHAO Shixiang, JI Qiang, LI Zhonghui, et al. Characteristics and mineralization in soil of apple-derived biochar producecd at different temperatures[J/OL]. Transactions of the Chinese Society for Agricultural Machinery, 2015, 46(6): 183-192.(in Chinese)
12 ROEFFAERS M B, AMELOOT R, BONS A J, et al. Relating pore structure to activity at the subcrystal level for ZSM-5: an electron backscattering diffraction and fluorescence microscopy study.[J]. Journal of the American Chemical Society, 2008, 130(41): 13516.
13 DALAI A K, AZARGOHAR R. Production of activated carbon from biochar using chemical and physical activation: mechanism and modeling[J]. ACS Symposium Series, 2007, 954: 463-476.
14 ABIOYE A M, ANI F N. The characteristics of oil palm shell biochar and activated carbon produced via microwave heating[J]. Applied Mechanics & Materials, 2014, 695(3): 12-15.
15 罗亚楠, 于丽颖, 于晓洋. 磷酸-微波活化法制备秸秆基活性炭[J]. 广州化工, 2015(13): 82-84.
LUO Yan’an, YU Liying, YU Xiaoyang. Preparation of straw active carbon in phosphoric acid-microwave method[J]. Guangzhou Chemical Industry, 2015(13): 82-84.(in Chinese)
16 YANG K B, PENG J H, SRINIVASAKANNAN C, et al. Preparation of high surface area activated carbon from coconut shells using microwave heating[J]. Bioresource Technology, 2010, 101(15): 6163-6169.
17 WILLIAMS P T, REED A R. Development of activated carbon pore structure via physical and chemical activation of biomass fibre waste[J]. Biomass & Bioenergy, 2006, 30(2):144-152.
18 JONES D A, LELYVELD T P, MAVROFIDIS S D, et al. Microwave heating applications in environmental engineering—a review[J]. Resources, Conservation and Recycling, 2002, 34(2): 75-90.
19 MA Y H. Comparison of activated carbons prepared from wheat straw via ZnCl2, and KOH activation[J]. Waste & Biomass Valorization, 2016.DOI:10.1007/s12649-016-9640-z.
20 FOO K Y, HAMEED B H. Preparation and characterization of activated carbon from pistachio nut shells via microwave-induced chemical activation[J]. Biomass & Bioenergy, 2011, 35(7): 3257-3261.
21 郑庆福, 王永和, 孙月光, 等. 不同物料和炭化方式制备生物炭结构性质的FTIR研究[J]. 光谱学与光谱分析, 2014,34(4): 962-966.
ZHENG Qingfu, WANG Yonghe, SUN Yueguang, et al. Study on structural properties of biochar under different materials and carbonized by FTIR[J]. Spectroscopy and Spectral Analysis, 2014,34(4): 962-966.(in Chinese)
22 CHIA C H, GONG B, JOSEPH S D, et al. Imaging of mineral-enriched biochar by FTIR, Raman and SEM-EDX[J]. Vibrational Spectroscopy, 2012, 62(9): 248-257.
23 MIMMO T, PANZACCHI P, BARATIERI M, et al. Effect of pyrolysis temperature on miscanthus (miscanthus×giganteus) biochar physical, chemical and functional properties[J]. Biomass & Bioenergy, 2014, 62: 149-157.

