骨盆区放射诱导肉瘤五例分析
王崇任 华莹奇 孙伟 沈嘉康 孙梦熊 傅泽泽 周承豪 蔡郑东
电离辐射存在诱导良恶性肿瘤发生的危险,根据对不同人群的研究发现,经放射线暴露后会增加人体诱导新生肿瘤发生的几率[1],放疗诱导肉瘤可呈多种类型,包括恶性纤维组织细胞瘤、血管肉瘤、平滑肌肉瘤、纤维肉瘤、恶性周围神经鞘瘤、黏液纤维肉瘤、软肉瘤及肉瘤[2-3]。放射诱导肉瘤及其罕见,占肉瘤总数的 1.5%[4]。以往研究发现,对于放疗后诱发肉瘤的诊断可归纳为:( 1 ) 肉瘤发生于放疗后较长时间,一般>10 年;( 2 ) 肿瘤发生于既往放疗区域;( 3 ) 与首次肿瘤的病例类型不同[5]。目前国内的研究发现,放射后诱导肉瘤恶性程度高、预后极差,5 年生存率仅 17%~58%,对放疗及化疗普遍不敏感,复发率高达 45%[6-7]。本研究拟探讨骨盆区放射诱导肉瘤的临床特征与治疗。
资料与方法
一、纳入与排除标准
1. 纳入标准:( 1 ) 2014~2017 年于我院收治的骨盆恶性肿瘤 225 例;( 2 ) 原发肿瘤均经手术后病例组织学证实者;( 3 ) 继发恶性骨盆肿瘤影像、临床、病理三结合诊断明确者;( 4 ) 肿瘤所在区域既往接受放疗者;( 5 ) 继发肿瘤病理学诊断与既往原发肿瘤病理学诊断组织来源不同者;( 6 ) 继发肿瘤与原发肿瘤放疗后间隔时间超过至少 7 年者。
2. 排除标准:( 1 ) 继发肿瘤与原发肿瘤存在良性肿瘤恶变可能者;( 2 ) 既往未接受放疗或放疗区域与继发肿瘤位置不相关者;( 3 ) 继发肿瘤无明确组织病理学诊断者;( 4 ) 原发肿瘤接受除放疗、手术以外的其它治疗方式者;( 5 ) 原发肿瘤放疗后至继发肿瘤发生之间,因其它疾病接受放疗者。
二、一般资料
本组共纳入 5 例,均为女性,其中 2 例为子宫内膜癌术后放疗,2 例为宫颈癌术后放疗,1 例为畸胎瘤术后放疗,年龄 ( 60±10 ) 岁,发病时间距初次疾病放疗后时间为 ( 13.6±4.7 ) 年,既往放疗剂量为 45~50 Gy,肿瘤位置 II+III 区 1 例,I+IV 区2 例,I+II+IV 区 1 例,IV 区 1 例,其中 3 例就诊时已合并出现肺转移 ( 表 1 )。
患者临床表现为局部肿块、活动后疼痛、跛行等,早期常常考虑关节炎而未予重视。短期内症状明显加重,局部可及包块,引起关节活动障碍,疼痛加剧无法缓解,患侧惧动。5 例均出现髋关节活动后疼痛症状,呈进行性加重。3 例因活动后疼痛加重、行走障碍就诊,1 例因局部包块疼痛伴排便困难就诊,1 例因体检发现碱性磷酸酶异常增高至1200 U / L 并局部包块就诊。骨盆区放疗后诱导肉瘤 X 线可见骨质破坏伴周围软组织不均匀密度增高影。CT 扫描可见骨盆骨质破坏,局部呈膨胀性改变及高密度骨化团块影,可见骨髓受侵,骨膜反应及骨质破坏,周围软组织肿块形成。( 图 1 ) MRI 检查可见骨质破坏异常信号,T1加权低信号,T2加权呈高信号,可见骨与软组织富血供占位性病变。本研究中 4 例为术后病理提示为放疗后骨肉瘤。骨盆放疗诱导骨肉瘤病理显示提示为放疗后骨肉瘤或软骨肉瘤成分,伴大片坏死 ( 图 2 )。1 例病理为放疗后平滑肌肉瘤。
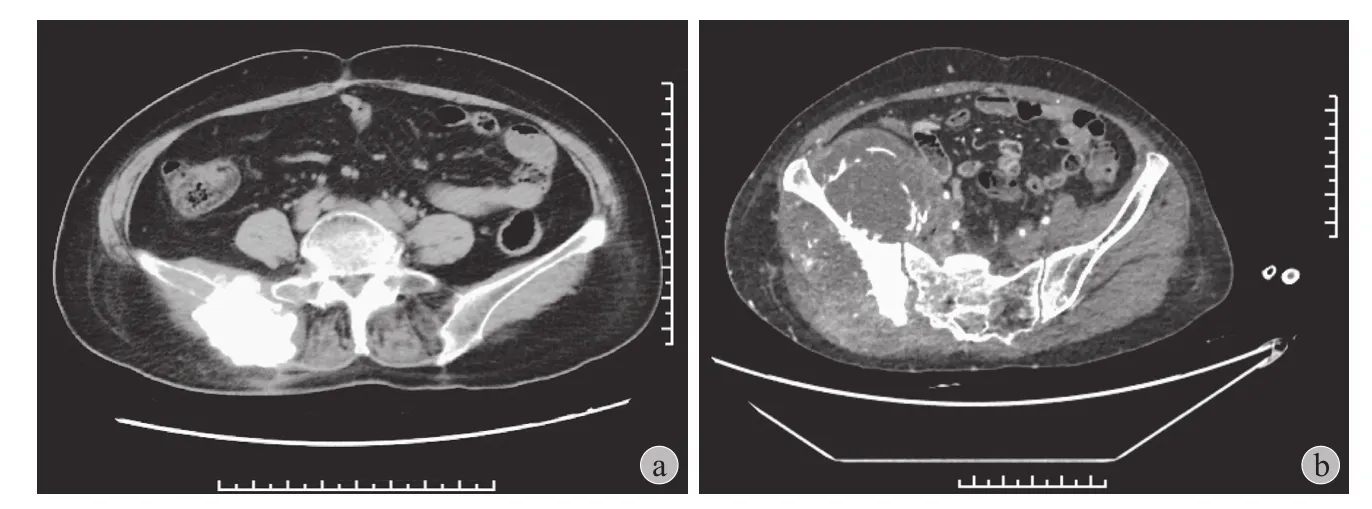
图1 骨盆区放疗后诱导肉瘤 CT 检查a:患者右髂骨成骨性骨质破坏伴周围软组织肿胀;b:患者右侧髂骨巨大软组织占位伴骨髓内密度增高影Fig.1 Axial pelvis CT scan a: Osteogenic bone destruction in the right ilium with signi fi cant swelling of surrounding soft tissues;b: A massive round-like soft tissue mass with mixed density and increased intramedullary density

图2 宫颈癌术后放疗 14 年出现放疗后相关性骨盆骨肉瘤 a:放疗后骨肉瘤病理切片可见肿瘤细胞侵犯宿主骨,周围大范围坏死组织及出血;b:可见异型肿瘤细胞侵犯宿主骨,分泌肿瘤成骨;c:骨肉瘤细胞呈明显异型性,可见多核及瘤巨细胞Fig.2 Pelvic radiation-induced osteosarcoma occurred 14 years after the radiotherapy of cervical cancer a: Osteosarcoma cells invaded the host bone nearby with extensive necrosis and bleeding; b: Atypical tumor cells invaded the host bone and secreted tumor osteoblasts; c: Osteosarcoma cells were atypia, multinucleated tumor and giant cells were showed
三、治疗方式
1 例接受骨盆瘤段切除+肿瘤假体置换术,1 例接受骨盆肿瘤切除+钉棒系统内固定、1 例行骨盆肿瘤切除术,术前均行经皮导管动脉栓塞术( transcatheter arterial embolization,TAE ),该 3 例手术中出血平均 4500 ml,手术创伤大,术后恢复较慢,其中 1 例术后接受 AP 方案、IFO 方案化疗1 次。1 例未行手术治疗,LADM 方案化疗 3 次。1 例行局部肿块切除术。
四、随访及预后
4 例术后局部症状均有所缓解,2 例可下地活动,1 例术后出现下肢深静脉血栓。患者术后出现不同程度恶液质,4 例出现肺转移、恶性肿瘤全身转移及多器官功能衰竭死亡,1 例出现重症肺炎,呼吸循环衰竭死亡。随访 3~11 个月,1 年生存率为 0%。
讨 论
BECK 等[8]于 1922 年发表首例与放疗后相关的骨组织恶性病变。至今为止已报道的放疗后诱导肉瘤已达 700 多例,发病率呈逐年递增趋势,这可能与原发肿瘤治疗的进步使接受放疗患者的生存期显著延长有关。但众多临床研究中缺乏针对骨盆区放疗后肉瘤的报道,同时也缺乏骨盆肉瘤与放疗相关性研究。放疗增加了骨与软组织肉瘤的发病风险[9-10],据统计肉瘤中约 1%~3% 与放疗相关[11]。骨盆肉瘤发病率较低,骨盆区放射诱导肉瘤及其罕见,放射诱导肉瘤预后极差,四肢、额面部 5 年生存率为 30%,而骨盆、脊柱的生存率为 0%。
一、发病机制
目前放疗诱导肉瘤的病理学机制仍然不清楚,可能与放疗后引起细胞内分子电离化导致细胞内DNA 破坏。原发肿瘤基因组存在易感因素。经放射治疗后局部细胞 MYC 表达扩增[12],后通过逆病毒启动子插入激活突变细胞瘤基因、染色体易位、基因扩增促进瘤基因活化,诱发正常细胞肿瘤性转化。放疗后诱导肉瘤患者常发现 P53 突变[13],破坏成骨细胞及骨母细胞分化功能、破坏 MSC 基因组稳定性,诱发低分化、高度恶性的肉瘤[14]。最近研究发现放疗后诱导肉瘤发病率可能与放疗剂量有关,当放疗剂量达到 30 Gy 时 RIS 的发生几率明显上升[15],其发病几率与放疗剂量呈正相关[16-17]。上述发现同时可破坏 DNA 损失 / 修复,从而导致恶性程度高于初次肿瘤、生长迅速、转移率高、对放疗不敏感。本研究中所有患者均接收超过 30 Gy 的放疗剂量。
二、发病因素
针对妇科恶性肿瘤的放疗可引起骨盆区放疗后诱导肉瘤。子宫内膜癌、子宫颈癌、卵巢癌是妇科三大恶性肿瘤,依据手术病理分期及复发高位因素选择术后放疗,ASTRO 发布的诊疗指南中建议超过 50% 肌层浸润的 1 级、2 级及未超过 50% 肌层的3 级肿瘤子宫内膜癌建议术后放疗[18]。NCCN 推荐FIGO 分期 IB2 及 IIA2 期以上子宫颈癌患者接受放疗。本研究共 4 例因妇科恶性肿瘤接受放疗,1 例因恶性畸胎瘤术后接受放疗[19]。
三、临床表现
最常见的骨盆区诱导肉瘤的临床表现为疼痛、功能障碍及局部肿块,依据肿瘤位置及生长方式临床表现不尽相同。骨盆肉瘤没有特异性症状及体征,常常伴有巨大局部肿块[20]。转移性骨盆肿瘤常常以疼痛为常见症状,与原发肿瘤的性质也有相关[21]。本研究中 3 例表现为疼痛及活动障碍,2 例表现为局部包块。骨盆放疗诱导肉瘤的影像学表现可见边缘不规则、界限不清的骨质破坏,以硬化性占位性病变多见,其与放射性骨坏死继发骨髓炎的影像学表现相似,广泛性骨质增生硬化较常见,骶髂关节间隙不规则,出现软组织肿块及骨质破坏,可出现病理性骨折,同时可见邻近软组织钙化常见,与软组织经放射损伤引起的纤维病变有关,是与放疗相关的另一严重并发症[22]。本研究 3 例影像学检查表现为成骨性骨质破坏伴软组织肿块,2 例以软组织肿块伴髓腔高密度影为突出表现。
四、诊断标准
因放疗后诱导骨肉瘤罕见,且该病常见老年患者,既往肿瘤病史,诊断时易考虑转移性骨肿瘤。但以下情况应注意警惕:( 1 ) 有放疗病史;( 2 ) 新生肿瘤位于骨盆放疗部位;( 3 ) 新发肿瘤病理与原肿瘤病理不同;( 4 ) 距初次肿瘤放疗后时间间隔较长[5,23-24]。病理活检发现“梭形细胞恶性肿瘤”,应考虑放疗后诱导肉瘤。本研究 5 例就诊时均首先考虑为“转移性肿瘤”,经完善病史、临床表现、影像学检查、病理检查后,符合放疗后诱导肉瘤诊断。
五、转移情况
以往骨盆骨肉瘤的临床观察研究发现,中位生存期为 56 个月,33% 患者出现原位复发,经手术及化疗,5 年生存率可达 67%[25]。而>60 岁的老年骨肉瘤患者,1 年生存率 67.8%,3 年生存率 35.7%,且手术联合放化疗能有效提高生存率[26]。与之相比较,放疗后肉瘤预后极差,头颈部放疗后诱导肉瘤患者随访,其中 22.8% 原位复发,4.7% 出现远处转移,1 年总生存率 ( OS ) 为 47.6%,2 年总生存率为 35.7%[27]。既往报道四肢、脊柱放疗后肉瘤患者中,2 年总生存率仅为 30.7%,其中 15.3% 出现远处转移[6-7]。本研究 5 例中 4 例出现肺转移,进展迅速( 图 3 ),经化疗及辅助化疗亦未能有效提高生存时间,1 年总生存率为 0%。
六、治疗方案
既往研究发现,放疗诱导骨肉瘤采取积极手术治疗,以安全边界为目的的瘤段切除配合辅助化疗能有效提高生存率[28-29],但对于肿瘤病灶无法完整切除及已发生远处转移的患者,生存率则明显下降。本研究中 3 例接受手术治疗,术前均行经皮导管血管造影 ( DSA ) 及栓塞术 ( TAE ),术中平均出血仍达 4500 ml,2 例接受术后辅助化疗,分别随访5 个月、11 个月死亡。
1. 化疗:骨盆放疗后诱导肉瘤多为高龄患者,体质较差。在以往的临床研究中发现与青年患者相比较,老年高龄患者接受新辅助化疗、术后化疗并未有效提高生存率[30-31],可能由诸多因素造成:( 1 )高龄患者因药代动力学变化影响化疗药物无法达到治疗需要的药物剂量浓度,而化疗副反应在高龄患者中表现更为突出;( 2 ) 各诊疗中心在治疗高龄患者时,提供不同药物、不同剂量、不同血药浓度的化疗方案,造成数据偏移,无法准确评估化疗有效性;( 3 ) 因高龄患者体质较差,常常合并其它系统、器官的疾病,无法耐受化疗引起的一系列并发症而避免使用灌续高剂量冲击治疗方案,影响化疗效果。老年骨盆骨肉瘤患者化疗联合放疗后,生存时间仅 10 个月[32]。因此在骨盆放疗后肉瘤患者的化疗应根据病情制订有效的个体化化疗方案,适当选用不良反应较小的化疗药物,如新型脂质体阿霉素等,但具体用药剂量及给药方案需进一步研究。
2. 手术治疗:老年骨肉瘤患者治疗原则一般不主张积极的术前化疗及术后辅助化疗[33],结合前节所述,老年骨肉瘤常常以手术治疗为首次治疗方式[26]。手术方式依据患者的个体情况,予瘤段切除、截肢、骨盆离断及局部切除。以往报道中放疗相关肉瘤转移瘤达 60%~76%[6,34],骨盆区放疗后诱导肉瘤起病隐匿,恶性程度较高,进展迅速,肿瘤血供丰富,转移率高,就诊时往往已出现肺部转移灶,手术采取优先保证患者肢体功能的姑息性肿瘤切除,满足条件的患者应行 R0 切除,以最大限度改善患者局部压迫症状、提高生活质量。本研究 4 例手术患者术后局部症状均有不同程度缓解,2 例可下地活动,1 例可坐轮椅,1 例术后出现下肢深静脉血栓卧床制动。患者术后短期生活质量得到提高。
骨盆区放疗后诱导肉瘤进展迅速,肿瘤病灶血供丰富,术中出血较多,常伴远处转移,疾病进展迅速,标准化化疗未显著提高生存率,出现转移后积极手术治疗亦无法改善预后且增加患者身体负担,建议采取姑息性手术、制订个体化辅助化疗,以改善患者生活质量。
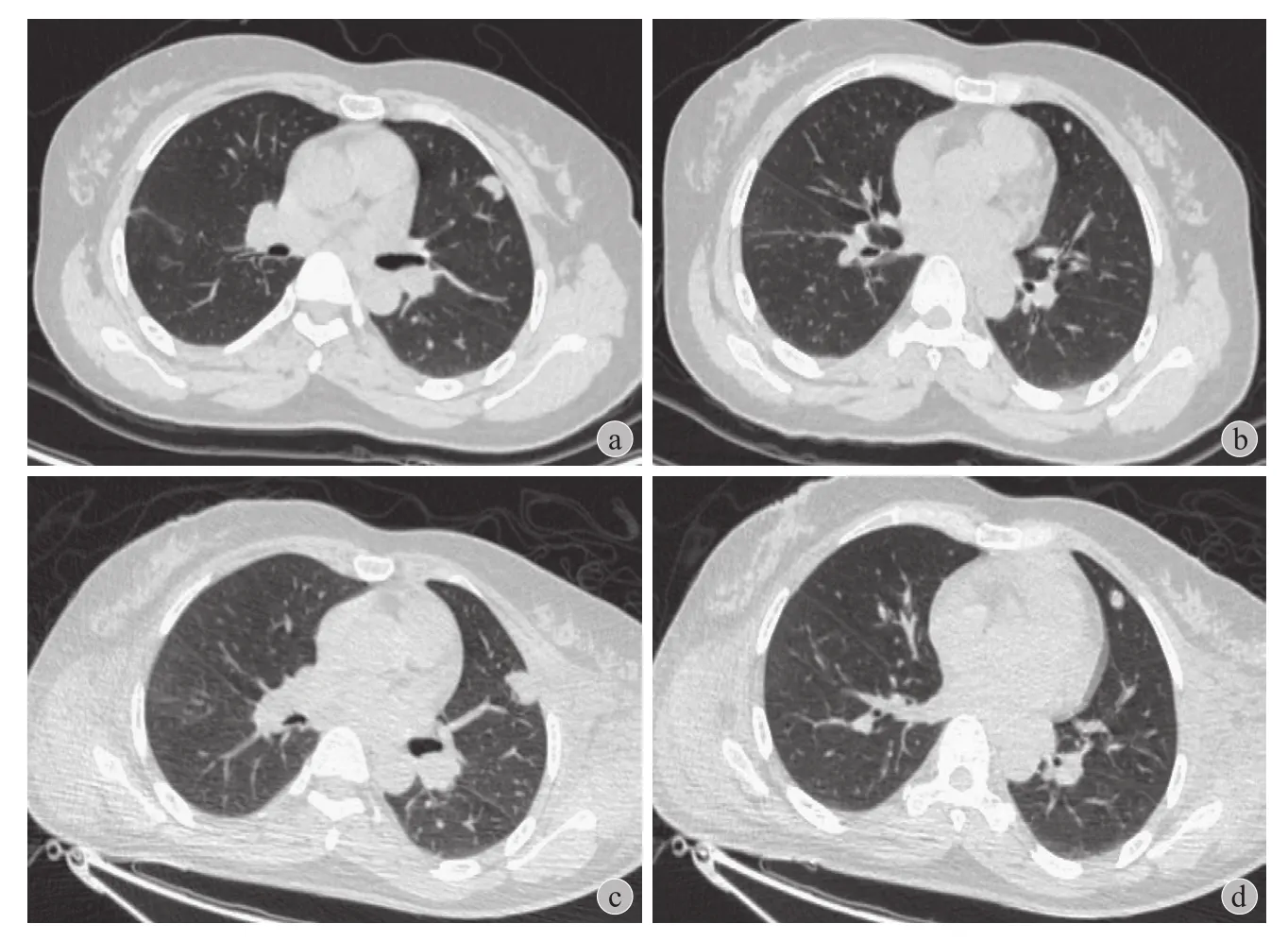
图3 骨盆放疗后诱导肉瘤肺转移患者,术前 ( a、b )、术后 2 周 ( c、d ) 肺部 CT对比,2 周内肺部转移瘤进展迅速 ( a →c、b → d )Fig.3 A pelvic radiation-induced sarcoma patient with lung metastases. Lung metastases( pre-operation: a, b; 2 weeks postoperation: c, d ) Lung metastases was rapidly progressing inonly 2 weeks ( a → c, b → d )
骨盆放疗诱导肉瘤恶性程度高、血供丰富、患者一般情况较差、转移率高、预后差,治疗原则可参考转移性骨盆肿瘤、手术、化疗以姑息治疗为主。随着诊疗技术的发展,骨盆恶性肿瘤患者接受放疗及其它治疗后,患者生存时间显著延长,由此放疗后诱导肉瘤发病率呈逐年上升趋势。针对骨盆放疗后诱导肉瘤,需要更有效的处理手段,比如靶向药物、免疫治疗方面研究,以进一步提高生存率及生活质量。
[1] Sholl LM, Barletta JA, Hornick JL. Radiation-associated neoplasia: clinical, pathological and genomic correlates[J].Histopathology, 2017, 70(1):70-80.
[2] des Guetz G, Chapelier A, Mosseri V, et al. Postirradiation sarcoma: clinicopathologic features and role of chemotherapy in the treatment strategy[J]. Sarcoma, 2009, 2009:764379.
[3] Mark RJ, Poen J, Tran LM, et al. Postirradiation sarcomas. A single-institution study and review of the literature[J]. Cancer,1994, 73(10):2653-2662.
[4] Weatherby RP, Dahlin DC, Ivins JC. Postradiation sarcoma of bone: review of 78 Mayo Clinic cases[J]. Mayo Clin Proc,1981, 56(5):294-306.
[5] Virtanen A, Pukkala E, Auvinen A. Incidence of bone and soft tissue sarcoma after radiotherapy: a cohort study of 295,712 Finnish cancer patients[J]. Int J Cancer, 2006, 118(4):1017-1021.
[6] 顾宇彤, 肖建如, 贾连顺, 等. 放疗后脊柱肉瘤的临床特点及治疗方法[J]. 脊柱外科杂志, 2004, 2(4):202-204.
[7] 丁易, 杨发军, 牛晓辉. 放疗后肉瘤的临床特点分析[J]. 山东医药, 2011, 51(36):32-33.
[8] Beck A. Zur frage des rontgensarcoms, zugleich ein beitrag zur patholgenese des sarcoms[J]. Munchen Med Wschr, 1922,69:623-625.
[9] Penel N, Grosjean J, Robin YM, et al. Frequency of certain established risk factors in soft tissue sarcomas in adults: a prospective descriptive study of 658 cases[J]. Sarcoma, 2008,2008:459386.
[10] Lagrange JL, Ramaioli A, Chateau MC, et al. Sarcoma after radiation therapy: retrospective multiinstitutional study of 80 histologically confirmed cases. Radiation therapist and pathologist groups of the fédération nationale des centres de lutte contre le cancer[J]. Radiology, 2000, 216(1):197-205.
[11] Su KK, Chang JH, Noorie C, et al. Radiation-induced sarcoma:a 15-year experience in a single large tertiary referral center[J].Cancer Res Treat, 2016, 48(2):650-657.
[12] Mentzel T, Schildhaus HU, Palmedo G, et al. Postradiation cutaneous angiosarcoma after treatment of breast carcinoma is characterized by MYC ampli fi cation in contrast to atypical vascular lesions after radiotherapy and control cases:clinicopathological, immunohistochemical and molecular analysis of 66 cases[J]. Mod Pathol, 2012, 25(1):75-85.
[13] Nakanishi H, Tomita Y, Myoui A, et al. Mutation of the p53 gene in postradiation sarcoma[J]. Lab Invest, 1998, 78(6):727-733.
[14] Velletri T, Xie N, Wang Y, et al. P53 functional abnormality in mesenchymal stem cells promotes osteosarcoma development[J]. Cell Death Dis, 2016, 7:e2015.
[15] Chabchoub I, Gharbi O, Remadi S, et al. Postirradiation osteosarcoma of the maxilla: a case report and current review of literature[J]. J Oncol, 2009, 2009:876138.
[16] Kalra S, Grimer RJ, Spooner D, et al. Radiation-induced sarcomas of bone: factors that affect outcome[J]. J Bone Joint Surg Br, 2007, 89(6):808-813.
[17] Wu LC, Kleinerman RA, Curtis RE, et al. Patterns of bone sarcomas as a second malignancy in relation to radiotherapy in adulthood and histologic type[J]. Cancer Epidemiol Biomarkers Prev, 2012, 21(11):1993-1999.
[18] Meyer LA, Bohlke K, Powell MA, et al. Postoperative radiation therapy for endometrial cancer: american society of clinical oncology clinical practice guideline endorsement of the american society for radiation oncology evidence-based guideline[J]. J Clin Oncol, 2015, 33(26):2908-2913.
[19] Cervial Cancer[Z]. NCCN Clincal Practice Guidelines in Oncology, 2016.
[20] Guo W, Sun X, Ji T, et al. Outcome of surgical treatment of pelvic osteosarcoma[J]. J Surg Oncol, 2012, 106(4):406-410.
[21] Wang C, Chen Z, Sun W et al. Palliative treatment of pelvic bone tumors using radioiodine (125I) brachytherapy[J]. World J Surg Oncol, 2016, 14(1):294.
[22] 应碧伟, 龚向阳, 钟月芳. 骨盆放射性骨坏死 2 例[J]. 中国临床医学影像杂志, 2000, 11(6):454-455.
[23] Huvos AG, Woodard HQ, Cahan WG, et al. Postradiation osteogenic sarcoma of bone and soft tissues. A clinicopathologic study of 66 patients[J]. Cancer, 1985, 55(6):1244-1255.
[24] Mavrogenis AF, Pala E, Guerra G, et al. Post-radiation sarcomas. Clinical outcome of 52 Patients[J]. J Surg Oncol,2012, 105(6):570-576.
[25] Puri A, Gulia A, Pruthi M. Outcome of surgical resection of pelvic osteosarcoma[J]. Indian J Orthop, 2014, 48(3):273-278.
[26] 王倩荣, 吴晋, 刘文超, 等. 老年骨肉瘤患者的临床特征与预后[J]. 中国骨与关节杂志, 2017, 6(2):92-95.
[27] Zhu W, Hu F, Zhao T, et al. Clinical characteristics of radiationinduced sarcoma of the head and neck: review of 15 cases and 323 cases in the literature[J]. J Oral Maxillofac Surg, 2016,74(2):283-291.
[28] Adachi M, Iwai T, Hirota M, et al. Radiation-induced fibrosarcoma after radiotherapy for osteosarcoma in the mandibular condyle[J]. J Craniofac Surg, 2012, 23(6):e619-621.
[29] Patel AJ, Rao VY, Fox BD, et al. Radiation-induced osteosarcomas of the calvarium and skull base[J]. Cancer, 2011,117(10):2120-2126.
[30] Nishida Y, Isu K, Ueda T, et al. Osteosarcoma in the elderly over 60 years: a multicenter study by the Japanese Musculoskeletal Oncology Group[J]. J Surg Oncol, 2009,100(1):48-54.
[31] Huvos AG. Osteogenic sarcoma of bones and soft tissues in older persons. A clinicopathologic analysis of 117 patients older than 60 years[J]. Cancer, 2015, 57(7):1442-1449.
[32] 肖砚斌, 许建波, 李凌, 等. 老年性原发骨肉瘤五例报告[J].中国骨与关节杂志, 2005, 4(5):274-277.
[33] 丁宜, 牛晓辉, 丁易, 等. 老年原发性骨肉瘤 12 例临床及病理分析[J]. 中华病理学杂志, 2011, 40(6):373-376.
[34] Li GZ, Fairweather M, Wang J, et al. Cutaneous radiationassociated breast angiosarcoma: radicality of surgery impacts survival[J]. Ann Surg, 2017, 265(4):814-820.

