大鼠撞击性肝挫伤后MMP-2和MMP-9蛋白时序性表达
王昌亮 ,夏志秀 ,张国华 ,尤家斌 ,于 浩 ,王林林 ,张孟周 ,杨洪波 ,谷建平 ,靳彦奎
(1.辽宁省人民检察院,辽宁 沈阳 110032;2.中国医科大学法医学院,辽宁 沈阳 110122;3.中国医科大学附属盛京医院,辽宁 沈阳 110004;4.河北省人民检察院,河北 石家庄 054002;5.最高人民检察院技术信息中心,北京 100144)
肝是人体最大的实质性器官,因位置相对固定,质地脆弱,血运丰富,在交通肇事和暴力事件中非常容易受到撞击而导致损伤破裂。据报道[1-2],肝破裂的死亡率可高达54%。真性肝破裂后较快出现症状与体征,伤者多因急性腹腔内大出血而死亡[3]。有时肝在受到直接或间接外力作用后,实质挫伤,表现为被膜下或实质中央出血,当腹部再次遭受外力作用或其他诱因时,可在数小时至数天后发生迟发性破裂而死亡[4]。法医学鉴定中,明确肝损伤与死亡之间的关系有利于判断案件性质以及对嫌疑人责任的认定,但目前国内外关于钝性外力造成肝挫伤的损伤时间推断研究较少,属于法医学鉴定中的一个难题。
肝损伤后的不同阶段会有诸多生物因子参与其炎症和修复过程,包括生长因子、黏附因子、基质金属蛋白酶(matrix metalloproteinase,MMP)等[5]。 MMP-2和MMP-9是MMP家族中的两个重要成员,存在于包括肝在内的许多器官和组织中,主要功能是降解细胞外基质,在损伤修复过程中发挥重要作用[6]。鉴于已有学者[7-9]将MMP-2和MMP-9作为脑损伤和皮肤损伤时间推断的参考指标,本研究拟通过建立大鼠撞击性肝挫伤模型,运用免疫组织化学和Western印迹法观察肝挫伤后不同时间MMP-2和MMP-9的蛋白表达情况,以期为肝挫伤的损伤时间推断提供一定参考。
1 材料与方法
1.1 主要试剂与仪器
兔抗大鼠MMP-2多克隆抗体(ab110186)、兔抗大鼠MMP-9多克隆抗体(ab38898)和兔抗大鼠GAPDH多克隆抗体(ab9485)均购自英国Abcam公司,辣根酶标记山羊抗兔 IgG(ZB2301)、SP 试剂盒(SP9001)及DAB显色液均购自北京中杉金桥生物技术有限公司。
RM2235石蜡切片机(德国Leica公司),ELx808酶标仪(美国BioTek公司),5500全自动化学发光成像分析系统(上海天能科技有限公司),立体垂直定位打击器(瑞沃德生命科技有限公司)。
1.2 动物分组与及模型建立
健康雄性SD大鼠50只,质量340~360g,随机分为对照组和伤后 1h、3h、6 h、12h、18h、24 h、3 d、5 d、7d组,共10组,每组5只大鼠。
实验组大鼠在禁食12h后,用4%水合氯醛溶液以0.5mL/100g腹腔注射麻醉,将大鼠仰卧于操作台,利用立体垂直定位打击器,参照陆明等[10]大鼠肝撞击模型制作方法,选择质量100g、直径5mm的打击锤,通过定位管从120cm高处垂直落下,撞击大鼠剑突与右侧肋弓夹角处,在损伤后上述时间点处死大鼠。解剖见大鼠肝被膜下血肿或浅表挫裂创,测量损伤区的长轴与短轴,计算损伤面积。提取损伤的肝叶并于挫伤区中心将其纵行分为两部分,一部分用于HE染色和免疫组织化学染色,另一部分剔除损伤周边正常肝组织,仅将挫伤组织经生理盐水清洗后速冻,用于Western印迹法检测。对照组直接提取肝中叶进行相同处理。
1.3 方法
1.3.1 HE染色
将提取的肝组织用4%多聚甲醛溶液固定24 h后,经脱水、透明等程序,制成蜡块,制作5μm厚度切片,进行常规HE染色。
1.3.2 免疫组织化学染色
采用链霉素抗生物素蛋白-过氧化酶连接法(SP法),以兔抗大鼠MMP-2和兔抗大鼠MMP-9多克隆抗体(1∶200)作为一抗,以PBS代替一抗作为阴性对照。DAB显色,显微镜下以胞质、胞膜及细胞间质着黄色或棕黄色为阳性。
1.3.3 Western印迹法
将对照组和伤后各组肝组织经液氮速冻并研磨后,加入裂解液,匀浆后在4℃下,以离心半径6 cm,12000r/min,离心10min,提取上清液。采用BCA法,应用ELx808酶标仪测定蛋白浓度,配制等量蛋白上样缓冲液,经电泳和转印,将蛋白转印到聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,用 8%牛奶封闭2 h,在目的蛋白所在区域分别加入兔抗大鼠MMP-2 和兔抗大鼠 MMP-9 多克隆抗体(1∶1000),4℃过夜,经山羊抗兔辣根酶标记二抗(1∶5000)孵育2h,以上各步骤间均用TBST洗膜5 min×3次,滴加发光液。在5500全自动化学发光成像分析系统发光显色,同时以 GAPDH(1∶5000)作为内参。
1.4 统计学处理
免疫组织化学染色图像于400倍显微镜下,在每张切片挫伤区随机选取5个测量视野,利用Image-Pro Plus 6.0软件计算阳性细胞率,并用GraphPad Prism 5.0软件分析,以±s表示。
Western印迹法中利用Image J软件计算MMP-2、MMP-9和 GAPDH的灰度值,分别将MMP-2和MMP-9与对应GAPDH灰度值的比值作为目的蛋白的相对表达量,用GraphPad Prism 5.0软件分析,以±s表示。
采用单因素方差分析和Bonferroni法对伤后各组与对照组之间以及各组与相邻上组之间数据进行两两分析比较,检验水准α=0.05。
2 结 果
2.1 肝挫伤的病理学改变
解剖各组大鼠,见挫伤多在肝中叶中下部,损伤面积为 0.45~0.82cm2。伤后 1~6h,见挫伤区被膜下血肿,切面出血;伤后12~24h,挫伤区表面及切面均呈乳白色;伤后3~7 d,损伤区表面及切面呈白色,切面质地由脆逐渐转韧。
HE染色见伤后1~6 h以出血、血肿为主;伤后12 h~3 d挫伤区红细胞逐渐被吸收,肝细胞坏死,细胞核碎裂,可见大量以中性粒细胞为主的炎症细胞浸润,其中含少量巨噬细胞和嗜酸性粒细胞;伤后5~7d挫伤区被纤维组织替代,出现大量成纤维细胞,同时出现许多新生的小胆管和小血管。
2.2 免疫组织化学染色结果
2.2.1 MMP-2的表达情况
对照组MMP-2主要在血管内皮及其周围肝细胞内表达;伤后1~3 h挫伤区边缘散在出现MMP-2阳性细胞;伤后6 h阳性细胞数量增加;伤后12 h挫伤区内表达明显增强,并可见少量胞质浓染的单核细胞;伤后18~24 h达到高峰,挫伤区内阳性表达呈弥漫性分布,部分中性粒细胞胞质内也有表达;伤后3 d,MMP-2表达减弱,挫伤区边缘肝细胞表达较强,部分成纤维细胞胞质内弱表达;伤后5d阳性表达明显减少,仅在新生区域部分肝细胞内表达;伤后7 d,MMP-2仅在新生区域部分窦内皮和少数肝细胞内表达(图 1)。
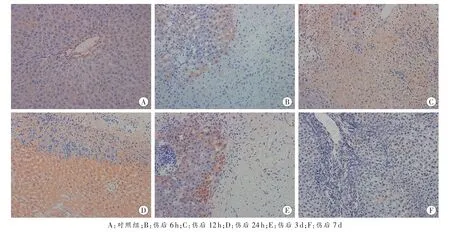
图1 MMP-2免疫组织化学染色结果 SP×200
除伤后1 h和7 d组阳性细胞率与对照组比较,差异无统计学意义(P>0.05)外,其余伤后各组与对照组比较,差异均具有统计学意义(P<0.05);伤后 6 h~7d各组与相邻上组比较,差异均具有统计学意义(P<0.05,表 1)。
2.2.2 MMP-9的表达情况
对照组MMP-9主要在中央静脉周围肝细胞和库普弗细胞表达;伤后1~3h挫伤区及周边肝细胞和肝窦内MMP-9表达开始增强,在部分中性粒细胞内开始表达;伤后6~12h挫伤区表达明显增强,范围扩大到损伤区外,细胞间隙内出现阳性颗粒;伤后18 h达到高峰,中性粒细胞和肝细胞内均高表达,挫伤区域周边出现大量阳性颗粒;伤后24h相比18h表达略减弱;伤后3d,MMP-9表达减弱,细胞间隙阳性颗粒减少,坏死区域内中性粒细胞、巨噬细胞内均有表达;伤后5~7d,MMP-9主要在挫伤区新生胆管上皮细胞内表达(图 2)。
伤后各组阳性细胞率与对照组比较,差异均具有统计学意义(P<0.05);各组(除 7d 组)与相邻上组比较,差异均具有统计学意义(P<0.05,表 1)。

表1 MMP-2和MMP-9的阳性细胞率比较
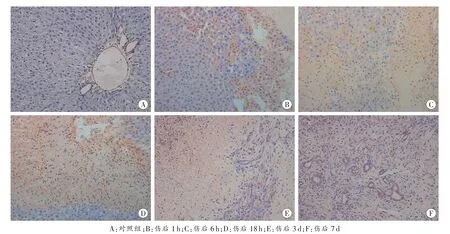
图2 MMP-9免疫组织化学染色结果 SP×200
2.3 Western印迹法检验结果
由表2可见:MMP-2蛋白表达在伤后1~3 h缓慢升高,6~18 h表达逐渐增强,24 h达到峰值,3~5 d表达下降,7 d已接近正常水平;除伤后1 h和7 d组外,其余伤后各组与对照组比较,差异均具有统计学意义(P<0.05);除伤后 18 h组外,损伤 6 h后各组与相邻上组比较,差异均具有统计学意义(P<0.05)。MMP-9蛋白表达在伤后1h即开始明显升高,随时间呈逐渐递增的趋势,18~24 h达到高峰,3~5 d表达回落,7d仍高于正常水平;伤后各组与对照组进行比较,差异均具有统计学意义(P<0.05);除伤后 12 h、24 h组外,各组与相邻上组比较,差异均具有统计学意义(P<0.05)。MMP-2和MMP-9蛋白在对照组和伤后各组均有表达(图3)。
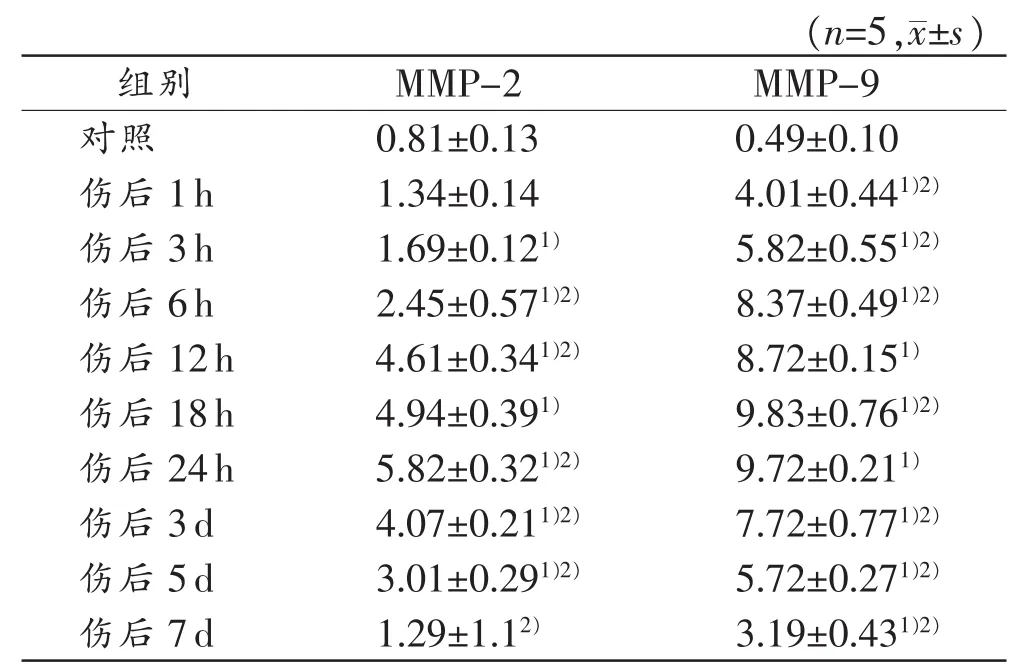
表2 MMP-2和MMP-9蛋白的相对表达量
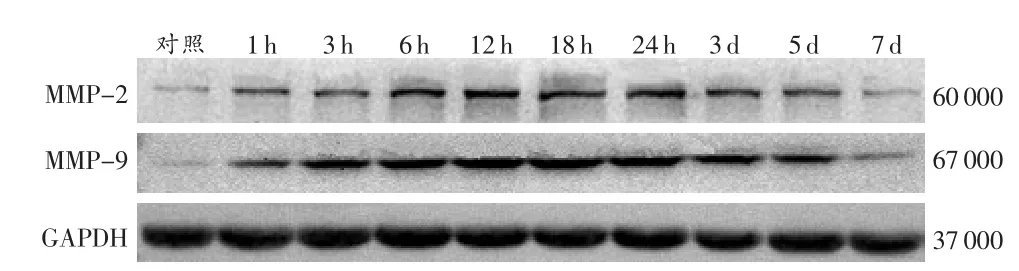
图3 大鼠肝挫伤后MMP-2和MMP-9蛋白表达变化
3 讨 论
MMP是一组Ca2+-Zn2+依赖性内肽酶,以无活性的酶原形式分泌,激活后形成瀑布效应,几乎能降解所有的细胞外基质(extracellular matrix,ECM),在胚胎发育、血管形成、组织修复、细胞脱落及迁移中起着至关重要的作用[11]。目前已发现25种MMP,分为胶原酶、明胶酶、间质溶解酶、基质溶酶和膜型蛋白酶五类[11]。MMP-2和MMP-9又称明胶酶Ⅳ,酶原相对分子质量分别为72000和92000,是MMP家族中的两个重要成员,在脑、心、肝、肺、皮肤及结缔组织等许多器官和组织中不同程度表达,在生理和病理过程中发挥着重要的作用[12]。
杜秋香等[7]报道,MMP-2和MMP-9在正常脑组织中表达量低,脑创伤后,通过丝裂原激活蛋白激酶和(或)氧化应激途径调控升高,在神经元和各种胶质细胞中表达增强。在大鼠脑缺血模型中,MMP-9在缺血24h升高,一直维持到5d,而MMP-2在第5天的缺血组织中表达明显,提示早期MMP-9表达增强与脑缺血损伤有相关性,而MMP-2则可能参与细胞碎片清除[13]。在皮肤的损伤愈合方面,李刚莲等[8]利用大鼠皮肤切创模型观察到MMP-2在伤后0.5~1h损伤区域的中性粒细胞内即表达,且随时间而增强,3d达到高峰,5d在成纤维细胞和血管内皮表达增强,12~14d恢复正常;MMP-9在伤后1h的中性粒细胞内表达,其余时间点的免疫组织化学特点与MMP-2相似。说明两者在皮肤创面修复的不同阶段参与了基底膜溶解、血管形成、坏死组织清除和瘢痕组织重建[9]。
肝损伤后,通过两个信号通路进行修复,一个通路是激酶裂解血浆纤溶蛋白酶原生成血浆纤溶蛋白酶,后者溶解纤溶蛋白,激活包括MMP-9在内的一系列MMP;另一个通路则与膜型基质金属蛋白酶1(membrane type1-matrix metalloproteinase,MT1-MMP)和基质金属蛋白酶组织抑制因子-2(tissue inhibitors of matrix metalloproteinase-2,TIMP-2)协同激活 MMP-2[14]。肝组织中MMP-2和MMP-9主要由星状细胞和库普弗细胞分泌,与TIMP共同维持ECM的降解与沉积的平衡[15]。KIM等[6]利用部分肝切除大鼠模型,观察到肝组织内MMP-2和MMP-9分别在术后6~12h和3~6h激活,在24 h和18 h达到高峰,可持续48~72h,通过降解ECM促进肝细胞增殖,对肝损伤早期修复过程起主要作用。
目前,国内外对肝损伤的研究多限于化学性肝损伤的机制和肝伤后的治疗。本研究借鉴MMP-2和MMP-9的生物学特性及其在脑和皮肤损伤修复过程中呈时间规律表达的特点,利用大鼠撞击性肝挫伤模型观察其蛋白表达情况。综合免疫组织化学和Western印迹法的结果,MMP-2在损伤初期蛋白表达与对照组没有明显区别,仅在挫伤周边有所表达;损伤6 h以后(除18 h组)各邻组之间表达存在一定差异(P<0.05);伤后6~12h开始表达增强,逐渐蔓延至整个损伤区域,中性粒细胞、单核细胞内开始表达,在24 h达到高峰,挫伤区及周边区肝细胞内弥漫性表达,3d时挫伤区的成纤维细胞胞质内开始表达;5~7 d是肝损伤修复的中后期,胶原纤维增生,此时期内MMP-2在新生区域内的肝细胞和肝窦内皮表达。MMP-2的表达特点说明其参与了肝损伤修复各阶段的炎症反应、组织修复以及新生组织的改建与塑形等过程。MMP-9蛋白表达在各邻组之间有较为明显的差异(P<0.05)。在伤后 1h 即表达增高,3~12h 随时间逐渐增强,在18h达到高峰,24h略有下降,各时段挫伤区内除肝细胞、中性粒细胞、巨噬细胞内明显表达外,大量MMP-9阳性颗粒在细胞间隙内弥散分布;在伤后3d,MMP-9表达虽减弱,但在坏死区内的炎症细胞还是高表达;伤后5~7d表达降低,但仍高于对照组,位置主要在新生的胆管上皮。上述特点说明MMP-9发挥作用要早于MMP-2,并且范围更广,持续时间更长,对损伤早期的炎症反应、坏死组织的清除以及对组织再生和胆管重建起到重要作用。MMP-2和MMP-9表达增强的时间有所不同,可能是因为MMP-2的前体激活因子MT1-MMP和TIMP-2以及MMP-9前体激活因子血浆纤溶酶分别是在损伤后6~18h和损伤后30min开始增高有关,而在18~24h后出现下降可能是因为TIMP-1在24~48 h表达增强并抑制了MMP的生物学作用[15]。本研究中MMP-2和MMP-9蛋白在挫伤的肝组织中表达呈现良好的时序性特点,这与KIM等[6]的肝切除大鼠模型中两者表达规律接近,但与脑和皮肤损伤中的表达规律[7-9]相差较大,这可能与组织的特异性以及MMP-2和MMP-9在各个官器和组织中发挥的作用不同所致。
在法医学鉴定实践中,有时会遇到如腹部曾遭受撞击或暴力打击,数小时或数天后出现迟发性肝破裂死亡的案例,也有短期内腹部受到两次甚至两次以上外力作用而出现肝破裂死亡的案例,法医学工作者需要判断外力与肝损伤之间的关系、明确肝损伤的经历时间,有利于案件的侦破和对嫌疑人责任的认定,因此,有必要对此问题进行深入的研究与探讨。本研究采用钝性外力直接撞击造成肝挫伤的模型更贴近人在遭受钝性外力所导致的肝损伤机制,通过免疫组织化学染色和Western印迹法对大鼠肝挫伤组织进行研究,证实了损伤组织内MMP-2和MMP-9的蛋白表达呈一定的时间规律性,有望为肝挫伤的时间推断提供重要的参考指标。
[1]SEKI S,IWAMOTO H.Disruptive forces for swine heart, liver, and spleen: their breaking stresses[J].J Trauma,1998,45(6):1079-1083.
[2]SLOTTA J E, JUSTINGER C,KOLLMAR O,et al.Liver injury following blunt abdominal trauma:a new mechanism-driven classification[J].Surg Today,2014,44(2):241-246.
[3]PARKS R W,CHRYSOS E,DIAMOND T.Management of liver trauma[J].Br J Surg,1999,86(9):1121-1135.
[4]TAFF M L,WOLODZKO A A,BOGLIOLI L R.Sudden death due to delayed rupture of hepatic subcapsular hematoma following blunt abdominal trauma[J].Am J Forensic Med Pathol,1990,11(3):270-274.
[5]DIEHL A M.Cytokine regulation of liver injury and repair[J].Immunol Rev,2000,174:160-171.
[6]KIM T H,MARS W M,STOLZ D B,et al.Expression and activation of pro-MMP-2 and pro-MMP-9 during rat liver regeneration[J].Hepatology,2000,31(1):75-82.
[7]杜秋香,王英元.MMP-2和MMP-9与脑损伤及其法医学意义[J].中国法医学杂志,2008,23(4):247-250.
[8]李刚莲,刘群英,夏鹏,等.大鼠皮肤MMP-2,MMP-9表达与损伤时间相关性的实验研究[J].重庆医科大学学报,2009,34(6):698-701.
[9]ISHIDA Y,KUNINAKA Y,NOSAKA M,et al.Immunohistochemical analysis on MMP-2 and MMP-9 for wound age determination[J].Int J Legal Med,2015,129(5):1043-1048.
[10]陆明,汤礼军,田伏洲,等.大鼠肝脏撞击伤动物模型的制备及评价[J].创伤外科杂志,2010,12(1):60-63.
[11]袁发焕,李惊子.细胞外基质、基质金属蛋白酶及其抑制因子的研究进展[J].国外医学临床生物化学与检验学分册,2000,21(2):62-65.
[12]PRYSTUPAA, BOGUSZEWSKA-CZUBARAA,BOJARSKA-JUNAK A, et al.Activity of MMP-2,MMP-8 and MMP-9 in serum as a marker of progression of alcoholic liver disease in people from Lublin Region,eastern Poland[J].Ann Agric Environ Med,2015,22(2):325-328.
[13]ROMANIC A M, WHITE R F, ARLETH A J, et al.Matrix metalloproteinase expression increases after cerebral focal ischemia in rats:inhibition of matrix metalloproteinase-9 reduces infarct size[J].Stroke,1998,29(5):1020-1030.
[14]PRÉAUX A M, MALLAT A, NHIEU J T, et al.Matrix metalloproteinase-2 activation in human hepatic fibrosis regulation by cell-matrix interactions[J].Hepatology,1999,30(4):944-950.
[15]邓新宇,李文瑞,孙言伟,等.肝再生[J].世界科技研究与发展,2006,28(6):1-8.

