应用InnoTyper®21试剂盒进行毛干检验
李 甫 ,张 敏 ,王颖希 ,水晶晶 ,彦 萌 ,靳小攀 ,朱晓君
(1.北京市东城区公安司法鉴定中心,北京 100061;2.北京市公安司法鉴定中心,北京 100192;3.北京瑞源文德科技有限公司,北京 100176)
插 入/缺 失 (insertion/deletion,InDel) 多 态 性 是一个或多个碱基的插入、缺失或移位而产生的多态性[1-2]。与传统的第二代遗传标记STR和第三代遗传标记 SNP 相比,InDel具有突变率低(2.3×10-9)[3]、扩增目标片段短[4]、兼容常规毛细管电泳或高通量的自动化分型方法且无阴影带等优点[5-6],可用于降解检材的检验分析等。毛干所含核DNA量少且降解严重,毛干中的黑色素是较强的PCR抑制剂,对毛干的核DNA进行STR分型的难度较大,因而毛干检验一直是DNA检验的难点。InnoTyper®21试剂盒是基于21个短散在重复序列(short interspersed nuclear element,SINE)转座子InDel位点的法医学个体识别试剂盒,可用于降解检材分析。本研究拟采用InnoTyper®21试剂盒对无毛囊毛干进行检验,同时以唾液样本为对照,以探讨InnoTyper®21试剂盒在无毛囊毛干检验中的应用。
1 材料与方法
1.1 样本来源
按照知情同意原则,随机采集8名近半年未染发个体的头顶部毛发及唾液样本(FTA卡),每名个体采集6根含毛囊的头发。
1.2 样本制备及DNA提取
去除头发近毛囊端部分,长度约0.5 cm,剪取近毛囊段毛干2cm,经紫外照射、5%次氯酸钠溶液浸泡20 min、无水乙醇漂洗、UltraPureTM超纯水(美国Life Technologies公司)清洗晾干后,置于1.5mL的微量离心管内;唾液样本(FTA卡)直接剪取少量变色部分置于1.5mL的微量离心管内。在微量离心管中加入210μL PrepFiler®BTA裂解液(美国Thermo Fisher Scientific公司)、7 μL 蛋白酶 K(20 mg/mL)和 3 μL DTT,56 ℃加热并振荡消化2h后,用AutoMate ExpressTM自动化法医DNA提取系统(美国AB公司)进行DNA提取。
1.3 PCR扩增
分别采用InnoTyper®21试剂盒(美国InnoGenomics公司)和 AmpFℓSTRTMIdentifilerTMPlus试剂盒(美国AB公司)在9700型PCR仪(美国AB公司)上对模板DNA进行STR复合扩增,反应体系及反应参数均按试剂盒说明书进行。其中,采用InnoTyper®21试剂盒进行PCR扩增时,无毛囊毛干样本中加入16μL模板DNA,唾液样本中加入1μL模板DNA。每份毛干样本平行扩增3次,相对荧光单位(relative fluorescence unit,RFU)值大于100且相同分型出现2次及以上算作一个完整分型。
1.4 电泳分离检测与结果分析
扩增产物采用3500xl基因分析仪(美国AB公司)进行毛细管电泳,电泳参数设置参照说明书。使用GeneMarker®HID软件对结果进行分析。
2 结 果
InnoTyper®21试剂盒与AmpFℓSTRTMIdentifilerTMPlus试剂盒对毛干样本扩增位点检出数见表1,其中InnoTyper®21试剂盒检出的毛干分型与唾液样本相应位点的分型结果一致。

表1 InnoTyper®21试剂盒与AmpFℓSTRTMIdentifilerTMPlus试剂盒扩增位点检出数 (个)
以2号样本为例,采用InnoTyper®21试剂盒扩增:唾液样本的分型图谱清晰、准确,未见等位基因缺失、非特异性扩增产物及双峰现象,位点间峰高平衡性较好(图1A);无毛囊毛干的分型图谱峰值为57~1219RFU,有时可见等位基因缺失,位点间峰高平衡欠佳(图1B);毛干的分型与唾液样本结果一致。
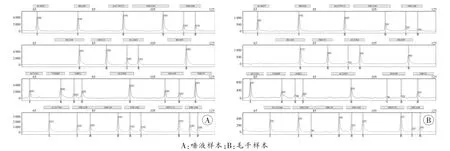
图1 2号样本采用InnoTyper®21试剂盒的分型结果
AmpFℓSTRTMIdentifilerTMPlus试剂盒对唾液样本的分型图谱清晰、准确,未见等位基因缺失、非特异性扩增产物及双峰现象,位点间峰高平衡性较好,但是无毛囊毛干未扩增出可用于同一认定的特异性片段。
3 讨 论
Alu家族是灵长类基因组内最具特征性的SINE[7]。人Alu元件由两个不完全对称的单体组成,总长度约300 bp,在170 bp左右有一个限制性内切酶AluⅠ的酶切位点[8]。Alu是人类最活跃的遗传元件之一,从灵长类动物进化的早期开始,Alu元件通过逆转录转座机制在基因组内快速扩增,目前在单倍体基因组中重复高达100万次,约占整个基因组的10%以上[9-11]。在法医DNA应用早期,Alu序列InDel位点曾经作为遗传标记被用于检验鉴定,但受限于其二等位基因的特性,很快被多态性更高的STR标记所取代[12]。随着技术的进步,Alu多态性因其更短的扩增片段长度和可应用于现有毛细管电泳检测平台等特点,很可能成为STR标记的有益补充。以往法医DNA鉴定中应用的InDel位点多为2~15个碱基的插入和(或)缺失,Investigator®DIPplex试剂盒(德国QIAGEN公司)就是同时扩增30个此种InDel位点的商品化试剂盒,其扩增片段长度约为160bp。InnoTyper®21试剂盒则是基于21个Alu和SINE转座子InDel位点的法医学个体识别试剂盒,研究人员将其称之为INNUL位点[7]。
LARUE等[7]选用一条未经荧光标记的上游引物和两条经过荧光标记的下游引物对InDel位点的插入和(或)缺失两种等位基因进行扩增,其中一条荧光标记的下游引物可与缺失型等位基因的转座插入点两侧片段特异性结合,而另一条荧光标记的下游引物则可与插入型等位基因转座插入片段5′端结合点两侧片段特异性结合。得益于这种巧妙的引物设计,INNUL位点的插入和缺失两种等位基因扩增片段长度可以被设计为仅相差1bp,而且由于复合扩增时下游两条引物可被标记上不同的荧光,所以相同片段长度的扩增产物也能被不同的荧光颜色加以区分。这种设计还使包含转座原件的插入型等位基因扩增片段长度较之以往大大缩短为60~125 bp(以往扩增片段多包含整个转座原件),加之与现有毛细管电泳平台兼容的特性,使其不仅可应用于法医学降解及疑难生物检材的检验,而且可提高降解生物检材的检验成功率。
法医学现场生物检材经常暴露于各种复杂环境之中,受到温度、湿度、阳光紫外照射、土壤细菌分解等化学及生物学的作用,细胞中的长链DNA会被降解成小片段。骨骼、牙齿、无毛囊毛干、降解检材等也因DNA含量低,不易进行STR检验。不含毛囊的毛干,因其细胞已角质化,细胞核消失,导致其中的核DNA严重降解,含量低,而毛干中又含有强烈的PCR抑制剂,严重影响PCR扩增效率,使得毛干的核DNA检验十分困难,常用试剂盒无法成功分型。关于毛干核DNA的含量,文献报道不一致。KALBE等[13]认为自然脱落的毛发及毛干含有一定量的核DNA,大多位于毛发的表皮层;HEYWOOD等[14]对毛干DNA进行了定量分析,近根部含量为(1.3±0.8)ng/mg,远根部含量为(0.3±0.6)ng/mg。不同个体毛干中的DNA含量存在差异,凃政等[15]认为年龄在35岁以下相比35岁以上的STR检出成功率高,提示毛干中的DNA含量与个体生长、代谢状况有关,可能儿童的毛干中DNA含量更高,需进一步研究。当前基层实验室对无毛囊毛干未开展常规检验,对重点检材常规STR检验无结果时会将检材送至相关科研单位进行其他检验。李彩霞等[16]报道的48个SNP位点复合分型体系、HID-Ion AmpliSeqTMIdentity Panel(美国 Thermo Fisher Scientific公司)的120个SNP位点复合分型体系(平均扩增片段长度 137 bp)、ForenSeq DNA Signature Prep试剂盒(美国Illumina公司)的94个个体识别SNP位点(扩增片段长度63~231 bp),均可有效提高降解及疑难检材的检验能力。但因其所采用的仪器设备还未普及,无法与现有大多数实验室拥有的毛细管电泳检测平台相兼容,所以无法快速应用于法医物证学一线实践。
InnoTyper®21试剂盒可以同时扩增21个个体识别InDel位点,研究[7]表明,该组位点在亚裔美国人、非裔美国人、高加索人3个人群中的随机匹配概率分别为 2.64×10-7、2.52×10-8、1.94×10-8。本研究使用InnoTyper®21试剂盒对8名个体的无毛囊毛干和唾液样本同时进行检测,2、3、4、5、7、8 号样本得到了较好的实验结果,1、6号样本结果欠佳。本研究采用多次平行扩增,通过叠加比较减少了随机带来的多带、丢带和非特异性峰的影响,降低了实验结果的检出率,提高了实验结果的可信度。另外,用AmpFℓSTRTMIdentifilerTMPlus试剂盒未检出可进行同一认定的特异性片段,说明InnoTyper®21试剂盒对毛干等检材的检验具有一定优势。然而,由于本实验样本量较小,该试剂盒能否应用到实际检案中进行同一认定,还需要通过更大样本量的实验进行研究。
InnoTyper®21试剂盒的应用也有局限性,由于缺乏群体数据,当未知名尸骨用该试剂盒检出分型而常规STR检验无结果时,无法在全国公安DNA数据库中进行比对,只能通过与高度怀疑为个体生前使用的物品或亲缘样本进行比对。而且InnoTyper®21试剂盒因其二等位基因特性,要达到与现有STR试剂盒相同的个体识别系统效能,须联合使用更多的位点。在二代测序技术还未广泛应用于法医物证学检验的现阶段,InnoTyper®21试剂盒由于扩增片段短,对于常规STR无法获得完整分型的降解检材,InDel遗传标记往往可以获得完整分型,在降解及疑难检材尤其在复杂亲缘关系鉴定及大规模群体灾难性事件的个体识别中有一定应用价值,但尚需在以后的实践工作中进一步完善。
[1]秦翠娇,迪力夏提·塔什,贾竟,等.30个InDels在中国三个民族的遗传学调查及法医学应用[J].中国法医学杂志,2014,29(4):299-303.
[2]WEBER J L,DAVID D,HEIL J,et al.Human diallelic insertion/deletion polymorphisms[J].Am J Hum Genet,2002,71(4):854-862.
[3]NACHMAN M W,CROWELL S L.Estimate of the mutation rate per nucleotide in humans[J].Genetics,2000,156(1):297-304.
[4]MILLS R E, LUTTIG C T, LARKINS C E, et al.An initial map of insertion and deletion (INDEL)variation in the human genome[J].Genome Res,2006,16(9):1182-1190.
[5]DA COSTA FRANCEZ P A,RODRIGUES E M,DE VELASCO A M,et al.Insertion-deletion polymorphisms--utilization on forensic analysis[J].Int J Legal Med,2012,126(4):491-496.
[6]YANG N,LI H,CRISWELL L A,et al.Examination of ancestry and ethnic affiliation using highly informativediallelicDNA markers: application to diverse and admixed populations and implications for clinical epidemiology and forensic medicine[J].Hum Genet,2005,118(3-4):382-392.
[7]LARUE B L,SINHA S K,MONTGOMERY A H,et al.INNULs:A novel design amplification strategy for retrotransposable elements for studying population variation[J].Hum Hered,2012,74(1):27-35.
[8]COMEAUX M S,ROY-ENGEL A M,HEDGES D J,et al.Diverse cis factors controlling Alu retrotransposition:what causes Alu elements to die?[J].Genome Res,2009,19(4):545-555.
[9]BENNETT E A,KELLER H,MILLS R E,et al.Active Alu retrotransposons in the human genome[J].Genome Res,2008,18(12):1875-1883.
[10]CORDAUX R,HEDGES D J,HERKE S W,et al.Estimating the retrotransposition rate of human Alu elements[J].Gene,2006,373:134-137.
[11]WANG J, SONG L, GONDER M K, et al.Whole genome computational comparative genomics:A fruitful approach for ascertaining Alu insertion polymorphisms[J].Gene,2006,365:11-20.
[12]SINHA S,MURPHY G,BROWN H,et al.Retrotransposable elements: Noveland sensitive DNA markers and their application in human identity[J].Forensic Science International:Genetics Supplement Series,2015,5:e627-e629.
[13]KALBE J, KUROPKA R, MEYER-STORK L S, et al.Isolation and characterization of high-molecular mass DNA from hair shafts[J].Biol Chem Hoppe Seyler,1988,369(5):413-416.
[14]HEYWOOD D M,SKINNER R,CORNWELL P A.Analysis of DNA in hair fibers[J].J Cosmet Sci,2003,54(1):21-27.
[15]凃政,陈松,李万水,等.脱落毛发及毛干DNA的STR分型研究[J].刑事技术,2011(5):3-7.
[16]李彩霞,于子辉,贾竟,等.法医SNP复合检测体系的构建及应用[J].中国法医学杂志,2012,27(3):193-196,200.

