新疆伊犁地区赤霞珠葡萄成熟过程中花色苷组成及含量变化研究
张珍珍,邓玉杰,陈新军,卢丕超,刘汝婧,古丽娜孜,袁浩
(1.新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830052)(2.新疆中信国安葡萄酒业有限公司,新疆玛纳斯 832200)
花色苷是红葡萄果实中重要的一种类黄酮物质,主要位于葡萄果皮细胞的液泡中,它能赋予葡萄果实和葡萄酒红色色调,对葡萄酒的感官品质有重要影响。花色苷还可与其它物质(如单宁)化合,从而影响葡萄酒的口感[1,2]。欧亚种葡萄与葡萄酒中的花色苷主要是包括花青素(矢车菊色素,Cyanidin)(Orange-red)、花翠素(飞燕草色素,Delphinidin)、甲基花青素(芍药色素,Peonidin)、3’-甲基花翠素(牵牛花色素,Petunidin)、和二甲花翠素(锦葵色素,Malvidin)在内的5种花色素的单糖苷,及其乙酰化、对香豆酰化、咖啡酰化单糖苷衍生物[3,4]。
花色苷是一类具有类黄酮骨架的色素物质,通过对其骨架结构的修饰可以增强其稳定性。这些修饰包括糖苷化、甲基化和酰化。天然存在的花色苷基本上都以糖苷化的形式存在,连有一个或多个糖基[5]。糖苷化修饰是花色素的一种重要的修饰反应,它可以在很大程度上增强花色苷的亲水性和稳定性,糖苷化修饰对后面的酰基化修饰也具有很关键的作用[6]。花色苷的颜色与花色苷B-环上取代基数目有很大关系,B-环上取代基数目越多,花色苷越偏向于蓝色色调。花色苷 B-环的 3’和 5’位甲基化取代可使花色苷的最大吸收波长变大[7~9]。甲基化修饰也是类黄酮类物质常见的一种修饰反应,大多数(90%)研究报道的已经鉴定结构的花色苷都是基于6种基本花色苷结构(花葵素-3-O-葡萄糖苷、花青素-3-O-葡萄糖苷、花翠素-3-O-葡萄糖苷、3’-甲基花青素-3-O-葡萄糖苷、3’-甲基花翠素-3-O-葡萄糖苷和 3’5’-二甲基花翠素-3-O-葡萄糖苷),3种甲基化花色苷3’-甲基花青素-3-O-葡萄糖苷、3’-甲基花翠素-3-O-葡萄糖苷和 3’5’-二甲基花翠素-3-O-葡萄糖苷占研究报道的花色苷的20%以上。在葡萄果实中,B-环甲基化修饰的花色苷占其总花色苷的75%左右。在大多数植物中花色苷都以酰基化形式存在,花色苷的酰基化修饰主要有两种类型:脂肪族酰化和芳香族酰化[10~12]。在葡萄中,大约有30%的花色苷分别以其乙酰化、香豆酰化和咖啡酰化形式存在,也有极少量以阿魏酰化形式存在[13~15]。
新疆葡萄酒普遍存在酿酒时颜色较好,但褪色快的情况,而花色苷是呈色的主要决定物质,因此,花色苷是决定酿酒葡萄及葡萄酒颜色的主要物质,而酿酒葡萄果实的花色苷除了受自身基因型的影响外,葡萄中花色苷类物质的构成及含量也会受地域、栽培条件、气候条件和成熟度等多种因素的影响[16~21]。
本实验以伊犁产区的酿酒葡萄赤霞珠果实为原料,采用液相色谱-质谱(HPLC-MS)联用检测分析葡萄成熟发育过程葡萄中不同类型花色苷成熟过程中的变化规律,研究结果的完成可以为今后更深入地认识环境因素如何影响葡萄果实中花色苷不同类型的修饰提供一些依据。
1 材料与方法
1.1 材料与试剂
以伊犁产区种植的的赤霞珠酿酒葡萄为原料,样品采集根据Boulton等[22]所述方法进行。将新鲜的葡萄果实放入冰袋中,尽快带回实验室于-40 ℃冰箱中保存。实验前,将果皮剥离并用液氮研磨,冷冻干燥,干燥后的粉末于-40 ℃冰箱中保存待用。
甲醇、乙腈、甲酸和乙酸均为色谱纯,购于Fisher(Fairlawn,NJ,USA)公司;乙酸乙酯为分析纯,购于北京化学试剂公司;超纯水采用 Milli-Q(Milipore,Bedford,MA)系统制备的超纯水。标样二甲花翠素-3-O-葡萄糖苷标准品购于Extrasynthese SA (Genay,France)公司。
1.2 主要仪器设备
KG 2200B型超声波清洗器;HZS-H型水浴振荡器;GL-20G-II型离心机;RE-52AA型旋转蒸发器;HPLC-MS液相色谱-质谱联用仪(配有电喷雾离子源(ESI)及Agilent Mass Hunter B.04.00数据处理系统),美国Fisher (Fairlawn,NJ,USA)公司。
1.3 实验方法
1.3.1 色谱条件
色谱柱:Kromasi l100-5C18柱(4 mm×250 mm,65 μm);流动相A为水:甲酸:乙腈=92:2:6(V/V);流动相B为水:甲酸:乙腈=44:2:54(V/V),洗脱程序:0~18 min,10%~25% B:18~20 min,25%B;20~30 min,25%~40%B:30~35 min,40%~70% B:35~40 min,70%~100%B:流速:1 mL/min;柱温:50 ℃;检测波长:525 nm;进样量 30 µL[23]。
1.3.2 质谱条件
质谱采用电喷雾离子源(ESI);正离子模式;离子扫描范围:100~1500 m/z;雾化器压力:241.33 kPa;干燥气流速:10 L/min;干燥气温度:350 ℃;选择了多重反应监测(MRM)模式识别和量化[24,25]。每个葡萄酒样品一式两份检测。
1.4 花色苷的提取
葡萄果皮中花色苷的提取:称取5.00 g葡萄皮干粉,浸入25 mL含90%甲醇溶液中,先超声萃取10 min,再在25 ℃下避光摇床萃取30 min,然后8000 r/min、14 ℃离心10 min,取上清液,重复提取5次。最后合并上清液,30 ℃真空旋蒸蒸发除去甲醇,用甲醇定容至5 mL。样品用0.45 µm水系滤膜过滤后上样。
1.5 花色苷的定性
本研究的花色苷定性工作基于中国农业大学葡萄酒研究中心建立的“葡萄与葡萄酒花色苷HPLC-UV-MS/MS指纹谱库”的基础上,结合文献报道,通过对样品HPLC-UV-MS/MS图谱中质谱信息、光谱信息和保留时间与谱库及文献报道比对分析从而确定各样品中各花色苷的种类与结构[26]。
1.6 花色苷的定量
建立5~500 mg/L之间、9个水平、三个重复的二甲花翠素-3-O-葡萄糖苷标准曲线,相关系数应在0.999以上,做二甲花翠素-3-O-葡萄糖苷的外标定量,其它花色苷以相当于二甲花翠素-3-葡萄糖苷(Malvidin-3-O-glucoside)的含量计。
1.7 数据处与分析
数据处理采用Microsoft Office Excel 2003,绘图采用OriginPro 9.064位。
2 结果与讨论
2.1 2016年伊犁地区赤霞珠葡萄成熟过程中花色苷含量的变化
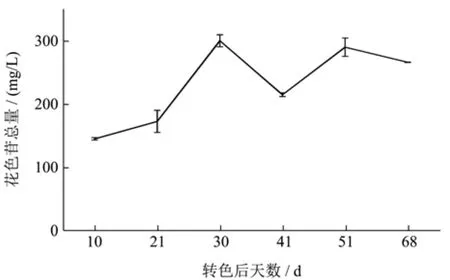
图1 赤霞珠葡萄果实成熟过程中花色苷的含量Fig.1 Content of anthocyanins in the ripening of Cabernet Sauvignon grape
2016年从伊犁赤霞珠葡萄果皮中分别共检测到了15种花色苷,其中二甲基花翠素葡萄糖苷是成熟发育过程中主要的花色苷,始终占总花色苷的30%以上。
如图1所示,从花色苷成熟过程中的总量来看,伊犁地区赤霞珠葡萄果实成熟发育过程中花色苷总量在转色30 d前就快速增加达到最高值300.21 mg/L,之后又急速下降,但是在转色41 d以后又出现了一次增加,在转色51 d的时候之后持续下降,至采收期时降至266.07 mg/L。
2.2 2016年伊犁地区赤霞珠葡萄果实花色苷组成比例
如图2所示,从花色苷总量和不同类型的花色苷含量来看,不同类型在伊犁表现不同。由以上结果可以看出,伊犁地区葡萄果实中总花色苷和各种类型的花色苷都有明显差异,并且葡萄果实中总花色苷和各种类型的花色苷含量受葡萄生长地区的响也不相同。

图2 赤霞珠葡萄果实中不同类型花色苷的含量Fig.2 Content of different types of anthocyanins in Cabernet Sauvignon grape
2.3 2016年伊犁地区赤霞珠葡萄果实花色苷组成的变化
图3是2016年份伊犁赤霞珠葡萄果实从转色第10 d到采收的过程中乙酰化、香豆酰化和未酰化花色苷占总花色苷的百分比变化图。如图所示,3’-取代花色苷占总花色苷的比例从20.57%到26.88%变化。成熟发育早期所占比例较高,在转色第30 d时,花色苷总量快速上升至300.21 mg/L,此时3’-取代花色苷的比例降至22.96%。在花色苷总量达到峰值后减少的过程中,3’-取代花色苷占总花色苷的比例也呈现下降趋势,至转色第51 d降至最低,仅有20.57%。这个过程中也表现出了在花色苷总量达到峰值后减少的过程中,3’-取代花色苷的减少比 3’5’-取代花色苷的减少更快。
伊犁赤霞珠葡萄果皮中甲基化花色苷占总花色苷的比例呈现缓慢的上升趋势,变化范围从76.62%~84.40%,其最高值出现在采收期。从转色30 d到采收期之间,花色苷总量减少了34.14 mg/L,其中甲基化花色苷减少了23.86 mg/L,降低了9.60%,未甲基化花色苷减少了10.28 mg/L,降低了19.6%,未甲基化花色苷降低的比例高于甲基化花色苷,由以上结果我们可以推测未甲基化花色苷的稳定性不如甲基化花色苷。
伊犁酰基化花色苷占总花色苷的比例在30.90%~33.64%之间呈缓慢下降趋势,香豆酰化花色苷占总花色苷的比例波动较大,在花色苷积累达到最大值以前(转色30 d)有明显的上升趋势,此后随着总花色苷的下降香豆酰化花色苷的含量有较小的破动。而乙酰化花色苷占总花色苷的比例没有显著性变化。说明赤霞珠葡萄果实成熟发育后期花色苷的减少主要由未酰化花色苷和乙酰化花色苷的减少引起,香豆酰化比较稳定,其含量不随总花色苷的急剧减少而减少。
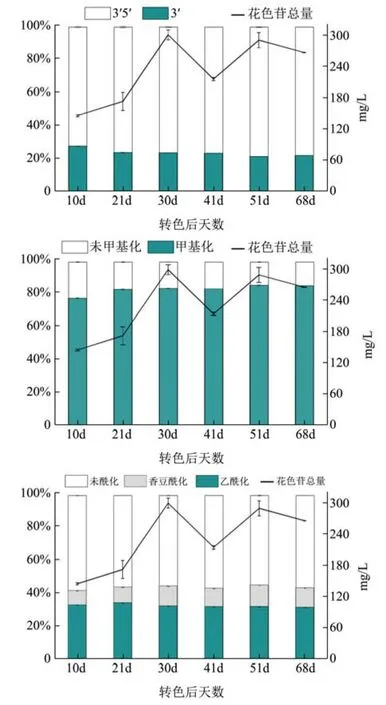
图3 伊犁地区赤霞珠葡萄果实花色苷组成的含量Fig.3 Content of anthocyanin of Cabernet Sauvignon grape in Yili area
3 结论
3.1 3’-取代花色苷和 3’5’-取代花色苷:从伊犁地区的花色苷含量来看,3’5’-取代花色苷占总花色苷的比例为 70%~90%不等,3’-取代花色苷所占总体花色苷的比例为10%~30%不等,伊犁地区的葡萄中的3’-取代花色苷和 3’5’-取代花色苷占总花色苷的比例明显高于伊犁相应样品中的比例。3’5’-取代花色苷是赤霞珠葡萄果实成熟发育过程中的主要花色苷类型,占花色苷总量的70%以上。在赤霞珠葡萄果皮中花色苷积累至最大值后,随花色苷总量的减少3’-取代花色苷占总花色苷的比例降低。
3.2 甲基化取代:在我们检测的伊犁产区的样品中,甲基化的花色苷所占比例为80%~85%,而未甲基化修饰的花色苷仅占10%~24%。葡萄果实成熟发育过程中的花色苷主要以甲基化形式存在,并且甲基化花色苷占总花色苷比例变化不大。在赤霞珠蛇葡萄中,当葡萄果皮中花色苷积累至最大值后,随花色苷总量的减少甲氧基化花色苷占总花色苷的比例增大。这可能是由于甲基化的花色苷比未被甲基化的花色苷稳定。
3.3 酰基化:在伊犁产区的检测中,花色苷发生酰化的比例相对较低占总花色苷的40%~50%,并且主要是乙酰化的花色苷,乙酰化花色苷和香豆酰化花色苷占总花色苷的比例在葡萄果实成熟发育过程中的变化不同。乙酰化花色苷占总花色苷的比例在赤霞珠葡萄果实成熟发育过程中缓慢下降,香豆酰化花色苷占总花色苷的比例在葡萄果实成熟发育过程中呈现无规律的变化。
3.4 总的来说,伊犁的花色苷在成熟过程中不同类型有不同的变化,但花色苷的生成到后期的积累情况并不是很理想,褪色较快程度较大,对于后期的酿酒中颜色的变化可能会有直接影响,有待于进一步的实践来证明,研究结果的完成可以为今后更深入地认识环境因素如何影响酿酒葡萄果实生长发育过程中不同类型花色苷生成与积累提供一些依据。
[1]孙明霞,王宝增,范海,等.叶片中的花色素苷及其对植物适应环境的意义[J].植物生理学报,2003,39(6):688-694 SUN Ming-xia, WANG Bao-zeng, FAN Hai, et al.Anthocyanins of leaves and their enviromental significance in plant stress responses [J]. Plant Physiology Communications,2003, 39(6): 688-694
[2]Yang J, Martinson T E, Liu R H. Phytochemical profiles and antioxidant activities of wine grapes [J]. Food Chemistry,2009, 116: 332-3
[3]韩富亮,李杨,李记明,等.红葡萄酒花色苷结构和颜色的关系研究进展[J].食品与生物技术学报,2011,30(3):328-336 HAN Fu-liang, LI Yang, LI Ji-ming, et al. Relation between anthocyanin structures and color in red wine:are view [J].Journal of Food Science and Biotechnology, 2011, 30(3):328-336
[4]anaka Y, Sasaki N, Ohmiya A. Biosynthesis of plant pigments:Anthocyanins, betalains and carotenoids [J]. Plant Journal,2008, 54(4): 733-749
[5]Anderson Q M, Joudheim M. Flavonoids: chemistry,biochemistry, and applications [M]. London: CRC Taylor &Francis Group, 2006
[6]Nardini M, D'Aquino M, Tomassi G, et al. Inhibition of human LDL oxidation by caffeic acid and other hydroxycinnamic acid derivatives [J]. Free Radical Biology and Medicine, 1995, 19(5): 541-552
[7]Boss P K, Davies C, Robinson S P. Anthocyanin composition and anthocyanin pathway gene expression in grapevine sports differing in berry skin colour [J]. Australian Journal of Grape and Wine Research, 1996, 2(3): 163-170
[8]Gomez S, Fernandez M, Mena A, et al. Anthocyanin profile of Spanish Vitis vinifera L. red grape cultivars in danger of extinction [J]. Australian Journal of Grape and Wine Research, 2007, 13(3): 150-156
[9]Sekher Pannala A, Chan T S, O'brien P J, et al. Flavonoid B-ring chemistry and antioxidant activity: Fast reaction kinetics [J]. Biochemical And Biophysical Research Communications, 2001, 282(5): 1161-1168
[10]Harborne J B. The natural distribution in angiosperms of anthocyanins acylated with aliphatic dicarboxylic acids [J].Phytochemistry, 1986, 25(8): 1887-1894
[11]Honda T, Saito N. Recent progress in the chemistry of polyacylated anthocyanins as flower color pigments [J].Heterocycles, 2002, 56(1): 633-692
[12]Nakayama T, Suzuki H, Nishino T. Anthocyanin acyltransferases: Specificities, mechanism, phylogenetics,and applications [J]. Journal of Molecular Catalysis B:Enzymatic, 2003, 23(2): 117-132
[13]肖慧琳,张珍珍,朱保庆,等.川西北干旱河谷地区赤霞珠葡萄果实花色苷的积累[J].中外葡萄与葡萄酒,2012,3:16-21 XIAO Hui-lin, ZHANG Zhen-zhen, ZHU Bao-qing, et al.Accumulation of anthocyanins in Cabernet Sauvignon grape berries from dry valley region of northwestern Sichuan [J].Sino-Overseas Grapevine & Wine, 2012, 3: 16-21
[14]Ryan J M, Revilla E. Anthocyanin composition of Cabernet Sauvignon and Tempranillo grapes at different stages of ripening [J]. Journal of Agricultural and Food Chemistry,2003, 51(11): 3372-3378
[15]Ageorges A, Fernandez L, Vialet S, et al. Four specific isogenes of the anthocyanin metabolic pathway are systematically co-expressed with the red colour of grape berries [J]. Plant Science, 2006, 170(2): 372-383
[16]蔡建.产区间酿酒葡萄及葡萄酒花色苷特征研究[D].北京:中国农业大学,2006 CAI Jian. Study on anthocyanin characteristics of wine grape and wine in different producing areas [D]. Beijing: China Agricultural University, 2006
[17]Kliewer W M. Influence of temperature, solar radiation and nitrogen on coloration and composition of Emperor grapes [J].American Journal of Enology and Viticulture, 1977, 28(2): 96-103
[18]Steyn W J, Holcroft D M, Wand S J E, et al. Anthocyanins in vegetative tissues: A proposed unified function in photoprotection [J]. New Phytologist, 2002, 155(3): 349-361
[19]高飞,柯燚,金韬,等.光照对植物合成花色素苷的影响研究进展[J].中国农学通报,2014,30(34):6-10 GAO Fei, KE Yi, JIN Tao, et al. Advances in the effects of light on anthocyanin biosynthesis in plants [J]. Chinese Agricultural Science Bulletin, 2014, 30(34): 6-10
[20]杨哲,成果,高媛,等.疏穗处理对‘赤霞珠’葡萄果粒大小及花色苷积累的影响[J].西北农业学报,2015,24(2):111-121 YANG Zhe, CHENG Guo, GAO Yuan, et al. Effects of spikelet treatment on grain size and anthocyanin accumulation of 'cabernet sauvignon' grape [J]. Journal of Northwest Agricultural Sciences, 2015, 24(2): 111-121
[21]Castellarin S D, Pfeiffer A, Sivilotti P, et al. Transcriptional regulation of anthocyanin biosynthesis in ripening fruits of grapevine under seasonal water deficit [J]. Plant, Cell and Environment, 2007, 30(11): 1381-1399
[22]Boulton R B, Singleton V L, Bisson L F, et al. Selection of state of ripeness for harvest and harvesting [J]. Principles and Practices of Winemaking, 1995: 52-60
[23]Li S Y, Liu P T, Pan Q H, et al. Association between modification of phenolic profiling and development of wine color during alcohol fermentation [J]. J Food Sci., 2015, 80(4): C703-C710
[24]Nicoletti I, Bello C, De Rossi A, et al. Identification and quantification of phenolic compounds in grapes by HPLC-PDA-ESI-MS on a semimicro separation scale [J].Journal of Agricultural and Food Chemistry, 2008, 56(19):8801-8808
[25]Flamini R, De Rosso M, Smaniotto A, et al. Fast analysis of isobaric grape anthocyanins by chip-liquid chromatography/mass spectrometry [J]. Rapid Communications In Mass Spectrometry, 2009, 23: 2891-2896
[26]孙建平.葡萄与葡萄酒中酚类物质 LC-UV-MS/MS谱库构建及应用[D].北京:中国农业大学,2006 SUN Jian-ping. Design and application of LC-UV-MS / MS library of grape and grape in grape and wine [D]. Beijing:China Agricultural University, 2006

