海湾扇贝碳氮稳定同位素的分馏系数和转化率研究
王 震,田甲申,李多慧,韩羽嘉,鹿志创,傅志宇,木云雷
(1.大连海洋大学 水产学院,辽宁 大连 116023;2.辽宁省海洋水产科学研究院,辽宁 大连 116023;3.大连市水产研究所,辽宁 大连 116019)
稳定同位素技术反映了被消费者吸收利用的较长一段时间的食物信息,已被广泛应用于食物网有机物传递过程、评估各种食物对捕食者生长贡献度的研究中[1]。确定生物体内稳定同位素的分馏系数和转化率,是稳定同位素技术应用于食物网研究的前提和基础[2]。
分馏系数是估算食物对消费者贡献度、判断消费者营养级的关键数据。早期研究表明,捕食者新陈代谢倾向于利用较轻元素,而富集较重元素,从而产生动物与食物之间的分馏效应[3-4],且动物与食物之间的稳定同位素值存在较为确定的判别值,如Δδ13C:0‰~1.0‰,Δδ15N:3.0‰~ 4.0‰[5-6],这是稳定同位素技术得以广泛应用的前提。然而,Deniro等[3]在研究食物对不同物种的C同位素影响时,发现各物种分馏系数的平均值为0.8‰,但种间变化较大(0.6‰~2.7‰)。因此,分馏系数的研究备受关注。Roth等[7]研究发现,红狐(Vulpesvulpes)体内血清对食物的Δδ15N值达4.2‰,而肝、肌肉和毛皮为3.3‰~3.5‰。Gamboa-Delgado等[8]通过室内饲喂试验,发现凡纳滨对虾(Litopenaeusvannamei)肌肉组织中Δδ15N值与饲料中蛋白质含量有关。应用稳定同位素技术研究食物网结构时,若忽略C、N稳定同位素的分馏系数变化,则很可能产生对食物网结构的错误构建[9-10]。
同位素转化率代表各组织稳定同位素值(动物吸收的食物)的时间尺度。研究发现,变温动物[11-12]和恒温动物[12-13]的稳定同位素转化率均存在物种特异性和组织特异性。Dubois等[2]在研究太平洋牡蛎(Crassostreagigas)和紫贻贝(Mytilusedulis)的稳定同位素转化率时,发现两种贝类的N同位素半衰期(14.5 d)大约是C同位素半衰期(8.5 d)的两倍;Guelinckx等[14]发现刺鳍鱼(Pomatoschistusminutus)新陈代谢快的组织(肝脏、心脏)稳定稳定同位素半衰期,短于新陈代谢慢的肌肉组织,即不同组织的同位素值反映出不同时间尺度动物的食物特征。因此,若要提高稳定同位素在研究食物网时的准确性、精确性,需通过更多室内喂养控制试验来获取不同物种不同组织的稳定同位素分馏系数和转化率。
目前,国内稳定同位素技术在生态系统中的应用多集中于野外研究,如潮间带、近海的食物网构建[15-16],鱼类、刺参等的食物组成等[17-19]。近几年,国内学者已对锦鲤(Cyprinuscarpio)、军曹鱼(Rachycentroncanadum)、黄颡鱼(Pelteobagrusfulvidraco)[20-22]的稳定同位素分馏系数和转化率进行了研究,而有关海湾扇贝(Argopectenirradias)稳定同位素分馏系数和和转化率的研究尚未见报道。海湾扇贝原产于美国大西洋沿岸,1982年引种到我国,具有生长速度快、养殖周期短、营养价值高等特点,现已成为我国主要养殖经济贝类之一。以海湾扇贝为研究对象,通过室内控制试验,研究海湾扇贝不同组织C、N稳定同位素的分馏系数和转化率,旨在为利用稳定同位素技术研究海湾扇贝等贝类在促熟期的饵料贡献率、在自然海域时的饵料来源奠定基础,同时也为海洋食物网的科学构建、稳定同位素技术更加科学的应用提供科学依据。
1 材料与方法
1.1 材料
采集大连大李家海域同龄海湾扇贝,按大小分为两类,体质量和壳高分别为:大规格,(30.23±3.25) g和(57.12±2.00) mm,小规格,(19.06±3.12) g和(49.03±2.13) mm。螺旋藻粉购自山东东营康瑞科技开发有限责任公司。
1.2 方法
1.2.1 试验设计和日常管理
试验开始前,将海湾扇贝表面附着物冲洗干净,挑选健康个体暂养于容积为2 m3的玻璃钢水槽内。试验开始后,设置试验组和对照组各1个,每组3个平行,共6个玻璃钢水槽,每槽放海湾扇贝大、小规格各60枚。试验期间每日倒池1次,持续充氧,水源为沙滤沉淀海水,水温为14.50~15.50 ℃、溶解氧为9.91~10.81 mg/L、pH为7.87~8.04,盐度33.92~34.16。试验周期74 d,前14 d不投饵,以使扇贝充分适应环境,并处于活力较好的状态;自第15 d开始,倒池后向试验组投喂螺旋藻粉,投喂前用400目筛绢网过滤,投喂密度7 mg/(L·d),对照组不投饵。
1.2.2 样品处理
将第14 d设为第0 d,分别在第0、4、8、12、16、20、28、36、44、52 d和60 d每槽各取3枚扇贝,取其肝胰腺、性腺、闭壳肌组织,用去离子水清洗干净,60 ℃烘干24 h,用玛瑙研钵研磨成粉末,经100目筛绢网过滤,同时取螺旋藻粉,用于δ15N和δ13C值的测定。
1.2.3 碳氮稳定同位素的测定
所有样品于辽宁省海洋水产科学研究院稳定同位素实验室进行测定。稳定同位素质谱仪为菲尼根Flash 2000 HT型元素分析仪和菲尼根Delta V Advantage同位素比率质谱仪相连而成。δ13C值以PDB为参考标准,δ15N值以大气氮为参考标准。为保证结果准确性,同一样品的碳、氮稳定同位素分别进行测定。每个样品测定3个平行样,为保持试验结果的准确性和仪器的稳定性,每测定5个样品后插测1个标准样,δ15N和δ13C值精密度<±0.15‰。
1.2.4 指标计算
应用指数衰减曲线对同位素的特征变化与时间进行拟合,分馏系数、扇贝各组织对C或N同位素的半衰期分别见下式:
Y=c+ae(-λt)
DTF =c-b[28]
t1/2=ln(2)/λ[23]。
式中,t为时间,Y为t时各组织的δ13C或δ15N值,c为组织同位素渐进值,a为初始与平衡条件之间的差异,λ为C或N同位素的转化率,DTF为分馏系数,b为饵料的同位素值,t1/2为半衰期。
1.3 数据处理
研究结果采用平均值±标准差表示。采用SPSS 13.0统计软件包中的Compare means进行One-way ANOVA分析,差异显著性用Scheffe和Tukey’s HSD法进行事后多重比较,生长曲线采用SigmaPlot 13.0软件进行拟合。
2 结 果
2.1 海湾扇贝的生长情况
不同规格海湾扇贝试验前后壳高、体质量变化见表1。试验组与对照组的海湾扇贝不同规格壳高、体质量均未发生显著变化(P>0.05)。
2.2 海湾扇贝各组织的分馏系数
海湾扇贝各组织C、N稳定稳定同位素比值变化见表2。试验过程中,海湾扇贝大、小规格之间的各组织C、N稳定同位素比值无显著差异(P>0.05),试验前后,对照组各组织的δ13C和δ15N值均未发生显著变化(P>0.05);试验组各组织的δ13C值变化显著,而δ15N值变化较小。第0 d,肝胰腺与其他两组织的δ13C值存在显著差异(P<0.05),性腺与闭壳肌之间δ13C值无显著差异(P>0.05);而三者之间的δ15N值无显著差异(P>0.05)。此后,试验组投喂螺旋藻粉(δ13C=-27.83‰; δ15N=7.36‰)。第60 d时,肝胰腺δ13C值变化最显著,由-18.46‰降至-23.61‰,分馏系数为3.92‰;其次是性腺由-17.32‰降至-19.90‰,分馏系数为7.84‰;闭壳肌的δ13C值变化最小,由-17.76‰降至-18.01‰,且三者之间δ13C值存在极显著差异(P<0.01)。第60 d时,肝胰腺的δ15N值变化显著,而性腺和闭壳肌的δ15N值未发生显著变化(P>0.05)。第44 d~60 d肝胰腺和性腺组织的δ15N值均趋于稳定且高于对照组,因此推断肝胰腺和性腺组织的Δδ15N值分别为2.15‰、1.84‰。
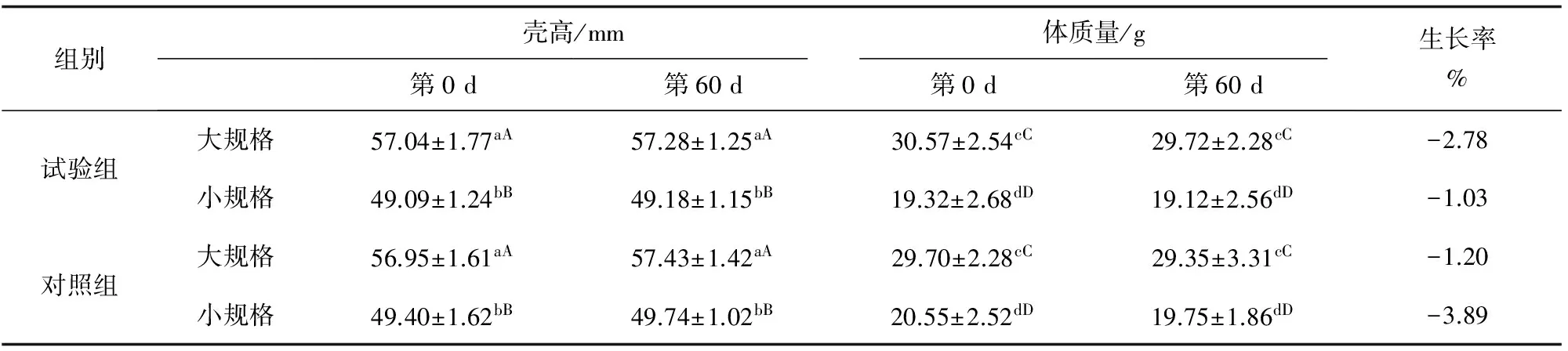
表1 试验前后海湾扇贝壳高和体质量的变化情况(n=10)
注:同一列中不同小写字母表示不同性状间差异显著(P<0.05),同一行中不同大写字母表示同一性状不同时间的值差异显著(P<0.05);n代表样本数量.下同.
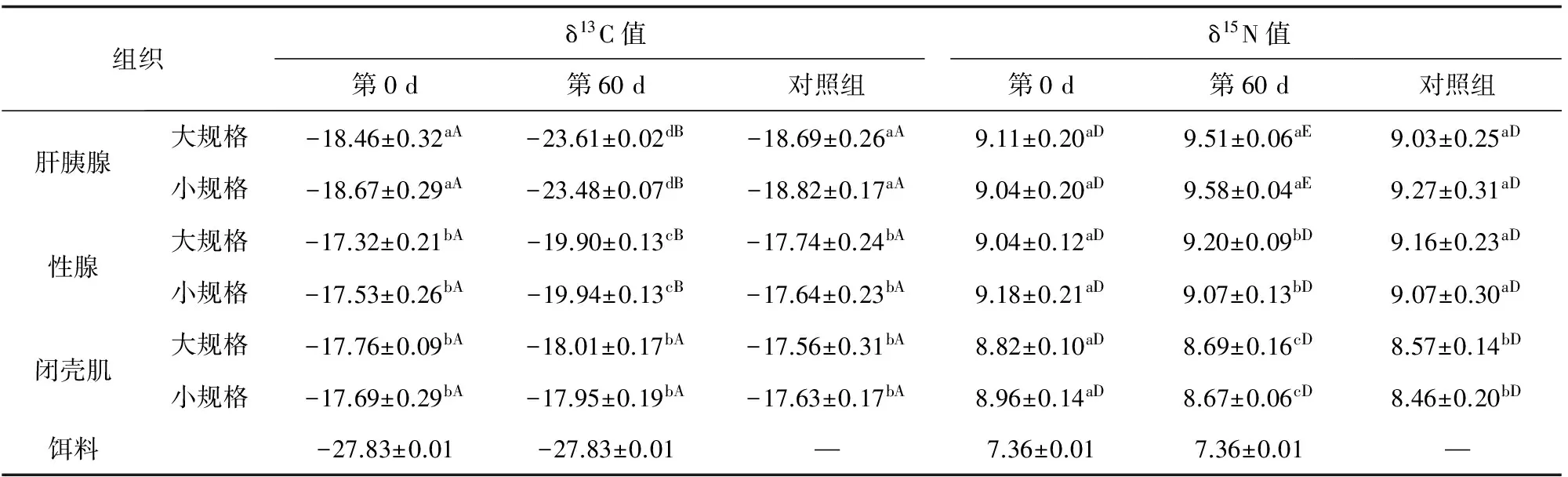
表2 海湾扇贝各组织C、N稳定同位素值的变化(n=3) ‰
2.3 海湾扇贝各组织的转化率
海湾扇贝各组织及饵料的C、N稳定同位素值随时间的变化见图1。对照组各组织δ13C和δ15N值在1.0‰范围内波动,未发生显著变化(P>0.05),饵料的δ13C和δ15N值在试验期间变化不显著(P>0.05)。试验组海湾扇贝肝胰腺、性腺、闭壳肌的δ13C值与时间拟合曲线的拟合优度(r2)分别为0.99、0.96、0.38(表3),肝胰腺和性腺的拟合优度良好,闭壳肌的拟合优度较差。肝胰腺和性腺的C稳定同位素转化率非常接近,半衰期分别为10.88 d和10.22 d,闭壳肌的C稳定同位素转化率最慢,但由于其与时间拟合曲线的拟合优度较差,不能准确反映出闭壳肌的C稳定同位素半衰期。试验组各组织的δ15N值无法与时间拟合成指数衰减曲线。第0 d~44 d,试验组肝胰腺和性腺的δ15N值上下波动,第44 d~60 d相对稳定,且略高于对照组,而闭壳肌的δ15N值与对照组差异最小。由此可推断,肝胰腺和性腺在第40 d达到稳定同位素平衡,两组织的N同位素半衰期约为20 d,闭壳肌N同位素半衰期远大于其他组织。

表3 海湾扇贝各组织δ13C值随时间的拟合方程及同位素转化半衰期
3 讨 论
3.1 影响动物组织稳定同位素转化的因素
动物组织稳定同位素组成受动物自身条件(种类、年龄等)与环境因素(食物、理化因素等)的综合影响。其中,食物的稳定同位素组成是动物组织稳定同位素组成的决定性因素[3,24]。食物的改变,可通过新陈代谢和组织生长两个过程影响动物组织稳定同位素组成[12,25-27]。Fry等[26]研究发现,当对虾的体质量增加4倍时,虾与饵料达到稳定同位素平衡,并利用组织同位素随组织生长的转化率模型,证明虾组织同位素转化率主要与组织生长有关。这一试验设计得到广泛认可,学者们在室内研究贝类稳定同位素转化率时,多以幼龄贝为研究对象,并应用上述模型得到了相似规律[2,28]。本研究的海湾扇贝均为成熟个体,试验前后无显著生长(P>0.05)。因此,本研究中饵料对海湾扇贝各组织同位素组成的影响,主要通过新陈代谢途径引起。

图1 海湾扇贝各组织δ13C和δ15N值随时间的变化注:虚线F1代表Y=c+ ae(-λt)拟合方程曲线;折线F2、C代表试验期间试验组、对照组各组织稳定同位素比值变化;折线E代表试验期间饵料同位素比值变化.
3.2 动物组织C、N稳定同位素的转化率
动物各组织新陈代谢速率不同,不同组织的同位素值反映了不同时间尺度动物的食物特征。研究表明,恒温动物和变温动物不同组织的同位素转化率均可能出现一定差异[13,20,23,29-30]。试验结果显示,海湾扇贝肝胰腺和性腺的同位素转化率相近,而闭壳肌同位素半衰期远大于其他组织,这可能与试验水温、海湾扇贝的贝龄有关。研究发现,成年宽鼻白鲑(Coregonusnasus)稳定同位素半衰期约为1年[25],远大于美洲拟鲽(Pseudopleuronectesamericanus)幼鱼半衰期(1~19 d)[31]。温度对C、N同位素转化率有显著影响,13 ℃时,美洲拟鲽幼鱼的C、N同位素半衰期分别为(4.1±0.6) d、(3.9±0.7) d;18 ℃时,C、N同位素半衰期分别为(2.2±0.3) d、(3.1±0.3) d[31]。这可能是因为成年动物组织生长和新陈代谢比幼龄动物缓慢,变温动物的生物化学反应在低温下会减缓[32]。本研究所用海湾扇贝均为成熟个体,试验温度为14.50~15.50 ℃,并非其最适生长温度(22 ℃)[33],且闭壳肌在3种组织中代谢最慢,这些可能与闭壳肌需要更长时间才能达到同位素平衡有关。
动物摄食后,食物中的C、N元素会在代谢途径上发生解偶联,即C、N元素的代谢传递途径可能发生变化[2]。Hobson等[23]在研究刺嘴莺(Sylviaborin)血液及羽毛同位素转化率时,发现C元素的转化率比N元素转化率快。Dubois等[2]在研究无脊椎动物时也报道了相似的转化规律,太平洋牡蛎和紫贻贝C元素新陈代谢速率是N元素的两倍。本试验中,肝胰腺和性腺的C元素半衰期约为10 d,根据折线图推断出的N元素半衰期接近20 d,同样验证了C、N元素在组织代谢过程中转化速率存在差异。这可能是由于双壳类储存物质(如,糖元)的积累,且加快了碳水化合物和脂肪的代谢。
3.3 动物组织C、N稳定同位素的分馏系数
本试验中,海湾扇贝各组织δ13C值在第60 d时存在极显著差异,闭壳肌的δ15N值与其他两组织存在显著差异。各组织的δ13C值差异可能是由于脂肪含量的不同引起:生命体在合成脂肪的过程中,会发生明显的碳歧视效应,即趋向于利用较轻的12C合成脂肪,进而脂肪中的δ13C要比蛋白质和单糖类化合物低6‰[34],而肝胰腺是双壳贝类脂质的主要贮存器官,脂肪含量高于其他组织[35]。各组织的δ15N值存在差异可能与氨基酸含量差异、不同组织代谢途径存在差异有关。同时,本研究为保证饵料δ13C和δ15N值的稳定性,试验组只投喂螺旋藻粉,这可能会导致海湾扇贝饵料过于单一。海湾扇贝不同组织对营养物质的需求不同,若饵料不能满足各组织的营养需求就会造成生物体营养不良。当生物体营养不良时,它会通过提高摄食量来弥补不足,这就导致各组织的分馏系数差异越来越大。
本研究选取年龄相同、大小不同的海湾扇贝,用于研究二者C、N稳定同位素转化及分馏是否存在差异,并探讨二者的生长差异是否与稳定同位素转化快慢有关。结果显示,海湾扇贝不同规格的C、N同位素转化率和分馏系数均无显著差异(P>0.05)。这可能与试验温度较低有关,在低温时大、小规格代谢水平都比较低,不存在显著差异。海湾扇贝不同规格的分馏系数与壳高无关,这与Herzka等[27]在研究幼鱼对食物的分馏时,发现分馏系数与美洲拟鲽自身大小无关相一致。本研究中海湾扇贝的稳定同位素分馏系数超出了被普遍接受的范围,这也验证了在利用稳定同位素技术研究食物网结构、饵料贡献率时,需充分考虑分馏系数变化所带来的影响,需谨慎引用经验值。
3.4 问题与展望
螺旋藻粉是海湾扇贝的一种代饵,可能无法满足扇贝的生长需求。同时,螺旋藻粉与试验对象之间δ15N值接近,无法清晰显示出海湾扇贝N元素随时间的变化情况。另外,试验水温较低,并不是试验对象的最适生长温度,这可能是造成闭壳肌在试验过程中未达到同位素平衡的主要原因。在今后的实验室研究中,需注意:(1)食物的选择。在保证食物单一且具有稳定的同位素比值前提下,食物与试验动物之间的同位素比值要有一定差异,并且饵料营养需均衡,以减少营养不良等因素对试验的影响。(2) 温度等影响新陈代谢因素的设定。不同温度对试验动物同位素转化率及分馏系数的影响是否存在显著差异;温度在何时,室内试验数据才能准确反映野外动物的同位素转化率及分馏系数,均有待进一步研究。(3) 试验对象的选择。受组织生长影响较大的低龄动物与食物之间更易达到同位素平衡,为获得较好的试验数据,大多数研究均选取低龄动物为研究对象。但在构建自然生态系统食物网时会涉及不同年龄的动物,同种动物不同年龄之间的同位素转化率及分馏系数是否存在显著差异,仍有待进一步研究。虽然稳定同位素技术已成为研究动物食物源与营养关系的重要手段,但仍需通过更多室内喂养控制试验来提高稳定同位素在研究食物网时的准确性、精确性。
[1] Fry B.Stable Isotope Ecology[M].Heidelberg: Springer,2006.
[2] Dubois S,Jean-Louis B,Bertrand B,et al.Isotope trophic-step fractionation of suspension-feeding species: implications for food partitioning in coastal ecosystems[J].J Exp Mar Bio Ecol,2007,351(2):121-128.
[3] Deniro M J,Epstein S.Influence of diet on the distribution of carbon isotopes in animals[J].GeochimCosmochim Acta,1978,42(5):495-506.
[4] Deniro M J,Epstein S.Influence of diet on the distribution of nitrogen isotopes in animals[J].Geochim Cosmochim Acta,1981,45(3):341-351.
[5] Peterson B J,Fry B.Stable isotopes in ecosystem studies[J].Annu Rev Ecol Syst,1987,18(1):293-320.
[6] Post D M.Using stable isotopes to estimate trophic position: models,methods,and assumptions[J].Ecology,2002,83(3):703-718.
[7] Roth J D,Hobson K A.Stable carbon and nitrogen isotopic fractionation between diet and tissue of captive red fox: implications for dietary reconstruction[J].Can J Zool,2000,78(5):848-852.
[8] Gamboa-Delgado J,Le Vay L.Natural stable isotopes as indicators of the relative contribution of soy protein and fish meal to tissue growth in Pacific white shrimp (Litopenaeusvannamei) fed compound diets[J].Aquaculture,2009,291(1/2):115-123.
[9] Gearing J N,Gearing P J,Rudnick D T,et al.Isotopic variability of organic carbon in a phytoplankton-based,temperate estuary[J].Geochim Cosmochim Acta,1984,48(5):1089-1098.
[10] Mc Cutchan Jr J H,Lewis Jr W M,Kendall C,et al.Variation in trophic shift for stable isotope ratios of carbon,nitrogen,and sulfur[J].Oikos,2003,102(2):378-390.
[11] Fry B.Food web structure on Georges Bank from stable C,N,and S isotopic compositions[J].Limnol Oceanogr,1988,33(5):1182-1190.
[12] Hobson K,Clark R.Assessing avian diets using stable isotopes Ⅰ: turnover of13C in tissues[J].Condor,1992,94(1):181-188.
[13] Tieszen L L,Boutton T W,Tesdahl K G,et al.Fractionation and turnover for δ13C analysis of diet in animal tissues: implications for δ13C analysis of diet[J].Ecology,1983,57(1):32-37.
[14] Guelinckx J,Maes J,Van Den Driessche P,et al.Changes in δ13C and δ15N in different tissues of juvenile sand gobyPomatoschistusminutus: a laboratory diet-switch experiment[J].Mar Ecol Prog Ser,2007,341(1):205-215.
[15] 蔡德陵,洪旭光,毛兴华,等.崂山湾潮间带食物网结构的碳稳定同位素初步研究[J].海洋学报,2011,23(4):41-47.
[16] 崔莹.基于稳定同位素和脂肪酸组成的中国近海生态系统物质流动研究[D].上海:华东师范大学,2012.
[17] 彭士明,施兆鸿,尹飞,等.利用碳氮稳定同位素技术分析东海银鲳食性[J].生态学杂志,2011,30(7):1565-1569.
[18] 颜云榕,张武科,卢伙胜,等.应用碳、氮稳定同位素研究北部湾带鱼(Trichiuruslepturus)食性及营养级[J].海洋与湖沼,2012,43(1):192-200.
[19] 金波昌.池塘养殖刺参(Apostichopusjaponicus)食物来源的稳定同位素法研究[D].青岛:中国海洋大学,2010.
[20] 曾庆飞,谷孝鸿,毛志刚,等.同位素富集-稀释法研究食性转变对鱼类不同组织N同位素转化率的影响[J].生态学报,2012,32(4):1257-1263.
[21] 周晖,陈刚,施钢,等.不同蛋白源对军曹鱼幼鱼碳、氮稳定同位素分馏的影响[J].热带海洋学报,2014,33(5):35-40.
[22] 张妙,陈新军,陈亚,等.黄颡鱼不同组织碳氮稳定同位素的周转与分馏研究[J].上海海洋大学学报,2016,25(6):822-830.
[23] Hobson K A,Bairlein F.Isotopic fractionatin and turnover in captive garden warblers (Sylviaborin): implications for delineating dietary and migratory associations in wild passerines[J].Can J Zool,2003,81(9):1630-1635.
[24] Yoneyama T,Ohta Y,Ohtani T.Variations of natural13C and15N abundances in the rat tissues and their correlation[J].Radioisotopes,1983,32(7):330-332.
[25] Hesslein R H,Hallard K A,Ramlal P.Replacement of sulfur,carbon,and nitrogen in tissue of growing broad whitefish (Coregonusnasus) in response to a change in diet traced by δ34S,δ13C,and δ15N[J].Can J Fish Aquat Sci,1993,50(6):2071-2076.
[26] Fry B,Arnold C.Rapid13C/12C turnover during growth of brown shrimp (Penaeusaztecus)[J].Oecologia,1982,54(2):200-204.
[27] Herzka S Z,Holt G J.Changes in isotopic composition of red drum (Sciaenopsocellatus) larvae in response to dietary shifts: potential pplications to settlement studies[J].Can J Fish Aquat Sci,2000,57(1):137-147.
[28] Yokoyama H,Tamaki A,Harada K,et al.Variability of diet-tissue isotopic fractionation in estuarine macrobenthos[J].Mar Ecol Prog Ser,2005,296(1):115-128.
[29] Macneil M A,Drouillard K G,Fisk A T.Variable uptake and elimination of stable nitrogen isotopes between tissues in fish[J].Can J Fish Aquat Sci,2006,63(2):345-353.
[30] Logan J,Haas H,Deegan L,et al.International association for ecology turnover rates of nitrogen stable isotopes in the salt marsh mummichog,fundulusheteroclitus,following a laboratory diet switch[J].Oecologia,2006,147(3):391-395.
[31] Bosley K L,Witting D A,Chambers R C,et al.Estimating turnover rates of carbon and nitrogen in recently metamorphosed winter flounderPseudopleuronectesamericanuswith stable isotopes[J].Mar Ecol Prog Ser,2002,236(7):233-240.
[32] Laurence G C.Laboratory growth and metabolism of the winter flounderPseudopleuronectesamericanusfrom hatching through metamorphosis at three temperatures[J].Mar Biol,1975,32(3):223-229.
[33] 林瑞才,林笔水.温、盐度对海湾扇贝稚贝迁移行为、生长和存活影响的实验[J].应用海洋学学报,1991(2):133-138.
[34] Deniro M J,Epstein S.Mechanism of carbon isotope fractionation associated with lipid synthesis[J].Science,1977,197(4300):261-263.
[35] Napolitano G E,Ackman R G.Anatomical distributions and temporal variations of lipid classes in sea scallopsPlacopectenmagellanicus(gmelin) from Georges Bank (Nova Scotia)[J].Comp Biochem Physiol,1992,103(3):645-650.

